Method Article
Preparação de culturas mista glial primários de rato adulto Spinal Cord Tissue
Neste Artigo
Resumo
O desenvolvimento de dor neuropática envolve alterações patológicas das células gliais medula espinhal. Um sistema de cultura de células gliais de confiança derivados de tecidos de medula espinal adulta e concebido para estudar estas células in vitro é inexistente. Portanto, vamos mostrar aqui como estabelecer culturas gliais mistas primárias de tecido da medula espinhal do rato adulto.
Resumo
foi bem aceite que a medula espinhal respostas gliais contribuir significativamente para o desenvolvimento de dor neuropática. Informações tremenda sobre as atividades da glia nos níveis celulares e moleculares foi obtida através dos sistemas de cultura de células in vitro. Os sistemas in vitro utilizados incluem, principalmente as células da glia primária derivada de tecido cortical cerebral neonatal e linhas de células imortalizadas. No entanto, estes sistemas podem não coincidir com as características das células da glia medula espinal in vivo. A fim de investigar o papel das células cabo gliais da coluna vertebral em desenvolvimento de nervo periférico dor neuropática induzida por lesão utilizando um sistema de cultura que reflete melhor a condição in vivo, nosso laboratório tem desenvolvido um método para estabelecer medula espinal primária culturas gliais mistas a partir de camundongos adultos. Em resumo, a espinal medula são coletadas de ratos adultos e processado através de digestão com papaína seguido pela remoção da mielina com tocasdade de gradiente médio. As suspensões de células isoladas são cultivadas em meio de Eagle modificado por Dulbecco completa (cDMEM) suplementado com 2-mercaptoetanol (2-ME) a 35,9 o C. Estas condições de cultura foram optimizado especificamente para o crescimento de células gliais mistas. Sob estas condições, as células estão prontas para serem utilizados para a experimentação entre 12 - 14 d (células são geralmente em fase log durante este tempo) após o estabelecimento da cultura (D 0) e pode ser mantido em condições de cultura até a D 21. este sistema de cultura pode ser utilizada para investigar as respostas de células gliais medula espinal após estimulação com várias substâncias e agentes. Além da dor neuropática, este sistema pode ser usado para estudar as respostas gliais em outras doenças que envolvem alterações patológicas das células gliais medula espinhal.
Introdução
A dor crônica é um problema de saúde grave que afeta cerca de 100 milhões de adultos nos Estados Unidos, com um custo anual estimado de até 635.000.000.000 $ 1. Evidências crescentes indicou uma contribuição significativa de células gliais medula espinhal no desenvolvimento da dor neuropática, um dos tipos mais devastadores da dor crônica 2. Um sistema in vitro cultura própria ajudaria significativamente em investigar mais os papéis de células gliais nos níveis celulares e moleculares.
Atualmente, os sistemas in vitro de cultura gliais utilizados pelos investigadores incluem principalmente células gliais derivadas de tecidos corticais de rato ou rato cérebros neonatal e linhas celulares imortalizadas gliais derivadas de rato neonatal ou rato células gliais primários. Neonatal células contêm um número significativo de células indiferenciadas que podem ainda ser diferenciadas em células gliais (astrócitos e principalmente da microglia), proporcionando assim umcélulas bundant para o uso experimental 3. No entanto, o nosso estudo anterior demonstrou que as células da glia cerebral neonatal responderam significativamente diferente a partir de células gliais medula espinal adultos mediante a estimulação de lipopolissacárido (LPS). Por exemplo, a interleucina (IL) -4 exibido aumenta os efeitos inibidores sobre o óxido nítrico induzida por LPS (NO) em células da glia de ratos adultos da medula espinal em comparação com as células da glia cerebral neonatal 4. Além disso, os perfis de produção de quimioquina após estimulação por um neuropeptídeo, calcitonina péptido relacionado com o gene da calcitonina (CGRP), são indiscutivelmente diferente entre as células da glia cerebral do rato neonatal (métodos descritos no Exemplo de Ref. 5) e de ratinho adulto espinal medula glia (Figura 1). As linhas celulares estabelecidas são fáceis de utilizar e de manter e pode fornecer um grande número de células num período de tempo curto. Em geral, as linhas celulares imortalizadas são gerados utilizando um sistema de imortalizao mediada por vírus (tais como a linha de células da microglia amplamente utilizado BV2) 6, 7 ou seguinte the identificação de transformação espontânea (tal como a linha de células de astrócitos C8-D1A e linha de células da microglia C8-B4) 8, 9, as linhas de células são excelentes no estudo das características moleculares dos astrócitos e microglia individualmente.; No entanto, os resultados obtidos a partir de linhas celulares exigem sempre uma validação adicional das células primárias ou em condições in vivo. Deve também notar-se que não houve um relato de uma linha de células da glia, que é derivada de uma medula espinal glia roedor.
Para ajudar a investigar o papel das células do cordão gliais da coluna vertebral no desenvolvimento de dor neuropática, num sistema de cultura que é derivado a partir da medula espinal do rato adulto foi desenvolvido por adaptação de um método previamente relatado usado para gerar ratos adultos culturas gliais mistas 4, 5 . A cultura de células gliais da medula espinal do rato foi ainda mais refinado recentemente 10 e é descrito em mais detalhe neste artigo. Adultas da medula espinal misturado culturas gliais cum ser estabelecida com um rato a partir de estirpes seleccionadas que se encaixam as necessidades do estudo particular, e as células podem ser mantidas em cultura durante até 21 dias após o inicio da cultura. Este método pode ser utilizado em estudos de dor neuropática, bem como em investigações de várias doenças neurológicas que envolvem alterações patológicas no interior da medula espinal, tais como esclerose amiotrófica lateral (ALS), o vírus da imunodeficiência humana (HIV) -associated neuropatia sensorial, e múltiplos A esclerose múltipla (MS).
Protocolo
O seguinte protocolo foi aprovado pelo Comitê Institucional de Animal Care and Use (IACUC) da Universidade de Nova Inglaterra. O protocolo seguinte é para a preparação de culturas gliais de rato adulto 4 medulas espinhais.
1. Preparação de Soluções em uma capa de cultura sob condições assépticas
- Preparar meios de cultura: modificação de meio de Eagle (cDMEM) contendo DMEM completo de Dulbecco (com 4,5 g / L de glucose), 10% de Soro Fetal Bovino (FBS), 2 mM de L-glutamina, 100 UI / mL de penicilina, 100 mg / mL de estreptomicina , 250 ng / mL de anfotericina B, e 50 uM de 2-mercaptoetanol (2-ME; ver 1.1.1). Homogeneizar e filtrar esterilizar todos os outros componentes e depois adicionar FBS. Armazenar o meio de cultura a 4 o C.
- Preparar 2-Me / solução salina tamponada com fosfato de solução de estoque 50 mM (PBS): adiciona-se 100 mL de concentrado de 2-ME (14,3 M) em 28,6 mL de 1x PBS, e esterilizar filtro (a solução pode ser armazenada a 4 ° C durante vários meses). vocêSE 1 mL de 2-ME solução estoque para cada 1000 mL de meio de cultura.
- Preparação dos meios de gradiente de densidade
- Prepare uma solução de mídia gradiente de densidade isotônica estoque (por exemplo, 100% Percoll) a partir de 1 parte 10x normal estéril PBS e 9 partes de meios gradientes estéril densidade estoque (por exemplo, Percoll).
- Dilui-se a meios de gradiente de densidade de 100% (feito em 1.2.1) com 1x PBS estéril normal para fazer uma de 20% de meio de gradiente de densidade (por exemplo, 10 mL de 100% de meio de gradiente de densidade com 40 mL de PBS 1x) e armazená-lo a quatro o C. Traga os 20% media gradiente de densidade à temperatura ambiente (RT) antes de preparar a cultura de células.
- Preparação de soluções a partir do sistema de dissociação de papaína
NOTA: O sistema de dissociação de papaína pode ser identificado na Tabela Materiais. Outros kits de dissociação semelhantes (incluindo aqueles montado em casa) também pode ser usado. Todos os componeNTS deve ser estéril.- Adicionar 32 ml de Solução Salina Equilibrada de Earle (EBSS) à mistura de inibidor de ovomucóide (pó).
- Adicionar 5 mL de EBSS para um frasco papaína (pó). Colocar o frasco papaína em um banho de água a 37 ° C durante 10 minutos ou até que a papaína é dissolvido.
- Adicionar 500 mL de EBSS para um frasco de ADNase (pó). Misture delicadamente.
- Adicionar 250 ul da solução de ADNase (acima) para o frasco de papaína.
- Calcula-se a quantidade total da mistura papaína / ADNase acima necessário (aproximadamente 800 ul de papaina mistura / ADNase por ratinho medula espinal) e transferir a mistura necessária para um tubo de 50 mL para a digestão de tecido (passo 3.2). Armazenar o restante no recipiente original, a 4 ° C durante pelo menos duas semanas.
- Manter todos os componentes dos kits em gelo até ser necessária.
- Preparar tubos de colheita de medula espinal: um tubo estéril de 15 mL com 5 mL de Solução Salina Equilibrada de Hank (HBSS; a partir do sistema de dissociação de papaína,0; para a recolha de medula espinhal) e um tubo de 15 mL estéril com 1x PBS (para encher a seringa de 5 mL, consulte o passo 2.4). Além disso, preparar uma placa de Petri estéril (35 mm ou 60 mm) com 5 mL de HBSS e mantê-lo na capa de cultura.
2. Spinal Cord Colecção
NOTA: Todos os equipamentos devem ser estéreis. Realizar a coleta em uma área designada aprovado pelo IACUC.
- Obter as seguintes ferramentas para a colheita do rato medulas espinhais: sem corte tesoura reta afiadas / 18 cm cirúrgicos, um bisturi de 12 cm padrão (# 3 sólida), em aço carbono estéreis bisturi lâmina nº 10, uma pequena decapitator animal, de 12 cm padrão curvo uma pinça, e uma agulha de 20G estéril ligada a uma seringa de 5 mL.
- Eutanásia do animal com CO2 e desinfectar a cabeça de rato e a região de volta com 70% de etanol (EtOH).
- Decapitar animal com o decapitator. Adicione uma incisão longitudinal no meio da parte inferior das costas para expor a camada muscular. Façouma transecção limpa através da coluna de vertebrados do nível do quadril (também corte através da camada de músculo que cobre a coluna de vertebrados) com as tesouras cirúrgicas retas estéreis (18 cm).
- Colocar o animal em uma folha de fresco pano descartável. Cuidadosamente inserir a agulha de 20 G (ligada a uma seringa de 5 ml cheio com PBS estéril 1x (passo 1.4)) dentro da coluna vertebral em direcção ao lado rostral. Mantenha o animal para baixo firmemente e empurre a seringa rapidamente. Toda a medula espinhal deve sair a partir do final do colo do útero. Recolha da medula espinal no interior do tubo 15 mL contendo HBSS.
- Repetir o passo 2.4 para o resto dos ratinhos. Entre cada animal, desinfectar todos os instrumentos utilizados com etanol 70%.
NOTA: Normalmente, uma única placa de 12 poços pode ser estabelecido para cada 4 rato medula espinhal (ver 4.3).
3. Preparação da suspensão de células individuais
Nota: Execute os passos 3 e 4 em uma capa de cultura para manter tudo esterilizado.
- Transfira todas as medulas espinhais na HBSS contendo placa de petri (passo 1.4). Corte cada uma das medulas espinhais em muitos finos, pequenos pedaços com uma tesoura e uma pinça estéril. Transferir o tecido da medula espinhal ao tubo cônico de 50 ml, contendo papaína preparado / mistura de enzima DNase (passo 1.3.5) usando uma pinça estéril ou uma pipeta de 10 (evitar a adição de HBSS à mistura enzimática, tal como esta continuará a diluir o preparado solução de enzima e pode resultar na diminuição do desempenho da enzima).
- Vortex o tubo suavemente para misturar. Incubar o tubo a 37 o C durante 1 h num incubador / agitador com agitação orbital a 150 rpm.
- Vortex e o tubo de novo vigorosamente tritura-se a solução de enzima com o tecido utilizando uma pipeta de 5 mL para promover ainda mais a dissociação.
- Transferir a suspensão de células para um tubo de 15 ml e centrifugar a 300 xg durante 5 min à TA.
- Durante a centrifugação, misturar 2,7 mL de EBSS, com 300 ul de albumina de INH-ovomucóide reconstituídosolução ibitor (1.3.1) em um tubo estéril. Adicionar 150 ul da solução de ADNase (passo 1.3.3).
- Após a centrifugação, remover o sobrenadante e ressuspender o sedimento de células com a solução preparada acima (passo 3.5). Vortex bem para quebrar o sedimento celular.
- Adicionar 3 ml de solução reconstituída albumina-ovomucóide inibidor (passo 1.4.1) para a suspensão de células. células Centrifugar a 70 xg durante 6 minutos à temperatura ambiente. Remover o sobrenadante (que contém os fragmentos de membrana).
4. Além disso remoção da mielina da suspensão de células individuais
- Adiciona-se 8 mL de 20% de meio de gradiente de densidade (preparado no passo 1.2.2) para o tubo contendo o sedimento de células, vortex suavemente para perturbar o sedimento, e centrifugar as células a 800 xg durante 30 min à temperatura ambiente sem travagem. Remova cuidadosamente a camada superior de detritos (principalmente mielina) e o sobrenadante, mas manter o sedimento.
- Para remover vestígios do gradiente de densidade, lavar as células por resuspending o sedimento celular com 8 mL de uma cDMEM diluída (1 parte cDMEM e 2 partes HBSS). Centrifugar as células a 400 xg durante 10 minutos a 4 o C. Remover o sobrenadante e lava-se as células novamente com o cDMEM diluída (de cima) da mesma maneira. Manter as células em gelo até semeando-os.
- Remover o sobrenadante e ressuspender o sedimento de células em meio de cultura (cDMEM fornecido com 2-ME (preparado no passo 1.1)). Para uma placa de 12 poços, utilize 3 mL x 4 (número de ratinhos usados 2 ml) + = 14 ml de meio. Isto irá assegurar que existe suspensão de células suficientes para toda a placa (12 poços) e vai proporcionar para poços adicionais que podem ser usados para determinar o número médio de células por poço e o conteúdo da microglia da cultura. Se vai ser utilizados outros tipos de recipientes de cultura, calcular o volume total de meios de cultura necessária proporcionalmente.
- Adicionar 1 ml de suspensão celular em cada poço de uma placa de 12 poços.
- Incubar as células a 35,9 ° C com 5% de CO 2.
- Alterar a mídia (remover a velha mídia através de aspiração) em D 1 e depois a cada 3 - 4 d depois (normalmente alterar a mídia on D: 1, 4, 8 e 11, e, em seguida, usar as células no dia 12).
NOTA: No dia 1, a cultura pode conter quantidades significativas de detritos devidos à mielina resíduo a partir do tecido da medula espinal; Assim, mudando a mídia no dia 1 é recomendada (consulte o Discussão para mais informações). As culturas estão prontas para tratamento entre D 12 - 14. As células são normalmente 80% confluentes em D 12, e pode ser próxima de 100% confluentes por D 14. Tipicamente, em D 12, existem cerca de 100000 células por poço numa placa de 12 poços .
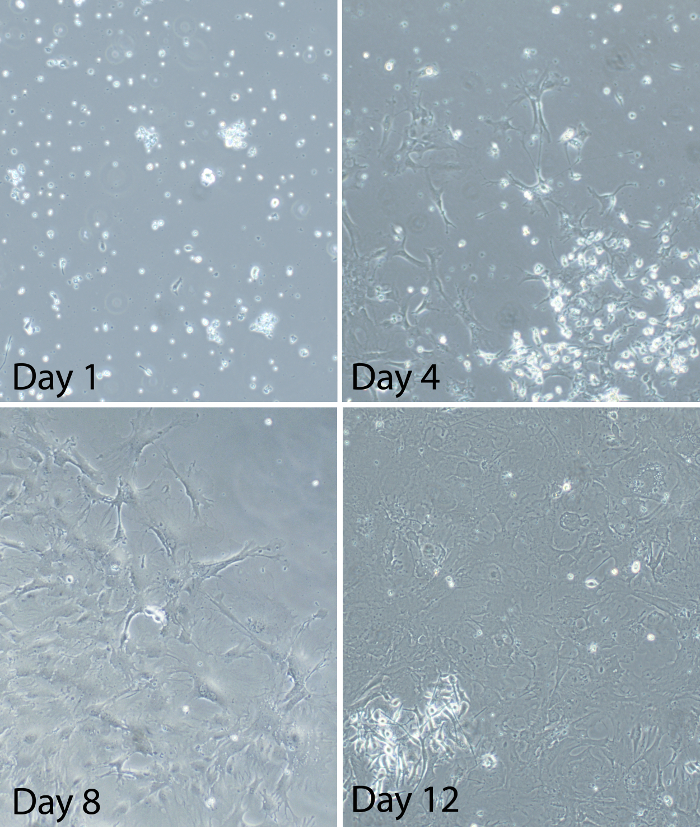
Figura 2:. Imagens representativas de células gliais misturadas em diferentes momentos após o estabelecimento da cultura glia mista medula espinhal glia mistos primários foram preparados a partir de adultos camundongos C57BL / 6. imagens representativasmostram o progresso da cultura glial após o plaqueamento. No dia 1, algumas células são ligados à placa de cultura, mas que ainda são principalmente redondo. Há também muitas células flutuantes e detritos significativo. No dia 4, a maioria das células estão ligados à placa de cultura. Células parecem ramificada com processos visíveis. As células são distribuídas de forma esporádica e culturas são cerca de 20-30% confluentes no momento. No dia 8, as culturas são entre 50-60% confluentes. Algumas áreas das culturas têm grandes manchas de células. Outras áreas das culturas ter um crescimento escasso de células. Algumas células no interior das manchas assumir uma aparência "quadrado-like". No dia 12, as culturas são iguais ou superiores a 80% confluentes (cerca de 90% confluentes na imagem mostrada aqui). Células estão na fase log do crescimento neste momento e entre os dias 12-14 é o momento ideal para o uso das células da glia para experimentos. Por favor clique aqui para ver umaversão maior desta figura.
- Examinar o conteúdo da microglia usando células dos poços adicionais (passo 4.3), através de células activadas por fluorescência padrão (FACS) usando o protocolo de coloração 11, a combinação de anticorpo anti-ratinho-CD45 e os anticorpos monoclonais anti-CD11b de rato. As células CD45 + CD11b + são identificados como microglia.
Resultados
Este método pode ser utilizado para preparar células gliais mistas de ambos os ratinhos e ratos. O número total de células médio por poço numa placa de 12 poços em D 12 pós-iniciação da cultura deve ser relativamente estável, com cerca de 100000 células por poço, quando as células são derivadas de medulas espinais de rato. As células da glia obtidos com este método pode ser utilizado em experiências que se destinam a examinar adultos respostas cabo gliais espinal após administração de substâncias e agentes de interesse. A Figura 3 proporciona um exemplo de respostas de citocinas e quimiocinas a partir de uma experiência típica em que a mediana da medula espinal microglia foram obtidas a partir de adultos ratinhos Balb / C e tratou-se com LPS (Salmonella Minnesota Re595) na D 13 pós-iniciação da cultura. Os sobrenadantes foram recolhidos passadas 24 h de tratamento pós-LPS para a determinação dos níveis de citocinas e quimiocinas através de um ensaio de imunossorvente ligado a enzima (ELISA) usando comercialmente disponíkits le.
Quando este sistema de cultura de células gliais de adultos foi estabelecida em primeiro lugar, as células foram incubadas num meio de cultura padrão, a 37 o C. Sob esta condição, o conteúdo microglial média variou de 5 - 10%. No entanto, observou-se que, apesar do uso de técnicas de cultura consistentes, as culturas que em algumas instâncias têm ou muito baixo teor de microglia (<2%) ou teor relativamente elevado da microglia (15 - 20%) 10. Pode ser frustrante para obter culturas que têm muito poucos microglia quando os resultados experimentais invocar as respostas microgliais na cultura mista. Seguindo a sugestão do Dr. Alejandro MS Mayer (Departamento de Farmacologia, Chicago Faculdade de Medicina Osteopática) 12, o método foi modificado pelo crescimento das células gliais mistas em 35,9 o C. Isto resultou num rendimento mais consistente da microglia e mais elevadas (compreendidas entre 10 - 40% e na maior parte restante ARound 20%) na maioria das culturas. Esta melhoria é ilustrada na Figura 4 Como relatado anteriormente, a microglia são estimadas para perfazer 5 -. 21% da população da glia do SNC em ratos adultos 13-15. Embora ambas as condições de cultura fornecer culturas que contêm quantidades semelhantes de microglia como estimado in vivo, a condição de cultura modificado (35,9 ° C) é mais adequado para as experiências nas quais é crítica para analisar as respostas de ambos os astrócitos e microglia.

Figura 1:. Relacionado com o gene da calcitonina Peptide (CGRP) induzida por quimiocinas pelas células gliais mistas células gliais misto preparado a partir de cérebros / c de ratinho BALB neonatais (esquerda) ou adultos BALB / c de ratinho medulas espinhais (direita) foram tratados com várias doses de CGRP. Níveis de várias quimiocinas em sobrenadantes de cultura foram determinadas através de ensaio multiplex (realizada pelo fabricante) nos horários mais favoráveis (média ± SEM, n = 2-6). Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: citocinas e quimiocinas Respostas de Rato Adulto Spinal Cord Mixed Glia sobre LPS estimulação da medula espinhal células gliais mistos adultos foram preparados a partir de camundongos BALB / c e estimuladas com várias doses de LPS.. Os níveis de IL-6 (A), factor de necrose tumoral (TNF-alfa) (B), proteína de interferão-gama indutível 10 (IP-10, também conhecido como CXCL10) (C), e proteína quimioatractiva de monócitos (1 MCP- 1, também conhecido como CCL2) (D) em sobrenadantes de cultura foram determinados através de ELISA às 24 horas pós-tratamento com LPS.ecsource.jove.com/files/ftp_upload/54801/54801fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 4:. Conteúdo microglia em culturas mista glial Adulto células gliais mistas foram gerados a partir de camundongos adultos C57B6 / L e cultivadas em cada 37 o C ou 35,9 o C. microglial conteúdo de cada cultura foi analisada por meio de citometria de fluxo utilizando a APC-anti-rato-CD45 (clone 30-F11) e FITC anti-ratinho-CD11b (clone M1 / 70). parcelas representativas do análises de citometria de fluxo são mostrados. (Células CD45 + CD11b +) as populações de células totais das culturas foram identificados em parcelas A (37 ° C) e C (35,9 ° C), e as populações microgliais foram ainda isoladas a partir das respectivas populações de células totais na B (37o C) e D (35,9 ° C). Análise de citometria de fluxo foi realizada, e todos os dados foram analisados como descrito anteriormente 5. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
É crítico para executar todas as etapas-incluindo os meios de comunicação Alterar o horário-de maneira consistente, a fim de obter resultados reprodutíveis entre experimentos. Os passos seguintes são particularmente crítico na obtenção de excelente qualidade adulto glia mista.
A digestão enzimática é um aspecto importante deste protocolo. É crucial que os pedaços de tecido são bem digerido, a fim de se obter uma suspensão de célula única. No entanto, o excesso de digestão irá resultar em um número significativamente menor de células. Cada laboratório deve realizar testes-piloto para determinar o tempo de digestão exata com base nos tipos de recipientes utilizados para a incubação, a quantidade de tecido média utilizada cada vez, e do tipo de agitador (rotação em relação agitador orbital). Além disso, independentemente do sistema de dissociação de papaína escolhido, é essencial utilizar os mesmos componentes de forma consistente a partir das mesmas fontes, tal como a substituição ocasional de componentes pode levar a variações significativas no rendimentodo número total de células.
Neste protocolo, a mielina é removido usando um meio de gradiente de densidade. É crítico para fazer e usar soluções de gradiente de densidade à TA uma vez que as densidades destas soluções é sensível à temperatura. Soluções gradiente de densidade são normalmente armazenados a 4 o C. Se necessário, as soluções de gradiente de densidade pode ser mantida à TA durante a noite antes do dia da criação da cultura. Além disso, a seguir a 30 minutos a centrifugação das células em gradiente de densidade de 20%, as células devem ser imediatamente retirados da centrífuga para evitar grandes peças de detritos de deslocamento (isto é, afastando-se do topo da solução; ver passo 4.1).
É importante remover os restos em D 1 após o inicio da cultura. Embora as células irão sobreviver e proliferar se o meio de cultura é mudado todos os 3 a 4 d, para mudar o media sobre D 1 e irá proporcionar uma cultura mais "de repouso" mais "limpo", mais tarde. estepermite que as células crescem num ambiente menos perturbado, e as células podem ser mantidas até 21 d pós-iniciação da cultura.
conteúdo microglial para cada experiência pode ser examinado antes de utilizar a glia misto. Mesmo com a técnica mais consistente, o conteúdo microglial pode ainda variar significativamente entre experimentos. Alguns efeitos celulares são dependentes do conteúdo da microglia 4, 10; assim, é crucial para monitorar o conteúdo microglial de cada conjunto de culturas estabelecidas. Os dados obtidos a partir desta prática pode ajudar a interpretar variações entre experiências, bem como proporcionar novos (por vezes inesperada) conhecimento sobre a contribuição de astrócitos contra microglia sob uma condição experimental particular. Além disso, as variações sazonais no conteúdo microglial foram observados. Este pode ser um fator adicional para considerar quando planear grandes conjuntos de experiências. Além disso, enquanto os neurônios normalmente não vai sobreviver sob nossa condição de cultura,como NeuN (um marcador neuronal-) -positivas células não foram observadas nas nossas culturas gliais após coloração imuno-histoquímica, a cultura pode conter um número limitado de oligodendrócitos (isto não tem sido rotineiramente quantificados). Deve-se decidir se essa população precisa ser examinada em função das condições experimentais específicas.
Tal como acontece com muitos métodos experimentais, este método pode ser modificado de acordo com as necessidades individuais dos investigadores. É essencial para realizar experiências-piloto para testar plenamente as modificações específicas antes de usá-los rotineiramente. Além disso, deve notar-se que as células gliais misto pode ser utilizado para obter empobrecido-microglia e enriquecido em microglia culturas para estudar as respostas de astrócitos-dominante contra células microgliais-dominante após estímulos específicos, tal como anteriormente descrito para as células gliais mistas neonatais 3, 4. no entanto, o rendimento de células enriquecida em microglia será limitado a menos que grandes números de espinalcordas são usadas para estabelecer a cultura no início. Esta é uma limitação deste método, particularmente se os ratos são usados. Quando são utilizados ratos medulas espinais, um indivíduo da medula espinal (em vez de 4 medulas espinais de rato) pode ser utilizado para configurar uma placa de 12 poços. Finalmente, o conteúdo microglial não parece ser significativamente diferentes entre as culturas gliais do rato e rato adulto da medula espinhal 4, 5 mouse e do rato adulto medula espinhal culturas gliais produzir uma resposta vigorosa à estimulação LPS em termos de produção de citocinas.; No entanto, podem ser observadas respostas diferenciais quando estímulos alternativos são utilizados.
No total, este sistema de cultura de células gliais roedor adulto fornece um método alternativo para estudar células gliais in vitro. Os resultados obtidos neste sistema de cultura mais estreitamente reflectir o que seria observado sob condições in vivo em comparação com os resultados obtidos a partir de culturas neonatais ou linhas celulares. No método atual, as células gliais são collected de roedores adultos, como adulto glia respondem a estímulos muito diferente quando comparado com as células da glia neonatal 4 (Figura 1). As células não são manipulados de forma significativa através de procedimentos de imortalização, que seriam usados para gerar e manter linhas de células. Embora este método foi desenvolvido inicialmente para ser usado em estudos de dor neuropática, que pode ser utilizada para estudar outras doenças neurológicas que envolvem alterações patológicas no interior da medula espinal, tais como ALS e MS.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Adult spinal cord mixed cultures were first developed using rats with grant support from an NIH/NIDA R01 award (PI De Leo) and an NIH T32 training grant (PI Green). These methods were further adapted for mouse spinal cords with support from the following grants: NIH/NIDA 5K01DA023503 (PI Cao), NIH/NINDS 5R21NS066130 (PI Cao), and NIH/NIGMS P20GM103643 (PI Meng). The authors would also like to thank Dr. Alejandro M. S. Mayer, Department of Pharmacology, Chicago College of Osteopathic Medicine, for his technical help in obtaining microglia-rich mixed glial cells.
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modification of Eagle’s media (DMEM) with 4.5 g/L glucose | Lonza | 12-709F | The cDMEM media is a standard, widely used culture media. Individual researchers can decide where to purchase the DMEM and all other components used to make cDMEM media. |
| L-Glutamine (100x) | Lonza | 17-605E | The L-glutamine is a standard, widely used component for various culture media. Individual researchers can decide where to purchase L-glutamine. |
| Antibiotic-Antimycotic Solution (100x) | Corning-Mediatech | 30-004-CI | This is a combination of penicillin, streptomycin and Amphotericin formulated to contain 10,000 units/mL penicillin G, 10 mg/mL streptomycin sulfate and 25 µg/mL amphotericin B. Individual researchers can decide where to purchase individual components. |
| 2-mercaptoethanol (2-ME) | Sigma-Aldrich | M3148 | A BioReagent, suitable for cell culture, molecular biology and electrophoresis. |
| Papain dissociation system | Worthington Biochemical Corporation | LK003150 | Individual components of this kit can be purchased separately. |
| Percoll | GE Health Care | 17-0891-01 | Percoll is sold as sterile solution. Undiluted Percoll can be re-autoclaved if needed. |
| Lab-line incubator/shaker | Barstead/Lab-line | MaxQ4000 | This is the incubator/shaker we have currently. Other types of shakers can be used instead. |
| Lipopolysaccharides, Salmonella Minnesota Re595 | Sigma-Aldrich | L-9764 | Other strains of LPS can also induce glial responses. The magnitude of the responses though, may vary. |
| Mouse IL-6 DuoSet ELISA | R&D Systems | DY406 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse TNF-alpha DuoSet ELISA | R&D Systems | DY410 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse IP-10 (CXCL10) DuoSet ELISA | R&D Systems | DY466 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse MCP-1 (CCL2) ELISA Opteia set | BD Biosciences | 555260 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse chemokine Q-Plex | Quansys Biosciences | 120251MS | This product was not available for in-house assay at the time. Instead, we sent out samples to the manufacturer for analysis. |
| APC-anti-mouse-CD45 (clone 30-F11) | eBioscience | 17-0451 | Antibody of the same clone but from other vendors can be used. |
| FITC-anti-mouse-CD11b (clone M1/70) | eBioscience | 11-0112 | Antibody of the same clone but from other vendors can be used. |
| Accuri C6 flow cytometer | BD Biosciences | BD Accuri C6 | Each individual Researcher can use any flow cytometer he or she prefers. |
| FlowJo software | Tree Star, Inc. | FlowJo7.6.5 | Each individual Researcher can use any analysis software he or she prefers. |
Referências
- Gaskin, D. J., Richard, P. The economic costs of pain in the United States. J Pain. 13 (8), 715-724 (2012).
- Ji, R. R., Berta, T., Nedergaard, M. Glia and pain: Is chronic pain a gliopathy? Pain. 154 (01), S10-S28 (2013).
- Ni, M., Aschner, M., et al. Neonatal rat primary icroglia: isolation, culturing and selected applications. Curr Protoc Toxicol. Maines, M. D., et al. , (2010).
- Cao, L., Fei, L., Chang, T. T., DeLeo, J. A. Induction of interleukin-1beta by interleukin-4 in lipopolysaccharide-treated mixed glial cultures: microglial-dependent effects. J Neurochem. 102 (2), 408-419 (2007).
- Malon, J. T., Maddula, S., Bell, H., Cao, L. Involvement of calcitonin gene-related peptide and CCL2 production in CD40-mediated behavioral hypersensitivity in a model of neuropathic pain. Neuron Glia Biol. 7 (2-4), 117-128 (2011).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf / v-myc carrying retrovirus. J Neuroimmunol. 27 (2), 229-237 (1990).
- Bocchini, V., et al. An immortalized cell line expresses properties of activated microglial cells. J Neurosci Res. 31 (4), 616-621 (1992).
- Alliot, F. O., Marty, M. C., Cambier, D., Pessac, B. A spontaneously immortalized mouse microglial cell line expressing CD4. Dev Brain Res. 95 (1), 140-143 (1996).
- Alliot, F. O., Pessac, B. Astrocytic cell clones derived from established cultures of 8-day postnatal mouse cerebella. Brain Res. 306 (1-2), 283-291 (1984).
- Malon, J. T., et al. Microglial content-dependent inhibitory effects of calcitonin gene-related peptide (CGRP) on murine retroviral infection of glial cells. J Neuroimmunol. 279, 64-70 (2015).
- Cao, L., DeLeo, J. A. CNS Infiltrating CD4(+) T lymphocytes Contribute to Murine Spinal Nerve Transection-Induced Neuropathic Pain. Eur J Immunol. 38 (2), 448-458 (2008).
- Mayer, A. M., et al. Effect of a short-term in vitro exposure to the marine toxin domoic acid on viability, tumor necrosis factor-alpha, matrix metalloproteinase-9 and superoxide anion release by rat neonatal microglia. BMC Pharmacol. 1, 7(2001).
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Rock, R. B., et al. Role of Microglia in Central Nervous System Infections. Clin Microbiol Rev. 17 (4), 942-964 (2004).
- Yang, I., Han, S. J., Kaur, G., Crane, C., Parsa, A. T. The Role of Microglia in Central Nervous System Immunity and Glioma Immunology. J Clin Neurosci. 17 (1), 6-10 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados