Method Article
Preparazione delle colture gliali miste primarie da adulti mouse spinale tessuto del midollo
In questo articolo
Riepilogo
Lo sviluppo del dolore neuropatico comporta alterazioni patologiche delle cellule gliali cordone spinale. Un affidabile sistema di coltura gliali derivate da tessuto del midollo spinale adulto e progettato per studiare queste cellule in vitro è carente. Pertanto, mostriamo qui come stabilire colture gliali miste primarie di topo adulto tessuto del midollo spinale.
Abstract
È stato ben accettato che midollo spinale risposte gliali contribuiscono significativamente allo sviluppo del dolore neuropatico. Informazioni enorme per quanto riguarda attività gliali a livello cellulare e molecolare è stata ottenuta attraverso sistemi di colture cellulari in vitro. I sistemi in vitro utilizzati, includono principalmente glia primarie derivate da tessuto corticale cerebrale neonatale e immortalati linee cellulari. Tuttavia, questi sistemi potrebbero non riflettere le caratteristiche delle cellule gliali cordone spinale in vivo. Per studiare ulteriormente il ruolo delle cellule del cavo gliali spinale nello sviluppo del nervo periferico dolore neuropatico lesione indotta utilizzando un sistema di coltura che riflette meglio la condizione in vivo, il nostro laboratorio ha sviluppato un metodo per stabilire primaria del midollo spinale culture gliali miste da topi adulti. In breve, il midollo spinale si raccolti da topi adulti e trattati tramite digestione papaina seguita dalla rimozione mielina con tanelità-pendenza media. Sospensioni cellulari singoli sono coltivate in mezzi di Eagle modificato di Dulbecco completa (cDMEM) supplementato con 2-mercaptoetanolo (2-ME) a 35,9 ° C. Queste condizioni di coltura sono state ottimizzate specificamente per la crescita delle cellule gliali miste. In queste condizioni, le cellule sono pronte per essere utilizzati per la sperimentazione tra 12 - 14 d (cellule di solito sono in fase di log durante questo tempo) dopo la creazione della coltura (D 0) e possono essere tenuti in condizioni di coltura fino a D 21. Questo sistema di coltura può essere usato per studiare le risposte delle cellule gliali cordone spinale dopo stimolazione con varie sostanze e agenti. Inoltre dolore neuropatico, questo sistema può essere usato per studiare le risposte gliali in altre malattie che coinvolgono alterazioni patologiche di cellule gliali cordone spinale.
Introduzione
Il dolore cronico è un grave problema di salute che colpisce circa 100 milioni di adulti negli Stati Uniti, con un costo annuo stimato di un massimo di $ 635.000.000.000 1. Prove di montaggio ha indicato un contributo significativo di cellule gliali cordone spinale nello sviluppo del dolore neuropatico, uno dei più devastanti tipi di dolore cronico 2. Una corretta vitro sistema di coltura in aiuterebbe in maniera significativa nelle indagini ulteriormente i ruoli delle cellule gliali a livello cellulare e molecolare.
Attualmente, le vitro gliali sistemi di coltura utilizzati dai ricercatori includono cellule gliali principalmente derivate da tessuti corticali di topo o ratto cervelli neonatali e immortalati linee di cellule gliali derivate da topo neonatale o ratto cellule gliali primarie. cellule neonatali contengono un numero significativo di cellule indifferenziate che possono essere ulteriormente differenziate in cellule gliali (soprattutto astrociti e microglia), fornendo così uncellule bundant per l'utilizzo sperimentale 3. Tuttavia, il nostro studio precedente ha dimostrato che il cervello neonatale cellule gliali hanno risposto significativamente diverso dalle cellule gliali cordone spinale adulto su lipopolisaccaride (LPS) stimolazione. Ad esempio, l'interleuchina (IL) -4 visualizzata migliorata effetti inibitori sulla ossido nitrico LPS-indotta (NO) la produzione nel ratto adulto midollo spinale glia rispetto al neonatale cervello glia 4. Inoltre, i profili di produzione di chemochine su di stimolazione da parte di un neuropeptide, la calcitonina peptide correlato al gene (CGRP), sono indiscutibilmente differenti tra topo neonatale glia cervello (metodi descritti in Rif. 5) e di topo adulto midollo spinale glia (Figura 1). Linee cellulari stabilizzate sono facili da usare e mantenere e possono fornire un gran numero di cellule in un breve periodo di tempo. In generale, immortalate linee cellulari vengono generati sia utilizzando un sistema immortalizzazione virus-mediata (ad esempio la linea di cellule microgliali diffuso BV2) 6, 7 o dopo the l'identificazione di trasformazione spontanea (come la linea cellulare astrociti C8-D1A e la linea di cellule microgliali C8-B4) 8, 9 linee cellulari sono eccellenti in studio delle caratteristiche molecolari di astrociti e microglia individualmente.; tuttavia, i risultati ottenuti da linee cellulari richiedono sempre ulteriore validazione in cellule primarie o in condizioni in vivo. Va inoltre notato che non c'è stata una relazione di una linea cellulare gliale derivato da un roditore glia del midollo spinale.
Per aiutare indagare il ruolo delle cellule cavo gliali spinale nello sviluppo del dolore neuropatico, un sistema di coltura derivato dal topo adulto midollo spinale è stato sviluppato adattando un metodo precedentemente segnalato utilizzato per generare ratto adulto colture gliali miste 4, 5 . La cultura gliale midollo spinale di topo è stata ulteriormente raffinata recente 10 ed è descritta in dettaglio in questo articolo. Adulti midollo spinale mescolato culture gliali cun essere stabilita con un mouse da ceppi selezionati che si adattano alle esigenze di un particolare studio, e le cellule possono essere mantenute in coltura per un massimo di 21 D postare l'inizio della cultura. Questo metodo può essere usato in studi di dolore neuropatico, nonché in ricerche di varie malattie neurologiche che comportano cambiamenti patologici all'interno del midollo spinale, come la sclerosi laterale amiotrofica (SLA), virus dell'immunodeficienza umana (HIV) -associated neuropatia sensoriale, e multipla La sclerosi (MS).
Protocollo
Il seguente protocollo è stato approvato dal Comitato Istituzionale Animal Care e Usa (IACUC) presso l'Università del New England. Il seguente protocollo è per la preparazione di colture gliali da 4 adulti topo midollo spinale.
1. preparazione di soluzioni in una cappa di coltura in condizioni asettiche
- Preparare terreni di coltura: modifica completa Dulbecco dei mezzi di Eagle (cDMEM) contenente DMEM (con 4,5 g / L di glucosio), il 10% siero fetale bovino (FBS), 2 mM L-glutammina, 100 UI / ml di penicillina, 100 mg / ml di streptomicina , 250 ng / mL Amfotericina B, e 50 mM 2-mercaptoetanolo (2-ME; vedi 1.1.1). Mescolare e filtrare sterilizzare tutti gli altri componenti e quindi aggiungere FBS. Conservare il terreno di coltura a 4 ° C.
- Preparare 50 mm 2-ME / PBS soluzione madre (PBS): aggiungere 100 ml di concentrato 2-ME (14.3 M) in 28,6 ml di PBS 1x, e sterilizzare il filtro (la soluzione può essere conservato a 4 ° C per diversi mesi). USE 1 ml di 2-ME soluzione di riserva per ogni 1.000 ml di terreni di coltura.
- Preparazione del supporto gradiente di densità
- Preparare uno stock isotonica soluzione multimediale gradiente di densità (ad esempio, 100% Percoll) da 1 parte di 10x normale PBS sterile e 9 parti dei media pendenza sterile magazzino densità (ad esempio, Percoll).
- Diluire il supporto gradiente di densità 100% (fatto in 1.2.1) con regolare 1x PBS sterile per fare un supporto gradiente di densità del 20% (ad esempio, 10 ml di 100% dei media gradiente di densità con 40 ml di PBS 1x) e conservarlo a 4 o C. Portare il supporto gradiente di densità 20% a temperatura ambiente (RT) prima di preparare la coltura cellulare.
- Preparazione delle soluzioni dal sistema di dissociazione papaina
NOTA: Il sistema di dissociazione papaina può essere identificato nella tabella materiali. Altri kit dissociazione simili (compresi quelli assemblati in-house) possono anche essere utilizzati. Tutti ComponeNTS devono essere sterili.- Aggiungere 32 ml di soluzione salina bilanciata di Earle (EBSS) alla miscela inibitore ovomucoid (polvere).
- Aggiungere 5 ml di EBSS di un flaconcino papaina (polvere). Posizionare la fiala papaina a 37 o C bagnomaria per 10 minuti o fino a quando la papaina è sciolto.
- Aggiungere 500 ml di EBSS di un flaconcino DNasi (polvere). Mescolare delicatamente.
- Aggiungere 250 ml di soluzione di DNasi (sopra) al flaconcino papaina.
- Calcolare la quantità totale di quanto sopra miscela papaina / DNasi necessario (circa 800 ml di papaina / miscela DNasi per il mouse midollo spinale) e trasferire la miscela necessaria in un tubo da 50 ml per la digestione del tessuto (punto 3.2). Conservare il rimanente nel flacone originale a 4 ° C per almeno due settimane.
- Tenere tutti i componenti dei kit in ghiaccio fino al momento dell'uso.
- Preparare provette per il prelievo del midollo spinale: una provetta sterile 15 ml con 5 ml di soluzione salina bilanciata di Hank (HBSS, dal sistema di papaina di dissociazione,0; per la raccolta di midollo spinale) e una sterile 15 ml di tubo con PBS 1x (per riempire la siringa da 5 ml, vedere il punto 2.4). Inoltre, preparare una piastra di Petri sterile (35 mm o 60 mm) con 5 ml di HBSS e tenerlo nella cappa coltura.
2. midollo spinale Collection
NOTA: Tutte le attrezzature devono essere sterili. Eseguire la collezione in una zona designata approvato dal IACUC.
- Ottenere i seguenti strumenti per la raccolta di topo midollo spinale: diritto / smussato forbici chirurgiche affilate 18 cm, un bisturi da 12 cm standard (3 solid #), in acciaio al carbonio sterili lame di bisturi # 10, un piccolo Decapitator animali, standard di 12 cm curvo forcipe, e un ago 20G sterili attaccato ad una siringa da 5 mL.
- Eutanasia l'animale con CO 2 e disinfettare la testa del mouse e la regione posteriore con il 70% di etanolo (EtOH).
- Decapitare animale con il Decapitator. Fare un incisione longitudinale centrale sulla parte bassa della schiena per esporre lo strato muscolare. Rendereuna transezione pulita attraverso la colonna vertebrati a livello dell'anca (taglio anche attraverso lo strato muscolare che copre la colonna vertebrato) con le forbici chirurgiche rette sterili (18 cm).
- Posto l'animale su un foglio di fresco salvietta monouso. Inserire con attenzione il 20 ago G (attaccato ad una siringa da 5 ml riempita con sterile 1x PBS (punto 1.4)) nella colonna vertebrale verso il lato rostrale. Tenere l'animale verso il basso con forza e spingere la siringa in fretta. L'intero midollo spinale dovrebbe uscire dalla fine cervicale. Raccogliere il midollo spinale nel tubo da 15 ml contenente HBSS.
- Ripetere il passaggio 2.4 per il resto dei topi. Tra ogni animale, disinfettare tutti gli strumenti utilizzati con il 70% EtOH.
NOTA: in genere, un unico 12-pozzetti può essere stabilita per ogni 4 topo midollo spinale (vedi 4.3).
3. Preparazione della cella singola sospensione
Nota: Eseguire i punti 3 e 4 in una cappa di coltura per tenere tutto sterile.
- Trasferire tutti i midolli spinali nella capsula di Petri HBSS contenente (passo 1,4). Tagliare ciascuno dei midollo spinale in tanti sottili, piccoli pezzi con le forbici e pinze sterili. Trasferire il tessuto del midollo spinale al tubo conico da 50 ml contenente la papaina preparato / miscela di enzimi DNasi (fase 1.3.5) utilizzando una pinza sterile o un mL pipetta 10 (evitare di aggiungere HBSS alla miscela di enzimi, in modo da diluire ulteriormente il preparato soluzione enzimatica e può causare una riduzione delle prestazioni di enzima).
- Agitare la provetta delicatamente per miscelare. Incubare la provetta a 37 ° C per 1 h in un incubatore / agitatore orbitale con agitazione a 150 rpm.
- Vortex la provetta nuovo e vigorosamente triturare soluzione enzimatica con il tessuto utilizzando una mL pipetta 5 per promuovere ulteriormente la dissociazione.
- Trasferire la sospensione cellulare in una provetta da 15 ml e centrifugare a 300 xg per 5 minuti a temperatura ambiente.
- Durante la centrifugazione, mescolare 2,7 mL EBSS con 300 ml di ricostituito inh albumina-ovomucoidsoluzione ibitor (1.3.1) in una provetta sterile. Aggiungere 150 ml di soluzione di DNasi (fase 1.3.3).
- Dopo la centrifugazione, rimuovere il supernatante e risospendere il pellet cellulare con la soluzione così preparata (punto 3.5). Vortex bene per rompere il pellet.
- Aggiungere 3 ml di soluzione ricostituita di albumina-ovomucoid inibitore (fase 1.4.1) alla sospensione cellulare. cellule centrifugare a 70 xg per 6 minuti a temperatura ambiente. Rimuovere il surnatante (che contiene frammenti di membrana).
4. ulteriore rimozione della mielina dalla cella singola sospensione
- Aggiungere 8 ml di terreni gradiente di densità 20% (preparato secondo il punto 1.2.2) nella provetta contenente il pellet cellulare, vortex delicatamente per disturbare il pellet e centrifugare le cellule a 800 xg per 30 min a RT senza frenare. Rimuovere con attenzione lo strato superiore di detriti (per lo più mielina) e il surnatante, ma mantenere il pellet.
- Per rimuovere residui del gradiente di densità, lavare le cellule resuspending il pellet cellulare con 8 mL di una cDMEM diluito (1 parte cDMEM e 2 parti HBSS). Centrifugare le cellule a 400 xg per 10 min a 4 ° C. Rimuovere il surnatante e lavare le cellule di nuovo con il cDMEM diluito (sopra) nello stesso modo. Mantenere le cellule in ghiaccio fino al loro semina.
- Rimuovere il surnatante e risospendere il pellet cellulare in terreni di coltura (cDMEM fornito con 2-ME (preparata al punto 1.1)). Per un 12-pozzetti, usare 3 ml x 4 (numero di topi utilizzati) + 2 ml = 14 ml di media. Questo farà sì che vi sia sospensione cellulare sufficiente per l'intera piastra (12 pozzetti) e fornirà per pozzi aggiuntivi che possono essere utilizzati per determinare il numero di cellule per pozzetto medio e il contenuto microglia della cultura. Se vengono utilizzati altri tipi di recipienti di coltura, calcola il volume totale dei terreni di coltura necessaria proporzionalmente.
- Aggiungere 1 ml di sospensione cellulare in ciascun pozzetto di una piastra 12 pozzetti.
- Incubare le cellule a 35,9 ° C con 5% di CO 2.
- Modifica dei media (rimuovere vecchi media tramite aspirazione) su D 1 e poi ogni 3 - 4 D in seguito (in genere a cambiare la media su D: 1, 4, 8, e 11, e quindi utilizzare le celle il giorno 12).
NOTA: Il giorno 1, la cultura può contenere significative quantità di detriti a causa della mielina residuo dal tessuto del midollo spinale; in tal modo, cambiando i media il giorno 1 è raccomandata (si veda la discussione per ulteriori informazioni). Le culture sono pronto per il trattamento tra il D 12 - 14. Le cellule sono di solito 80% confluenti in D 12 e può essere vicino al 100% confluenti da D 14. In genere, il D 12, ci sono circa 100.000 cellule per bene in un 12-pozzetti .
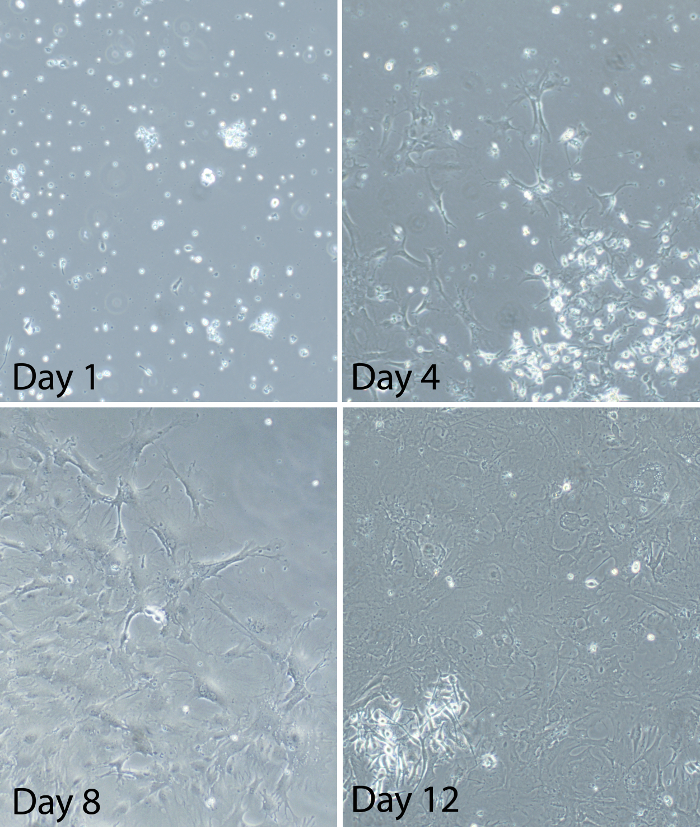
Figura 2:. Immagini rappresentative di cellule gliali miste in tempi diversi dopo l'istituzione della cultura glia mista glia misti midollo spinale primarie sono stati preparati da adulti topi C57BL / 6. immagini rappresentativemostrare lo stato di avanzamento della cultura gliali dopo la placcatura. Al giorno 1, alcune cellule sono attaccati alla piastra di coltura, ma sono ancora in gran parte intorno. Ci sono anche molte cellule galleggianti e detriti significativa. Al giorno 4, la maggior parte delle cellule sono attaccati alla piastra di coltura. Le cellule appaiono ramificata con i processi visibili. Le cellule sono sporadicamente distribuite e culture sono circa il 20-30% confluenti in questo momento. Al giorno 8, le culture sono tra il 50-60% confluenti. Alcune aree delle culture hanno grandi macchie di cellule. Altre aree delle culture hanno una crescita scarsa di cellule. Alcune cellule all'interno delle zone assumono un aspetto "piazza-like". Al giorno 12, le culture sono uguali o superiore a 80% confluenti (circa il 90% confluenti nell'immagine mostrato qui). Cellule sono in fase di log di crescita in questo momento e tra giorni 12-14 è il momento ottimale per l'utilizzo delle cellule gliali per gli esperimenti. Clicca qui per visualizzare ungrande versione di questa figura.
- Esaminare il contenuto utilizzando cellule microgliali dai pozzetti supplementari (punto 4.3) tramite standard di celle a fluorescenza-attivato (FACS) protocollo di colorazione 11 utilizzando la combinazione di anti-topo-CD45 e anticorpi monoclonali anti-topo CD11b. Cellule CD45 + CD11b + sono identificati come microglia.
Risultati
Questo metodo può essere utilizzato per preparare cellule gliali miste sia da topi e ratti. Il numero di cellule totale medio per bene in un 12-pozzetti su D 12 post-iniziale della cultura dovrebbe essere relativamente stabile, con circa 100.000 cellule per bene quando le cellule sono derivate da midollo spinale di topo. Le cellule gliali ottenute da questo metodo possono essere utilizzati in esperimenti che sono stati progettati per esaminare adulti spinale risposte cavo gliali la somministrazione di sostanze e agenti di interesse. La figura 3 fornisce un esempio di citochine e chemochine risposte da un esperimento tipico in cui adulti midollo spinale microglia sono stati ottenuti da topi adulti BALB / C e trattati con LPS (Salmonella Minnesota Re595) su D 13 post-avvio della cultura. Surnatanti sono stati raccolti 24 ore trattamento post-LPS per la determinazione dei livelli di citochine e chemochine mediante un saggio di immunoassorbimento enzimatico (ELISA) utilizzando in commercio disponibilLe kit.
Quando questo sistema di coltura gliali adulto sua costituzione, le cellule sono state incubate in un ambiente di coltura standard a 37 ° C. In questa condizione, il contenuto medio microglia variava da 5 - 10%. Tuttavia, è stato osservato che nonostante l'uso di tecniche di coltura consistenti, culture sarebbero in alcuni casi avere sia molto basso contenuto microglia (<2%) o relativamente alto contenuto microglia (15 - 20%) 10. Può essere frustrante per ottenere colture che hanno ben pochi microglia quando i risultati sperimentali si basano sulle risposte microgliali all'interno della coltura mista. Seguendo il suggerimento del Dr. Alejandro MS Mayer (Dipartimento di Farmacologia, Chicago College of Osteopathic Medicine) 12, il metodo è stato modificato da una crescente delle cellule gliali miste a 35,9 ° C. Ciò ha provocato una resa microglia più coerente e più alta (compresa tra 10 - 40% e rimanendo per lo più around 20%) all'interno della maggioranza delle culture. Questo miglioramento è illustrato nella figura 4 Come riportato in precedenza, microglia sono stimate per compensare 5 -. 21% della popolazione gliale CNS in topi adulti 13-15. Anche se entrambe le condizioni di coltura forniscono culture che contengono quantità simili di microglia come stimato in vivo, la condizione della cultura modificato (35,9 ° C) è più appropriato per gli esperimenti in cui è fondamentale per esaminare le risposte da entrambi i astrociti e microglia.

Figura 1:. CGRP (CGRP) indotta chemochine da cellule gliali miste cellule gliali miste preparate da neonati cervelli topo BALB / c (a sinistra) o di adulti BALB / c del mouse midollo spinale (a destra) sono stati trattati con varie dosi di CGRP. I livelli di diverse chemochine in sovranatanti sono stati determinati tramite test multiplex (eseguita dal costruttore) nei momenti ottimali (media ± SEM, n = 2-6). Clicca qui per vedere una versione più grande di questa figura.

Figura 3: citochine e chemochine Risposte di topo adulto Spinal Cord misto Glia su LPS stimolazione del midollo spinale adulto cellule gliali miste sono state preparate da topi BALB / c e stimolati con varie dosi di LPS.. I livelli di IL-6 (A), fattore di necrosi tumorale (TNF) -alfa (B), interferone-gamma-inducibile proteina 10 (IP-10, noto anche come CXCL10) (C), e monociti chemoattractant protein 1 (MCP 1, conosciuto anche come CCL2) (D) in sovranatanti di coltura sono stati determinati tramite ELISA a 24 ore post-trattamento LPS.ecsource.jove.com/files/ftp_upload/54801/54801fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 4:. Il contenuto microglia in adulti Culture gliali miste cellule gliali miste sono stati generati da topi adulti C57B6 / L e colta sia a 37 ° C o 35,9 ° C. il contenuto della microglia da ogni cultura è stato analizzato mediante citometria a flusso utilizzando APC-anti-topo-CD45 (clone 30-F11) e FITC-anti-topo-CD11b (clone M1 / 70). trame Rappresentante Dalle analisi di citometria di flusso sono mostrati. (Cellule CD45 + CD11b +) Le popolazioni di cellule totale delle colture sono state identificate in trame A (37 ° C) e C (35,9 ° C), e le popolazioni microgliali sono state ulteriormente isolate dalle rispettive popolazioni di cellule totali in B (37o C) e D (35,9 ° C). Analisi dei flussi di citometria è stata eseguita, e tutti i dati sono stati analizzati come descritto in precedenza 5. Clicca qui per vedere una versione più grande di questa figura.
Discussione
È fondamentale per eseguire tutte le operazioni, tra cui il supporto cambiando pianificazione in modo coerente per ottenere risultati riproducibili tra esperimenti. I seguenti passaggi sono particolarmente critico per ottenere un'eccellente qualità adulta glia misto.
La digestione enzimatica è un aspetto importante di questo protocollo. E 'fondamentale che i pezzi di tessuto sono ben digeriti in modo da ottenere una sospensione di cellule singole. Tuttavia, over-digestione comporta significativamente meno cellule. Ogni laboratorio deve eseguire test pilota per determinare il tempo esatto di digestione in base ai tipi di fiale utilizzate per l'incubazione, la quantità media di tessuto utilizzato ogni volta, e il tipo di shaker (girevole rispetto agitatore orbitale). Inoltre, indipendentemente dal sistema papaina dissociazione prescelto, è indispensabile utilizzare sempre gli stessi componenti dalle stesse fonti, come la sostituzione occasionale di componenti potrebbe portare a significative variazioni nella resadel numero totale di cellule.
In questo protocollo, la mielina viene rimosso utilizzando un mezzo di gradiente di densità. E 'fondamentale per creare e utilizzare soluzioni gradiente di densità a temperatura ambiente dato che la densità di queste soluzioni sono sensibili alla temperatura. Le soluzioni gradiente di densità sono solitamente conservati a 4 ° C. Se necessario, le soluzioni gradiente di densità possono essere conservati a temperatura ambiente durante la notte prima del giorno di creazione della cultura. Inoltre, a seguito della 30 min centrifugazione delle cellule del gradiente di densità 20%, le cellule devono essere rimossi immediatamente dalla centrifuga per impedire grossi pezzi di detriti da spostamento (cioè allontanandosi dalla sommità della soluzione; vedere la fase 4.1).
È importante rimuovere detriti sulla D 1 posto iniziazione della cultura. Anche se le cellule sopravvivono e proliferano se il terreno di coltura viene cambiata ogni 3-4 d, cambio di un supporto su D 1 fornirà una più "quiescente" e cultura "pulito" in seguito. Questoconsente alle cellule di crescere in un ambiente meno disturbato, e le cellule possono essere mantenute fino a 21 d post-avvio della cultura.
contenuti microglia per ogni esperimento può essere esaminata prima di utilizzare il glia misto. Anche con la tecnica più coerente, il contenuto della microglia può comunque variare in modo significativo tra esperimenti. Alcuni effetti cellulari dipendono contenuti microglia 4, 10; in tal modo, è fondamentale per monitorare il contenuto di microglia di ogni serie di culture stabiliti. I dati ottenuti da questa pratica può aiutare ad interpretare variazioni tra esperimenti, nonché di fornire nuovi (talvolta inaspettato) conoscenze riguardanti il contributo degli astrociti rispetto microglia in una determinata condizione sperimentale. Inoltre, sono state osservate variazioni stagionali sul contenuto della microglia. Questo può essere un ulteriore fattore da considerare quando si pianifica grandi insiemi di esperimenti. Inoltre, mentre i neuroni di solito non saranno sopravvivere sotto la nostra condizione culturale,come non sono stati osservati NeuN (un marcatore neuronal-) cellule -positive nelle nostre culture gliali dopo la colorazione immunoistochimica, la cultura può contenere un numero limitato di oligodendrociti (questo non è stato quantificato di routine). Si dovrebbe decidere se questa popolazione deve essere esaminata a seconda delle condizioni sperimentali specifiche.
Come con molti metodi sperimentali, questo metodo può essere modificato secondo le esigenze dei singoli ricercatori. E 'essenziale per eseguire esperimenti pilota per testare a fondo le modifiche specifiche prima di utilizzarli regolarmente. Inoltre, va notato che la glia miscelato può essere utilizzato per ottenere colture microgliali impoverito e microglia arricchita per studiare le risposte di astrociti-dominante nei confronti di cellule microgliali dominante dopo stimolazioni specifiche, come precedentemente descritto per neonatali cellule gliali miste 3, 4. Tuttavia, la resa di cellule microgliali arricchita sarà limitato a meno che un gran numero di midollocavi sono utilizzati per stabilire la cultura all'inizio. Questa è una limitazione di questo metodo, in particolare se sono utilizzati topi. Quando vengono utilizzati ratti midollo spinale, uno midollo spinale individuale (invece di 4 topo midollo spinale) può essere utilizzato per impostare un 12-pozzetti. Infine, il contenuto della microglia non sembra essere significativamente differente tra le culture gliali topo e nel ratto adulto midollo spinale 4, 5 Sia topo e nel ratto adulto midollo spinale culture gliali produrre una risposta solida alla stimolazione LPS in termini di produzione di citochine.; Tuttavia, le risposte differenziali possono essere osservati quando si utilizzano stimoli alternativi.
Complessivamente, questo sistema di coltura gliali roditore adulto fornisce un metodo alternativo per studiare le cellule gliali in vitro. I risultati ottenuti con questo sistema di coltura maggiormente riflettono ciò sarebbe osservata in vivo in condizioni rispetto ai risultati ottenuti da colture neonatali o linee cellulari. Nel metodo attuale, le cellule gliali sono craccolte dalle roditori adulti, come adulti glia rispondono agli stimoli in modo molto diverso rispetto a glia neonatale 4 (figura 1). Le cellule non sono manipolati in modo significativo attraverso procedure immortalizzazione, che sarebbero utilizzati per generare e mantenere linee cellulari. Anche se questo metodo è stato inizialmente sviluppato per essere usato in studi di dolore neuropatico, può essere usato per studiare altre malattie neurologiche che comportano cambiamenti patologici all'interno del midollo spinale, come la SLA e MS.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Adult spinal cord mixed cultures were first developed using rats with grant support from an NIH/NIDA R01 award (PI De Leo) and an NIH T32 training grant (PI Green). These methods were further adapted for mouse spinal cords with support from the following grants: NIH/NIDA 5K01DA023503 (PI Cao), NIH/NINDS 5R21NS066130 (PI Cao), and NIH/NIGMS P20GM103643 (PI Meng). The authors would also like to thank Dr. Alejandro M. S. Mayer, Department of Pharmacology, Chicago College of Osteopathic Medicine, for his technical help in obtaining microglia-rich mixed glial cells.
Materiali
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modification of Eagle’s media (DMEM) with 4.5 g/L glucose | Lonza | 12-709F | The cDMEM media is a standard, widely used culture media. Individual researchers can decide where to purchase the DMEM and all other components used to make cDMEM media. |
| L-Glutamine (100x) | Lonza | 17-605E | The L-glutamine is a standard, widely used component for various culture media. Individual researchers can decide where to purchase L-glutamine. |
| Antibiotic-Antimycotic Solution (100x) | Corning-Mediatech | 30-004-CI | This is a combination of penicillin, streptomycin and Amphotericin formulated to contain 10,000 units/mL penicillin G, 10 mg/mL streptomycin sulfate and 25 µg/mL amphotericin B. Individual researchers can decide where to purchase individual components. |
| 2-mercaptoethanol (2-ME) | Sigma-Aldrich | M3148 | A BioReagent, suitable for cell culture, molecular biology and electrophoresis. |
| Papain dissociation system | Worthington Biochemical Corporation | LK003150 | Individual components of this kit can be purchased separately. |
| Percoll | GE Health Care | 17-0891-01 | Percoll is sold as sterile solution. Undiluted Percoll can be re-autoclaved if needed. |
| Lab-line incubator/shaker | Barstead/Lab-line | MaxQ4000 | This is the incubator/shaker we have currently. Other types of shakers can be used instead. |
| Lipopolysaccharides, Salmonella Minnesota Re595 | Sigma-Aldrich | L-9764 | Other strains of LPS can also induce glial responses. The magnitude of the responses though, may vary. |
| Mouse IL-6 DuoSet ELISA | R&D Systems | DY406 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse TNF-alpha DuoSet ELISA | R&D Systems | DY410 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse IP-10 (CXCL10) DuoSet ELISA | R&D Systems | DY466 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse MCP-1 (CCL2) ELISA Opteia set | BD Biosciences | 555260 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse chemokine Q-Plex | Quansys Biosciences | 120251MS | This product was not available for in-house assay at the time. Instead, we sent out samples to the manufacturer for analysis. |
| APC-anti-mouse-CD45 (clone 30-F11) | eBioscience | 17-0451 | Antibody of the same clone but from other vendors can be used. |
| FITC-anti-mouse-CD11b (clone M1/70) | eBioscience | 11-0112 | Antibody of the same clone but from other vendors can be used. |
| Accuri C6 flow cytometer | BD Biosciences | BD Accuri C6 | Each individual Researcher can use any flow cytometer he or she prefers. |
| FlowJo software | Tree Star, Inc. | FlowJo7.6.5 | Each individual Researcher can use any analysis software he or she prefers. |
Riferimenti
- Gaskin, D. J., Richard, P. The economic costs of pain in the United States. J Pain. 13 (8), 715-724 (2012).
- Ji, R. R., Berta, T., Nedergaard, M. Glia and pain: Is chronic pain a gliopathy? Pain. 154 (01), S10-S28 (2013).
- Ni, M., Aschner, M., et al. Neonatal rat primary icroglia: isolation, culturing and selected applications. Curr Protoc Toxicol. Maines, M. D., et al. , (2010).
- Cao, L., Fei, L., Chang, T. T., DeLeo, J. A. Induction of interleukin-1beta by interleukin-4 in lipopolysaccharide-treated mixed glial cultures: microglial-dependent effects. J Neurochem. 102 (2), 408-419 (2007).
- Malon, J. T., Maddula, S., Bell, H., Cao, L. Involvement of calcitonin gene-related peptide and CCL2 production in CD40-mediated behavioral hypersensitivity in a model of neuropathic pain. Neuron Glia Biol. 7 (2-4), 117-128 (2011).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf / v-myc carrying retrovirus. J Neuroimmunol. 27 (2), 229-237 (1990).
- Bocchini, V., et al. An immortalized cell line expresses properties of activated microglial cells. J Neurosci Res. 31 (4), 616-621 (1992).
- Alliot, F. O., Marty, M. C., Cambier, D., Pessac, B. A spontaneously immortalized mouse microglial cell line expressing CD4. Dev Brain Res. 95 (1), 140-143 (1996).
- Alliot, F. O., Pessac, B. Astrocytic cell clones derived from established cultures of 8-day postnatal mouse cerebella. Brain Res. 306 (1-2), 283-291 (1984).
- Malon, J. T., et al. Microglial content-dependent inhibitory effects of calcitonin gene-related peptide (CGRP) on murine retroviral infection of glial cells. J Neuroimmunol. 279, 64-70 (2015).
- Cao, L., DeLeo, J. A. CNS Infiltrating CD4(+) T lymphocytes Contribute to Murine Spinal Nerve Transection-Induced Neuropathic Pain. Eur J Immunol. 38 (2), 448-458 (2008).
- Mayer, A. M., et al. Effect of a short-term in vitro exposure to the marine toxin domoic acid on viability, tumor necrosis factor-alpha, matrix metalloproteinase-9 and superoxide anion release by rat neonatal microglia. BMC Pharmacol. 1, 7(2001).
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Rock, R. B., et al. Role of Microglia in Central Nervous System Infections. Clin Microbiol Rev. 17 (4), 942-964 (2004).
- Yang, I., Han, S. J., Kaur, G., Crane, C., Parsa, A. T. The Role of Microglia in Central Nervous System Immunity and Glioma Immunology. J Clin Neurosci. 17 (1), 6-10 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon