Method Article
Herstellung von primären gemischten Gliazellen Kulturen von erwachsenen Maus Rückenmarksgewebe
In diesem Artikel
Zusammenfassung
Die Entwicklung von neuropathischen Schmerzen handelt pathologischen Veränderungen der Wirbelsäule Gliazellen. Eine zuverlässige Gliazellen Kultursystem aus adulten Rückenmarksgewebe abgeleitet und für diese Zellen in vitro zu studieren fehlt. Deshalb zeigen wir hier, wie primären gemischten Glia-Kulturen von adulten Mausrückenmarksgewebe herzustellen.
Zusammenfassung
Es wurde gut angenommen, dass das Rückenmark glial Reaktionen wesentlich zur Entwicklung von neuropathischen Schmerzen bei. Enorme Informationen über Gliazellen Aktivitäten auf zellulärer und molekularer Ebene wurde durch in - vitro - Zellkultursystemen erhalten. Die in - vitro - Systemen verwendet werden , umfassen vor allem primäre Gliazellen abgeleitet von Neugeborenen Gehirn Rindengewebe und immortalisierten Zelllinien. Jedoch beziehen sich diese Systeme können nicht die Merkmale des Rückenmarks Gliazellen in vivo. Um die Rollen der Rückenmark Gliazellen in der Entwicklung peripherer Nervenverletzung induzierter neuropathischer Schmerz unter Verwendung eines Kultursystems weiter zu untersuchen , die besser auf die in - vivo - Zustand wiedergibt , hat unserem Labor , ein Verfahren zu etablieren primären Rückenmark gemischten Gliakulturen entwickelt von erwachsene Mäuse. Kurz gesagt, werden Rückenmark von erwachsenen Mäusen und verarbeitet durch Papainverdau durch Myelinentfernung mit einem dens gesammelt, gefolgtkeit-Gradientenmedium. Einzelzellsuspensionen werden kultiviert in vollständigen Dulbeccos modifiziertem Eagle Medium (cDMEM) , ergänzt mit 2-Mercaptoethanol (2-ME) bei 35,9 o C. Diese Kulturbedingungen wurden speziell für das Wachstum von gemischten Gliazellen optimiert. Unter diesen Bedingungen bereit sind Zellen zwischen 12 für Experimente verwendet werden - 14 d (Zellen sind in der Regel in der log-Phase während dieser Zeit) nach der Einrichtung der Kultur (D 0) und 21 in Kulturbedingungen bis zu D gehalten werden. Dieses Kultursystem kann verwendet werden, um die Reaktionen des Rückenmarks Gliazellen bei Stimulierung mit verschiedenen Substanzen und Wirkstoffe zu untersuchen. Neben neuropathischen Schmerzen, kann dieses System verwendet werden, glial Reaktionen in andere Krankheiten zu studieren, die pathologischen Veränderungen des Rückenmarks Gliazellen beinhalten.
Einleitung
Chronische Schmerzen sind ein ernstes gesundheitliches Problem , dass etwa 100 Millionen Erwachsene in den Vereinigten Staaten, mit einem geschätzten jährlichen Kosten von bis zu 635.000.000.000 $ 1 betrifft. Montage Beweise hat einen wesentlichen Beitrag des Rückenmarks Gliazellen bei der Entwicklung von neuropathischen Schmerzen angegeben, einer der verheerendsten Arten von chronischen Schmerzen 2. Eine geeignete in vitro - Kultursystem würde dazu beitragen , deutlich weiter die Rolle von Gliazellen auf zellulärer und molekularer Ebene zu untersuchen.
Derzeit umfassen die in - vitro - Glia - Kultursystemen von Forschern verwendet hauptsächlich Gliazellen aus Rindengewebe von neugeborenen Maus oder Ratte Gehirn abgeleiteten Zellen und verewigte Linien Gliazellen aus neonatalen Maus abgeleitet oder primäre Gliazellen Ratte. Neonatal Zellen enthalten eine signifikante Anzahl von undifferenzierten Zellen, die in Gliazellen unterschieden werden weiter können (vor allem Astrozyten und Mikroglia), so dass eine Bereitstellung vonbundant Zellen für die experimentelle Verwendung 3. Allerdings hat unsere früheren Studie gezeigt, dass die neonatale Gehirn Gliazellen Rückenmark Gliazellen auf Lipopolysaccharid (LPS) Stimulation signifikant unterschiedlich von Erwachsenen reagiert. Beispielsweise Interleukin (IL) -4 angezeigt verbesserte hemmende Wirkung auf LPS-induzierten Stickstoffmonoxid (NO) Produktion in adulten Ratten Glia Rückenmark im Vergleich zu neugeborenen Gehirn Glia 4. Des Weiteren sind die Profile der Chemokin - Produktion nach Stimulierung durch ein Neuropeptid, Calcitonin - Gen-verwandtes Peptid (CGRP), unarguably unterschiedlich zwischen neonatalen Mausgehirn Glia (Methods in Ref. 5 beschrieben) und adulten Rückenmark der Maus Glia (Abbildung 1). Etablierte Zelllinien sind leicht zu bedienen und zu warten, und eine große Anzahl von Zellen in einer kurzen Zeitperiode liefern kann. Im allgemeinen sind immortalisierte Zelllinien erzeugt entweder einen Virus-vermittelte Immortalisierung System (wie beispielsweise die weit verbreiteten Mikroglia - Zelllinie , BV2) 6 unter Verwendung von , 7 oder folgenden the Identifizierung von spontanen Transformation (wie beispielsweise die Astrozyten Zelllinie C8-D1A und Mikroglia - Zelllinie C8-B4) 8, 9 Zellinien sind ausgezeichnet in den molekularen Eigenschaften von Astrozyten und Mikroglia individuell studieren. aber die erhaltenen Ergebnisse aus Zelllinien erfordern immer eine weitere Validierung in primären Zellen oder in in vivo - Bedingungen. Es sollte auch angemerkt werden, dass es keinen Bericht einer glialen Zelllinie wurde, die aus einem Nagetier Rückenmark Gliazellen abgeleitet ist.
Um die Rolle des Rückenmarks Gliazellen in der Entwicklung von neuropathischen Schmerzen untersucht, einem Kultursystem , das aus adulten Rückenmark der Maus abgeleitet ist , wurde durch Anpassung einer zuvor berichteten Verfahren entwickelt worden verwendet erwachsenen Ratte gemischten Gliakulturen 4 erzeugen, 5 . Das Rückenmark glial Kultur Maus wurde weitere kürzlich 10 verfeinert und wird ausführlicher in diesem Artikel beschrieben. Erwachsener Rückenmark gemischt Gliakulturen ceine mit einer Maus aus ausgewählten Stämmen hergestellt werden, die den Bedürfnissen der speziellen Studie passen, und die Zellen können für bis zu 21 d nach Beginn der Kultur in Kultur gehalten werden. Dieses Verfahren kann bei neuropathischen Schmerzstudien verwendet werden, sowie in Untersuchungen von verschiedenen neurologischen Erkrankungen, die pathologischen Veränderungen innerhalb des Rückenmarks, wie amyotropher Lateralsklerose (ALS), human immunodeficiency virus (HIV) -assoziierten sensorische Neuropathie beinhalten, und multiple Sklerose (MS).
Protokoll
Das folgende Protokoll wurde von der Institutional Animal Care und Use Committee (IACUC) an der Universität von New England zugelassen. Das folgende Protokoll ist für Glia-Kulturen von 4 erwachsenen Maus Rückenmark vor.
1. Herstellung von Lösungen in einer Kultur Hood unter aseptischen Bedingungen
- Bereiten Kulturmedien: alle Dulbeccos modifiziertes Eagle-Medium (cDMEM), enthaltend DMEM (mit 4,5 g / L Glucose), 10% Fetal Bovine Serum (FBS), 2 mM L-Glutamin, 100 IU / ml Penicillin, 100 mg / ml Streptomycin , 250 ng / ml Amphotericin B und 50 & mgr; M 2-Mercaptoethanol (2-ME, siehe 1.1.1). Mischen Sie und filtern alle anderen Komponenten zu sterilisieren und dann FBS hinzufügen. Bewahren Sie die Kulturmedien bei 4 o C
- Bereiten Sie 50 mM 2-ME / Phosphat-gepufferte Salzlösung (PBS) Stammlösung: 100 l konzentriert 2-ME (14,3 M) in 28,6 ml 1x PBS und Filter zu sterilisieren (die Lösung kann bei 4 ° C gelagert werden mehrere Monate). Use 1 ml 2-ME-Stammlösung für jede 1.000 ml Kulturmedien.
- Herstellung des Dichtegradientenmedien
- Bereiten Sie einen Vorrat isotonische Dichtegradientenmedien Lösung (zB 100% Percoll) von 1 Teil 10x regelmäßigen sterilem PBS und 9 Teile sterile Lager Dichtegradientenmedien (zB Percoll).
- Verdünnen Sie die 100% Dichtegradientenmedien (hergestellt in Abschnitt 1.2.1) mit regelmäßigen 1x steriler PBS mit 20% Dichtegradientenmedien zu machen (zB 10 ml 100% Dichtegradientenmedien mit 40 ml 1x PBS) und speichern sie in 4 o C. Bringen Sie die 20% Dichtegradientenmedien auf Raumtemperatur (RT), bevor die Zellkultur vorbereitet.
- Herstellung von Lösungen aus dem Papain Dissoziation System
ANMERKUNG: Das System Papain Dissoziation in der Werkstoff - Tabelle identifiziert werden. Andere ähnliche Dissoziation kits (einschließlich zusammengebaut in-house) können ebenfalls verwendet werden. Alle components müssen steril sein.- In 32 ml Balanced Salt Solution Earle (EBSS) zum Ovomucoid Hemmittelgemisches (Pulver).
- In 5 ml EBSS einem Papain Fläschchen (Pulver). Platzieren Sie die Papain Phiole in einem 37 ° C Wasserbad für 10 min oder bis das Papain aufgelöst wird.
- In 500 ul EBSS einem DNase Fläschchen (Pulver). Vorsichtig mischen.
- In 250 ul der DNase-Lösung (siehe oben) auf die Papain Fläschchen.
- Berechne die Gesamtmenge der oben Papain / DNase-Gemisch benötigt wird (etwa 800 & mgr; l Papain / DNase Mischung pro Rückenmark der Maus) und übertragen die benötigte Mischung in ein 50 ml-Röhrchen für die Gewebeverdauungs (Schritt 3.2). Bewahren Sie die Überbleibsel in der Originalflasche bei 4 ° C für mindestens zwei Wochen.
- Halten Sie alle Komponenten aus den Kits auf Eis, bis sie benötigt.
- Vorbereitung Rückenmark Sammelröhrchen: ein steriles 15 ml-Röhrchen mit 5 ml Hanks Balanced Salt Solution (HBSS; von der Papain Dissoziation System,0; für Rückenmark) und einem sterilen 15 ml-Röhrchen mit 1x PBS (zum Auffüllen der 5-ml-Spritze zu sammeln, siehe Schritt 2.4). Darüber hinaus bereiten eine sterile Petrischale (35 mm oder 60 mm) mit 5 ml HBSS und halten es in der Kultur Kapuze.
2. Spinal Cord-Sammlung
HINWEIS: Alle Geräte müssen steril sein. Führen Sie die Sammlung in einem bestimmten Bereich durch die IACUC genehmigt.
- Beziehen Sie die folgenden Werkzeuge für die Ernte Maus Rückenmark: gerade scharf / stumpf 18 cm chirurgische Schere, ein 12-cm-Standard Skalpell (# 3 fest), Kohlenstoffstahl sterile Skalpellklingen # 10, ein kleines Tier Decapitator, 12-cm-Standard gebogen Zange und eine sterile Nadel 20G auf eine 5-ml-Spritze angebracht ist.
- Euthanize das Tier mit CO 2 und desinfizieren Sie die Mauskopf und den hinteren Bereich mit 70% Ethanol (EtOH).
- Enthaupten Tier mit dem Decapitator. Machen Sie einen mittleren Längsschnitt auf der unteren Rückseite der Muskelschicht zu belichten. Macheneine saubere Durchtrennung durch die wirbel Säule an der Hüfte Ebene (auch durch die Muskelschicht schneiden, die die wirbel Säule umfasst) mit den sterilen gerade chirurgische Scheren (18 cm).
- Legen Sie das Tier auf einem Blatt frischen Einweg-Feger. Schieben Sie die 20 G-Nadel (an einer 5-ml-Spritze gefüllt mit sterilem 1x PBS (Schritt 1.4)) in die Wirbelsäule in Richtung der rostralen Seite. Halten Sie das Tier nach unten fest, und drücken Sie schnell die Spritze. Die gesamte Rückenmark sollten aus dem zervikalen Ende kommen. Sammeln Sie das Rückenmark in das 15 ml-Röhrchen mit HBSS.
- Wiederholen Sie Schritt 2.4 für den Rest der Mäuse. Zwischen jedem Tier, Desinfektion aller verwendeten Instrumente mit 70% EtOH.
HINWEIS: In der Regel eine einzige 12-Well-Platte für alle 4 Maus Rückenmark festgelegt werden (siehe 4.3).
3. Herstellung der Einzelzellsuspension
Hinweis: Führen Sie die Schritte 3 und 4 in einer Kultur Haube alles steril zu halten.
- Übertragen Sie alle Rückenmark in die HBSS enthaltende Petrischale (Schritt 1.4). Schneiden Sie jede der Rückenmark in viele feine, kleine Stücke mit einer sterilen Schere und Pinzette. Übertragen das Rückenmarksgewebe zu dem 50 ml konischen Röhrchen die vorbereitete Papain / DNase Enzymmischung (Schritt 1.3.5) unter Verwendung einer sterilen Pinzette oder einem 10 ml-Pipette enthält (HBSS vermeiden zu der Enzymmischung hinzufügen, wie dies weiter verdünnt das hergestellte Enzymlösung und zu einer verringerten Leistung des Enzyms führen kann).
- Mischen Sie den Schlauch vorsichtig zu mischen. Inkubieren Sie die Röhrchen bei 37 ° C für 1 h in einem Inkubator / Schüttler mit Orbital bei 150 Umdrehungen pro Minute schütteln.
- Vortex das Rohr wieder und kräftig verreiben der Enzymlösung mit dem Gewebe einer 5 ml Pipette weitere Dissoziation zu fördern.
- Übertragen die Zellsuspension in eine 15-ml-Röhrchen und zentrifugiert bei 300 g für 5 min bei RT.
- Während der Zentrifugation mischen 2,7 ml EBSS mit 300 & mgr; l der rekonstituierten Albumin-Ovomucoid Einwibitor Lösung (1.3.1) in ein steriles Röhrchen. In 150 ul der DNase-Lösung (Schritt 1.3.3).
- Nach der Zentrifugation den Überstand und Zellpellet mit der Lösung oben hergestellt (Schritt 3.5). Vortex gut das Zellpellet zu brechen.
- 3 ml rekonstituiert Albumin-Ovomucoid-Inhibitor-Lösung (Schritt 1.4.1) zu der Zellsuspension. Zentrifugen Zellen bei 70 x g für 6 Minuten bei RT. Entfernen Sie den Überstand (die Membranfragmente enthält).
4. Weitere Entfernen von Myelin aus der Einzelzellsuspension
- 8 ml 20% Dichtegradientenmedien (hergestellt in Schritt 1.2.2) in das Rohr das Zellpellet enthält, vortex sanft das Pellet zu stören, und zentrifugieren Sie die Zellen bei 800 · g für 30 min bei RT ohne Bremse. Entfernen Sie vorsichtig die oberste Schicht von Schutt (meist Myelin) und der Überstand, aber das Pellet halten.
- So entfernen Sie Reste des Dichtegradienten, waschen Sie die Zellen durch resuspending des Zellpellets mit 8 ml einer verdünnten cDMEM (1 Teil cDMEM und 2 Teile HBSS). Zentrifugieren der Zellen bei 400 xg für 10 min bei 4 o C. Entfernen Sie den Überstand und wasche die Zellen erneut mit dem verdünnten cDMEM (oben) in der gleichen Weise. Halten Sie die Zellen auf Eis, bis sie Aussaat.
- Entfernen Sie den Überstand und Zellpellet in Kulturmedien (cDMEM geliefert mit 2-ME (hergestellt in Schritt 1.1)). Für eine 12-Well-Platte, verwenden Sie 3 ml x 4 (Anzahl der verwendeten Mäuse) + 2 ml = 14 ml Medien. Dadurch wird sichergestellt, dass eine ausreichende Zellsuspension für die gesamte Platte (12 Vertiefungen) und wird für zusätzliche Vertiefungen schaffen, die verwendet werden können, die durchschnittliche Zellzahl pro Vertiefung und die Mikroglia-Gehalt der Kultur zu bestimmen. Wenn andere Arten von Kulturgefäßen verwendet werden, die Berechnung der Gesamtmenge der benötigten Kulturmedien proportional.
- 1 ml der Zellsuspension in jede Vertiefung einer 12-Well-Platte.
- Inkubieren der Zellen bei 35,9 o C mit 5% CO 2. die Medien (entfernen alte Medien über Aspiration) auf D 1 und dann alle 3 - 4 d danach (in der Regel die Medien ändern auf D: 1, 4, 8 und 11, und verwenden Sie dann die Zellen am Tag 12).
HINWEIS: Am Tag 1 kann das Kultur erhebliche Mengen an Ablagerungen enthalten aufgrund der Rückstand Myelin aus dem Rückenmarksgewebe; also, die Änderung der Medien am Tag 1 wird empfohlen (bitte die Diskussion für weitere Informationen). Kulturen sind bereit für die Behandlung zwischen D 12 - 14. Die Zellen sind in der Regel 80% konfluenten 12 D und kann durch D 14. Typischerweise in der Nähe von 100% konfluent sein, auf D 12, gibt es etwa 100.000 Zellen pro Well in einer 12-Well-Platte .
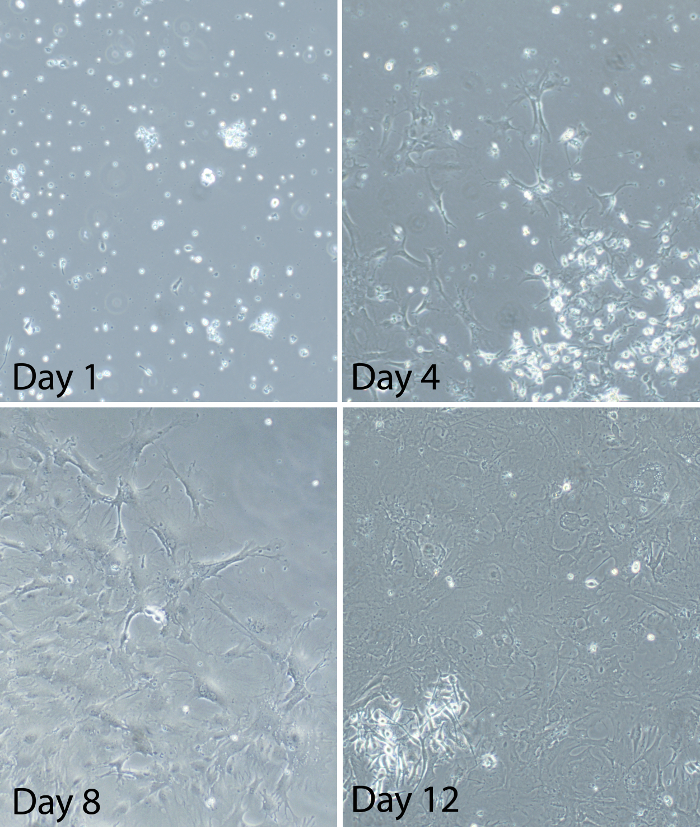
Fig . 2: Repräsentative Bilder von gemischten Gliazellen zu verschiedenen Zeiten nach der Errichtung des gemischten Gliazellen Kultur Primärrückenmark wurden gemischt Glia hergestellt aus adulten C57BL / 6 - Mäusen. Repräsentative Bilderzeigen den Fortschritt der Glia-Kultur nach der Plattierung. Am Tag 1 werden einige Zellen auf der Kulturplatte angebracht, aber sie sind immer noch meist rund. Es gibt auch viele Floating-Zellen und erhebliche Rückstände. Am Tag 4 werden die meisten der Zellen auf der Kulturplatte befestigt. Zellen scheinen mit sichtbaren Prozesse verästelte. Die Zellen werden sporadisch verteilt und Kulturen sind etwa 20-30% konfluent zu diesem Zeitpunkt. Am Tag 8 Kulturen sind zwischen 50-60% konfluent. Einige Bereiche der Kulturen haben große Flecken von Zellen. Andere Bereiche der Kulturen sparse Wachstum von Zellen. Einige Zellen innerhalb der Patches nehmen auf einem "Quadrat-like" Aussehen. Am Tag 12 Kulturen werden bei oder über 80% konfluent (ca. 90% konfluent in dem Bild dargestellt). Die Zellen werden in der Log - Phase des Wachstums in dieser Zeit und zwischen den Tagen 12 bis 14 ist die optimale Zeit für die Gliazellen für Experimente verwenden. Bitte klicken Sie hier anzuschauenGrößere Version der Figur.
- Untersuche die Mikroglia - Zellen Inhalt aus den zusätzlichen Vertiefungen (4.3 Schritt) über Standard - Fluoreszenz-aktivierten Zellsortierung (FACS) Färbeprotokoll 11 unter Verwendung der Kombination von Anti-Maus-CD45 und anti-Maus - CD11b unter Verwendung monoklonaler Antikörper. CD45 + CD11b + Zellen werden als Mikrogliazellen identifiziert.
Ergebnisse
Dieses Verfahren kann verwendet werden, um gemischte Gliazellen von beiden Mäusen und Ratten herzustellen. Die durchschnittliche Gesamtzellzahl pro Vertiefung in einer 12-Well-Platte auf D 12 nach Beginn der Kultur sollte relativ stabil sein, mit etwa 100.000 Zellen pro Vertiefung, wenn die Zellen aus Maus-Rückenmark abgeleitet sind. Gliazellen aus diesem Verfahren erhalten wird, kann in Versuchen verwendet werden, die für Erwachsene glial Rückenmark zu prüfen sollen Antworten auf die Verabreichung von Substanzen und Mittel von Interesse dar. 3 stellt ein Beispiel von Zytokin und Chemokin - Antworten von einem typischen Experiment , in dem Erwachsenenrückenmark Mikroglia wurden aus erwachsenen BALB / c - Mäusen erhalten und mit LPS (Salmonella minnesota Re595) auf D 13 nach Beginn der Kultur behandelt. Überstände wurden über ein enzyme-linked immunosorbent assay (ELISA) unter Verwendung von handels availab 24 h nach LPS-Behandlung zur Bestimmung der Zytokin und Chemokin Ebenen gesammeltle-Kits.
Wenn diese Erwachsenen Gliazellen Kultursystem zuerst gegründet wurde, wurden die Zellen bei 37 ° C in einer Standard - Kultur Umgebung inkubiert Unter dieser Bedingung betrug die durchschnittliche Mikroglia-Gehalt von 5 bis 10%. Es wurde jedoch festgestellt , dass trotz der Verwendung konsistenter Kulturtechniken würde Kulturen in einigen Fällen entweder sehr niedrige Mikroglia - Gehalt (<2%) oder relativ hohen Mikroglia - Gehalt (15 bis 20%) 10. Es kann frustrierend sein, Kulturen zu erhalten, die nur sehr wenige Mikroglia haben, wenn die experimentellen Ergebnisse auf die Mikroglia-Antworten innerhalb der Mischkultur verlassen. Nach dem Vorschlag von Dr. Alejandro MS Mayer (Institut für Pharmakologie, Chicago College of Osteopathic Medicine) 12 wurde das Verfahren durch Züchten der gemischten Gliazellen verändert bei 35,9 o C. Dies führte zu einer konsistenteren und höhere Mikroglia-Ausbeute (im Bereich von 10 - 40% und die verbleibenden meist around 20%) innerhalb der Mehrzahl der Kulturen. Diese Verbesserung ist in Abbildung 4 dargestellt Wie bereits berichtet, Mikroglia sind schätzungsweise bilden . 5 - Glia Bevölkerung 21% des ZNS in erwachsenen Mäusen 13-15. Obwohl beide Kulturbedingungen Kulturen schaffen , die ähnliche Mengen an Mikroglia enthalten als in vivo abgeschätzt ist das modifizierte Kulturbedingung (35,9 o C) besser geeignet für Experimente , in denen es wichtig ist , die Antworten von beiden Astrozyten und Mikroglia zu untersuchen.

Abb . 1: Calcitonin Gene-Related Peptide (CGRP) -induzierten Chemokinproduktion von Mixed Gliazellen Mixed Glia - Zellen , hergestellt von Neugeborenen Balb / c - Maus Gehirn (links) oder erwachsenen BALB / c - Maus Rückenmark (rechts) wurden mit verschiedenen Dosierungen behandelt von CGRP. Niveaus von mehreren Chemokinen in den Kulturüberständen wurden über Multiplex - Assays bestimmt zu optimalen Zeitpunkten (vom Hersteller durchgeführt) (Mittelwert ± SEM, n = 2 - 6). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 3: Cytokine und Chemokine Responses of Mouse Spinal Cord Adult Gemischte Glia auf LPS Stimulation Erwachsenenrückenmark gemischten Gliazellen aus BALB / c Mäusen und stimuliert mit verschiedenen Dosen von LPS hergestellt.. Niveaus von IL-6 (A), Tumor - Nekrose - Faktor (TNF) -alpha (B), Interferon-gamma-inducible protein 10 (IP-10, auch als CXCL10 bekannt) (C) und monocyte chemoattractant protein 1 (MCP 1, die auch als CCL2) (D) in den Kulturüberständen wurden durch ELISAs bekannt bei 24 h nach der LPS - Behandlung bestimmt.ecsource.jove.com/files/ftp_upload/54801/54801fig2large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 4:. Microglial Inhalt in der Erwachsenen Gemischte Gliazellen Kulturen Gemischte Gliazellen wurden von erwachsenen C57B6 / L Mäusen erzeugt und kultiviert bei entweder 37 ° C oder 35,9 o C. Mikroglia Inhalte von jeder Kultur wurde mittels Durchflusscytometrie unter Verwendung von APC-anti-Maus-CD45 (Klon 30-F11) und FITC-Anti-Maus-CD11b (Klon M1 / 70) untersucht. Repräsentative Diagramme der durchflusszytometrischen Analysen gezeigt. Die Gesamtzellpopulationen aus den Kulturen in Plots A (37 o C) und C (35,9 o C) und die Mikroglia - Populationen (CD45 + CD11b + Zellen) wurden weiterhin getrennt von den jeweiligen Gesamtzellpopulationen in B identifiziert wurden (37o C) und D (35,9 o C). Die durchflusszytometrische Analyse wurde durchgeführt, und alle Daten analysiert wurden wie zuvor 5 beschrieben. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Es ist wichtig, alle Schritte-einschließlich der Medien zur Durchführung plan in einer konsistenten Art und Weise zu ändern, um zu reproduzierbaren Ergebnissen zwischen den Experimenten erhalten. Die folgenden Schritte sind besonders kritisch in ausgezeichneter Qualität erwachsenen gemischten Glia zu erhalten.
Die enzymatische Verdauung ist ein wichtiger Aspekt dieses Protokolls. Entscheidend ist, dass die Gewebestücke sind gut verdaut, um eine Einzelzellsuspension zu erhalten. Allerdings wird über Verdauung in deutlich weniger Zellen zur Folge haben. Jedes Labor muss Pilottests durchzuführen, um die genaue Aufschlusszeit über die Arten von Fläschchen für die Inkubation, die durchschnittliche Gewebemenge jedes Mal verwendet, zu bestimmen, und die Art der Schüttler (Drehen gegen Schüttler) verwendet. Ferner, unabhängig von der Papain-Dissoziierung System gewählt, ist es wichtig, stets die gleichen Komponenten aus den gleichen Quellen verwenden, da der gelegentliche Austausch von Komponenten zu erheblichen Schwankungen in der Ausbeute führen könnteder Gesamtzahl der Zellen.
In diesem Protokoll wird das Myelin entfernt, um ein Dichtegradienten-Medium verwendet wird. Es ist wichtig, zu machen und Dichtegradient-Lösungen bei RT da die Dichten dieser Lösungen sind temperaturempfindliche verwenden. Dichtegradienten - Lösungen werden üblicherweise bei 4ºC gelagert Falls erforderlich, kann der Dichtegradient-Lösungen bei RT aufbewahrt werden über Nacht vor dem Tag des Einstellens der Kultur auf. Außerdem nach 30 min Zentrifugieren der Zellen in der 20% Dichtegradienten, sollten die Zellen unmittelbar aus der Zentrifuge entfernt werden große Stücke von Ablagerungen zu verhindern , Verschiebung (dh weg von der Oberseite der Lösung; siehe Schritt 4.1).
Es ist wichtig, Ablagerungen auf D 1 nach Beginn der Kultur zu entfernen. Obwohl Zellen überleben und sich vermehren, wenn das Kulturmedium alle 3 bis 4 d geändert wird, Medien auf D Ändern 1 wird später eine "Ruhe" und "sauberer" Kultur bieten. DiesZellen können in einer weniger gestörten Umgebung zu wachsen, und die Zellen zu 21 d nach der Initiierung der Kultur gehalten werden können.
Mikroglia-Gehalt für jedes Experiment kann vor der Verwendung des gemischten Gliazellen untersucht. Auch mit der beständigsten Technik kann Mikroglia-Gehalt variieren immer noch deutlich zwischen den Experimenten. Einige zelluläre Effekte sind abhängig von Mikroglia - Gehalt 4, 10; Daher ist es entscheidend, den Mikroglia Inhalt jedes Satzes von Kulturen etabliert zu überwachen. Die Daten aus dieser Praxis erhalten kann helfen, Variationen zwischen den Experimenten zu interpretieren, sowie die Bereitstellung von neuen (manchmal unerwartete) Kenntnisse in Bezug auf den Beitrag von Astrozyten im Vergleich zu Mikroglia unter einer bestimmten experimentellen Bedingungen. Darüber hinaus haben saisonalen Schwankungen auf Mikroglia-Gehalt beobachtet. Dies kann ein zusätzlicher Faktor zu berücksichtigen, wenn große Mengen von Experimenten zu planen. Hinzu kommt, dass Neuronen in der Regel nicht unter unseren Kulturbedingungen überleben,wie NeuN (a neuronal- Marker) -positiven Zellen in unserem Gliakulturen nach immunhistochemischen Färbung nicht beobachtet wurde, kann die Kultur eine begrenzte Anzahl von Oligodendrozyten enthalten (diese routinemäßig nicht quantifiziert wurde). Man sollte sich entscheiden, ob diese Population untersucht werden muss, je nach den spezifischen experimentellen Bedingungen.
Wie bei vielen experimentellen Verfahren kann dieses Verfahren nach einzelner Forscher an die Bedürfnisse angepasst werden. Es ist wichtig, Pilotversuche durchzuführen, voll auf die spezifischen Änderungen zu testen, bevor sie routinemäßig verwendet wird. Ferner ist zu beachten, dass das gemischte Glia verwendet werden kann Mikroglia abgereicherte und Mikroglia angereicherten Kulturen zu erhalten , die Antworten von Astrozyten-dominant Vergleich Mikroglia-dominant Zellen nach bestimmten Stimulationen zu studieren, wie zuvor für neonatale gemischten Gliazellen 3 beschrieben, 4. Allerdings ist die Ausbeute von Mikroglia-Zellen angereichert werden , es sei denn eine große Anzahl von spinalen begrenztSchnüre werden verwendet, um die Kultur zu Beginn zu etablieren. Dies ist eine Beschränkung dieses Verfahrens, insbesondere dann, wenn Mäuse verwendet werden. Wenn Rattenrückenmark verwendet werden, eine individuelle Rückenmark (statt 4 Maus Rückenmark) können verwendet werden, um eine 12-Well-Platte einzurichten. Schließlich wird der Mikroglia - Inhalt erscheint nicht signifikant verschieden zu sein zwischen Maus und Ratte erwachsenen Rückenmark Gliakulturen 4, 5 Beide Maus und Ratte erwachsenen Rückenmark Gliakulturen eine robuste Reaktion auf LPS - Stimulation in Bezug auf die Produktion von Zytokinen erzeugen. jedoch kann unterschiedlichen Reaktionen beobachtet werden, wenn alternative Stimuli verwendet werden.
Insgesamt bietet diese rodent erwachsenen glial Kultursystem , ein alternatives Verfahren Gliazellen in vitro zu studieren. Die Ergebnisse dieser Kultursystem erhalten genauer widerspiegeln , was aus neonatalen Kulturen oder Zelllinien unter in vivo - Bedingungen im Vergleich zu den Ergebnissen beobachtet werden würde. In der aktuellen Verfahren sind Gliazellen collected von erwachsenen Nagern als Erwachsener Gliazellen reagieren sehr unterschiedlich , wenn die Neugeborenen - Glia 4 (Abbildung 1) im Vergleich zu Stimuli. Die Zellen werden nicht wesentlich durch Immortalisierung Verfahren manipuliert werden, die verwendet werden würde, zu erzeugen und zu Zelllinien aufrechtzuerhalten. Obwohl dieses Verfahren zunächst bei neuropathischen Schmerzstudien verwendet werden, entwickelt wurde, kann es verwendet werden, um andere neurologische Erkrankungen zu untersuchen, die pathologischen Veränderungen innerhalb des Rückenmarks beinhalten, wie ALS und MS.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Adult spinal cord mixed cultures were first developed using rats with grant support from an NIH/NIDA R01 award (PI De Leo) and an NIH T32 training grant (PI Green). These methods were further adapted for mouse spinal cords with support from the following grants: NIH/NIDA 5K01DA023503 (PI Cao), NIH/NINDS 5R21NS066130 (PI Cao), and NIH/NIGMS P20GM103643 (PI Meng). The authors would also like to thank Dr. Alejandro M. S. Mayer, Department of Pharmacology, Chicago College of Osteopathic Medicine, for his technical help in obtaining microglia-rich mixed glial cells.
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modification of Eagle’s media (DMEM) with 4.5 g/L glucose | Lonza | 12-709F | The cDMEM media is a standard, widely used culture media. Individual researchers can decide where to purchase the DMEM and all other components used to make cDMEM media. |
| L-Glutamine (100x) | Lonza | 17-605E | The L-glutamine is a standard, widely used component for various culture media. Individual researchers can decide where to purchase L-glutamine. |
| Antibiotic-Antimycotic Solution (100x) | Corning-Mediatech | 30-004-CI | This is a combination of penicillin, streptomycin and Amphotericin formulated to contain 10,000 units/mL penicillin G, 10 mg/mL streptomycin sulfate and 25 µg/mL amphotericin B. Individual researchers can decide where to purchase individual components. |
| 2-mercaptoethanol (2-ME) | Sigma-Aldrich | M3148 | A BioReagent, suitable for cell culture, molecular biology and electrophoresis. |
| Papain dissociation system | Worthington Biochemical Corporation | LK003150 | Individual components of this kit can be purchased separately. |
| Percoll | GE Health Care | 17-0891-01 | Percoll is sold as sterile solution. Undiluted Percoll can be re-autoclaved if needed. |
| Lab-line incubator/shaker | Barstead/Lab-line | MaxQ4000 | This is the incubator/shaker we have currently. Other types of shakers can be used instead. |
| Lipopolysaccharides, Salmonella Minnesota Re595 | Sigma-Aldrich | L-9764 | Other strains of LPS can also induce glial responses. The magnitude of the responses though, may vary. |
| Mouse IL-6 DuoSet ELISA | R&D Systems | DY406 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse TNF-alpha DuoSet ELISA | R&D Systems | DY410 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse IP-10 (CXCL10) DuoSet ELISA | R&D Systems | DY466 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse MCP-1 (CCL2) ELISA Opteia set | BD Biosciences | 555260 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse chemokine Q-Plex | Quansys Biosciences | 120251MS | This product was not available for in-house assay at the time. Instead, we sent out samples to the manufacturer for analysis. |
| APC-anti-mouse-CD45 (clone 30-F11) | eBioscience | 17-0451 | Antibody of the same clone but from other vendors can be used. |
| FITC-anti-mouse-CD11b (clone M1/70) | eBioscience | 11-0112 | Antibody of the same clone but from other vendors can be used. |
| Accuri C6 flow cytometer | BD Biosciences | BD Accuri C6 | Each individual Researcher can use any flow cytometer he or she prefers. |
| FlowJo software | Tree Star, Inc. | FlowJo7.6.5 | Each individual Researcher can use any analysis software he or she prefers. |
Referenzen
- Gaskin, D. J., Richard, P. The economic costs of pain in the United States. J Pain. 13 (8), 715-724 (2012).
- Ji, R. R., Berta, T., Nedergaard, M. Glia and pain: Is chronic pain a gliopathy? Pain. 154 (01), S10-S28 (2013).
- Ni, M., Aschner, M., et al. Neonatal rat primary icroglia: isolation, culturing and selected applications. Curr Protoc Toxicol. Maines, M. D., et al. , (2010).
- Cao, L., Fei, L., Chang, T. T., DeLeo, J. A. Induction of interleukin-1beta by interleukin-4 in lipopolysaccharide-treated mixed glial cultures: microglial-dependent effects. J Neurochem. 102 (2), 408-419 (2007).
- Malon, J. T., Maddula, S., Bell, H., Cao, L. Involvement of calcitonin gene-related peptide and CCL2 production in CD40-mediated behavioral hypersensitivity in a model of neuropathic pain. Neuron Glia Biol. 7 (2-4), 117-128 (2011).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf / v-myc carrying retrovirus. J Neuroimmunol. 27 (2), 229-237 (1990).
- Bocchini, V., et al. An immortalized cell line expresses properties of activated microglial cells. J Neurosci Res. 31 (4), 616-621 (1992).
- Alliot, F. O., Marty, M. C., Cambier, D., Pessac, B. A spontaneously immortalized mouse microglial cell line expressing CD4. Dev Brain Res. 95 (1), 140-143 (1996).
- Alliot, F. O., Pessac, B. Astrocytic cell clones derived from established cultures of 8-day postnatal mouse cerebella. Brain Res. 306 (1-2), 283-291 (1984).
- Malon, J. T., et al. Microglial content-dependent inhibitory effects of calcitonin gene-related peptide (CGRP) on murine retroviral infection of glial cells. J Neuroimmunol. 279, 64-70 (2015).
- Cao, L., DeLeo, J. A. CNS Infiltrating CD4(+) T lymphocytes Contribute to Murine Spinal Nerve Transection-Induced Neuropathic Pain. Eur J Immunol. 38 (2), 448-458 (2008).
- Mayer, A. M., et al. Effect of a short-term in vitro exposure to the marine toxin domoic acid on viability, tumor necrosis factor-alpha, matrix metalloproteinase-9 and superoxide anion release by rat neonatal microglia. BMC Pharmacol. 1, 7(2001).
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Rock, R. B., et al. Role of Microglia in Central Nervous System Infections. Clin Microbiol Rev. 17 (4), 942-964 (2004).
- Yang, I., Han, S. J., Kaur, G., Crane, C., Parsa, A. T. The Role of Microglia in Central Nervous System Immunity and Glioma Immunology. J Clin Neurosci. 17 (1), 6-10 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten