Method Article
성인 마우스 척수 조직에서 차 혼합 폐해 문화의 준비
요약
신경 병성 통증의 개발 척수 신경교 세포의 병리학 적 변화를 수반한다. 시험관 내에서 이들 세포를 공부 성인 척수 조직으로부터 유래 설계된 신뢰성 신경교 배양 시스템이 부족하다. 따라서, 우리는 성인 마우스 척수 조직에서 차 혼합 된 아교 문화를 설정하는 방법을 여기에 표시됩니다.
초록
척수 신경교 반응은 신경 병증 통증의 발전에 크게 기여하는 것이 잘 인정되었다. 세포 및 분자 수준에서 신경교 활동에 대한 상당한 정보를 시험 관내 세포 배양 시스템을 통해 얻어진다. 사용 된 시험 관내 시스템은 주로 신생아의 뇌 피질 조직으로부터 유도 된 일차 신경교 포함 및 세포주 불멸. 그러나, 이러한 시스템은 생체 내에서 척수 신경교 세포의 특성을 반영하지 않을 수있다. 더 나은 생체 상태를 반영 배양 시스템을 이용하여 말초 신경 손상 - 유도 된 신경 병증 통증의 개발 척수 신경교 세포의 역할을 조사하기 위해, 우리 실험실에서 기본 척수 혼합 신경교 배양을 설정하는 방법을 개발했다 성인 마우스. 간단히, 척수는 성인 쥐에서 수집하고 굴과 수초 제거하여 파파인 소화를 통해 처리됩니다성만 구배 매체. 단일 세포 현탁액은 35.9 오 ℃에서 2- 머 캅토 에탄올 (2-ME) 보충 완전한 둘 베코의 변형 이글 미디어 (cDMEM)에서 배양 이러한 배양 조건은 혼합 아교 세포의 성장을 위해 특별히 최적화된다. 이러한 조건 하에서, 셀 (12) 사이의 실험에 사용될 준비가 - 14 일 배양의 설립 (D 0) 후 (셀이 기간 동안 로그 단계에서 일반적 임) 및 D (21)까지의 배양 조건에서 유지 될 수있다. 이 배양 시스템은 다양한 물질 및 제제로 자극시 척수 신경교 세포의 반응을 조사하기 위해 사용될 수있다. 신경 병성 통증 외에,이 시스템은 척수 신경교 세포의 병리학 적 변화를 포함하는 다른 질병의 폐해 반응을 연구하는데 사용될 수있다.
서문
만성 통증은 최대 $ (635) 10 억의 추정 연간 비용으로, 미국에서 약 1 억 성인에 영향을 미치는 심각한 건강 문제이다. 증거 확보는 신경 병증 통증, 만성 통증이 가장 파괴 한 가지의 개발 척수 신경교 세포의 상당한 기여를 표시하고있다. 적절한 시험 관내 배양 시스템은 세포 및 분자 수준에서 신경교 세포의 역할을 조사 크게 도움이 될 것이다.
현재 연구에서 사용되는 시험 관내 신경교 배양 시스템은 신생아 마우스 또는 쥐의 뇌 피질 조직 유래 주로 아교 세포를 포함하는 불멸화 및 신생아 마우스로부터 유도 된 아교 세포주 또는 일차 신경교 세포를 쥐. 신생아 세포 따라서를 제공, 추가 (주로 성상 세포 및 미세 아교 세포) 신경 교세포로 분화 할 수있는 미분화 세포의 큰 숫자를 포함실험 사용 3 bundant 세포. 그러나, 우리의 이전 연구는 신생아의 뇌 신경 교세포는 리포 폴리 사카 라이드 (LPS) 자극에 성인 척수 아교 세포에서 크게 다르게 반응 것으로 나타났습니다. 예를 들면, 인터루킨 (IL)는 -4 신생아의 뇌 신경교 4 비교 성숙한 래트 척수에서 신경교 (NO)의 생산 LPS 유도 된 산화 질소에 대한 억제 효과를 강화 표시됩니다. 또한, 유전자 관련 펩타이드 (CGRP) 칼시토닌 신경 펩티드에 의한 자극에 따라 케모카인 생산의 프로파일은, (5. 참고 문헌에 기술 된 방법) 신생 마우스의 뇌 신경교 사이 말할 나위 다른 성인 마우스 척수 신경교 (도 1). 확립 된 세포주를 사용 및 유지 관리가 용이하고 단시간에 다수의 셀을 제공 할 수있다. 일반적으로, 세포주를 생성하거나 6, 7, 또는 다음의 제 (예 널리 사용 소교 세포주 BV2 등) 바이러스 - 매개 불멸화 시스템을 사용하는 불멸화자발 변환의 전자 식별 (예 성상 세포주 C8-D1A 및 소교 세포주 C8-B4)를 8, 9 세포주 개별적 성상 세포 및 미세 아교 세포의 분자 적 특징을 연구하는데 우수하다.; 그러나, 세포주에서 얻어진 결과는 항상 주요 세포 또는 생체 내 조건에서의 추가 확인을 요구한다. 또한 설치류의 척수 아교에서 유래하는 아교 세포주 보고서가 없었던 것을 주목해야한다.
신경 병증 성 통증, 성인 쥐 혼합 신경교 배양 (4)를 생성하는 데 사용되는 이전에보고 된 방법을 적용하여 개발 된 성인 마우스 척수로부터 유래 배양 시스템 (5)의 개발 척수 신경교 세포의 역할을 조사하는 데 도움 . 마우스 척수 폐해 문화는 더 최근에 (10)를 정제하고,이 문서에 자세히 설명되어 있습니다. 성인 척수 혼합 폐해 문화의 C는 특정 연구의 요구에 맞게 선택된 균주로부터 마우스를 확립하고, 세포를 배양 개시 게시 d는 최대 21 명까지 배양 유지할 수있다. 이 방법뿐만 아니라 -associated 근 위축성 측삭 경화증 (ALS), 인간 면역 결핍 바이러스 (HIV) 감각 신경 병증, 복수 등의 척수 내 병리학 적 변화를 포함하는 다양한 신경 질환의 연구에서, 신경병 통증의 연구에 사용될 수있다 경화증 (MS).
프로토콜
다음 프로토콜은 뉴 잉글랜드 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었다. 다음 프로토콜은 4 성인 마우스 척수에서 아교 문화를 준비입니다.
무균 조건 하에서 문화 후드에서 솔루션 1. 준비
- 배양 배지를 준비 : 이글 미디어 (cDMEM) DMEM을 함유하는 완전한 둘 베코 변형 10 % 태아 소 혈청 (FBS), 2 mM L- 글루타민, 100 IU / ㎖ 페니실린 (4.5 g / L의 포도당), 100 ㎎ / ㎖ 스트렙토 마이신 250 NG / ㎖의 암포 테리 신 B, 및 50 μM 2- 머 캅토 에탄올 (2-ME는, 1.1.1 참조). 믹스와 다른 모든 구성 요소를 소독 필터링하고 FBS를 추가합니다. 4 오 ℃에서 배양 배지를 저장
- 50 ㎜ × 2-ME / 인산 완충 식염수 (PBS) 스톡 용액을 제조 하였다 : 100 ㎕를 추가 농축 2 ME 28.6 1X PBS mL를 필터 소독 (용액을 4 ℃로 저장 될 수로 (14.3 M) 몇 달). 유문화 미디어의 1,000 mL의 2-ME 원액의 자체 1 mL를.
- 밀도 구배 매체의 제조
- 주식 등장 밀도 구배 매체 용액을 제조 하였다 (예를 들어, 100 % 퍼콜) 1 부 배 정규 멸균 PBS 9 부 멸균 스톡 밀도 구배 매체 (예를 들어, 퍼콜) 발.
- 20 %의 밀도 구배 매체 (예를 들면, 1X PBS 40 mL로 100 % 밀도 구배 배지 10 mL)을 만들기 위해 정기적 1X 멸균 PBS로 (1.2.1 제) 100 % 밀도 구배 매체를 희석 4에서 보관 오 C. 세포 배양을 준비하기 전에, 실온 (RT) 내지 20 % 밀도 구배 매체를 준비한다.
- 파파인 해리 시스템에서 용액의 제조
주 : 파파인 해리 시스템은 자료 표에서 확인할 수있다. (자체 조립 포함) 다른 유사한 분리 키트를 사용할 수도있다. 모든 compone국세청은 멸균해야합니다.- ovomucoid 억제제 혼합물 (분말)에 얼의 균형 소금 솔루션 (EBSS)의 32 ML을 추가합니다.
- 하나 파파인 바이알 (분말)에 EBSS 5 mL를 추가합니다. 10 분 동안 또는 파파인이 용해 될 때까지 37 O를 C의 물을 욕조에있는 파파인 병을 놓습니다.
- 한 DNase의 바이알 (분말)에 EBSS 500 μL를 추가합니다. 부드럽게 섞는다.
- 파파인 유리 병에 DNase의 솔루션 (위) 250 μL를 추가합니다.
- 필요한 상기 파파인 / DNase의 혼합물 (마우스 척수 당 파파인 / DNase의 혼합물을 약 800 μL)의 총량을 계산 및 조직 분해 (단계 3.2)에 대한 50 ㎖ 튜브에 필요한 혼합물을 옮긴다. 적어도 2 주 동안 4 ° C에서 원래 유리 병에 남은 저장합니다.
- 필요할 때까지 얼음에 키트의 모든 구성 요소를 유지합니다.
- 척수 수집 튜브를 준비 하나 멸균 15ml의 튜브를 5 ㎖ 행크 균형 염 용액 (HBSS로의 상기 파파인 해리 시스템에서,0; 1X PBS와 척수)와 하나의 멸균 15 ML의 튜브를 수집 (5 ML의 주사기를 채우는) 단계 2.4를 참조하십시오. 또한, HBSS의 5 mL로 한 멸균 페트리 접시 (35mm 또는 60mm)를 준비하고 문화 후드에 보관합니다.
2. 척수 컬렉션
주 : 모든 장비는 멸균해야합니다. IACUC 승인 지정된 지역에서 컬렉션을 수행합니다.
- 수확 마우스 척수에 대한 다음과 같은 도구를 얻 바로 날카로운 / 무딘 18 cm 수술 가위, 12 cm 표준 메스 (# 3 고체), 탄소 강철 멸균 메스 블레이드 # 10, 작은 동물 decapitator, 12 cm 표준 곡선 겸자 및 멸균 20G 바늘 5 ml 주사기에 부착.
- CO 2 동물을 안락사 마우스 헤드와 70 % 에탄올 (EtOH 중)과 후방 영역 소독.
- decapitator과 동물의 목을 벨. 근육 층을 노출시키는 하부 후면 중간 세로 절개를. 하다엉덩이 수준에서 척추 칼럼을 통해 깨끗한 절개는 멸균 바로 수술 가위 (18cm)와 (또한 척추 열을 덮고있는 근육 층을 통해 절단).
- 일회용 신선한 닦아 장에 동물을 배치합니다. 조심스럽게 주동이쪽으로 척추에 (멸균 1X PBS (단계 1.4)로 가득 찬 5 ML의 주사기에 부착) 20 G 바늘을 삽입합니다. 아래로 단단히 동물을 잡고 신속하게 주사기를 밀어 넣습니다. 전체 척수는 자궁 끝에서 나올 것이다. HBSS를 함유하는 15 ㎖의 튜브에 척수 수집.
- 마우스의 나머지 단계를 반복 2.4. 각 동물 사이에, 70 % EtOH로 모든 중고 악기를 소독.
주 : 일반적으로, 12- 웰 플레이트는 매 4 마우스 척수 (4.3 참조)에 대해 설정 될 수있다.
단일 세포 현탁액 3. 준비
참고 : 무균 모든 것을 유지하기 위해 문화 후드의 단계 3과 4를 수행합니다.
- HBSS 함유 배양 접시 (단계 1.4)에 모든 척추 코드를 전송합니다. 멸균 가위와 집게로 많은 훌륭한, 작은 조각으로 척수의 각을 잘라. 이것이 상기 제조 된 희석 된 바와 같이 무균 핀셋 또는 10 ㎖ 피펫을 사용하여 제조 된 파파인 / DNase의 효소 혼합물 (단계 1.3.5)를 함유하는 50 mL의 원뿔 관 척수 조직을 트랜스퍼 (효소 혼합물로 HBSS를 추가하지 효소 용액과 효소의 성능이 저하 될 수 있습니다).
- 섞어 부드럽게 튜브를 소용돌이. 궤도는 150 rpm으로 진탕 배양기 / 쉐이커에 1 시간 동안 37 ℃로 튜브를 품어.
- 와류 튜브 다시 격렬 상기 해리를 촉진하기 위해 5 ㎖ 피펫을 사용하여 조직과 효소 용액을 씹다.
- RT에서 5 분 동안 300 XG에 15 mL의 원심 분리 튜브에 세포 현탁액을 전송.
- 원심 분리 동안, 재구성 알부민 ovomucoid INH 300 μL와 2.7 mL의 EBSS를 혼합멸균 튜브에 ibitor 용액 (1.3.1). DNase의 용액 (단계 1.3.3)의 150 μL를 추가합니다.
- 원심 분리 후, 상등액을 제거하고 (단계 3.5) 상기 제조 한 용액과 세포 펠렛을 재현 탁. 소용돌이 잘 세포 펠렛을 깰 수 있습니다.
- 세포 현탁액에 재구성 알부민 ovomucoid 방지 액 (단계 1.4.1)의 3 ML을 추가합니다. 실온에서 6 분 70 XG에 원심 분리기 세포. (막 조각을 포함) 상층 액을 제거합니다.
단일 세포 현탁액에서 미엘린 4. 또한 제거
- 제동없이 RT에서 30 분 동안 800 XG에서 세포 펠렛을 방해 부드럽게 세포 펠렛을 함유하는 튜브에 와동 (단계 1.2.2에서 제조) 20 % 밀도 구배 매체 8 mL를 넣어 원심 분리. 조심스럽게 이물질 (주로 수초)과 상층 액의 상단 층을 제거하지만, 펠렛을 유지한다.
- resuspendi로 세포를 씻어, 밀도 구배의 잔해를 제거하려면희석 된 cDMEM 8 ㎖ (1 부 cDMEM 2 부분 HBSS)으로 세포 펠렛 겨. 4 O ℃에서 10 분 동안 400 XG에 세포를 원심 분리기 상등액을 제거하고 동일한 방식으로 희석 된 cDMEM (위)로 다시 세포를 세척 하였다. 를 파종 할 때까지 얼음 세포를 유지합니다.
- 상층 액을 제거하고 배양 배지에서 세포 펠렛을 재현 탁 (cDMEM이와 함께 제공되는 2-ME (단계 1.1에서 준비)). 한 12 웰 플레이트를 들어, 3 ㎖ × 4 (사용하는 마우스의 수) + 2 mL의 = 14 mL의 미디어를 사용합니다. 이것은 전체 판에 충분한 세포 현탁액 (12 웰)가 확인되며, 웰 당 평균 셀 수와 배양 소교 콘텐츠를 결정하는데 이용 될 수있는 추가 우물을 제공한다. 배양 용기의 다른 형태가 사용되는 경우, 비례 적으로 필요한 배양 배지의 총 체적을 계산한다.
- 12 웰 플레이트의 각 웰에 세포 현탁액 1 ㎖를 추가한다.
- 5 % CO 2 35.9 ℃로 세포를 품어. D 1에 용지를 (흡입을 통해 이전 용지를 제거) 변경 후 매 3입니다.
주 : 1 일째에 배양 의한 척수 조직으로부터 잔류 미엘린에 파편 상당량 함유 할 수있다; 따라서, 1 일에 미디어를 변경 (자세한 내용은 토론 참조)을 권장합니다. D (12)에 잘 당 약 10 만 세포를 12 웰 플레이트에가, 14 셀 일반적으로 D 12에서 80 % 합류하고 일반적으로 D (14)에 의해 100 % 합류 근처가 될 수 - 문화 (12)은 D 사이의 치료를위한 준비 .
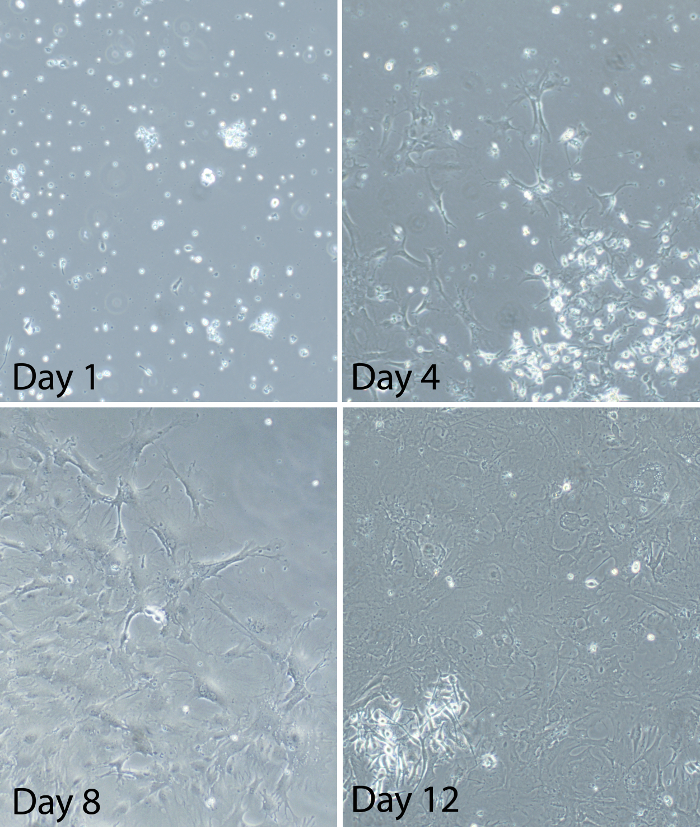
그림 2 :. 혼합 아교 세포 문화의 설립 후 다른 시간에 혼합 된 아교 세포의 대표 이미지를 기본 척수 혼합 된 아교 세포는 성인 C57BL / 6 마우스에서 제조 하였다. 대표 이미지도금 후 아교 문화의 진행 상황을 보여줍니다. 1 일에, 일부 세포는 배양 접시에 부착하지만, 대부분은 여전히 둥근된다. 부동 세포와 중요한 파편 많은도 있습니다. 4 일에, 세포의 대부분은 배양 플레이트에 부착된다. 세포는 눈에 보이는 프로세스와 분지 나타납니다. 세포는 산발적으로 분포되어 문화는 현재 약 20 ~ 30 %의 합류이다. 일 8시, 문화 50-60 %의 합류 사이. 문화의 일부 영역은 세포의 큰 패치가 있습니다. 문화의 다른 영역은 세포의 스파 스 성장을해야합니다. 패치 내에서 일부 세포는 "광장 같은"모습에 걸릴. 12 일째에, 배양 물 (여기에 도시 된 이미지에서, 약 90 %의 융합 성) 또는 80 % 이상 융합 성이다. 셀이 시점에서 성장의 로그 단계에와 12-14 실험의 신경교 세포를 사용하기위한 최적의 시간이다 일 사이입니다. 을 보려면 여기를 클릭하십시오이 그림의 더 큰 버전.
- 안티 마우스 CD45 및 안티 마우스 CD11b를 단일 클론 항체의 조합을 사용하여 표준 형광 활성화 된 셀 정렬 (FACS) 염색 프로토콜 (11)를 통해 별도의 우물에서 세포를 (4.3 단계)를 사용하여 미세 아교 내용을 검사합니다. CD45 + CD11b를 + 세포는 미세 아교 세포로 식별됩니다.
결과
이 방법은 마우스 및 래트에서 모두 혼합 아교 세포를 제조 할 수있다. 세포가 마우스 척수에서 파생 된 때 문화의 D (12) 이후 개시에 12 웰 플레이트에 웰 당 평균 총 세포 수는 물론 당 약 10 만 세포와 상대적으로 안정해야한다. 이 방법에서 얻은 신경교 세포 물질 및 관심 제의 투여시 성인 척수 신경교 응답을 검사하도록 설계된 실험에 사용될 수있다. (3)가 하나의 대표적인 실험에서 사이토 카인과 케모카인 응답의 예를도있는 성인 척수 미세 아교 세포에서 성인 BALB / c 마우스에서 얻은 및 문화의 D (13) 이후 개시에 LPS (살모넬라 균 미네소타 Re595)로 처리 하였다. 상청액 상업적 availab을 사용하여 효소 면역 분석법 (ELISA)을 통해 사이토 카인 및 케모카인의 농도를 결정하기위한 24 시간 후 LPS 처리 수거제작 키트.
이 성인 폐해 문화 시스템이 처음 설립되었을 때, 세포는 37 오 ℃에서 표준 문화 환경에서 배양 하였다 10 % -이 상태에서, 평균 소교 함량은 5이었다. (- 20 % 15) (10) 그러나, 일관된 배양 기술의 사용에도 불구하고, 배양 물은 경우에 따라 하나 소교 매우 낮은 함량 (<2 %) 또는 비교적 높은 콘텐츠가 소교 것이 관찰되었다. 이 실험 결과가 혼합 된 문화 내에서 소교 응답에 의존 할 때 매우 적은 미세 아교 세포가 문화를 얻기 위해 초조 할 수 있습니다. 박사 알레한드로 MS 메이어 (약리학 교실, 정골 의학의 시카고 대학) (12)의 제안에 따라, 방법은 35.9 오 ℃에서 혼합 아교 세포를 성장시켜 수정 이보다 일관되고 높은 소교 수율 결과 (10 ~ 이르기까지 - 40 %를 주로 아칸소 나머지문화의 대부분에서 운드, 20 %). 이러한 개선은 그림 4에 도시 이전에보고 된 바와 같이, 미세 아교 세포가 5 구성하는 것으로 추정된다 -. 성인 마우스 13-15에서 CNS 아교 인구의 21 %. 두 배양 조건은 생체 내에서 추정으로 미세 아교 세포의 비슷한 금액을 포함하는 문화를 제공하지만, 수정 된 배양 조건 (35.9 O를 C는)은 성상 세포 및 미세 아교 세포 모두에서 반응을 검사하는 것이 중요하는 실험에 더 적합합니다.

그림 1 :. 칼시토닌 유전자 관련 펩타이드 (CGRP)이 혼합 된 신경 교세포에 의해 케모카인 생산을 유도 된 신생아 BALB / C 마우스의 뇌 (왼쪽) 또는 성인 BALB / C 마우스 척수로부터 제조 된 혼합 아교 세포 (오른쪽) 다양한 용량으로 처리 하였다 CGRP의. 배양 상층 액에서 여러 케모카인의 수준 최적의 시간에 (제조 업체에 의해 수행) 멀티 플렉스 분석을 통해 측정 하였다 (평균 ± SEM, N = 2-6). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :에 글 리아 혼합 된 마우스 성인 척수의 사이토 카인과 케모카인 응답 LPS 자극 성인 척수 혼합 된 아교 세포 BALB / c 마우스에서 준비 LPS의 다양한 용량으로 자극 하였다.. IL-6의 (A), 종양 괴사 인자 (TNF) - 알파 (B), 인터페론 - 감마 - 유도 성 단백질 10 (IP-10, 또한 CXCL10라고도 함) (C), 및 단핵 세포 화학 유인 물질 단백질 1 레벨 (MCP- 배양 상청액에서도 CCL2라고도 1) (D)는 24 시간 후 LPS 처리에 ELISA를 통해 측정 하였다.ecsource.jove.com/files/ftp_upload/54801/54801fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 :. 성인 혼합 폐해 문화에서 소교 콘텐츠 혼합 된 아교 세포는 성인 C57B6 / L 생쥐에서 생성 된 37 O를 C 또는 35.9 오 C. 중 하나에서 배양 하였다 각 문화 소교 내용은 APC-항 - 마우스-CD45 (클론 30 F11) 및 FITC - 항 - 마우스-CD11b를 (클론 M1 / 70)를 사용하여 유동 세포 계측법을 통해 분석 하였다. 유동 세포 계측 분석 대표 플롯이 도시되어있다. 문화에서 총 세포 인구가 플롯 A (37 O를 C) 및 C (35.9 O를 C)와 소교 인구에서 확인되었다 (CD45 + CD11b를 + 세포가) 더 B에서 각각의 총 세포 집단에서 분리 하였다 (37오 C) 및 D (35.9 O를 C). 유세포 분석을 수행하고, 이전에 5 바와 같이 모든 데이터를 분석 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
는 모든 단계를 포함한 실험 간 재현성있는 결과를 얻기 위해 일관된 방식으로 일정 변화 매체를 수행하는 것이 중요하다. 다음 단계는 우수한 품질의 성인 혼합 된 아교 세포를 얻기에 특히 중요하다.
효소 소화는이 프로토콜의 중요한 측면이다. 이 조직 조각을 단일 세포 현탁액을 얻기 위해서 잘 소화하는 것이 중요하다. 그러나, 오버 소화 상당히 적은 세포에서 발생합니다. 각각의 실험실 배양에 사용되는 튜브의 유형에 기초하여 상기 실제 소화 시간을 결정하는 파일럿 테스트를 수행 할 필요가 평균 조직 량마다 사용하고, 진탕 기의 종류 (진탕 대 회). 또한, 관계없이 선택된 파파인 해리 시스템, 그것을 구성 요소 가끔 교체 수율에 상당한 변화를 초래할 수 있으므로, 일관 동일한 소스에서 동일한 구성 요소를 사용하는 것이 필수적세포의 총 수의.
이 프로토콜에서, 미엘린은 밀도 구배 매체를 이용하여 제거된다. 하고 이러한 솔루션의 밀도는 온도에 민감한 때문에 실온에서 밀도 구배 솔루션을 사용하는 것이 중요합니다. 밀도 구배 용액은 일반적으로 4 O C.에 저장된 필요한 경우, 밀도 구배 용액을 밤새 배양을 설정하는 일 전에 실온에서 유지 될 수있다. 또한, 20 % 농도 구배 세포의 30 분간 원심 다음, 세포 이동 파편의 큰 조각을 방지하기 위해 원심 분리기에서 즉시 제거되어야한다 (즉, 거리 용액의 위쪽에서 이동하는 단계 4.1 참조).
문화의 D 일 이후 개시에 파편을 제거하는 것이 중요하다. 세포가 생존하고 배양 배지 나중에 더 "정지"와 "청소기"문화를 제공 할 것입니다 D 1에 용지를 변경, 매 3 ~ 4 D를 변경하면 증식되지만. 이세포는 덜 방해 환경에서 성장할 수 있으며, 세포는 배양 21 일 후 (D)의 개시까지 유지 될 수있다.
각 실험 소교 콘텐츠 혼합 아교를 사용하기 전에 검사 될 수있다. 심지어 가장 일관성있는 기술로, 소교 내용은 아직 실험 사이에 상당히 다를 수 있습니다. 일부 휴대 효과는 소교 내용 (4), (10)에 의존한다; 따라서, 배양 확립 각 세트의 소교 콘텐츠를 모니터링하는 것이 중요하다. 본 실시로부터 획득 된 데이터는 실험간에 변동 해석뿐만 아니라, 특정 실험 조건에서 미세 아교 대 성상의 기여에 대하여 (경우에 예기치 않은) 새로운 기술을 제공하는 것을 도울 수있다. 또한, 소교 콘텐츠 계절적인 변화가 관찰되었다. 이 실험의 큰 세트를 계획 할 때 고려해야 할 추가 요소가 될 수 있습니다. 또한, 신경 세포는 일반적으로 우리의 문화 조건에서 생존하지 반면,NeuN (A neuronal- 마커) 양성 세포는 면역 조직 화학 염색을 한 후 우리의 폐해 문화에서 관찰되지 않은 것처럼, 문화 (이 정기적으로 정량화되지 않은) 희소 돌기 아교 세포의 제한된 숫자를 포함 할 수있다. 하나는이 인구가 특정 실험 조건에 따라 검토해야하는지 여부를 결정해야합니다.
많은 실험 방법과 마찬가지로이 방법은 개별 연구자의 필요에 따라 변형 될 수있다. 완전히 일상을 사용하기 전에 특정 변형을 테스트하기 위해 파일럿 실험을 수행하는 것이 필수적이다. 또한, 이전에 신생아 혼합 교세포 3에서 기술 한 바와 같이 혼합 된 아교가 성상 지배적 특정 자극 후의 미세 아교 지배적 셀 비교의 반응을 연구하는 미세 아교 세포 고갈 및 미세 아교 세포가 풍부한 배양을 구하는데 사용될 수 있다는 것을 주목해야한다 (4). 그러나, 미세 아교 세포가 풍부한 세포의 수율은 척추 다수 않는 제한 될코드는 초기에 배양을 설정하는 데 사용된다. 이 마우스를 사용하는 경우 특히,이 방법의 제한 사항입니다. 래트 척수가 사용되는 경우, (4 대신 마우스 척수의) 하나의 개별 척수는 한 12 웰 플레이트를 설정하는데 사용될 수있다. . 마지막으로, 소교 함량은 4, 5 모두 마우스와 랫트 성인 척수 신경교 배양이 사이토 카인 생성의 관점에서 LPS 자극에 강력한 반응을 생산 마우스 및 래트 성인 척수 신경교 배양 물 간의 유의 한 차이로 나타나지 않는다; 다른 자극이 사용되는 경우에는, 차분의 반응이 관찰 될 수있다.
요컨대,이 설치류 성인 신경교 배양 시스템은 시험 관내에서 신경교 세포를 연구하는 다른 방법을 제공한다. 더 밀접하게이 문화 시스템에서 얻어진 결과는 신생아 문화 또는 세포주에서 얻어진 결과에 비해 생체 조건에서 관찰 될 것을 반영한다. 현재의 방법에서, 아교 세포는 다 있습니다신생아 신경교 4 (도 1)과 비교할 때, 성인 신경교의 응답은 매우 다르게 자극하도록, 성인 설치류에서 ollected. 세포 생성 및 세포 라인을 유지하기 위해 사용되는 불멸화 과정을 통해 상당히 조작되지 않는다. 이 방법은 초기 신경 통증 연구에서 사용되도록 개발되었지만, 이러한 ALS 및 MS와 척수 내 병리학 적 변화를 포함하는 다른 신경 질환을 연구하는데 사용될 수있다.
공개
The authors have nothing to disclose.
감사의 말
Adult spinal cord mixed cultures were first developed using rats with grant support from an NIH/NIDA R01 award (PI De Leo) and an NIH T32 training grant (PI Green). These methods were further adapted for mouse spinal cords with support from the following grants: NIH/NIDA 5K01DA023503 (PI Cao), NIH/NINDS 5R21NS066130 (PI Cao), and NIH/NIGMS P20GM103643 (PI Meng). The authors would also like to thank Dr. Alejandro M. S. Mayer, Department of Pharmacology, Chicago College of Osteopathic Medicine, for his technical help in obtaining microglia-rich mixed glial cells.
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modification of Eagle’s media (DMEM) with 4.5 g/L glucose | Lonza | 12-709F | The cDMEM media is a standard, widely used culture media. Individual researchers can decide where to purchase the DMEM and all other components used to make cDMEM media. |
| L-Glutamine (100x) | Lonza | 17-605E | The L-glutamine is a standard, widely used component for various culture media. Individual researchers can decide where to purchase L-glutamine. |
| Antibiotic-Antimycotic Solution (100x) | Corning-Mediatech | 30-004-CI | This is a combination of penicillin, streptomycin and Amphotericin formulated to contain 10,000 units/mL penicillin G, 10 mg/mL streptomycin sulfate and 25 µg/mL amphotericin B. Individual researchers can decide where to purchase individual components. |
| 2-mercaptoethanol (2-ME) | Sigma-Aldrich | M3148 | A BioReagent, suitable for cell culture, molecular biology and electrophoresis. |
| Papain dissociation system | Worthington Biochemical Corporation | LK003150 | Individual components of this kit can be purchased separately. |
| Percoll | GE Health Care | 17-0891-01 | Percoll is sold as sterile solution. Undiluted Percoll can be re-autoclaved if needed. |
| Lab-line incubator/shaker | Barstead/Lab-line | MaxQ4000 | This is the incubator/shaker we have currently. Other types of shakers can be used instead. |
| Lipopolysaccharides, Salmonella Minnesota Re595 | Sigma-Aldrich | L-9764 | Other strains of LPS can also induce glial responses. The magnitude of the responses though, may vary. |
| Mouse IL-6 DuoSet ELISA | R&D Systems | DY406 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse TNF-alpha DuoSet ELISA | R&D Systems | DY410 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse IP-10 (CXCL10) DuoSet ELISA | R&D Systems | DY466 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse MCP-1 (CCL2) ELISA Opteia set | BD Biosciences | 555260 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse chemokine Q-Plex | Quansys Biosciences | 120251MS | This product was not available for in-house assay at the time. Instead, we sent out samples to the manufacturer for analysis. |
| APC-anti-mouse-CD45 (clone 30-F11) | eBioscience | 17-0451 | Antibody of the same clone but from other vendors can be used. |
| FITC-anti-mouse-CD11b (clone M1/70) | eBioscience | 11-0112 | Antibody of the same clone but from other vendors can be used. |
| Accuri C6 flow cytometer | BD Biosciences | BD Accuri C6 | Each individual Researcher can use any flow cytometer he or she prefers. |
| FlowJo software | Tree Star, Inc. | FlowJo7.6.5 | Each individual Researcher can use any analysis software he or she prefers. |
참고문헌
- Gaskin, D. J., Richard, P. The economic costs of pain in the United States. J Pain. 13 (8), 715-724 (2012).
- Ji, R. R., Berta, T., Nedergaard, M. Glia and pain: Is chronic pain a gliopathy? Pain. 154 (01), S10-S28 (2013).
- Ni, M., Aschner, M., et al. Neonatal rat primary icroglia: isolation, culturing and selected applications. Curr Protoc Toxicol. Maines, M. D., et al. , (2010).
- Cao, L., Fei, L., Chang, T. T., DeLeo, J. A. Induction of interleukin-1beta by interleukin-4 in lipopolysaccharide-treated mixed glial cultures: microglial-dependent effects. J Neurochem. 102 (2), 408-419 (2007).
- Malon, J. T., Maddula, S., Bell, H., Cao, L. Involvement of calcitonin gene-related peptide and CCL2 production in CD40-mediated behavioral hypersensitivity in a model of neuropathic pain. Neuron Glia Biol. 7 (2-4), 117-128 (2011).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf / v-myc carrying retrovirus. J Neuroimmunol. 27 (2), 229-237 (1990).
- Bocchini, V., et al. An immortalized cell line expresses properties of activated microglial cells. J Neurosci Res. 31 (4), 616-621 (1992).
- Alliot, F. O., Marty, M. C., Cambier, D., Pessac, B. A spontaneously immortalized mouse microglial cell line expressing CD4. Dev Brain Res. 95 (1), 140-143 (1996).
- Alliot, F. O., Pessac, B. Astrocytic cell clones derived from established cultures of 8-day postnatal mouse cerebella. Brain Res. 306 (1-2), 283-291 (1984).
- Malon, J. T., et al. Microglial content-dependent inhibitory effects of calcitonin gene-related peptide (CGRP) on murine retroviral infection of glial cells. J Neuroimmunol. 279, 64-70 (2015).
- Cao, L., DeLeo, J. A. CNS Infiltrating CD4(+) T lymphocytes Contribute to Murine Spinal Nerve Transection-Induced Neuropathic Pain. Eur J Immunol. 38 (2), 448-458 (2008).
- Mayer, A. M., et al. Effect of a short-term in vitro exposure to the marine toxin domoic acid on viability, tumor necrosis factor-alpha, matrix metalloproteinase-9 and superoxide anion release by rat neonatal microglia. BMC Pharmacol. 1, 7(2001).
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Rock, R. B., et al. Role of Microglia in Central Nervous System Infections. Clin Microbiol Rev. 17 (4), 942-964 (2004).
- Yang, I., Han, S. J., Kaur, G., Crane, C., Parsa, A. T. The Role of Microglia in Central Nervous System Immunity and Glioma Immunology. J Clin Neurosci. 17 (1), 6-10 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유