Method Article
Préparation de cultures mixtes gliales primaires de souris adultes Spinal Cord Tissue
Dans cet article
Résumé
Le développement de la douleur neuropathique implique des changements pathologiques des cellules gliales cordon de la colonne vertébrale. Un système de culture gliale fiable provenant d' un tissu de la moelle épinière adulte et conçu pour l' étude de ces cellules in vitro est absente. Par conséquent, nous montrons ici comment établir cultures primaires gliales mixtes de souris adultes tissu de la moelle épinière.
Résumé
Il a été bien accepté que les réponses gliales de la moelle épinière contribuent de manière significative au développement de la douleur neuropathique. Informations énormes concernant les activités de gliales aux niveaux cellulaires et moléculaires a été obtenue grâce à des systèmes in vitro de culture cellulaire in. Les systèmes in vitro utilisés, comprennent principalement des cellules gliales primaires dérivées de tissu cérébral néonatal cortical et des lignées cellulaires immortalisées. Toutefois, ces systèmes peuvent ne pas refléter les caractéristiques des cellules gliales cordon spinaux in vivo. Afin d'étudier plus avant le rôle des cellules de cordon gliales spinaux dans le développement de nerf périphérique blessures induites par la douleur neuropathique en utilisant un système de culture qui reflète mieux la condition in vivo, notre laboratoire a mis au point une méthode pour établir la moelle épinière primaire cultures gliales mixtes de souris adultes. En bref, la moelle épinière sont collectées à partir des souris adultes et traitées par digestion papaïne suivie de l'élimination de la myéline avec un tanièreslité-gradient moyen. Des suspensions de cellules simples sont cultivées dans un support Eagle modifié Dulbecco complet (cDMEM) additionné de 2-mercaptoéthanol (2-ME) à 35,9 ° C. Ces conditions de culture sont optimisées spécifiquement pour la croissance des cellules gliales mélangées. Dans ces conditions, les cellules sont prêtes à être utilisées pour l'expérimentation de 12 - 14 J (cellules sont généralement en phase logarithmique pendant ce temps) après la mise en place de la culture (D 0) et peuvent être conservés dans des conditions de culture jusqu'à D 21. ce système de culture peut être utilisé pour étudier les réponses des cellules gliales épinière de la colonne vertébrale lors d'une stimulation avec différentes substances et agents. En plus de la douleur neuropathique, ce système peut être utilisé pour étudier les réponses gliales dans d'autres maladies qui impliquent des changements pathologiques des cellules gliales du cordon médullaire.
Introduction
La douleur chronique est un problème de santé grave qui touche environ 100 millions d' adultes aux États-Unis, avec un coût annuel estimé de jusqu'à 635 milliards $ 1. Preuves de montage a indiqué une contribution significative des cellules gliales cordon de la colonne vertébrale dans le développement de la douleur neuropathique, l' un des types les plus dévastateurs de la douleur chronique 2. Un système in vitro de culture approprié dans contribuerait de manière significative dans les enquêtes davantage les rôles des cellules gliales aux niveaux cellulaires et moléculaires.
Actuellement, les systèmes de culture in vitro de gliales utilisées par les chercheurs comprennent principalement des cellules gliales provenant de tissus corticaux de souris ou de rat nouveau - nés et les cerveaux des lignées cellulaires immortalisées dérivées de cellules gliales souris ou rat néonatal des cellules gliales primaires. néonatale cellules contiennent un nombre important de cellules non différenciées qui peuvent encore être différenciées en cellules gliales (astrocytes et la microglie principalement), fournissant ainsi uncellules bundant pour l' utilisation expérimentale 3. Cependant, notre étude antérieure a montré que les cellules gliales du cerveau du nouveau-né ont réagi de manière significative différemment des cellules gliales du cordon sur la moelle épinière adulte lipopolysaccharide (LPS) de stimulation. Par exemple, l' interleukine (IL) -4 affichée améliorée des effets inhibiteurs sur l' oxyde nitrique induite par le LPS (NO) chez le rat adulte moelle épinière glie par rapport au cerveau du nouveau - né glie 4. En outre, les profils de la production de chimiokines lors d'une stimulation par un neuropeptide, la calcitonine gene-related peptide (CGRP), sont incontestablement différent entre le cerveau glie de souris néonatale (méthodes décrites dans la réf. 5) et une souris adulte moelle glie épinière (figure 1). des lignées cellulaires établies sont faciles à utiliser et à entretenir, et peuvent fournir un grand nombre de cellules dans un court laps de temps. En général, les lignées cellulaires immortalisées sont générées soit à l' aide d' un système d'immortalisation à médiation par un virus ( par exemple, la lignée de cellules microgliales BV2 largement utilisé) , 6, 7 ou suivant el' identification du courrier de transformation spontanée ( par exemple, la lignée cellulaire d'astrocytes en C8-D1A et la lignée cellulaire microgliale en C8-B4) , 8, 9 lignées cellulaires sont excellents en étudiant les caractéristiques moléculaires des astrocytes et la microglie individuellement. cependant, les résultats obtenus à partir des lignées cellulaires nécessitent toujours une validation supplémentaire dans des cellules primaires ou dans des conditions in vivo. Il convient également de noter qu'il n'y a pas eu un rapport d'une lignée de cellules gliales qui est dérivé d'un glie de la moelle épinière rongeur.
Pour aider à étudier le rôle des cellules de cordon gliales spinaux dans le développement de la douleur neuropathique, un système de culture qui est dérivée de la moelle épinière de souris adulte a été développé en adaptant une méthode précédemment rapporté utilisé pour générer rat adulte cultures gliales mixtes 4, 5 . La culture gliale de souris de la moelle épinière a également été récemment affinée 10 et est décrite plus en détail dans cet article. Adulte cordon mélangé colonne vertébrale cultures gliales cun être établi avec une souris à partir de souches sélectionnées qui correspondent aux besoins de l'étude particulière, et les cellules peuvent être maintenues en culture pendant jusqu'à 21 jours post début de la culture. Cette méthode peut être utilisée dans les études de la douleur neuropathique, ainsi que dans les enquêtes de diverses maladies neurologiques qui impliquent des changements pathologiques de la moelle épinière, tels que la sclérose latérale amyotrophique (SLA), le virus de l'immunodéficience humaine (VIH) -Associated neuropathie sensorielle et multiple la sclérose en plaques (SEP).
Protocole
Le protocole suivant a été approuvé par le Comité institutionnel des animaux soin et l'utilisation (IACUC) à l'Université de la Nouvelle-Angleterre. Le protocole suivant pour la préparation des cultures gliales de la moelle épinière 4 de souris adulte.
1. Préparation des solutions dans un capot Culture dans des conditions aseptiques
- Préparer les milieux de culture: la modification de toutes les Dulbecco des médias d'Eagle (cDMEM) contenant DMEM (avec 4,5 g / L de glucose), 10% de sérum bovin fœtal (FBS), 2 mM de L-glutamine, de la pénicilline 100 UI / ml, 100 mg / ml de streptomycine , 250 ng / ml d'amphotéricine B et 50 uM de 2-mercaptoéthanol (2-ME, voir 1.1.1). Mélanger et filtrer stériliser tous les autres composants, puis ajoutez FBS. Stocker les milieux de culture à 4 o C.
- Préparer 50 mM de 2-ME / solution saline tamponnée au phosphate (PBS) solution mère: ajouter 100 pi de concentré 2-ME (14,3 M) dans 28,6 ml de PBS 1x et stériliser par filtration (la solution peut être conservé à 4 ° C pendant plusieurs mois). Use 1 ml de 2-ME solution mère pour chaque 1000 ml de milieu de culture.
- Préparation du milieu de gradient de densité
- Préparer un stock de solution isotonique de milieu à gradient de densité (par exemple, 100% Percoll) de 1 partie 10x régulière PBS stérile et 9 parties milieu à gradient de densité du stock stérile (par exemple, Percoll).
- Diluer le milieu de gradient de densité de 100% (faite en 1.2.1) avec 1x régulière PBS stérile pour faire un milieu de gradient de densité de 20% (par exemple, 10 ml de 100% des médias de gradient de densité avec 40 ml de PBS 1x) et le stocker à 4 o C. Apportez les médias 20% de gradient de densité à la température ambiante (RT) avant de préparer la culture cellulaire.
- Préparation des solutions à partir du système de dissociation de la papaïne
NOTE: Le système de dissociation papaïne peut être identifié dans le tableau des matériaux. D'autres kits de dissociation similaires (y compris ceux qui sont assemblés en interne) peuvent également être utilisés. Tout components doivent être stériles.- Ajouter 32 ml de solution saline équilibrée de Earle (EBSS) au mélange d'inhibiteur de l'ovomucoïde (poudre).
- Ajouter 5 ml de EBSS à un flacon de papaïne (poudre). Placer le flacon de la papaïne dans un bain d'eau à 37 ° pendant 10 minutes ou jusqu'à ce que la papaïne est dissoute.
- Ajouter 500 ul de EBSS à un flacon de DNase (poudre). Mélanger délicatement.
- Ajouter 250 ul de la solution de DNase (ci-dessus) dans le flacon de la papaïne.
- Calculer la quantité totale du mélange papaïne / DNase ci-dessus nécessaire (environ 800 pi de mélange papaïne / DNase par souris moelle épinière) et transférer le mélange nécessaire dans un tube de 50 ml pour la digestion du tissu (étape 3.2). Stockez le reste dans le flacon d'origine à 4 ° C pendant au moins deux semaines.
- Conservez tous les composants des kits sur la glace jusqu'à ce que nécessaire.
- Préparer des tubes de prélèvement de la moelle épinière: une stérile tube de 15 ml avec 5 ml de solution saline équilibrée de Hank (HBSS, à partir du système de dissociation papaïne,0; pour la collecte de la moelle épinière) et un stérile 15 ml tube avec PBS 1x (pour remplir la seringue de 5 ml, voir étape 2.4). En outre, de préparer un plat stérile Pétri (35 mm ou 60 mm) avec 5 ml de HBSS et le maintenir dans la hotte de culture.
2. Spinal Cord Collection
REMARQUE: Tous les équipements doivent être stériles. Effectuer la collecte dans une zone désignée approuvée par le IACUC.
- Procurez-vous les outils suivants pour la moelle épinière récolte de souris: contondants ciseaux droits tranchants / 18 cm chirurgicales, un scalpel de 12 cm standard (# 3 solide), acier au carbone lames de scalpels stériles N ° 10, un petit décapiteur animal, courbe standard de 12 cm des pinces, et une aiguille stérile 20G fixée à une seringue de 5 ml.
- Euthanasier l'animal avec du CO 2 et désinfecter la tête de la souris et la région arrière avec 70% d' éthanol (EtOH).
- Décapitez animal avec le décapiteur. Faire une incision longitudinale du milieu sur le bas du dos pour exposer la couche musculaire. Faireun transection propre à travers la colonne de vertébrés au niveau de la hanche (également couper à travers la couche musculaire qui couvre la colonne vertébré) avec les ciseaux chirurgicaux droites stériles (18 cm).
- Placez l'animal sur une feuille de frais lingette jetable. Insérez délicatement l'aiguille 20 G (attachée à une seringue de 5 ml remplie stérile 1x PBS (étape 1.4)) dans la colonne vertébrale vers le côté rostral. Tenir l'animal vers le bas fermement et pousser la seringue rapidement. L'ensemble de la moelle épinière devrait sortir de l'extrémité du col utérin. Collecter la moelle épinière dans le tube 15 ml contenant du HBSS.
- Répétez l'étape 2.4 pour le reste des souris. Entre chaque animal, désinfecter tous les instruments utilisés avec 70% EtOH.
NOTE: En règle générale, une plaque de 12 puits unique peut être établi pour tous les moelles épinières 4 de souris (voir 4.3).
3. Préparation de la cellule unique Suspension
Remarque: Effectuer les étapes 3 et 4 dans une hotte de culture pour garder tout stérile.
- Transférez tous les cordons de la colonne vertébrale dans la boîte de Pétri HBSS contenant (étape 1.4). Coupez chacune des moelles épinières dans de nombreuses fins, petits morceaux avec des ciseaux et des pinces stériles. Le transfert du tissu de la moelle épinière au tube conique de 50 ml contenant de la papaïne préparée / le mélange d'enzymes désoxyribonucléase (étape 1.3.5) à l'aide d'une pince stérile ou d'une pipette de 10 ml (pour éviter l'ajout HBSS au mélange de l'enzyme, comme cela sera en outre diluer la préparée solution enzymatique et peut entraîner une baisse des performances de l'enzyme).
- Vortex doucement le tube pour mélanger. Incuber le tube à 37 ° C pendant 1 h dans un incubateur / agitateur avec agitation orbitale à 150 rpm.
- Le tube vortex à nouveau et triturer vigoureusement la solution d'enzyme avec le tissu à l'aide d'une pipette de 5 ml pour promouvoir davantage la dissociation.
- Transférer la suspension cellulaire dans un tube de 15 ml et on centrifuge à 300 g pendant 5 min à température ambiante.
- Pendant la centrifugation, mélanger 2,7 mL EBSS avec 300 pi de reconstitution inh d'albumine-ovomucoïdesolution ibitor (1.3.1) dans un tube stérile. Ajouter 150 ul de la solution de DNase (étape 1.3.3).
- Après centrifugation, éliminer le surnageant et remettre en suspension le culot de cellules avec la solution préparée ci-dessus (étape 3.5). Tourbillonnaire bien pour briser le culot cellulaire.
- Ajouter 3 ml de la solution reconstituée à l'albumine inhibiteur ovomucoïde (étape 1.4.1) à la suspension cellulaire. Centrifuger les cellules à 70 g pendant 6 min à température ambiante. Retirer le surnageant (qui contient des fragments de membrane).
4. En outre Enlèvement de myéline de la cellule unique Suspension
- Ajouter 8 ml de milieu de gradient de densité de 20% (préparée à l' étape 1.2.2) dans le tube contenant le culot cellulaire, vortexer doucement pour perturber le culot et centrifuge les cellules à 800 xg pendant 30 min à température ambiante sans freinage. Retirez délicatement la couche supérieure de débris (principalement la myéline) et le surnageant, mais garder la pastille.
- Pour enlever les restes du gradient de densité, laver les cellules par resuspending du culot cellulaire avec 8 ml d'une cDMEM dilué (1 partie cDMEM et 2 parties HBSS). Centrifuger les cellules à 400 xg pendant 10 min à 4 ° C Retirer le surnageant et laver les cellules à nouveau avec le cDMEM dilué (au-dessus) de la même manière. Gardez les cellules sur la glace jusqu'à ce que les ensemençant.
- Retirer le surnageant et remettre en suspension le culot cellulaire dans les milieux de culture (cDMEM fourni avec 2-ME (préparé à l'étape 1.1)). Pour une plaque de 12 puits, utiliser 3 ml x 4 (nombre de souris utilisées) + 2 ml = 14 ml médias. Cela garantira qu'il y a suspension cellulaire suffisante pour que la totalité de la plaque (12 puits) et fournira des puits supplémentaires qui peuvent être utilisés pour déterminer le nombre moyen de cellules par puits et la teneur microgliale de la culture. Si d'autres types de récipients de culture seront utilisés, calculer le volume total des milieux de culture nécessaire proportionnellement.
- Ajouter 1 ml de la suspension cellulaire dans chaque puits d'une plaque à 12 puits.
- Incuber les cellules à 35,9 ° C avec 5% de CO 2.
- Changer les médias (supprimer les anciens médias par aspiration) sur D 1, puis tous les 3 - 4 d par la suite (généralement changer les médias sur D: 1, 4, 8 et 11, puis utiliser les cellules au jour 12).
Remarque: Au jour 1, la culture peut contenir des quantités importantes de débris dus à la myéline du résidu à partir du tissu de la moelle épinière; ainsi, en changeant les médias le jour 1 est recommandé (s'il vous plaît voir la discussion pour plus d'informations). Les cultures sont prêtes pour le traitement entre les D 12 - 14. Les cellules sont généralement 80% confluentes à D 12 et peut être proche de 100% confluentes par D 14. En règle générale, sur la D 12, il y a environ 100.000 cellules par puits dans une plaque de 12 puits .
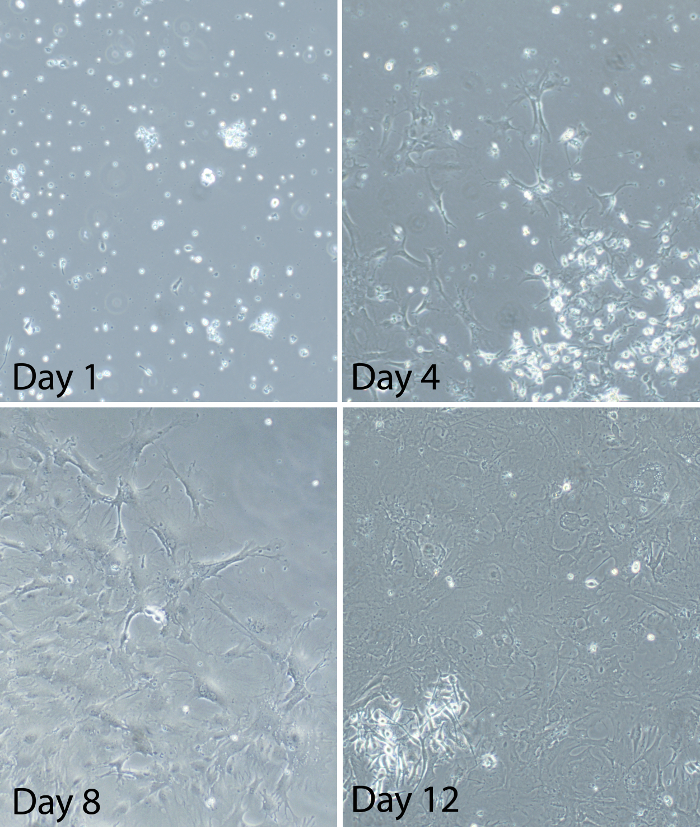
Figure 2:. Des images représentatives de cellules gliales mixtes à différents moments après la mise en place de la culture de cellules gliales mixtes glie mixtes médullaires primaires ont été préparés à partir des adultes C57BL / 6 souris. Des images représentativesmontrer les progrès de la culture gliale après placage. Au jour 1, certaines cellules sont fixées à la plaque de culture, mais ils sont encore essentiellement ronde. Il y a aussi beaucoup de cellules flottantes et des débris importants. Au jour 4, la majorité des cellules sont attachées à la plaque de culture. Les cellules apparaissent ramifiaient avec les processus visibles. Les cellules sont sporadiquement distribués et les cultures sont environ 20-30% confluentes à ce moment. Au jour 8, les cultures sont entre 50-60% confluentes. Certaines zones de cultures ont de grandes taches de cellules. D'autres domaines de la culture ont une croissance clairsemée de cellules. Certaines cellules dans les patchs prennent un aspect "carré-like". Au jour 12, les cultures sont égales ou supérieures à 80% de confluence (environ 90% de confluence dans l'image montrée ici). Cellulaire sont dans la phase de croissance logarithmique à ce moment et entre les jours 12-14 est le moment optimal pour l' utilisation des cellules gliales pour les expériences. S'il vous plaît cliquer ici pour voir uneune plus grande version de ce chiffre.
- Examiner le contenu en utilisant des cellules microgliales des puits supplémentaires (étape 4.3) par cellule activé par fluorescence tri standard (FACS) protocole de coloration 11 en utilisant la combinaison d'anti-souris CD45 et des anticorps monoclonaux anti-souris CD11b. Cellules CD45 + CD11b + sont identifiées comme microglie.
Résultats
Cette méthode peut être utilisée pour préparer des cellules gliales mélangées à partir des souris et des rats. Le nombre total de cellules moyenne par puits dans une plaque de 12 puits sur D 12 après l'initiation de la culture devrait être relativement stable, avec environ 100 000 cellules par puits lorsque les cellules sont dérivées de la moelle épinière de souris. Les cellules gliales obtenues à partir de ce procédé peuvent être utilisés dans des expériences conçues pour étudier moelle épinière adulte gliales réponses lors de l' administration des substances et agents d'intérêt. La figure 3 donne un exemple de la réponse des cytokines et chimiokines à partir d' une expérience typique dans laquelle moelle épinière adulte microglie ont été obtenus à partir de souris BALB / c adultes et traités avec du LPS (Salmonella minnesota Re595) sur D 13 après le début de la culture. Les surnageants ont été recueillis 24 h de traitement post-LPS pour la détermination des niveaux de cytokines et de chimiokines par un dosage immuno-enzymatique (ELISA) en utilisant le commerce availabkits. Le
Lorsque ce système de culture de cellules gliales adultes a été établie, les cellules ont été incubées dans un milieu de culture standard à 37 ° C. Sous cette condition, le contenu de la microglie moyenne variait de 5 à 10%. Cependant, il a été observé que , malgré l'utilisation de techniques de culture cohérentes, les cultures seraient dans certains cas , ont soit très faible teneur en microglie (<2%) ou le contenu de la microglie relativement élevée (15 - 20%) 10. Il peut être frustrant pour obtenir des cultures qui ont très peu microglie lorsque les résultats expérimentaux reposent sur les réponses microgliales au sein de la culture mixte. Suite à la suggestion du Dr Alejandro MS Mayer (Département de pharmacologie, Chicago College of Osteopathic Medicine) 12, la méthode a été modifiée par la croissance des cellules gliales mixtes à 35,9 o C. Il en est résulté un rendement microgliale plus uniforme et plus élevée (comprise entre 10-40% et le reste principalement arolide 20%) dans la plupart des cultures. Cette amélioration est illustrée dans la Figure 4 Comme indiqué précédemment, les microglies sont estimés pour compenser 5 -. 21% de la population gliales du système nerveux central chez les souris adultes 13-15. Bien que les deux conditions de culture fournissent des cultures qui contiennent des quantités similaires de microglies estimée in vivo, les conditions de culture modifié (35,9 o C) est plus approprié pour les expériences dans lesquelles il est essentiel d'examiner les réponses des deux astrocytes et la microglie.

Figure 1:. Peptide relié au gène calcitonine (CGRP) induite par chimiokines par les cellules gliales mélangées cellules gliales mixtes préparés à partir de cerveaux / c de souris néonatales BALB ( à gauche) ou de la moelle épinière des adultes BALB / c de souris ( à droite) ont été traités avec diverses doses de CGRP. Les niveaux de plusieurs chimiokines dans les surnageants de culture ont été déterminées par analyse multiplex (effectuée par le fabricant) au meilleur moment (moyenne ± SEM, n = 2-6). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: cytokine et chimiokines Réponses de souris adultes de la moelle épinière mixte Glia sur LPS Stimulation moelle épinière adulte cellules gliales mixtes ont été préparées à partir de souris BALB / c et stimulées avec différentes doses de LPS.. Les niveaux d'IL-6 (A), le facteur de nécrose tumorale (TNF) -alpha (B), l' interféron gamma inductible par la protéine 10 (IP-10, également connu sous CXCL10) (C), et des monocytes protéine chimiotactique 1 (MCP 1, également connu sous le CCL2) (D) dans les surnageants de culture ont été déterminées par ELISA à 24 h le traitement post-LPS.ecsource.jove.com/files/ftp_upload/54801/54801fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4:. Contenu microgliales adultes Cultures gliales mixtes cellules gliales mixtes ont été générées à partir de C57B6 / L souris adultes et cultivées à soit 37 o C ou 35,9 o C. le contenu de la microglie à partir de chaque culture a été analysée par cytométrie en flux en utilisant APC anti-souris CD45 (clone 30-F11) et FITC anti-souris CD11b (clone M1 / 70). parcelles représentatives de l'analyse de cytométrie de flux sont présentés. Les populations cellulaires totaux des cultures ont été identifiées dans les parcelles A (37 o C) et C (35,9 ° C), et les populations microgliales (CD45 + CD11b + cellules) ont encore été isolés à partir des populations de cellules totales respectives dans B (37o C) et D (35,9 ° C). L' analyse par cytométrie de flux a été effectuée, et toutes les données ont été analysées comme décrit précédemment 5. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
Il est essentiel d'effectuer toutes les étapes, y compris les médias changer le calendrier dans une manière cohérente afin d'obtenir des résultats reproductibles entre les expériences. Les étapes suivantes sont particulièrement critiques pour obtenir une excellente adulte de qualité glie mixte.
La digestion enzymatique est un aspect important de ce protocole. Il est crucial que les morceaux de tissu sont bien digérée afin d'obtenir une suspension cellulaire unique. Cependant, sur-digestion entraînera beaucoup moins de cellules. Chaque laboratoire doit effectuer des tests pilotes pour déterminer le temps de digestion exacte basée sur les types de flacons utilisés pour l'incubation, la quantité de tissu moyen utilisé à chaque fois, et le type de dispositif trembleur (rotation par rapport à agitation). En outre, quel que soit le système papaïne de dissociation choisi, il est essentiel d'utiliser systématiquement les mêmes composants à partir des mêmes sources, comme le remplacement occasionnel des composants pourrait conduire à des variations importantes dans le rendementdu nombre total de cellules.
Dans ce protocole, la myéline est éliminé à l'aide d'un milieu à gradient de densité. Il est essentiel de fabriquer et d'utiliser des solutions de gradient de densité à la température ambiante car les densités de ces solutions sont sensibles à la température. Solutions de gradient de densité sont généralement stockés à 4 o C. Le cas échéant, les solutions à gradient de densité peut être conservé à la température ambiante pendant une nuit avant le jour de la mise en place de la culture. En outre, après 30 min centrifugation des cellules dans le gradient de densité de 20%, les cellules doivent être retirées immédiatement de la centrifugeuse afin d' éviter de gros morceaux de débris de se déplacer ( par exemple, se déplaçant loin de la partie supérieure de la solution, voir étape 4.1).
Il est important d'enlever les débris sur le D 1 après l'initiation de la culture. Bien que les cellules survivent et prolifèrent si le milieu de culture est changé tous les 3 à 4 d, changer de support sur D 1 fournira une culture plus "repos" "propre" plus tard. Cepermet aux cellules de se développer dans un environnement moins perturbé, et les cellules peuvent être conservés jusqu'à 21 jours post-initiation de la culture.
contenu microglial pour chaque expérience peut être examinée avant d'utiliser le glie mixte. Même avec la technique la plus cohérente, le contenu de la microglie peut encore varier de manière significative entre les expériences. Certains effets cellulaires dépendent sur le contenu de la microglie 4, 10; ainsi, il est essentiel de contrôler le contenu de la microglie de chaque ensemble de cultures établies. Les données obtenues à partir de cette pratique peuvent aider à interpréter les variations entre les expériences, ainsi que de fournir de nouvelles connaissances (parfois inattendues) en ce qui concerne la contribution des astrocytes par rapport à la microglie dans une condition expérimentale particulière. En outre, les variations saisonnières sur le contenu de la microglie ont été observées. Cela peut être un facteur supplémentaire à considérer lors de la planification de grandes séries d'expériences. En outre, alors que les neurones en général ne seront pas survivre dans notre condition de culture,comme NeuN (marqueur neuronal-) Les cellules -positifs n'a pas été observée dans nos cultures gliales après coloration immunohistochimique, la culture peut contenir un nombre limité d'oligodendrocytes (cela n'a pas été systématiquement quantifiés). On doit décider si cette population doit être examinée en fonction des conditions expérimentales spécifiques.
Comme dans le cas de nombreuses méthodes expérimentales, cette méthode peut être modifiée en fonction des besoins des chercheurs individuels. Il est essentiel d'effectuer des expériences pilotes pour tester pleinement les modifications spécifiques avant de les utiliser régulièrement. En outre, il convient de noter que la glie mixte peut être utilisé pour obtenir des cultures de microglie appauvri et microglie enrichi pour étudier les réponses des astrocytes dominante par rapport aux cellules de la microglie dominant après des stimulations spécifiques, comme décrit précédemment pour les cellules gliales mélangées néonatales 3, 4. Cependant, le rendement des cellules microgliales enrichi sera limitée à moins d'un grand nombre de moelleles cordons sont utilisés pour établir la culture au début. Ceci est une limitation de cette méthode, en particulier si les souris sont utilisées. Lorsque la moelle épinière de rat sont utilisées, une moelle épinière individuelle (au lieu de 4 la moelle épinière de souris) peut être utilisé pour mettre en place une plaque de 12 puits. Enfin, le contenu de la microglie ne semble pas être significativement différente entre les cultures gliales souris et le rat adulte moelle épinière 4, 5 Les deux souris et le rat adulte moelle épinière cultures gliales produire une réponse robuste au LPS stimulation en termes de production de cytokines. Cependant, les réponses différentielles peuvent être observés lorsque les stimuli alternatifs sont utilisés.
Au total, ce système de culture gliales rongeur adulte fournit une méthode alternative pour étudier les cellules gliales in vitro. Les résultats obtenus avec ce système plus étroitement la culture reflètent ce que l' on observe dans des conditions in vivo par rapport aux résultats obtenus à partir de cultures néonatales ou des lignées cellulaires. Dans la méthode actuelle, les cellules gliales sont collected des rongeurs adultes, comme la glie adulte répondent à des stimuli très différente par rapport à la glie néonatale 4 (figure 1). Les cellules ne sont pas manipulés de manière significative grâce à des procédures d'immortalisation, qui seraient utilisés pour générer et maintenir des lignées cellulaires. Bien que cette méthode a été initialement développé pour être utilisé dans des études de la douleur neuropathique, il peut être utilisé pour étudier d'autres maladies neurologiques qui impliquent des changements pathologiques de la moelle épinière, telles que la SLA et la SP.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Adult spinal cord mixed cultures were first developed using rats with grant support from an NIH/NIDA R01 award (PI De Leo) and an NIH T32 training grant (PI Green). These methods were further adapted for mouse spinal cords with support from the following grants: NIH/NIDA 5K01DA023503 (PI Cao), NIH/NINDS 5R21NS066130 (PI Cao), and NIH/NIGMS P20GM103643 (PI Meng). The authors would also like to thank Dr. Alejandro M. S. Mayer, Department of Pharmacology, Chicago College of Osteopathic Medicine, for his technical help in obtaining microglia-rich mixed glial cells.
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modification of Eagle’s media (DMEM) with 4.5 g/L glucose | Lonza | 12-709F | The cDMEM media is a standard, widely used culture media. Individual researchers can decide where to purchase the DMEM and all other components used to make cDMEM media. |
| L-Glutamine (100x) | Lonza | 17-605E | The L-glutamine is a standard, widely used component for various culture media. Individual researchers can decide where to purchase L-glutamine. |
| Antibiotic-Antimycotic Solution (100x) | Corning-Mediatech | 30-004-CI | This is a combination of penicillin, streptomycin and Amphotericin formulated to contain 10,000 units/mL penicillin G, 10 mg/mL streptomycin sulfate and 25 µg/mL amphotericin B. Individual researchers can decide where to purchase individual components. |
| 2-mercaptoethanol (2-ME) | Sigma-Aldrich | M3148 | A BioReagent, suitable for cell culture, molecular biology and electrophoresis. |
| Papain dissociation system | Worthington Biochemical Corporation | LK003150 | Individual components of this kit can be purchased separately. |
| Percoll | GE Health Care | 17-0891-01 | Percoll is sold as sterile solution. Undiluted Percoll can be re-autoclaved if needed. |
| Lab-line incubator/shaker | Barstead/Lab-line | MaxQ4000 | This is the incubator/shaker we have currently. Other types of shakers can be used instead. |
| Lipopolysaccharides, Salmonella Minnesota Re595 | Sigma-Aldrich | L-9764 | Other strains of LPS can also induce glial responses. The magnitude of the responses though, may vary. |
| Mouse IL-6 DuoSet ELISA | R&D Systems | DY406 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse TNF-alpha DuoSet ELISA | R&D Systems | DY410 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse IP-10 (CXCL10) DuoSet ELISA | R&D Systems | DY466 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse MCP-1 (CCL2) ELISA Opteia set | BD Biosciences | 555260 | Each individual Researcher can select the ELISA kit he or she prefers. |
| Mouse chemokine Q-Plex | Quansys Biosciences | 120251MS | This product was not available for in-house assay at the time. Instead, we sent out samples to the manufacturer for analysis. |
| APC-anti-mouse-CD45 (clone 30-F11) | eBioscience | 17-0451 | Antibody of the same clone but from other vendors can be used. |
| FITC-anti-mouse-CD11b (clone M1/70) | eBioscience | 11-0112 | Antibody of the same clone but from other vendors can be used. |
| Accuri C6 flow cytometer | BD Biosciences | BD Accuri C6 | Each individual Researcher can use any flow cytometer he or she prefers. |
| FlowJo software | Tree Star, Inc. | FlowJo7.6.5 | Each individual Researcher can use any analysis software he or she prefers. |
Références
- Gaskin, D. J., Richard, P. The economic costs of pain in the United States. J Pain. 13 (8), 715-724 (2012).
- Ji, R. R., Berta, T., Nedergaard, M. Glia and pain: Is chronic pain a gliopathy? Pain. 154 (01), S10-S28 (2013).
- Ni, M., Aschner, M., et al. Neonatal rat primary icroglia: isolation, culturing and selected applications. Curr Protoc Toxicol. Maines, M. D., et al. , (2010).
- Cao, L., Fei, L., Chang, T. T., DeLeo, J. A. Induction of interleukin-1beta by interleukin-4 in lipopolysaccharide-treated mixed glial cultures: microglial-dependent effects. J Neurochem. 102 (2), 408-419 (2007).
- Malon, J. T., Maddula, S., Bell, H., Cao, L. Involvement of calcitonin gene-related peptide and CCL2 production in CD40-mediated behavioral hypersensitivity in a model of neuropathic pain. Neuron Glia Biol. 7 (2-4), 117-128 (2011).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf / v-myc carrying retrovirus. J Neuroimmunol. 27 (2), 229-237 (1990).
- Bocchini, V., et al. An immortalized cell line expresses properties of activated microglial cells. J Neurosci Res. 31 (4), 616-621 (1992).
- Alliot, F. O., Marty, M. C., Cambier, D., Pessac, B. A spontaneously immortalized mouse microglial cell line expressing CD4. Dev Brain Res. 95 (1), 140-143 (1996).
- Alliot, F. O., Pessac, B. Astrocytic cell clones derived from established cultures of 8-day postnatal mouse cerebella. Brain Res. 306 (1-2), 283-291 (1984).
- Malon, J. T., et al. Microglial content-dependent inhibitory effects of calcitonin gene-related peptide (CGRP) on murine retroviral infection of glial cells. J Neuroimmunol. 279, 64-70 (2015).
- Cao, L., DeLeo, J. A. CNS Infiltrating CD4(+) T lymphocytes Contribute to Murine Spinal Nerve Transection-Induced Neuropathic Pain. Eur J Immunol. 38 (2), 448-458 (2008).
- Mayer, A. M., et al. Effect of a short-term in vitro exposure to the marine toxin domoic acid on viability, tumor necrosis factor-alpha, matrix metalloproteinase-9 and superoxide anion release by rat neonatal microglia. BMC Pharmacol. 1, 7(2001).
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Rock, R. B., et al. Role of Microglia in Central Nervous System Infections. Clin Microbiol Rev. 17 (4), 942-964 (2004).
- Yang, I., Han, S. J., Kaur, G., Crane, C., Parsa, A. T. The Role of Microglia in Central Nervous System Immunity and Glioma Immunology. J Clin Neurosci. 17 (1), 6-10 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon