Method Article
Complexo polielectrólito de ligação à heparina de entrega osteogénica Factor de Crescimento Domínio
Neste Artigo
Resumo
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
Resumo
Durante cirurgias ósseas reconstrutivas, quantidades suprafisiológicas de fatores de crescimento são empiricamente carregado em andaimes para promover a fusão óssea bem sucedido. Grandes doses de agentes biológicos muito potentes são necessários devido ao factor de instabilidade do crescimento, como resultado da degradação enzimática rápida, bem como as ineficiências transportadora na localização de uma quantidade suficiente de factor de crescimento em locais de implante. Assim, estratégias que prolongam a estabilidade de factores de crescimento, tais como BMP-2 / NELL-1, e controlar a sua libertação pode realmente diminuir a dose eficaz e, assim, reduzir a necessidade de doses mais elevadas durante as futuras cirurgias de regeneração óssea. Isto por sua vez irá reduzir os efeitos secundários e os custos de factores de crescimento. PEC auto-montadas têm sido fabricados para proporcionar um melhor controlo de PMO-2 / NELL-1 entrega através de ligação à heparina e outro factor de crescimento bioactividade potenciam reforço, em estabilidade in vivo. Aqui, ilustramos a simplicidade de fabricação PEC que auxilia na DELIVERY de uma variedade de factores de crescimento durante cirurgias reconstrutivas ósseas.
Introdução
A incidência de pseudoartrose tem sido relatada como sendo tão elevado como 10 a 45% em fusão espinal degenerativa e revisão cirurgias espinhais 1. Para reduzir a taxa de pseudoartrose durante a fusão da coluna e outras cirurgias reconstrutivas ósseas, factores de crescimento osteogénico, tais como BMP-2, Nell-1 e um factor de crescimento derivado de plaquetas (PDGF) foram introduzidos para promover a osteogénese de novo. Entre estes, BMP-2 é uma escolha popular para a fusão espinhal 2. Embora a potência de BMP-2 na indução e facilitando a formação de osso novo foi bem estabelecido 3; complicações clinicamente significativos, tais como a formação heterotópica de osso, seroma e formação de hematoma, resposta inflamatória, radiculite, osteólise corpo vertebral, e ejaculação retrógrada continuam a ser questões de preocupação devido às quantidades suprafisiológicas utilizados 4,5.
Por isso, diminuindo a dose de PMO-2 continua a ser uma estratégia relevante em pelotenta a minimizar os efeitos colaterais. Além disso, sistemas de veículo eficazes são necessários para suprimir a libertação brusca inicial de BMP-2 observado em sistemas veiculares de esponja de colagénio contemporânea e aumentar ainda mais a entrega prolongada e localizada desta citoquina potente. A auto-montagem da camada-por-camada da alternância polielectrólitos catiónicos e aniónicos podem ser utilizados como um método sintonizável para construir-se complexos de polielectrólitos na superfície de matrizes de andaime ou materiais implantáveis 6. A este respeito, a heparina (conhecida por ter a maior densidade de carga negativa de todos os agentes biológicos) tem sido reconhecido que se ligam avidamente com uma variedade de factores de crescimento através de domínios de ligação a heparina e electrostáticas. Com efeito, a heparina tem sido mostrada a prolongar a meia-vida e assim potenciar a bioactividade de vários factores de crescimento.
Com base nisso, o nosso grupo de um protocolo adaptado de auto-montagem da camada-por-camada para o fabrico de um complexo à base de polielectrólito heparina (PEC) que cargas e preserva as bioatividades de fatores de crescimento osteogénico durante a imobilização 7,8. O núcleo microesferas de alginato foi fabricado por reticulação de resíduos de alginato com catiões divalentes de cálcio ou estrôncio α-L-guluronato (L). O núcleo é uma matriz de alginato biodegradável andaime; que depois da implantação, é reabsorvido no leito de fusão proporcionando espaço para crescimento ósseo. A poli-L-lisina (PLL) ou protamina é utilizada como a camada de catiónico para entrelaçar com tanto a matriz de andaime (neste caso, o núcleo de alginato transportador micropérola) e a heparina carregada negativamente; enquanto que as funções da camada de heparina aniónico para estabilizar e localizar factores de crescimento carregados. A camada tripla PEC foi mostrada para aumentar a capacidade de carga do factor de crescimento num modelo suíno 9. Recentemente, os transportadores de PEC tenham sido demonstrado com sucesso para reduzir a dose eficaz de BMP-2 em pelo menos 20 vezes em ratos 10 e modelos de suíno de fusão vertebral 8.
ntent "> Aqui, nós relatamos os métodos de PECs de fabricação para a entrega do fator de crescimento reforçada em fusão espinhal e as outras cirurgias ósseas de reconstrução utilizando BMP-2 como um factor de crescimento osteogénico modelo.Protocolo
1. O alginato Preparação Solution
- Dissolver 200 mg de alginato de sódio (não irradiado) ou 400 mg de 8 MRad irradiado alginato de sódio em 10 ml dupla de água destilada e agitar durante 1 hora para alginato não-irradiada e 15 min para o alginato irradiado. Guardar a solução de alginato a 4 ° C durante a noite. Filtra-se a solução de alginato com um filtro de seringa de 0,2 um estéril antes da fabricação de microesferas de alginato.
2. O alginato Microbead Fabrication
- Desinfectar o gerador de talão eletrostática e bomba de seringa com 70% de etanol e colocá-los em uma classe II Biológica Gabinete de Segurança (Figura 1).
- Colocar uma bacia de vidro com uma barra de agitação magnética no interior do gerador talão.
- Defina o eletrodo braço do gerador de talão de 9 cm acima da bacia.
- Conecte o cabo de força do gerador talão para o parafuso serrilhado 2 do eletrodo braço, e despeje 80 ml de solução SrCl2 nobacia.
- Carga de 5 ml de solução de alginato de 0,2 um filtrado para dentro do tubo da seringa e de borracha. Depois de ligar o tubo de borracha para o eléctrodo de braço, ligar a bomba de seringa a 5 ml / h durante 2 minutos para expelir o ar de dentro da tubagem e proporcionar a solução de alginato para a ponta do bocal. Desligue a bomba de seringa.
- Em seguida, liga o encapsulador e, em seguida, a bomba de seringa para iniciar a geração de microesferas. Definir a taxa de fluxo de alginato a 5 ml / hr ea tensão de 5,8 kV na encapsulator. Descartar as micropérolas gerados durante os dois primeiros minutos (ou a solução de alginato de 0,5 ml iniciais bombeado para fora da seringa), uma vez que estas microesferas tendem a ser irregular dimensionada e conformada.
- Recolha microbeads subsequentes na solução de cloreto de 0,2 M de estrôncio. Desligue a bomba de seringa e o encapsulator (nessa ordem) depois bombear o volume pré-planejada de solução de alginato. Repita esse procedimento para lotes posteriores de fabricação microbead. Após a conclusão, vire def a bomba de seringa em primeiro lugar, seguido pelo encapsulador.
- Armazenar as microesferas em 20 ml de solução de cloreto de 0,2 M de estrôncio a 4 ° C durante a noite para completar a ligação transversal e estabilizar o gel.
3. Tamanho Medição de microesferas de alginato
- Recolha 0,5 ml de microesferas de alginato com uma pipeta de plástico e coloque-o sobre uma lâmina de vidro. Ver as microesferas sob um microscópio óptico com aumento de 10x. Tome dez imagens das microesferas com um microscópio de câmara CCD. Guardar as imagens com barra de escala (500 mm) em formato TIFF com resolução de 2.048 x 1.536.
- Usando as ferramentas de comprimento em ImageJ, medir o tamanho das microesferas e barra de escala (Figura 2). Converter o comprimento a partir de microesferas de pixel para micrómetro.
- Clique nas ferramentas de linha e desenhar uma linha através do meio do cordão de alginato.
- Clique em "Analisar" na barra de menu e selecione "Measure". Uma janela pop-up irá aparecer.
- Repita os passos 3.2.1-3.2.2 para medir todas as esferas de alginato dentro da imagem. Medir a barra de escala na imagem.
- Converter o diâmetro do cordão de alginato com o comprimento real por meio da seguinte fórmula: comprimento de drageia de alginato / comprimento da barra de escala x 500 mm. Por exemplo, 1.420 (diâmetro medido pelo ImageJ) / 2.657 (comprimento da barra de escala medido pelo ImageJ) * 500 mm = 267 mm.
- Considere o tamanho médio das microesferas de 100 (média ± desvio padrão) medida que o tamanho representativas de cada lote de microesferas.
4. Esterilização
- Recolher as microesferas utilizando uma peneira de nylon de 100 um e lava-se as pérolas com água destilada duas vezes.
- Com uma espátula, transferir todas as microesferas feitas a partir de 0,1 ml de solução de alginato para um tubo de microcentrifugação de 2 ml e cobrir com gaze para evitar a secagem.
- Finalmente, esterilizar as microesferas por autoclavagem usando o modo de líquido (115 ° C, 15 min) ou em conformidade com mespecificações do ABRICANTE. Adicionar 1,5 L de água destilada para a câmara para impedir os grânulos de secagem.
5. Revestimento de protamina e heparina
- No interior do capuz NB-2, incubar as micropérolas estéreis, com 1 ml de 2 mg / ml de solução de protamina (esterilizada utilizando um filtro de seringa de 0,2 uM) durante 1 h à temperatura ambiente.
- Após incubação das microesferas durante 1 h (Passo 5.1), recolher 150 uL da solução de protamina para o teste de micro ácido bicinconínico (MicroBCA) (ver secção 6).
- Lavam-se as microesferas de protamina revestidos duas vezes com água duplamente destilada. Girar para baixo usando uma centrífuga de bancada superior a 200 xg durante 3 minutos à temperatura ambiente. Após centrifugação, aspirar a água através de uma seringa.
- Incubar protamina micropérolas revestido com 1 ml de 0,5 mg / ml de solução de heparina (esterilizada utilizando um filtro de seringa de 0,2 uM) durante 30 minutos para criar complexo polielectrólito (PEC).
- Após incubação a protamina revestidas microesferas fou 30 min (Passo 5.4), recolher 400 ml da solução de heparina para determinar o teor de heparina (secção 7).
- Após a incubação, lavar a heparina não ligada de PECs por lavagem duas vezes com água duplamente destilada.
Conteúdo 6. protamina
- Realizar o teste MicroBCA de acordo com as instruções do fabricante. Resumidamente, adicionar 150 ul de solução de protamina (recolhido antes e após a incubação com microesferas) numa placa de 96 poços. Adicionar 150 uL de solução de trabalho MicroBCA.
- Use solução de albumina (0, 0,5, 1, 2, 5, 10, 20, 40 e 200 ug / ml) como padrões de calibração.
- Incubar a mistura durante 60 min a 60 ° C. Medir a absorvância com um espectrofotómetro a 562 nm.
- Utilizar a curva padrão para determinar a concentração de protamina de cada amostra desconhecida de acordo com as instruções do fabricante.
- Determinar o teor de protamina das microesferas, subtraindo a quantidade total de protamina nasolução de revestimento (antes da incubação com microesferas) a partir da quantidade de protamina restante na solução de revestimento (após incubação com microesferas).
7. A heparina conteúdo
- Preparar 10 ml de solução de trabalho por dissolução de 4 mg de azul de toluidina e 20 mg de cloreto de sódio em ácido clorídrico 0,01 N.
- Adicionar 400 ul de amostra (a partir do passo 5.5) para a solução de trabalho a uma razão de 2: 3 e vortex durante 30 seg.
- Adicionar 600 ul de n-hexano (volume equivalente à solução do reagente de trabalho) e agitar com vortex a mistura para extrair o complexo heparina azul de toluidina.
- Aspirar 200 ul da fase aquosa através de uma seringa após a separação de fases.
- Medir a quantidade de azul de toluidina extraiu-un contido na fase aquosa utilizando um espectrofotómetro a 631 nm.
- Prepare soluções padrão de heparina de 0-20 ug / ml.
- Traçar a leitura 631 nm de cada padrão de heparina versus concentração de heparina em mg / meu. Utilizar a curva padrão para determinar a concentração de heparina de cada amostra.
8. confocal Imagem de estrutura de camada por camada
- Fabricar protamina, heparina e NELL-1 / BMP-2 analógico fluorescente CF-405 protamina (azul), CF 594 heparina (vermelho) e FITC NELL-1 / FITC (verde) BMP-2 + heparina + protamina acordo com o fabricante do folha de dados técnicos.
- Revestimento 100 ug micropérolas com 300 ul de análogo fluorescente (método de revestimento tal como descrito no 5,3-5,6) CF-405 protamina (azul) (2 mg / mL, incubação de 1 hora), CF 594 heparina (vermelho) (0,5 mg / ml, 30 min) e marcado com FITC NELL-1 / marcado com FITC (verde) BMP-2 (1,5 mg / ml, durante a noite). Lavam-se as microesferas por duas vezes com água destilada para eliminar a não ligado fluorescente protamina, heparina e NELL-1 / BMP-2.
- Observar a estrutura camada-por-camada (Figura 3) usando um microscópio confocal de ampliação 10X. 7
9. BMP-2e NELL-1 Captação e Lançamento
- Carregar 13,3 ul de 1,5 mg / ml de solução de BMP-2 ou NELL-1 em 100 g de PEC. Incubar PEC a 4 ° C sob agitação durante 30 rpm 10 h.
- Mergulhar as microesferas em 1 ml de fosfato salino tamponado (PBS) a 37 ° C com agitação constante (30 rpm).
- Recolha de 1 ml do sobrenadante e substitui-la com 1 ml de PBS, depois 1, 3, 6, 10 e 14 dias.
- Avaliar a absorção e libertação eficiência de BMP-2, utilizando o método de ELISA de acordo com o protocolo do fabricante. Avaliar a absorção e libertação de eficiência NELL-1 usando o método de ensaio de proteína carboxibenzoílo quinolina-2-carboxaldeído (CBQCA) de acordo com o protocolo do fabricante.
- Determinar a libertação cumulativa no momento (t):
libertação cumulativa no momento (t) = Lançamento no momento (t) + versão anterior no momento (t-1). - Traçar libertação cumulativa de BMP-2 e NELL-1 contra o tempo.
10. in vitro A bioactividadede NELL-1
Nota: A bioactividade de NELL-1 libertado da PEC foi avaliada medindo a sua capacidade para aumentar a expressão de fosfatase alcalina (ALP) nas células estaminais de medula óssea de coelho (rBMSC).
- Semente 20000 rBMSCs por poço numa placa de 24 poços, permitindo-lhes crescer durante um dia com 1 ml de Meio de Eagle Modificado por Dulbecco (DMEM) + 10% de soro fetal bovino (FBS) a 37 ° C e CO2 a 5%.
- Após 24 h, substituir o meio com 1 ml de um meio osteogénico (DMEM suplementado com 10% de FBS, 2% de penicilina estreptomicina, / ml de ácido ascórbico a 50 ^ g, 10 mmol / L de beta-glicerofosfato, e 10 -8 mol / L dexametasona ) durante 7 dias a 37 ° C e 5% de CO 2.
- Coloque 300 ug PEC-NELL-1 (a partir do passo 8.2) e PEC dentro inserções de cultura de células (inserção TC) para manter os PEC em separado a partir das células (isto evita a lavagem de micropérolas PEC durante a mudança de meio osteogénico). Lugar TC inserir no 24 bem plcomeu por 14 dias.
- Uma vez a cada três dias, aspirado 1 ml de meio osteogênico, colocando uma agulha fora da inserção TC, e substituir com 1 ml de meio osteogênico fresco.
- Após 7 e 14 dias de incubação, determinar a actividade de ALP com um kit de ensaio de ALP em conformidade com o protocolo do fabricante do kit.
- Lisar as células com tampão de ensaio contendo 0,1% de Triton X-100 a 4 ° C durante 10 min. Raspar células aderidas usando um raspador de células. Incubar suspensão de células a 4 ° C sob agitação durante pelo menos 60 min.
- Centrifugar a suspensão de células a 2500 x g a 4 ° C durante 10 min. Recolhe-se o sobrenadante para o ensaio de ALP.
- Adicionar 50 uL de solução padrão de fosfatase alcalina diluída em série 200-0 ng / ml para os poços de uma placa de 96 poços. Os valores finais do padrão de fosfatase alcalina são 10, 5, 2,5, 1,2, 0,6, 0,3, 0,15 e 0 ng / poço.
- Adicionar o sobrenadante do passo 10.5.2 (50 uL / poço) e dilui-se com diluição bpode ser prejudicado.
- Adicionar 50 ul de solução de fosfato (pNPP) substrato de p-nitrofenilo em cada poço. Misturar os reagentes agitando cuidadosamente a placa durante 30 segundos. Incubar a mistura durante 30 min no escuro. Medir a absorvância a 405 nm pelo leitor de placas.
- Calcular a actividade de ALP usando a curva de calibração.
- Determinar o teor de proteína utilizando o kit de ensaio de proteínas MicroBCA de acordo com as instruções do fabricante. Normalizar a actividade ALP dividindo a actividade de ALP em teor proteico.
Viabilidade 11. celular
- Incubar 200 mg de PEC-NELL-1 com 1 ml de DMEM + 10% FBS a 37 ° C durante 24 h para a 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazólio (MTT) ensaio.
- Semente rBMSCs 2.000 por cavidade (em 100 ul de DMEM com FBS a 10%) numa placa de 96 poços e incuba-se durante 1 dia a 37 ° C, 5% de CO 2.
- Substituir DMEM + FBS a 10% com 100 ul de extracto de PEC-NELL-1 / PEC e incubara 37 ° C, 5% de CO 2.
- Após 1 dia ou 3 dias de incubação, adicionar 10 uL de 5 mg de solução de MTT / ml e ainda mais incubar a 37 ° C, 5% de CO 2 durante 4 h na escuridão.
- Adicionar 100 ul de solução de DMSO a cada poço para dissolver cristais de formazano.
- Determinar a absorvância a 570 nm utilizando um leitor de microplacas.
- Calcula-se a taxa de crescimento relativa:
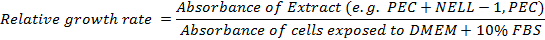
12. Embalagem para Andaime e BMP-2 & NELL-1 Carregando
- Embalar os PEC para dentro dos poros de um Policaprolactona de grau médico bioreabsorv�el - fosfato de tri-cálcio (mPCL-TCP) andaime utilizando uma espátula esterilizada dentro de uma câmara de NBS-2.
- Adicionar 1,5 mg / ml, solução de BMP-2 ou NELL-1 para o andaime mPCL-TCP embalado com PEC e incubar durante a noite a 4 ° C.
Resultados
No nosso transportador, protamina foi escolhido como substituto de poli-L-lisina, uma vez que tem propriedades químicas semelhantes e é aprovado pela FDA como um antídoto de heparina. resultados da microscopia óptica mostrou que as microesferas não-irradiados foram de forma esférica com um diâmetro de 267 ± 14 pM. (0,35 mm de bocal, taxa de fluxo de 5 ml / h e 5,8 kV). A maioria das micropérolas são irradiados de forma de lágrima. O diâmetro medido na parte turno das microesferas irradiados foi de 212 ± 30 mm (0,35 bico mm, a taxa de 4 ml / h e 6 kV de fluxo). (Figura 4).
imagens confocal das microesferas PEC revelar revestimento de camada por camada de CF-405 protamina marcada (azul), heparina marcada com CF594 (vermelho) e FITC-BMP-2 / FITC-NELL-1 (verde). Os resultados indicam que os PEC podem ligar-se com a carga positiva de BMP-2 e carregado negativamente NELL-1 através do bindi heparinadomínio ng (Figura 5). Isto sugere que a interacção entre os PEC e os factores de crescimento osteogénico não é dependente cobra.
Para provar que os PEC são capazes de absorver e libertar o BMP-2, foi utilizado um ensaio ELISA para determinar a quantidade de BMP-2 remanescente após a incubação e a quantidade de BMP-2 em PBS no dia 1, 3, 6, 10 e 14 . no entanto, uma abordagem semelhante não funcionam bem com a proteína NELL-1, uma vez que a heparina bloqueia o local de ligação do anticorpo, reduzindo significativamente o sinal. Portanto, o ensaio de proteína CBQCA foi utilizado para determinar a diferença entre o PEC-NELL-1 e PEC. A partir da curva de libertação cumulativa, os PEC não só mostrar um maior NELL-1 eficiência de absorção em comparação com BMP-2, mas também libertar-se muito mais lento do que a BMP-2 (NELL-1: 20% vs BMP-2: 25%) (Figura 6). Isto sugere que os PEC se ligam mais fortemente com NELL-1 de BMP-2.
from o ensaio de MTT, PEC-NELL-1 não é citotóxico (Figura 7). O resultado combina com o resultado do ensaio Alamar Blue em um estudo anterior 7. A heparina neutralizam a carga positiva de protamina, que desempenha um papel importante na manutenção da biocompatibilidade de PEC.
Para determinar se o NELL-1 libertação de PEC afecta diferenciação osteogénica de longa duração, o nível de expressão de um marcador osteogénico, fosfatase alcalina (ALP), foi investigada por um ensaio colorimétrico. NELL-1 libertação de PEC aumenta a actividade de ALP de células estaminais de medula óssea de coelho de 2,2 vezes ao 14 ° dia em comparação com o grupo de controlo PEC (Figura 8). BMP-2 mostra aumento máximo de atividade de ALP (3,75 vezes) no dia 7. Ambos PEC-BMP-2 e PEC-BMP-2 + extra BMP-2 mostram diminuição da atividade no dia 9.
a actividade de ALP com BMP-2 no meio sem PEC é mostrado na Figura 8C. Apesar de 70% do factor de crescimento permanece no PEC, a actividade de ALP de PEC grupo BMP-2 é equivalente ao grupo de BMP-livre. In vivo, o factor de crescimento deve ser entregue pelo transportador para evitar lavagem. Do nosso roedor e porcino modelo, que pode diminuir a dose de PMO-2 por 20 vezes e de 6 vezes, respectivamente. A redução de não só reduzir efeitos colaterais indesejados, mas também reduz o custo de utilização do fator de crescimento.

Figura 1: Gerador de talão eletrostática e seringa bomba criada em gabinete BSL-2 biossegurança (A) Bico garantido no suporte do bico.. (B) bacia grande para a solução de cloreto de estrôncio. (C) Eletrodo cabo. (D) Mangueira oferece solução de alginato. (E) no bocal e no braço. Fornecimento T (F) Os eléctrodosEle diferença de potencial para regular o tamanho do grânulo. (G) um agitador magnético. (H) 5 ml de uma seringa. (I) da bomba de seringa para regular o fluxo de alginato. Botão de controle (J) Agitador para controlar a velocidade de agitação. Botão de controlo (K) de tensão para regular a diferença de potencial entre 0-10 kV. Por favor clique aqui para ver uma versão maior desta figura.
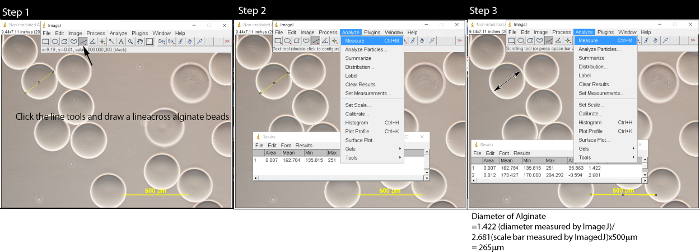
Figura 2: Medição de microesferas de alginato com software ImageJ Depois de abrir o arquivo de imagem clicando em Arquivo → Abrir, execute a Etapa 1:. Clique na ferramenta linha e desenhar uma linha sobre as microesferas de alginato. Na Etapa 2, clique em Analisar na barra de menu e uma janela pop-up irá aparecer. Repita as Etapas 1 e 2 até que todas as microesferas são measured. Na Etapa 3, clique na ferramenta de linha, desenhar uma linha em toda a barra de escala e medir o comprimento da barra de escala. Converter o comprimento microesferas de mm usando fórmula:. Comprimento do alginato / comprimento da barra de escala x 500 mm Por favor clique aqui para ver uma versão maior desta figura.

Figura 3:. Representação esquemática do complexo polielectrólito núcleo de alginato (verde-escuro) camada carga protamina positiva (verde-claro), a camada de carga heparina negativo (vermelho), factor de crescimento osteogénico, por exemplo, BMP-2 / NELL-1 na camada mais externa (pálida azul). por favor clique aqui para ver uma versão maior desta figura.

Figura 4:. Imagens de campo claro de microesferas de alginato (A) não irradiados. (B) 8M Rad irradiadas. microesferas de alginato não irradiadas são esféricos e 8M Rad irradiado contrapartida é em forma de lágrima. Ampliação 100X. (Escala bar = 500 mm.) Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5:. As imagens de microscopia confocal de varrimento laser de micro-esferas de alginato incubadas com análogos fluorescentes de protamina, heparina, NELL-1 e BMP-2 (A) CF 405 protamina (azul), (B) CF 594 Heparina (vermelho), (C ) FITC NELL-1 (verde) e (D ) FITC BMP-2 (verde). Microesferas permanecem esférica mesmo após incubação com análogos fluorescentes. Barra de escala = 250 mm. Por favor clique aqui para ver uma versão maior desta figura.
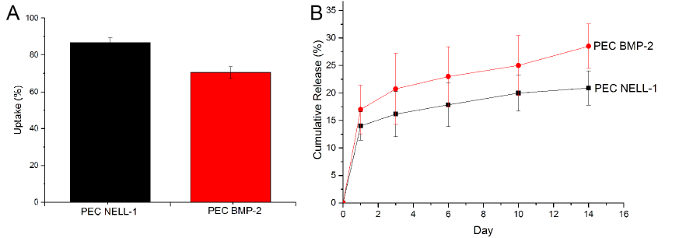
Figura 6:. A absorção e libertação de BMP-2 e NELL-1 (A) A absorção de NELL-1 proteína (preto) BMP-2 (vermelho), (B) curva de libertação cumulativa de BMP-2 (vermelho) e NELL- 1 (preto) da transportadora PEC. Os resultados são apresentados como média ± desvio padrão. Por favor clique aqui para ver uma versão maior desta figura.
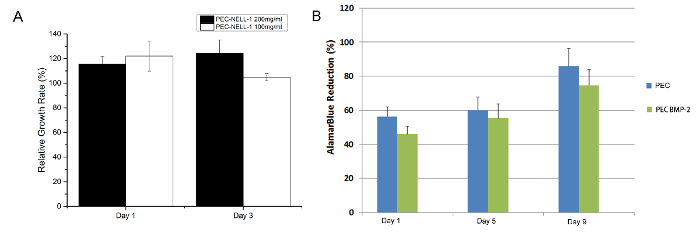
Figura 7:. Citotoxicidade Ensaio (A) Ensaio de MTT de medula óssea de coelho origina células com protamina base PEC NELL-1 200 mg / ml extrair (preto), PEC-NELL-1 100 mg / ml extrair (branco) a dia 1 e 3. (B) ensaio Alamar Blue de medula óssea de coelho hastes celular com PEC BMP-2 (azul), PEC (verde) As experiências foram realizadas em triplicado e os resultados são apresentados como média ± desvio padrão. por favor clique aqui para ver uma versão maior desta figura.
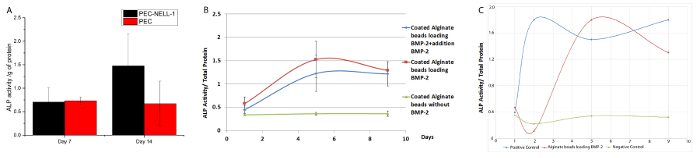
Figura 8: Ensaio para a bioactividade de BMP-2 e NELL-1 de transportador de libertação PEC (A) a actividade de ALP de células estaminais de medula óssea de coelho incubadas com PEC-NELL-1 (preto), PEC (vermelho).. a actividade de ALP foi medida como absorvância a 405 nm. 2.2dobra foi observado aumento na actividade de ALP após incubação com PEC-NELL-1 no dia 14. (B) a actividade de ALP de células estaminais de medula óssea de coelho incubadas com PEC-BMP-2 (vermelho) PEC-BMP-2 + adição de BMP- 2 (verde) e PEC (azul). Aumento da actividade de ALP após incubação com PEC-BMP-2 e BMP-PEC-2 + adição de BMP-2 no dia 7, a actividade de ALP gotas no Dia 9. (C) ALP actividade de células estaminais de medula óssea de coelho incubadas com PEC- BMP-2 (vermelho) BMP-2 (azul) e Médio (verde). Os resultados são apresentados como média ± desvio padrão. Por favor clique aqui para ver uma versão maior desta figura.

Figura 9: fosfato Polycaprolactone Tri-cálcio (PCL-TCP) scaffold embalado com transportador PEC (A) Polycaprola.ctone fosfato de Tri-cálcio (PCL-TCP) scaffold (tamanho de poro de 1.300 mm) embalado com transportador PEC. andaime (B) PCL-TCP. (C) de alta ampliação: PEC mantém a sua forma após a embalagem. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo apresenta um método para a preparação de CPE através de camada-por-camada de auto-montagem. A estrutura de camada-por-camada é visualizada utilizando análogos fluorescentes de protamina, heparina, BMP-2 e NELL-1 e microscopia confocal. Captação e testes de libertação mostram que heparinas de PEC medeia a captação fator de crescimento osteogénico e solte. A eficiência de absorção do método de PEC é: NELL-1: 86,7 ± 2,7%, BMP-2: 70,5 ± 3,1%. O transportador PEC tem uma melhor modulação da libertação NELL-1 (20%) em comparação com um veículo de adsorção de superfície puro tal como partículas de apatite de cálcio (40-80%) 11.
Além modulador da libertação, a heparina neutraliza a carga positiva excessiva de policati�s tais como protamina para evitar problemas relacionados com citotoxicidade indesejado 12. Os PEC não mostram quaisquer sinais de citotoxicidade, tal como determinado pelo teste de MTT e o ensaio Alamar Blue 7. O ensaio de ALP mostra o transportador PEC pode manter a Bioactivity de ambos NELL-1 e BMP-2. Embora tenha sido desenvolvido para o fator de crescimento osteogénico terapia BMP-2 em cirurgias de fusão espinhal, PEC também pode levar até outros fatores de crescimento com domínios de ligação de heparina, como NELL-1 e PDGF-BB. Em comparação com outros métodos de entrega tais como a encapsulação de factores de crescimento em microsferas de ácido poliglicólico, PEC não requerem solventes orgânicos que tendem a inactivar os factores de crescimento 13.
Uma série de fatores no processo de fabricação PEC pode afetar o desempenho transportadora. Em primeiro lugar, o tamanho micropérola afecta a relação de área de superfície / volume. Maior factor de crescimento osteogénico carregamento pode ser conseguido com microesferas mais pequenas. Em segundo lugar, a concentração de alginato deve ser suficiente para manter a estabilidade da estrutura de microesferas. Microbead estabilidade depende do tipo de alginato, do comprimento da cadeia (afectado por irradiação gama) e o ião divalente utilizado (de bário> estrôncio> cálcio). Enquanto 2% de solução de alginato é suficiente para Fábricasre PECs com estruturas microbead estáveis, 4% de alginato é necessário seguir 8 irradiação gama MRad para compensar os efeitos de encurtamento da cadeia de alginato durante a irradiação. Em terceiro lugar, a velocidade de degradação in vivo das micro-esferas de alginato é fortemente influenciada pelo comprimento da cadeia de alginato. Com base em nossa experiência com modelos de ratos e suínos, PEC fabricados usando 8 MRad irradiado alginato mostra degradação rápida (28 dias) e completa do núcleo de alginato (dados não publicados). Degradação do núcleo alginato fornece espaço essencial para crescimento ósseo. Em quarto lugar, a incubação durante a noite de BMP-2 e NELL-1 a 4 ° C com agitação constante (por exemplo, 30 rpm) pode melhorar a eficiência de absorção. Por último, a espessura do revestimento é dependente do tempo de protamina. Uma vez que a extensão da interacção da heparina-protamina determina a libertação de factores de crescimento osteogénico, tais como BMP-2 ou NELL-1, 1 h de incubação a protamina é adoptado para melhorar a estabilidade da estrutura PEC.
A utilização de heparina nesta técnica é crítico na estabilização dos factores de crescimento delicadas e, portanto, importante para o prolongamento de bioactividade in vivo. Dada a quantidade muito limitada da heparina envolvidos e juntamente com a escolha do antídoto, por exemplo, a protamina (uma droga altamente eficaz para neutralizar as actividades anticoagulantes da heparina), o tempo de hemorragia prolongada em osso decorticada é em grande parte teórica e praticamente irrelevante.
Carregando as PECs no andaime PCL-TCP melhora a localização de contas em sites de implantes. Scaffolds fornecer suporte mecânico necessário que é crucial para a fusão da coluna. Nos presentes estudos, foi utilizado andaimes PCL-TCP com 1.300 uM poros para facilitar a embalagem adequada (Figura 9). Embora a ilustração atual mostra PEC entrega fator de crescimento osteogénico com o andaime PCL-TCP, o nosso grupo tem também avaliou o desempenho carrier com um polyetherketoneketone (PEKK) Câmara de osso em um estudo coelho com eficácia semelhante.
Neste estudo, a falta de comparação com outros transportadores previamente avaliadas de rhBMP-2 e NELL-1 pode representar uma limitação.
Em conclusão, o processo apresentado fornece um veículo útil para controlar a libertação de factores de crescimento osteogénicos com domínios de heparina, tais como BMP-2 e NELL-1. A estratégia descrita combina muitas vantagens: não é restrito para BMP-2 e aplicável a outros factores de crescimento com domínios de ligação à heparina, tais como NELL-1. A redução da dose de factor de crescimento osteogénico pode reduzir os efeitos colaterais indesejáveis, tais como seroma, a formação de osso heterotróficas e reduzir o custo global do tratamento.
Divulgações
Nós não temos nenhum conflito de interesses.
Agradecimentos
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
Materiais
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
Referências
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados