Method Article
Complexe de polyélectrolyte pour Heparin Binding Domain Growth Factor ostéogénique Livraison
Dans cet article
Résumé
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
Résumé
Pendant les chirurgies reconstructives osseuses, des quantités supraphysiologiques de facteurs de croissance sont empiriquement chargés sur des échafaudages pour promouvoir avec succès la fusion osseuse. De fortes doses d'agents biologiques très puissants sont nécessaires en raison de l'instabilité facteur de croissance par suite de la dégradation enzymatique rapide, ainsi que l'inefficacité de support en localisant des quantités suffisantes de facteur de croissance sur les sites d'implantation. Par conséquent, les stratégies qui prolongent la stabilité des facteurs de croissance tels que le BMP-2 / NELL-1, et de contrôler leur libération pourrait effectivement réduire leur dose efficace et de réduire ainsi le besoin de doses plus importantes lors de futures opérations de la régénération osseuse. Cela permettra de réduire les effets secondaires et les coûts des facteurs de croissance. PECs auto-assemblées ont été fabriqués pour fournir un meilleur contrôle de la BMP-2 / NELL-1 livraison par liaison à l' héparine et autre facteur bioactivité de croissance de potentialisent en améliorant la stabilité in vivo. Ici, nous illustrons la simplicité de fabrication PEC qui facilite la delivery d'une variété de facteurs de croissance des os lors d'interventions chirurgicales de reconstruction.
Introduction
L'incidence de la pseudarthrose a été rapporté comme étant aussi élevé que 10 à 45% en fusion spinale dégénérative et de révision des chirurgies de la colonne vertébrale 1. Pour réduire le taux de pseudarthrose lors de la colonne vertébrale fusion et d' autres chirurgies reconstructives osseuses, des facteurs de croissance ostéogéniques tels que BMP-2, Nell-1 1 et facteur de croissance plaquettaire (PDGF) ont été introduites pour promouvoir de novo ostéogenèse. Parmi ceux - ci, la BMP-2 est un choix populaire pour la fusion vertébrale 2. Bien que l'activité de BMP-2 pour induire et faciliter la formation d'os a été bien établi 3; complications cliniquement significatives telles que la formation osseuse hétérotopique, sérome et formation d' un hématome, la réponse inflammatoire, radiculite, vertébral ostéolyse du corps, et l' éjaculation rétrograde continuent d'être sujets de préoccupation en raison des quantités utilisées supraphysiologiques 4,5.
Par conséquent, en abaissant la dose de BMP-2 reste une stratégie pertinente àtente de réduire au minimum les effets secondaires. Par ailleurs, les systèmes de support efficaces sont nécessaires pour supprimer la libération de rafale initiale de la BMP-2 observée dans des systèmes de support de l'éponge de collagène contemporaine et en outre améliorer l'administration prolongée et localisée de cette cytokine puissante. L'auto-assemblage couche par couche d' une alternance de polyélectrolytes cationiques et anioniques peuvent être utilisés en tant que méthode accordable pour construire des complexes de polyélectrolytes sur la surface des matrices d'échafaudage ou de matériaux implantables 6. A cet égard, l'héparine (connu pour avoir la plus forte densité de charge négative de tous les agents biologiques) a été reconnue pour lier avidement avec une variété de facteurs de croissance par l'intermédiaire des domaines de liaison électrostatique et l'héparine. En effet, l'héparine a été démontré que pour prolonger la demi-vie et donc de potentialiser l'activité biologique de plusieurs facteurs de croissance.
Sur cette base, notre groupe a adapté un protocole couche par couche auto-assemblage pour fabriquer un complexe polyélectrolyte à base d'héparine (PEC) qui les charges et conserve les activités biologiques de facteurs de croissance ostéogéniques lors de l' immobilisation 7,8. Le noyau de microbilles d'alginate a été fabriqué par réticulation d'α-L-guluronate (G) des résidus d'alginate avec des ions calcium en cations divalents ou de strontium. Le noyau d'alginate est une matrice d'échafaudage biodégradable; qui, après l'implantation, il est résorbé dans le lit de fusion fournissant la place pour l'interposition osseuse. Poly-L-lysine (PLL) ou la protamine est utilisée comme couche cationique entrelacer à la fois avec la matrice d'échafaudage (dans ce cas, le noyau alginate de support de microbilles) et l'héparine chargée négativement; tandis que les fonctions anioniques de la couche d'héparine pour stabiliser et localiser les facteurs de croissance chargés. La triple couche PEC a été montré pour augmenter la capacité de chargement du facteur de croissance dans un modèle porcin 9. Récemment, les transporteurs PEC ont été montré pour réduire avec succès la dose efficace de BMP-2 d'au moins 20 fois chez le rat 10 et modèles porcins de fusion rachidienne 8.
ntent "> Ici, nous rapportons les méthodes de fabrication d'PECs pour une meilleure prestation de facteur de croissance dans la fusion spinale et les autres chirurgies reconstructives osseuses en utilisant BMP-2 en tant que facteur modèle de croissance ostéogénique.Protocole
1. Préparation de la solution d'alginate
- Dissoudre 200 mg d'alginate de sodium (non irradié) ou 400 mg de 8 Mrad irradié alginate de sodium dans 10 ml d'eau bidistillée et agiter pendant 1 h pour alginate non irradiée et 15 min pour l'alginate irradié. Stocker la solution d'alginate à 4 ° C pendant une nuit. Filtrer la solution d'alginate avec un filtre à seringue de 0,2 um stérile avant d'alginate microbille fabrication.
2. Alginate Microbead Fabrication
- Désinfecter le générateur de perles électrostatique et pompe à seringue avec 70% d' éthanol et de les placer dans une classe II Cabinet de sécurité biologique (Figure 1).
- Placez un bassin de verre avec une barre d'agitation magnétique à l'intérieur du générateur de perles.
- Fixer l'électrode de bras du générateur de talon de 9 cm au-dessus du bassin.
- Branchez le câble d'électrode du générateur de bourrelet à la vis moletée 2 de l'électrode de bras, et versez 80 ml de SrCl2 solution dans lebassin.
- Charge 5 ml de 0,2 um solution d'alginate filtré dans le tube de la seringue et du caoutchouc. Après avoir branché le tube de caoutchouc à l'électrode de bras, activer la pompe seringue à 5 ml / h pendant 2 minutes pour expulser l'air à l'intérieur du tube et de fournir la solution d'alginate à la pointe de la buse. Eteignez la pompe seringue.
- Ensuite, allumer le encapsulateur puis, la pompe à seringue pour commencer la génération microbille. Réglez le débit alginate à 5 ml / h et la tension à 5,8 kV sur le encapsulateur. Jeter les microbilles générés pendant les deux premières minutes (ou la solution d'alginate initiale 0,5 ml pompé hors de la seringue), ces microbilles ont tendance à être irrégulière galbée et dimensionnée.
- Collecter des microbilles ultérieures dans une solution de chlorure de 0,2 M de strontium. Eteignez à la fois la pompe à seringue et l'encapsulateur (dans cet ordre) après le pompage du volume pré-planifiée de la solution d'alginate. Répétez cette opération pour les lots suivants de microbille fabrication. À la fin, tourner def la pompe à seringue en premier, suivie par l'encapsulateur.
- Stocker les microbilles dans 20 ml d'une solution de chlorure de strontium 0,2 M à 4 ° C pendant une nuit pour achever la réticulation et la stabilisation du gel.
3. Mesure de la taille des microbilles alginate
- Recueillir 0,5 ml de microbilles alginate avec une pipette en plastique et le placer sur une lame de verre. Voir les microbilles sous un microscope optique à un grossissement de 10X. Prenez dix images des microbilles avec une caméra microscope CCD. Enregistrer les images avec barre d'échelle (500 um) en format TIFF avec une résolution 2048 x 1536.
- En utilisant les outils de longueur dans ImageJ, mesurer la taille des microbilles et barre d'échelle (figure 2). Convertir la longueur des microbilles de pixel au micromètre.
- Cliquez sur les outils en ligne et tracer une ligne à travers le milieu de la bille d'alginate.
- Cliquez sur "Analyser" dans la barre de menu et sélectionnez "Mesure". Une fenêtre pop-up apparaîtra.
- Répétez les étapes 3.2.1-3.2.2 pour mesurer toutes les billes d'alginate dans l'image. Mesurer la barre d'échelle sur l'image.
- Convertir le diamètre du cordon d'alginate à la longueur réelle en utilisant la formule: longueur du cordon d'alginate / longueur de la barre d'échelle x 500 um. Par exemple, 1.420 (diamètre mesuré par ImageJ) / 2.657 (échelle de longueur de la barre mesurée par ImageJ) * 500 um = 267 um.
- Pensez à la taille moyenne de 100 microbilles (moyenne ± écart-type) que la taille représentative de chaque lot de microbilles.
4. Stérilisation
- Collecter les microbilles en utilisant un nylon crépine 100 um et laver les billes avec de l'eau distillée deux fois.
- Avec une spatule, transférer tous les microbilles fabriqués à partir de 0,1 ml de solution d'alginate dans un tube de microcentrifugeuse de 2 ml et couvrir avec de la gaze pour éviter le dessèchement.
- Enfin, les stériliser par autoclavage microbilles en utilisant le mode de liquide (115 ° C, 15 min) ou en conformité avec mles spécifications abricant. Ajouter 1,5 L d'eau distillée à la chambre pour empêcher les perles de séchage.
5. protamine et Heparin Coating
- A l'intérieur du BSL-2 capot, incuber les microbilles stériles avec 1 ml de 2 mg / ml de solution de protamine (stérilisé en utilisant un filtre à seringue de 0,2 pm) pendant 1 heure à température ambiante.
- Après incubation des microbilles pendant 1 heure (étape 5.1), de recueillir 150 ul de la solution de protamine pour l'acide bicinchoninique (microBCA) Test micro (article 6).
- Laver les protamines enduit microbilles deux fois avec de l'eau distillée deux fois. Isoler l'aide d'une centrifugeuse de banc à 200 xg pendant 3 min à température ambiante. Après centrifugation, aspirer l'eau à l'aide d'une seringue.
- Incuber protamine microbilles revêtues avec 1 ml de 0,5 mg / ml de solution d'héparine (stérilisé en utilisant un filtre à seringue de 0,2 um) pendant 30 min pour créer complexe polyélectrolyte (PEC).
- Après incubation de la protamine revêtue microbilles fou 30 min (étape 5.4), recueille 400 ul de la solution d'héparine pour déterminer la teneur en héparine (section 7).
- Après incubation, laver l'héparine non lié de CBV par deux lavages avec de l'eau distillée deux fois.
6. protamine Content
- Effectuer le test microBCA selon les instructions du fabricant. En bref, ajouter 150 solution de protamine ul (recueillies avant et après incubation avec des microbilles) dans une plaque de 96 puits. Ajouter 150 pi de solution de travail microBCA.
- Utiliser une solution d'albumine (0, 0,5, 1, 2, 5, 10, 20, 40 et 200 pg / ml) comme étalons.
- Laisser incuber le mélange pendant 60 min à 60 ° C. Mesurer l'absorbance avec un spectrophotomètre à 562 nm.
- Utiliser la courbe d'étalonnage pour déterminer la concentration de protamine de chaque échantillon inconnu selon les instructions du fabricant.
- Déterminer la teneur en protamine des microbilles en soustrayant la quantité totale de protamine dans leSolution de revêtement (avant l'incubation avec des microperles) à partir de la quantité de protamine restant dans la solution de revêtement (après incubation avec des microperles).
7. Héparine Content
- Préparer les 10 ml de la solution de travail en dissolvant 4 mg de bleu de toluidine et de 20 chlorure de sodium 0,01 mg dans de l'acide chlorhydrique.
- Ajouter 400 ul d'échantillon (étape 5.5) à la solution de travail à un rapport de 2: 3 et vortexer pendant 30 secondes.
- Ajouter 600 ul de n-hexane (volume équivalent à la solution de réactif de travail) et vortexer le mélange pour extraire le complexe d'héparine bleu de toluidine.
- Aspirer 200 ul de la phase aqueuse par la seringue après séparation des phases.
- Mesurer la quantité de non-extrait bleu de toluidine contenu dans la phase aqueuse à l'aide d'un spectrophotomètre à 631 nm.
- Préparer des solutions étalons d'héparine de 0 à 20 pg / ml.
- Tracer la lecture 631 nm de chaque norme par rapport à la concentration d'héparine de l'héparine en ug / ml. Utiliser la courbe d'étalonnage pour déterminer la concentration d'héparine de chaque échantillon.
8. confocale Image de la structure de couche par couche
- Fabriquez protamine, l'héparine et NELL-1 / BMP-2 analogue fluorescent CF-405 protamine (bleu), CF 594 héparine (rouge) et FITC étiqueté NELL-1 / FITC marqué (vert) BMP-2 + héparine + protamine selon fabricant fiche technique.
- Coat 100 ug microbilles avec 300 pi de analogue fluorescent (de procédé de revêtement tel que décrit dans 05/03 au 05/06) CF-405 protamine (bleu) (2 mg / ml, 1 h d'incubation), CF 594 héparine (rouge) (0,5 mg / ml, 30 min) et marqué au FITC NELL-1 / marqué au FITC (vert) BMP-2 (1,5 mg / ml, pendant la nuit). Laver les microbilles deux fois avec de l'eau distillée pour éliminer le non lié fluorescent protamine, l'héparine et NELL-1 / BMP-2.
- Observer la structure couche par couche (figure 3) à l'aide d' un microscope confocal à un grossissement 10X. 7
9. BMP-2et NELL-1 Uptake and Release
- Charge 13,3 pi de 1,5 mg / ml de BMP-2 ou NELL-1 sur une solution de 100 ug de PEC. Incuber PEC à 4 ° C de moins de 30 rpm tremblantes pendant 10 heures.
- Immerger les microbilles dans 1 ml de tampon phosphate salin (PBS) à 37 ° C avec agitation constante (30 tpm).
- Prélever 1 ml du surnageant et de la remplacer par 1 ml de PBS après 1, 3, 6, 10 et 14 jours.
- Évaluer l'efficacité de l'absorption et la libération de la BMP-2 en utilisant la méthode ELISA selon le protocole du fabricant. Évaluer l'absorption et la libération de l'efficacité NELL-1 en utilisant le carboxybenzoyle quinoléine-2-carboxaldéhyde (CBQCA) Méthode de dosage des protéines selon le protocole du fabricant.
- Déterminer la libération cumulative au temps (t):
libération cumulative au temps (t) = sortie au temps (t) + Communiqué précédent à l'instant (t-1). - Tracer la libération cumulative de BMP-2 et NELL-1 contre le temps.
10. La bioactivité in vitrode NELL-1
Remarque: La bioactivité de NELL-1 libéré du PEC a été évaluée en mesurant sa capacité à augmenter l'expression de la phosphatase alcaline (ALP) dans les cellules souches de la moelle osseuse (lapin rBMSC).
- Seed 20.000 rBMSCs par puits dans une plaque de 24 puits et leur permettre de se développer pendant une journée avec 1 ml de milieu de Eagle modifié par Dulbecco (DMEM) + 10% de sérum bovin fœtal (FBS) à 37 ° C et 5% de CO 2.
- Au bout de 24 heures, remplacer le milieu par 1 ml d'un milieu ostéogénique (DMEM supplémenté avec 10% de FBS, 2% de pénicilline streptomycine, 50 pg / ml d' acide ascorbique, 10 mmol / l de bêta-glycérophosphate et de 10 -8 mol / L dexaméthasone ) pendant 7 jours à 37 ° C et 5% de CO 2.
- Placer 300 ug PEC-NELL-1 (de l'étape 8.2) et PEC à l'intérieur des inserts de culture cellulaire (TC insert) pour garder les PECs séparés des cellules (ce qui évite le lessivage de microbilles PEC pendant le changement de milieu ostéogénique). Lieu TC insérer dans le 24 et plmangé pendant 14 jours.
- Une fois tous les trois jours, aspirée 1 ml du milieu ostéogénique en plaçant une aiguille en dehors de l'insert de TC, et remplacer par 1 ml de milieu ostéogénique frais.
- Après 7 et 14 jours d'incubation, de déterminer l'activité ALP avec un kit de dosage de l'ALP en conformité avec le protocole du fabricant du kit.
- lyser les cellules avec du tampon d'essai contenant 0,1% de Triton X-100 à 4 ° C pendant 10 min. Grattez les cellules adhérentes à l'aide d'un grattoir cellulaire. Incuber la suspension de cellules à 4 ° C sous agitation pendant au moins 60 min.
- Centrifuger la suspension cellulaire à 2500 g à 4 ° C pendant 10 min. Recueillir le surnageant pour le dosage de l'ALP.
- Ajouter 50 ul d'une solution alcaline diluée en série de la phosphatase norme 200-0 ng / ml dans les puits d'une plaque à 96 puits. Les montants définitifs de la norme de la phosphatase alcaline sont 10, 5, 2,5, 1,2, 0,6, 0,3, 0,15, et 0 ng / puits.
- Ajouter le surnageant de l'étape 10.5.2 (50 pl / puits) et diluer avec de dilution buffer.
- Ajouter 50 pi de solution phosphate (pNPP) de substrat p - nitrophényle dans chaque puits. Mélanger les réactifs en agitant doucement la plaque pendant 30 secondes. Laisser incuber le mélange pendant 30 minutes dans l'obscurité. Mesurer l'absorbance à 405 nm par un lecteur de plaque.
- Calculer l'activité ALP en utilisant la courbe d'étalonnage.
- Déterminer la teneur en protéines en utilisant le kit de dosage de protéine microBCA selon les instructions du fabricant. Normaliser l'activité de l'ALP en divisant l'activité d'ALP par la teneur en protéines.
11. Viabilité cellulaire
- Incuber 200 mg de PEC-NELL-1 avec 1 ml de DMEM + 10% de FBS à 37 ° C pendant 24 h pour la 3- (4,5-diméthylthiazol-2-yl) -2,5-diphényltétrazolium (MTT) essai.
- Seed 2000 rBMSCs par puits (dans 100 ul de DMEM avec 10% de FBS) dans une plaque de 96 puits et incuber pendant 1 jour à 37 ° C, 5% de CO 2.
- Remplacer DMEM + 10% de FBS avec 100 pi d'extrait PEC-NELL-1 / PEC et incuberà 37 ° C, 5% de CO 2.
- Après 1 jour à 3 jours d'incubation, ajouter 10 ul de 5 mg / ml de solution de MTT et on incube encore à 37 ° C, 5% de CO 2 pendant 4 heures dans l' obscurité.
- Ajouter 100 ul solution de DMSO dans chaque puits pour dissoudre les cristaux de formazan.
- Déterminer l'absorbance à 570 nm en utilisant un lecteur de microplaques.
- Calculer le taux de croissance relative:
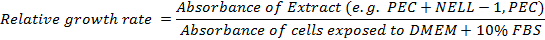
12. Emballage en Échafaudages et BMP-2 & NELL-1 Loading
- Emballer les CBV dans les pores d'une polycaprolactone de grade médical biorésorbable - phosphate de tri-calcium (TCP MPCL) échafaudage à l'aide d'une spatule stérile à l'intérieur d'une chambre BSL-2.
- Ajouter 1,5 mg / ml de solution de BMP-2 ou NELL-1 sur l'échafaud MPCL-TCP emballé avec PEC et incuber une nuit à 4 ° C.
Résultats
Dans notre transporteur, protamine a été choisi comme un substitut de poly-L-lysine comme il a des propriétés chimiques similaires et il est approuvé par la FDA comme un antidote de l'héparine. résultats au microscope optique montre que les microbilles non irradiés ont une forme sphérique avec un diamètre de 267 ± 14 um. (0,35 mm buse, débit de 5 ml / h et 5,8 kV). La majorité des microbilles irradiés sont de forme de larme. Le diamètre mesuré sur la partie ronde des microbilles irradiées était de 212 ± 30 um (0,35 mm buse, débit de 4 ml / h et 6 kV flux). (Figure 4).
Les images confocales des microbilles PEC révèle revêtement couche par couche de CF-405 protamine marqué (bleu), l'héparine de CF594 marqué (rouge) et FITC-BMP-2 / FITC-NELL-1 (vert). Les résultats indiquent que les PECs peuvent se lier avec une charge positive BMP-2 et chargé négativement NELL-1 via le bindi d'héparinedomaine ng (Figure 5). Ceci suggère que l'interaction entre les CPE et les facteurs de croissance ostéogénique est chargent pas dépendante.
Pour prouver que les PECs peuvent l'absorption et la libération BMP-2, nous avons utilisé un test ELISA pour déterminer la quantité de BMP-2 restant après incubation et la quantité de BMP-2 dans le PBS le jour 1, 3, 6, 10 et 14 . Cependant, une approche similaire ne fonctionne pas bien avec la protéine NELL-1, étant donné que l'héparine bloque le site de liaison d'anticorps, ce qui réduit de manière significative le signal. Par conséquent, le dosage de la protéine CBQCA a été utilisé pour déterminer la différence entre les PEC-NELL-1 et de PEC. De la courbe de libération cumulée, PECs montrent non seulement une meilleure NELL-1 efficacité d'absorption par rapport à la BMP-2 , mais libèrent également beaucoup plus lent que BMP-2 (NELL-1: 20% par rapport à la BMP-2: 25%) (Figure 6). Ceci suggère que les PECs lient plus étroitement avec NELL-1 que BMP-2.
From le test MTT, PEC-NELL-1 est pas cytotoxique (Figure 7). Le résultat correspond au résultat d'essai bleu Alamar dans une étude précédente 7. Héparine neutralise la charge positive de protamine qui joue un rôle important dans le maintien de la biocompatibilité du PEC.
Pour déterminer si NELL-1 libération de PEC affecte la différenciation ostéogénique à long terme, le niveau d'un marqueur ostéogénique d'expression, la phosphatase alcaline (ALP), a été étudiée par un dosage colorimétrique. NELL-1 sortie de PEC augmente l'activité ALP de cellules souches de la moelle osseuse de lapin de 2,2 fois au jour 14 par rapport au groupe de contrôle PEC (figure 8). BMP-2 montre une augmentation maximale de l'activité ALP (3,75 fois) au jour 7. Les deux PEC-BMP-2 et PEC-BMP-2 + supplémentaire BMP-2 montrent la diminution de l'activité au jour 9.
l'activité ALP avec BMP-2 dans le milieu sans PEC est représenté sur la Figure 8C. Bien que 70% du facteur de croissance reste sur le PEC, l'activité ALP du PEC groupe BMP-2 est équivalent à la BMP-groupe libre. In vivo, le facteur de croissance doit être remis par le transporteur afin d' éviter délavage. De notre rongeur et modèle porcin, nous pouvons réduire la dose de BMP-2 de 20 fois et 6 fois, respectivement. La réduction de ne réduit pas seulement des effets secondaires indésirables, mais réduit également le coût de l'utilisation des facteurs de croissance.

Figure 1: Electrostatique générateur de talon et une seringue pompe mis en place en BSL-2 biosécurité armoire (A) Nozzle fixé sur support de buse.. (B) de grande bassin pour une solution de chlorure de strontium. (C) Câble d' électrode. (D) flexible offre une solution d' alginate. (E) porte-buse et le bras. (F) Electrodes approvisionnement til différence de potentiel pour réguler la taille des billes. (G) agitateur magnétique. (H) , 5 ml d'une seringue. (I) pompe à seringue pour réguler l' écoulement de l' alginate. Bouton de commande (J) Agitateur pour contrôler la vitesse d' agitation. Bouton de commande (K) Tension pour réguler la différence de potentiel entre 0-10 kV. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
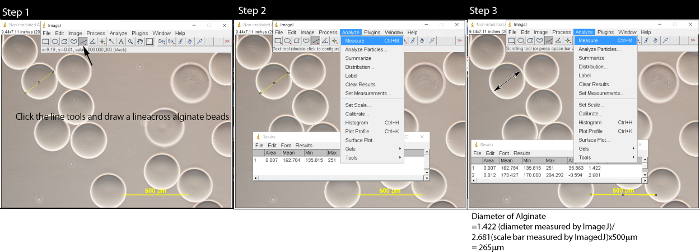
Figure 2: Mesure de microbilles alginate avec le logiciel ImageJ Après avoir ouvert le fichier image en cliquant sur Fichier → Ouvrir, suivez l' étape 1:. Cliquez sur l'outil de ligne et tracer une ligne sur les microbilles d'alginate. Dans l'étape 2, cliquez sur Analyser dans la barre de menu et une fenêtre pop-up apparaîtra. Répétez les étapes 1 et 2 jusqu'à ce que tous les microbilles sont measuré. Dans l'étape 3, cliquez sur l'outil de ligne, tracer une ligne sur la barre d'échelle et de mesurer la longueur de la barre d'échelle. Convertir la longueur de microbilles um en utilisant la formule:. Longueur d'alginate / longueur de barre d'échelle x 500 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3:. Représentation schématique du complexe polyélectrolyte noyau Alginate (vert foncé) couche de protamine de charge positive (vert pâle), la couche charge d'héparine négative (rouge), le facteur de croissance ostéogénique, par exemple, BMP-2 / NELL-1 sur la couche la plus externe (pâle bleu). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4:. Images lumineuses de microbilles alginate de terrain (A) non irradiées. (B) 8M Rad irradiée. microbilles d'alginate non-irradiées sont sphériques et 8M Rad irradiées contrepartie est en forme de larme. Grossissement 100X. (Barre d' échelle = 500 um.) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5:. Confocal à balayage laser des images de microscopie de microbilles alginate incubés avec des analogues fluorescents de protamine, l' héparine, NELL-1 et BMP-2 (A) CF 405 protamine (bleu), (B) CF 594 Héparine (rouge), (C ) NELL FITC-1 (vert), et (D ) FITC BMP-2 (vert). Microbilles restent sphériques même après incubation avec des analogues fluorescents. Barre d' échelle = 250 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
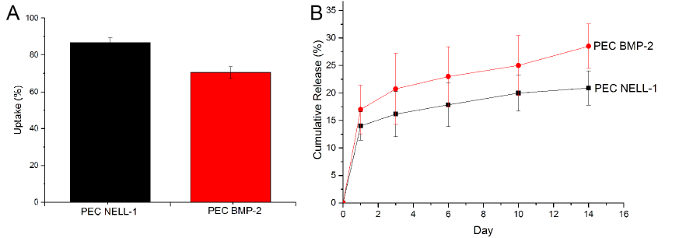
Figure 6:. Uptake et la libération de BMP-2 et NELL-1 (A) Uptake de NELL-1 protéine (noir) BMP-2 (rouge), (B) de la courbe de libération cumulative de BMP-2 (rouge) et NELL- 1 (noir) du support PEC. Les résultats sont présentés sous forme de moyenne ± écart - type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
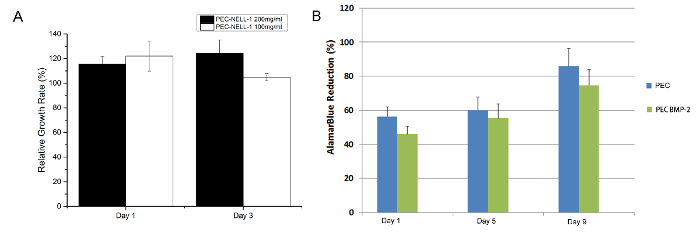
Figure 7: Essai de cytotoxicité (A) test MTT de lapin de la moelle osseuse des tiges cellule avec protamine base PEC NELL-1 200 mg / ml d' extrait (noir), PEC-NELL-1 100 mg / ml d' extrait (blanc) à. jour 1 et 3. (B) bleu Alamar dosage de moelle osseuse de lapin tiges cellule avec PEC BMP-2 (bleu), PEC (vert) des expériences ont été réalisées en triple et les résultats sont présentés sous forme de moyenne ± écart - type. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
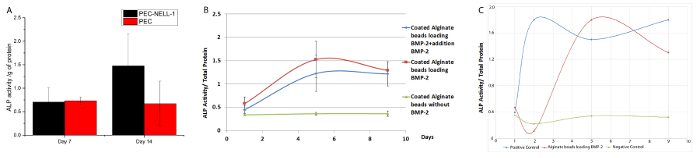
Figure 8: bioactivité Essai pour BMP-2 et NELL-1 sortie de support PEC (A) l' activité de l' ALP de lapin os cellules souches de moelle osseuse incubé avec PEC-NELL-1 (noir), PEC (rouge).. l'activité ALP a été mesurée par absorbance à 405 nm. 2.2fold augmentation de l'activité ALP a été observée après incubation avec PEC-NELL-1 au jour 14. (B) Activité de l' ALP de lapin os cellules souches de la moelle incubé avec PEC-BMP-2 (rouge) PEC-BMP-2 + ajout de BMP 2 (vert) et PEC (bleu). Augmentation de l'activité ALP après incubation avec PEC-BMP-2 et PEC-BMP-2 + ajout de BMP-2 au jour 7, l' activité ALP tombe le jour 9. (C) ALP activité de lapin os cellules souches de moelle osseuse incubé avec PEC- BMP-2 (rouge) BMP-2 (bleu) et moyen (vert). Les résultats sont présentés sous forme de moyenne ± écart - type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 9: phosphate polycaprolactone Tri-calcium (PCL-TCP) échafaudage emballé avec support PEC (A) Polycaprola.ctone phosphate tri-calcium (TCP PCL) échafaudage (taille des pores de 1,300 um) garnie avec un support de PEC. échafaudage (B) PCL-TCP. (C) Fort grossissement: PEC conserve sa forme après l' emballage. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Ce protocole présente un procédé pour la préparation de CBV à travers la couche par couche auto-assemblage. La structure couche par couche est visualisée en utilisant des analogues fluorescents de protamine, l'héparine, la BMP-2 et NELL-1 et microscopie confocale. Captage et libérer les tests montrent que l'héparine sur le PEC médie l'absorption du facteur de croissance ostéogénique et la libération. L'efficacité de l'absorption de la méthode PEC est: NELL-1: 86,7 ± 2,7%, BMP-2: 70,5 ± 3,1%. Le support de PEC présente une meilleure modulation de NELL-1 (20%) par rapport à la libération d' un support d'adsorption de surface pur tel que des particules d'apatite de calcium (40-80%) de 11.
Outre la modulation de la libération, l' héparine neutralise la charge positive excessive de polycations tels que protamine pour éviter cytotoxicité indésirable questions liées 12. Les PECs ne montrent pas de signes de cytotoxicité, tel que déterminé par le test MTT et le test bleu Alamar 7. Le dosage de l'ALP montre le transporteur PEC peut maintenir la Bioactivité des deux NELL-1 et BMP-2. Bien que développé pour le facteur de croissance ostéogénique BMP-2 thérapie dans les chirurgies de fusion rachidienne, PEC peut également prendre d'autres facteurs de croissance avec des domaines de liaison à l'héparine tels que NELL-1 et PDGF-BB. Par rapport à d' autres méthodes d'administration telles que l' encapsulation de facteurs de croissance dans des microsphères d'acide polyglycolique, CBV ne nécessitent pas de solvants organiques qui ont tendance à inactiver les facteurs de croissance 13.
Un certain nombre de facteurs dans la procédure de fabrication PEC peut affecter les performances du transporteur. Tout d'abord, la taille des microbilles affecte le rapport surface / volume. Chargement supérieur facteur de croissance ostéogénique peut être réalisé avec de plus petites microbilles. D'autre part, la concentration d'alginate doit être suffisante pour maintenir la stabilité de la structure de microbilles. microbille stabilité dépend du type alginate, la longueur de la chaîne (affectée par irradiation gamma) et l'ion divalent utilisé (baryum> strontium> calcium). Tandis que 2% de solution d'alginate est suffisante pour fabrire CBV avec des structures de microbilles stables, 4% d'alginate est requise après 8 Mrad irradiation gamma pour compenser les effets de l'alginate de raccourcissement de la chaîne pendant l'irradiation. En troisième lieu, la vitesse de dégradation in vivo de microbilles d' alginate est fortement influencée par la longueur de chaîne d' alginate. Basé sur notre expérience des modèles de rats et de porcins, PEC fabriqué en utilisant 8 Mrad irradiée alginate montre une dégradation rapide (28 jours) et complète de l'alginate de base (données non publiées). La dégradation du noyau alginate fournit essentiel de la place pour la croissance osseuse. En quatrième lieu , l'incubation d'une nuit de la BMP-2 et NELL-1 à 4 ° C avec une agitation constante (par exemple 30 tours par minute) peut améliorer l' efficacité d' absorption. Enfin, l'épaisseur du revêtement de protamine est fonction du temps. Etant donné que l'ampleur de l'interaction avec l'héparine-protamine détermine la libération de facteurs de croissance ostéogéniques tels que BMP-2 ou NELL-1, 1 h d'incubation protamine est adoptée pour améliorer la stabilité de la structure PEC.
L'utilisation de l' héparine dans cette technique est essentiel pour la stabilisation des facteurs de croissance délicates et donc important pour prolonger la bioactivité in vivo. Compte tenu de la quantité très limitée de l' héparine impliquée et couplé avec le choix de l'antidote, à savoir, la protamine (un médicament très efficace pour neutraliser les activités anti-coagulant de l' héparine), le temps de saignement prolongé dans l' os décortiquée est en grande partie théorique et pratiquement sans conséquence.
Chargement de la CPES dans l'échafaudage PCL-TCP améliore la localisation des perles sur les sites d'implant. Echafaudages fournir un soutien mécanique nécessaire qui est crucial pour la colonne vertébrale fusion. Dans les présentes études, nous avons utilisé échafauds PCL-TCP avec 1.300 um pores pour faciliter l' emballage approprié (Figure 9). Bien que l'illustration actuelle montre PEC livraison du facteur de croissance ostéogénique avec l'échafaud PCL-TCP, notre groupe a également évalué les performances du support avec une polyéthercétonecétone (PEKK) Chambre osseuse dans une étude de lapin avec une efficacité similaire.
Dans cette étude, le manque de comparaison avec d'autres transporteurs précédemment évalués de rhBMP-2 et NELL-1 pourrait représenter une limitation.
En conclusion, la procédure présentée fournit un support utile pour contrôler la libération de facteurs de croissance ostéogéniques avec des domaines d'héparine tels que BMP-2 et NELL-1. La stratégie décrite combine de nombreux avantages: il ne se limite pas à la BMP-2 et applicable à d'autres facteurs de croissance avec des domaines de liaison à l'héparine tels que NELL-1. La réduction de dose sur le facteur de croissance ostéogénique peut réduire les effets secondaires indésirables tels que le sérome, la formation osseuse hétérotrophe et abaisser le coût global du traitement.
Déclarations de divulgation
Nous avons aucun conflit d'intérêts.
Remerciements
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
matériels
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
Références
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon