Method Article
ヘパリン結合ドメイン骨形成成長因子の送達のための高分子電解質複合体
要約
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
要約
再建骨手術中に、成長因子の超生理学的な量は、経験的に成功した骨の融合を促進するために足場上に装填されています。非常に強力な生物剤の大量投与は、急速な酵素分解の結果としての成長因子の不安定性だけでなく、移植部位で成長因子の十分な量をローカライズにおけるキャリアの非効率性に必要とされます。したがって、例えばBMP-2 / NELL-1のような成長因子の安定性を延長戦略、及びそれらの放出を制御するには、実際に有効な投与量を低下させ、従って、将来の骨再生手術の間に、より大きな用量の必要性を減らすことができます。これにより、副作用および成長因子コストを削減します。自己集合のPECは、 インビボでの安定性を高めることにより、ヘパリン結合、さらに増強成長因子の生物活性を介して、BMP-2 / NELL-1送達の良好な制御を提供するために製造されています。ここでは、deliveに役立つPEC製造の単純さを示しています再建骨の手術中に種々の成長因子のRY。
概要
偽の発生率は、変性脊椎固定術およびリビジョン脊椎手術1の10〜45%と高いことが報告されています。脊椎融合および他の再建骨手術中に偽関節の速度を減少させるために、例えば、BMP-2、NELL-1および血小板由来増殖因子(PDGF)などの骨形成増殖因子はデノボ骨形成を促進するために導入されています。これらのうち、BMP-2は、脊椎固定術2のための一般的な選択です。新骨形成を誘導および促進におけるBMP-2の効力は十分に3を確立してきたが。このような異骨形成、血清腫および血腫形成、炎症反応、神経根炎、椎体の骨溶解、および逆行性射精などの臨床的に有意な合併症が原因で4,5使用超生理学的量に関心事項であり続けます。
したがって、BMP-2の用量を低下させることがでに関連する戦略まま副作用を最小にするために誘惑。また、効率的なキャリアシステムは、現代のコラーゲンスポンジ担体系で観察されたBMP-2の初期バースト放出を抑制し、さらに、この強力なサイトカインの長期化と局所的な送達を促進するために必要とされます。陽イオンおよび陰イオン高分子電解質の交互の層毎の自己集合足場マトリックスまたは移植可能な材料6の表面に高分子電解質複合体を構築するための調整可能な方法として使用することができます。この点では、(すべての生物学的因子の最も負の電荷密度を有するために知られている)、ヘパリンが強く静電及びヘパリン結合ドメインを介して、種々の増殖因子と結合することが認識されています。実際、ヘパリンは半減期を延長し、従って、いくつかの成長因子の生物活性を増強することが示されています。
これに基づいて、私たちのグループは、ヘパリン系高分子電解質複合体(PEC)を製造するために層ごとの自己集合のプロトコルを適合その負荷および固定化7,8の間に骨形成成長因子の生物活性を保持します。アルギン酸マイクロビーズのコアは、二価カチオン、カルシウムまたはストロンチウムイオンと、アルギン酸塩のα-L-グルロン酸(G)残基を架橋することによって作製しました。アルギン酸コアは、生分解性足場の行列です。これは移植後、それは骨の内部成長のための部屋を提供する融合ベッドに再吸収されます。ポリ-L-リジン(PLL)またはプロタミン(この場合は、アルギン酸マイクロビーズキャリアコア)足場マトリックスと負に帯電したヘパリンの両方とインタレースするカチオン性層として使用されます。アニオン性ヘパリン層の機能は、ロードされた成長因子を安定化し、局在化しています。三層PECは、ブタモデル9における成長因子負荷容量を増加させることが示されています。近年、PECキャリアは正常ラット10と脊椎8のブタモデルにおいて少なくとも20倍のBMP-2の有効量を減少させることが示されています。
ntent ">ここでは、我々はモデル骨形成増殖因子としてBMP-2を使用して、脊椎固定術で強化された成長因子の配信および他の再建骨手術のためのPECを製造する方法を報告しています。プロトコル
1.アルギン酸塩溶液の調製
- アルギン酸ナトリウム(非照射)または8ミリラジアンの400mgの200 mgの溶解10mlの蒸留水にアルギン酸ナトリウムを照射および非照射アルギン酸照射アルギン酸15分間、1時間振とうします。 4℃で一晩アルギン酸塩溶液を保管してください。アルギン酸マイクロビーズの製造の前に滅菌0.2μmのシリンジフィルターでアルギン酸塩溶液をフィルタリングします。
2.アルギン酸マイクロビーズの作製
- 70%エタノールで静電ビーズ発生器とシリンジポンプを消毒し、クラスII生物学的安全キャビネット( 図1)に配置します。
- ビーズ発電機内部の磁気攪拌棒をガラス洗面器を置きます。
- 9センチメートル流域上記のビーズ発電機のアーム電極を設定します。
- アーム電極のローレットネジ2にビーズ発生器の電極ケーブルを接続し、へのSrCl 2溶液の80ミリリットルを注ぎます流域。
- シリンジ及びゴムチューブにロード0.2μmのろ過アルギン酸塩溶液の5ミリリットルを。アーム電極にゴムチューブを接続した後、チューブ内の空気を排出し、ノズルの先端にアルギン酸塩溶液を提供するために2分間5ミリリットル/時でシリンジポンプのスイッチを入れます。シリンジポンプの電源を切ります。
- 次に、カプセル化装置のスイッチをオンにした後、シリンジポンプは、マイクロビーズの生成を開始します。 5ミリリットル/時アルギン酸流量とキャプに5.8 kVの電圧を設定します。これらのマイクロビーズは不規則な大きさと形状になる傾向があるように、最初の2分(またはシリンジから送り出さ初期0.5ミリリットルアルギン酸塩溶液)中に生成されたマイクロビーズを捨てます。
- 0.2 M塩化ストロンチウム溶液中でその後のマイクロビーズを収集します。アルギン酸塩溶液の事前計画されたボリュームをポンピングした後、シリンジポンプと(その順序で)カプセル化装置の両方の電源をオフにします。マイクロビーズ製造のその後のバッチのためにこれを繰り返します。完了すると、のターンキャプ続いて第1のシリンジポンプ、F。
- 架橋を完了し、ゲルを安定化するために4℃で一晩、0.2M塩化ストロンチウム溶液20mlにマイクロビーズを格納します。
アルギン酸マイクロビーズの3サイズの測定
- プラスチックピペットを用いてアルギン酸マイクロビーズの0.5ミリリットルを採取し、スライドガラス上に置きます。 10倍の倍率で光学顕微鏡下でのマイクロビーズを表示します。顕微鏡用CCDカメラとマイクロビーズの10画像を撮ります。解像度2048 X 1536でTIFF形式のスケールバー(500ミクロン)の画像を保存します。
- ImageJの長さツールを使用して、マイクロビーズのサイズ及びスケールバー( 図2)を測定します 。画素からのマイクロビーズの長さは、マイクロメートルに変換します。
- ラインツールをクリックするとアルギン酸ビーズの真ん中を横切る線を引きます。
- メニューバーの「分析」と「測定」を選択しクリックしてください。ポップアップウィンドウが表示されます。
- 繰り返し画像内の全てのアルギン酸ビーズを測定するために3.2.1-3.2.2を繰り返します。画像上のスケールバーを測定します。
- ×500μmのスケールバーのアルギン酸ビーズ/長さの長さを:式を用いて実際の長さにアルギン酸ビーズの直径を変換します。例えば、1.420(ImageJをすることによって測定された直径)/ 2.657(ImageJをすることによって測定スケールバーの長さ)* 500ミクロン= 267ミクロン。
- マイクロビーズの各バッチの代表サイズとして(平均±標準偏差)100マイクロビーズの平均サイズを考慮してください。
4.滅菌
- 100μmのナイロンストレーナーを使用してマイクロビーズを収集し、蒸留水でビーズを洗浄します。
- スパチュラを使用して、2mLのマイクロ遠心チューブに0.1 mlのアルギネート溶液から作られたすべてのマイクロビーズを転送し、乾燥を防ぐために、ガーゼで覆います。
- 最後に、液体モードを使用して、オートクレーブによりマイクロビーズを滅菌(115℃、15分)またはmに応じてanufacturerの仕様。乾燥からビーズを防ぐために、チャンバに蒸留水1.5リットルを加えます。
5.プロタミンとヘパリンコーティング
- BSL-2フードの内側には、室温で1時間(0.2μmのシリンジフィルターを用いて滅菌)を2mg / mlのプロタミン溶液1ml滅菌マイクロビーズをインキュベートします。
- 1時間(ステップ5.1)のためのマイクロビーズをインキュベートした後、マイクロビシンコニン酸(マイクロBCA)テスト(セクション6)のためのプロタミン溶液150μLを集めます。
- 蒸留水で2回プロタミン被覆したマイクロビーズを洗ってください。室温で3分間、200×gでベンチトップ遠心機を用いてスピンダウン。遠心分離後、シリンジを用いて水を吸引します。
- 高分子電解質複合体(PEC)を作成するために30分間(0.2μmのシリンジフィルターを用いて滅菌)を0.5mg / mlのヘパリン溶液1mlとプロタミンコーティングされたマイクロビーズをインキュベートします。
- プロタミンコーティングされたマイクロビーズFをインキュベートした後、または30分(ステップ5.4)、ヘパリンコンテンツ(セクション7)を決定するためにヘパリン溶液の400μLを集めます。
- インキュベーション後、蒸留水で2回洗浄してたPECから未結合ヘパリンを洗い流してください。
6.プロタミンコンテンツ
- 製造業者の指示に従ってマイクロBCAテストを実行します。簡単に言えば、96ウェルプレートに150μlのプロタミン溶液(前およびマイクロビーズとのインキュベーション後に回収)を追加します。 150μlのマイクロBCAワーキング溶液を追加します。
- 較正標準としてアルブミン溶液(0、0.5、1、2、5、10、20、40及び200μgの/ ml)を使用します。
- 60℃で60分間混合物をインキュベートします。 562 nmで分光光度計で吸光度を測定します。
- 製造者の指示に従って、各未知試料のプロタミン濃度を決定するための標準曲線を使用します。
- プロタミンの合計量を差し引くことにより、マイクロビーズのプロタミン含有量を決定(マイクロビーズとのインキュベーション後に)塗布液中に残存するプロタミンの量から(マイクロビーズとのインキュベーション前に)コーティング液。
7.ヘパリンコンテンツ
- ブルー4mgのトルイジンと0.01 N塩酸中20mgの塩化ナトリウムを溶解させて使用液の10ミリリットルを準備します。
- 30秒3、ボルテックス:2の比率で作業溶液に(ステップ5.5から)のサンプル400μlを添加します。
- n-ヘキサン(ワーキング試薬溶液に相当するボリューム)の600μl加え、トルイジンブルーヘパリン複合体を抽出するために、混合物をボルテックス。
- 吸引し、相分離後のシリンジで水相200μlの。
- 631 nmで分光光度計を使用して水相中に含まれる未抽出トルイジンブルーの量を測定します。
- 0-20 / mlのヘパリン標準溶液を準備します。
- μgの/メートルでヘパリン濃度対各ヘパリン標準の631 nmの読み取りをプロットリットル。各サンプルのヘパリン濃度を決定するために、標準曲線を使用してください。
レイヤー・バイ・レイヤー構造の8共焦点イメージ
- プロタミン、ヘパリンとNELL-1 / BMP-2蛍光アナログCF-405プロタミン(青)、CF 594ヘパリン(赤)を作製し、FITCは、NELL-1 / FITC標識に従って(緑)、BMP-2 +ヘパリン+プロタミンメーカーのラベル付けテクニカルデータシート。
- コート100μgの蛍光アナログ300μlのマイクロビーズ(5.3から5.6で説明したように塗布法)CF-405プロタミン(青)(2 mg / mlで、1時間のインキュベーション)、CF 594ヘパリン(赤)(0.5 mg / mlで、 30分)し、FITCは、標識されたNELL-1 / FITC標識した(緑)、BMP-2(1.5 mg / mlで、一晩)。未結合の蛍光プロタミン、ヘパリンとNELL-1 / BMP-2を除去するために蒸留水で2回マイクロビーズを洗ってください。
- 10X倍率で共焦点顕微鏡を使用してレイヤーバイレイヤー構造( 図3)を確認します。7
前記BMP-2そして、NELL-1取り込みおよびリリース
- 負荷PEC100μgの上のBMP-2またはNELL-1溶液の1.5 mg / mlでの13.3μlの。 10時間振盪30 rpmの下に4℃でPECをインキュベートします。
- 一定の振とう(30 rpm)しながら37℃でリン酸緩衝生理食塩水(PBS)の1ミリリットル中にマイクロビーズを浸し。
- 1mlの上清を収集し、1、3、6、10および14日後に1 mlのPBSと交換してください。
- 取り込みを評価し、製造業者のプロトコルに従ってELISA法を用いてBMP-2の効率を放出します。取り込みを評価し、製造業者のプロトコルに従ってカルボキノリン-2-カルボキシアルデヒド(CBQCA)タンパク質アッセイ法を用いて、NELL-1の効率をリリース。
- 時間(t)での累積放出を決定します。
当時の時間(t)+前のリリースでの時間(t)=リリースでの累積放出(tは-1)。 - 時間に対するBMP-2およびNELL-1の累積放出をプロットします。
10. インビトロ生物活性NELL-1の
注:PECから放出されたNELL-1の生物活性は、ウサギ骨髄幹細胞におけるアルカリホスファターゼ(ALP)の発現を増加させる能力(rBMSC)を測定することによって評価しました。
- シード2万24ウェルプレート中のウェルあたりrBMSCsし、それらをウシ胎児血清(FBS)CO 2、37℃で、5%ダルベッコ改変イーグル培地(DMEM)+ 10%の1ミリリットルで一日のために成長することができます。
- 24時間後、10 -8モル/ Lのデキサメタゾン、10%FBS、2%ペニシリンストレプトマイシン、50μg/ mlのアスコルビン酸、10ミリモル/ Lのβグリセロリン酸を補充した骨形成培地(DMEM 1mlの培地を交換し、そして)37℃で7日間、5%CO 2のため。
- 細胞(これは骨形成培地交換時のPECマイクロビーズの洗い出しを回避)とは別のPECを維持するために300μgのPEC-NELL-1細胞培養インサートの内側とPEC(ステップ8.2から)(TCインサート)を配置します。場所TCはPLも24に挿入します14日間食べました。
- 3日に1回、TCインサート外に針を配置することによって吸引骨形成培地の1ミリリットルを、新鮮な骨形成培地1mlと交換してください。
- インキュベーションの7および14日後に、キットの製造業者のプロトコルに従って、ALPアッセイキットを用いてALP活性を決定します。
- 10分間4℃で0.1%トリトンX-100を含むアッセイ緩衝液で溶解細胞。セルスクレーパーを使用して付着した細胞を削り取ります。少なくとも60分間攪拌しながら4℃で細胞懸濁液をインキュベートします。
- 10分間4℃で2,500×gで細胞懸濁液を遠心。 ALPアッセイのために上清を収集します。
- 96ウェルプレートのウェルにミリリットル200 0 ngの/から連続的に希釈したアルカリホスファターゼ標準溶液50μlを追加します。アルカリホスファターゼ標準の最終的な量は、よく/ 10、5、2.5、1.2、0.6、0.3、0.15、および0 ngのです。
- ステップ10.5.2からの上清を追加します(50μL/ウェル)、希釈Bで希釈uffer。
- 各ウェルにp個の -nitrophenylリン酸(のpNPP)基質溶液50μlを追加します。穏やかに30秒間プレートを振盪することにより、試薬を混ぜます。暗所で30分間混合物をインキュベートします。プレートリーダーにより405nmの吸光度を測定します。
- 検量線を用いてALP活性を計算します。
- 製造業者の指示に従ってマイクロBCAタンパク質アッセイキットを用いてタンパク質含量を決定します。タンパク質含量によりALP活性を割ることによりALP活性を正常化します。
11.細胞生存率
- 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)のために24時間37℃でDMEM + 10%FBSを1 mlのPEC-NELL-1 200mgのインキュベートアッセイ。
- 96ウェルプレート中の種子(10%FBSを含むDMEM100μl中)ウェルあたり2,000 rBMSCsし、37℃、5%CO 2で1日間インキュベートします。
- PEC-NELL-1 / PECエキス100μlのDMEM + 10%FBSを交換し、インキュベート37℃、5%CO 2。
- インキュベーションの1日または3日後、5 mg / mlでのMTT溶液10μlを追加し、さらに暗闇の中で4時間、37℃、5%CO 2でインキュベートします。
- ホルマザン結晶を溶解し、各ウエルに100μlのDMSO溶液を加えます。
- マイクロプレートリーダーを用いて570 nmの吸光度を決定します。
- 相対成長率を計算します。
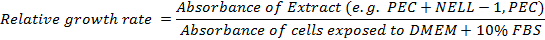
12.足場へのパッケージ化とBMP-2&NELL-1のロード
- BSL-2チャンバー内の滅菌スパチュラを用いてリン酸三カルシウム(mPCL-TCP)足場 - 生体吸収性医療グレードのポリカプロラクトンの孔にPECを梱包してください。
- PECを詰めmPCL-TCP足場の上に1.5mg / BMP-2またはNELL-1 mlの溶液を加え、4℃で一晩インキュベートします。
結果
それは、類似の化学的特性を有し、それは、FDAは、ヘパリンの解毒剤として承認されているとしてのキャリアでは、プロタミン、ポリ-L-リジンの代わりに選択しました。光学顕微鏡の結果は、非照射マイクロビーズが267±14ミクロンの直径を有する球形であることを示しました。 (0.35ミリメートルノズルを5ミリリットル/時間及び5.8 kVでの流量)。照射されたマイクロビーズの大部分は、涙滴形状です。照射されたマイクロビーズのラウンド部分で測定した直径が212±30ミクロン(0.35ミリメートルノズル、4ミリリットル/時&6 kVでの流量)でした。 ( 図4)。
PECマイクロビーズの共焦点画像は、CF-405ラベルされたプロタミン(青)、CF594標識ヘパリン(赤)とFITC-BMP-2 / FITC-NELL-1(緑)のレイヤーバイレイヤーコーティングを明らかにする。結果は、PECのは、正に帯電したBMP-2と結合し、負ヘパリンビンディを経由してNELL-1を帯電し得ることを示していますNG領域( 図5)。これは、のPECおよび骨形成成長因子との相互作用に依存充電されていないことを示唆しています。
PECは、BMP-2を取り込み及び放出することができることを証明するために、我々は、1、3、6、10および14日目にPBS中でのインキュベーション後に残存するBMP-2の量とBMP-2の量を決定するために、ELISAアッセイを使用ししかし、同様のアプローチが大幅に信号を低減し、ブロックに抗体結合部位をヘパリンので、NELL-1蛋白質とうまく動作しません。したがって、CBQCAタンパク質アッセイは、PEC-NELL-1とPECとの間の差を決定しました。累積放出曲線から、のPECは、BMP-2に比べて高いNELL-1の取り込み効率を示すだけでなく、BMP-2よりもはるかに遅いそれを解放するだけでなく(NELL-1:BMP-2対20%:25%)( 図6)。これは、PECのは、BMP-2よりも、NELL-1とより強固に結合することを示唆しています。
金曜日MTTアッセイOM、PEC-NELL-1は( 図7)細胞傷害性ではありません。結果は、先行研究7でアラマーブルーアッセイの結果と一致します。ヘパリンは、PECの生体適合性を維持する上で重要な役割を果たしているプロタミンの正電荷を中和します。
PECからNELL-1の放出が長期骨形成分化、骨形成マーカーの発現レベル、アルカリホスファターゼ(ALP)に影響を与えるかどうかを判断するには、比色アッセイにより調べました。 PECからNELL-1リリースには、PECの対照群( 図8)と比較して14日目に2.2倍ウサギ骨髄幹細胞のALP活性を増加させます。 BMP-2は、7日目にALP活性(3.75倍)の最大の増加PEC-BMP-2との両方PEC-BMP-2 + 9日目の活動の余分なBMP-2ショーの減少を示します。
PECを含まない培地中のBMP-2とのALP活性がに示されています図8C。成長因子の70%はPEC上のままであるが、PEC BMP-2グループのALP活性が無料BMP-グループと等価である。 インビボでは 、成長因子は、ウォッシュアウトを避けるために、キャリアによって送達されなければなりません。我々の齧歯動物およびブタモデルから、我々は、それぞれ、20倍および6倍のBMP-2の用量を低下させることができます。減少は、望ましくない副作用を減少させるだけでなく、成長因子の使用のコストが削減されません。

図1: 静電ビーズ発生器とBSL-2生物学的安全キャビネットの中で設定したシリンジポンプノズルホルダーに固定(A)ノズル。 (B)塩化ストロンチウムソリューションのビッグ盆地。 (C)電極ケーブル。 (D)ホースは、アルギン酸塩溶液を提供します。 (E)ノズルホルダーとアーム。 (F)は、電極供給T彼の電位差は、ビーズサイズを調節します。 (G)マグネチックスターラー。 (H)を5mlの注射器。アルギン酸塩の流れを調節する(I)シリンジポンプ。攪拌速度を制御する(J)アジテータ制御ノブ。 (K)電圧制御ノブが0〜10 kVの間の電位差を調節するために。 この図の拡大版をご覧になるにはこちらをクリックしてください。
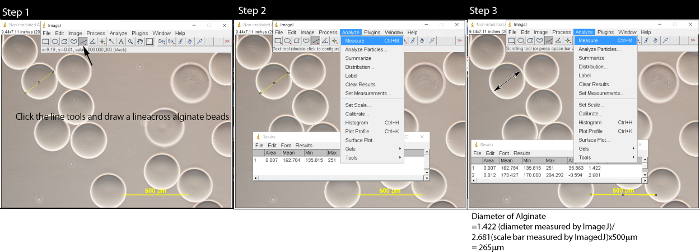
図2:ImageJ ソフトウェアとのアルギン酸マイクロビーズを測定開く→ファイルをクリックすることで、画像ファイルを開いた後、ステップ1は、次のとおりです。ラインツールをクリックして、アルギン酸マイクロビーズ上に線を引きます。ステップ2では、メニューバーの[分析]をクリックし、ポップアップウィンドウが表示されます。繰り返しステップ1とステップ2すべてのマイクロビーズがMEAになるまでsured。ステップ3では、ラインツールをクリックし、スケールバーを横切って線を描画し、スケールバーの長さを測定します。式を使用してμmのマイクロビーズの長さを変換します。×500μmのスケールバーのアルギン酸塩/長さの長さは、この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:最も外側の層の上に高分子電解質複合体の模式図アルギン酸コア(ダークグリーン)正電荷のプロタミン層(薄緑色)、負電荷のヘパリン層(赤)、骨形成成長因子、 例えば 、BMP-2 / NELL-1(淡青)。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4: アルギン酸マイクロビーズの明視野像 (A)非照射しました。 (B)8Mラッドを照射しました。非照射アルギン酸マイクロビーズは球状であり、8Mラッドは、相手が涙滴形状である照射しました。倍率100倍。 (スケールバー=500μmの。) この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:NELL-1、BMP-2、プロタミン、ヘパリンの蛍光類似体と共にインキュベートしたアルギン酸ビーズの共焦点レーザー走査顕微鏡画像 (A)CF 405プロタミン(青)、(B)CF 594ヘパリン(赤)、(C )FITC NELL-1(緑)、および(D )FITC BMP-2(緑)。マイクロビーズはあっても、蛍光類似体とのインキュベーション後に球状のまま。スケールバー=250μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
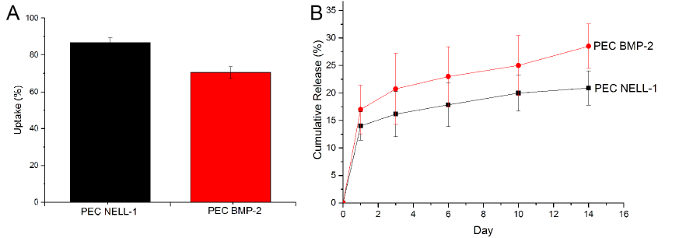
図6: 取り込みおよびBMP-2およびNELL-1のリリース NELL-1蛋白質(黒)BMP-2(赤)、BMP-2(赤)とNELL-の(B)累積放出曲線の(A)の取り込み。 PECのキャリアから1(黒)。結果は、平均±標準偏差として提示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
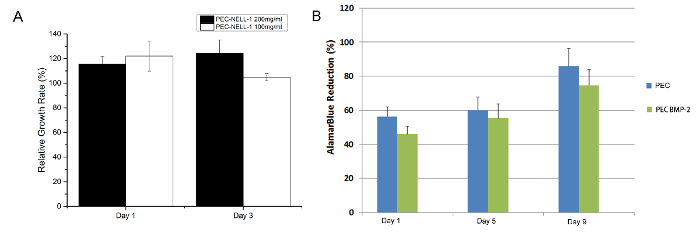
図7: 細胞毒性アッセイは、ウサギ骨髄の(A)MTTアッセイは、茎プロタミンベースPEC NELL-1を200mg /(黒)を抽出mlの、PEC-NELL-1を100mg抽出/ ML(白)で持つセル1日目および3(B)のウサギ骨髄のアラマーブルーアッセイはPEC BMP-2(青)と細胞を茎、PEC( 緑)実験は3回行い、結果は平均値±標準偏差として提示されています。 ご覧になるにはこちらをクリックしてください。この図の拡大版。
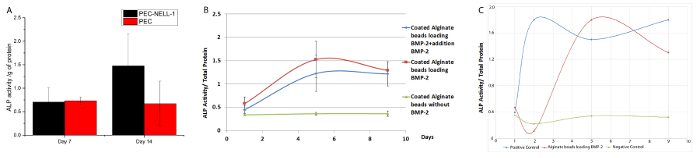
図8:BMP-2およびPECキャリアからNELL-1放出のための生物活性アッセイ (A)PEC-NELL-1(黒)、PEC( 赤)とインキュベートしたウサギの骨髄幹細胞のALP活性。 ALP活性は、405nmでの吸光度として測定しました。 2.2ALP活性の増加は、PEC-NELL-1 14日目(B)PEC-BMP-2(赤)BMP-のPEC-BMP-2 +を添加して培養したウサギ骨髄幹細胞のALP活性にとのインキュベーション後に観察された倍2(緑)、PEC(青)。 PEC-BMP-2および7日目でのBMP-2のPEC-BMP-2 +を添加してインキュベーションした後、ALP活性の増加、ALP活性がPEC-とインキュベートしたウサギ骨髄幹細胞の日9(C)ALP活性に低下しますBMP-2(赤色)BMP-2(青)及び培地(緑)。結果は、平均±標準偏差として提示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図9:PEC のキャリアを充填したポリカプロラクトンリン酸三カルシウム(PCL-TCP)足場(A)Polycaprola。PEC担体を充填ctone三リン酸カルシウム(PCL-TCP)足場(細孔サイズ1300ミクロン)。 (B)PCL-TCP足場。 (C)高倍率:PECは梱包後にその形状を維持している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
このプロトコルは、レイヤーバイレイヤー自己組織化を通じたPECの調製のための方法を提示しています。層ごとの構造は、プロタミン、ヘパリン、BMP-2およびNELL-1および共焦点顕微鏡の蛍光類似体を用いて可視化されます。取り込みおよび放出試験は、PECのヘパリンは骨形成成長因子の取り込み及び放出を媒介することを示します。 PEC法の取り込み効率は次のとおりです。NELL-1:86.7±2.7%、BMP-2:70.5±3.1%。 PECの担体は、カルシウムアパタイト粒子として純粋表面吸着担体(40-80%)11と比較して、NELL-1(20%)の放出のより良好な調節を有します。
リリースを調節することに加えて、ヘパリンは、このような不要な細胞毒性関連の問題12を回避するためにプロタミンなどのポリカチオンの過度の正電荷を中和します。 MTTアッセイおよびアラマーブルーアッセイ7によって決定されるのPECは、細胞毒性の兆候を示しません。 ALPアッセイは、PECキャリアがbioactを維持することができます示していNELL-1、BMP-2の両方のivity。脊椎固定手術における骨形成成長因子BMP-2療法のために開発されたが、PECはまた、NELL-1およびPDGF-BBなどのヘパリン結合ドメインと他の成長因子を取ることができます。ポリグリコール酸微小球の成長因子のカプセル化など他の発送方法に比べて、のPECは成長が13因子不活性化する傾向がある有機溶剤を必要としません。
PECの製造手順の多くの要因は、キャリアのパフォーマンスに影響を与えることができます。まず、マイクロビーズのサイズは、表面積/体積比に影響を与えます。より高い骨形成成長因子負荷が小さいマイクロビーズを用いて達成することができます。第二に、アルギン酸塩濃度がマイクロビーズ構造の安定性を維持するのに十分であるべきです。マイクロビーズの安定性は、アルギン酸塩タイプ、(ガンマ線照射の影響を受けて)チェーンの長さと使用する二価イオン(バリウム>ストロンチウム>カルシウム)に依存します。 2%アルギン酸塩溶液はのmanufactuに十分であるが安定したマイクロビーズ構造とのPEC再、4%アルギン酸は、照射中のアルギン酸チェーン短縮の影響を補償するために8メガラドのガンマ線照射を次の必要とされます。第三に、アルギン酸塩ビーズの生体内分解速度が強くアルギネート鎖の長さによって影響されます。ラットおよびブタモデルから私たちの経験に基づき、PECは、アルギン酸塩は、アルギン酸塩コア(未発表データ)の急速な(28日)と完全な分解を示し照射8メガラドを使用して製造しました。アルギン酸塩コアの分解は、骨の内部成長に不可欠な部屋を提供します。第四に、一定に振盪しながら4℃でBMP-2およびNELL-1の一晩のインキュベーション( 例えば 、30 rpmが)の取り込み効率を向上させることができます。最後に、プロタミン被覆厚さは、時間依存性です。プロタミン、ヘパリン相互作用の程度は、BMP-2またはNELL-1のような骨形成性成長因子の放出を決定するので、プロタミンインキュベーションの1時間は、PEC構造の安定性を向上させるために採用されています。
この手法でのヘパリンの使用は、繊細な成長因子の安定化に重要なおよびin vivoの生物活性に延長するためことが重要です。解毒剤、 すなわち 、プロタミン(ヘパリンの抗凝固活性を中和するのに非常に有効な薬剤)の選択に関与し、結合されたヘパリンの非常に限られた量を考えると、剥皮骨における長引く出血時間は、主に理論的かつ実用的に重要ではありません。
PCL-TCP足場へのPECをロードすると、移植部位でのビーズの局在性を向上させます。足場は、脊椎固定のために重要である必要な機械的支持を提供します。本研究では、我々は適切な梱包( 図9)を容易にするために、1300μmの細孔を有するPCL-TCP足場を使用していました。現在の図は、PCL-TCP足場とPEC骨形成成長因子の配信を示していますが、私たちのグループはまたPEKK(ポリエーテルとキャリア性能を評価しました同様の効力を有する1ウサギの研究で)骨室。
本研究では、のrhBMP-2とNELL-1の他の以前に評価されたキャリアとの比較の欠如は、制限を表すことができます。
結論として、提示された手順は、BMP-2、NELL-1とヘパリンドメインと骨形成成長因子の放出を制御するための有用な担体を提供します。説明戦略は、多くの利点を組み合わせた:それは、BMP-2に限定し、そのようなNELL-1などのヘパリン結合ドメインと他の成長因子には適用されません。骨形成増殖因子の投与減少は、漿液腫、従属骨形成などの望ましくない副作用を減少させ、治療の全体的なコストを下げることができます。
開示事項
私たちは、利害関係のありません。
謝辞
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
資料
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
参考文献
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved