Method Article
Complejo de polielectrolito para la unión a heparina de entrega osteogénico Factor de Crecimiento de dominio
En este artículo
Resumen
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
Resumen
Durante cirugías reconstructivas óseas, cantidades suprafisiológicas de factores de crecimiento se cargan empíricamente en los andamios para promover la fusión ósea exitosa. Se requieren grandes dosis de agentes biológicos altamente potentes debido a la inestabilidad del factor de crecimiento como resultado de la rápida degradación enzimática, así como las ineficiencias de soporte en la localización de cantidades suficientes de factor de crecimiento en los sitios de implante. Por lo tanto, las estrategias que prolonguen la estabilidad de los factores de crecimiento, tales como BMP-2 / NELL-1, y controlan su liberación en realidad podría disminuir su dosis eficaz y, por tanto, reducir la necesidad de dosis mayores durante las futuras cirugías de regeneración ósea. Esto a su vez reducirá los efectos secundarios y costos de los factores de crecimiento. Los PEC autoensambladas se han fabricado para proporcionar un mejor control de la BMP-2 / NELL-1 a través de la entrega de unión a la heparina y el factor de mayor bioactividad crecimiento potencian mediante la mejora de la estabilidad in vivo. Aquí se ilustra la simplicidad de fabricación PEC que ayuda en la delivery de una variedad de factores de crecimiento durante las cirugías óseas reconstructivos.
Introducción
La incidencia de pseudoartrosis se ha reportado que ser tan alta como 10 a 45% en la fusión espinal degenerativa y revisión cirugías de columna 1. Para reducir la tasa de pseudoartrosis durante la fusión columna vertebral y otras cirugías reconstructivas óseas, se han introducido factores de crecimiento osteogénicos tales como BMP-2, Nell-1 1 y factor de crecimiento derivado de plaquetas (PDGF) para promover la osteogénesis de novo. Entre estos, BMP-2 es una opción popular para la fusión espinal 2. Aunque la potencia de la BMP-2 en la inducción y facilitación de la formación de hueso nuevo ha sido bien establecida 3; complicaciones clínicamente importantes, tales como la formación de hueso heterotópico, seroma y la formación de hematomas, respuesta inflamatoria, radiculitis, osteolisis cuerpo vertebral, y la eyaculación retrógrada siguen siendo temas de preocupación debido a las cantidades utilizadas supraphysiological 4,5.
Por lo tanto, la reducción de la dosis de BMP-2 sigue siendo una estrategia relevante en altienta para minimizar los efectos secundarios. Además, se requieren sistemas de portadores eficaces para suprimir la liberación de ráfaga inicial de BMP-2 observada en los sistemas de portadora de esponja de colágeno contemporáneo y mejorar aún más la administración prolongada y localizada de esta potente citoquina. La auto-ensamblaje capa por capa de polielectrolitos catiónicos alterna y aniónicos puede ser empleado como un método sintonizable para construir complejos de polielectrolito en la superficie de matrices de andamio o materiales implantables 6. A este respecto, la heparina (conocido por tener la densidad de carga negativa más alta de todos los agentes biológicos) ha sido reconocido para unir ávidamente con una variedad de factores de crecimiento a través de los dominios de unión electrostáticas y heparina. De hecho, la heparina se ha demostrado prolongar la vida media y por lo tanto potenciar la bioactividad de varios factores de crecimiento.
Basado en esto, nuestro grupo adaptado un protocolo de auto-ensamblaje capa por capa para fabricar un complejo de polielectrolito a base de heparina (PEC) que cargas y preserva las bioactividades de los factores de crecimiento osteogénicos durante la inmovilización 7,8. El núcleo de microperlas de alginato se fabricó por entrecruzamiento de residuos de alginato con iones de calcio de cationes divalentes o estroncio α-L-guluronato (G). El núcleo de alginato es una matriz andamio biodegradable; el cual después de la implantación, se reabsorbe en el lecho de fusión que proporciona espacio para el crecimiento óseo. Poli-L-lisina (PLL) o protamina se utiliza como la capa catiónica para entrelazar tanto con la matriz de andamio (en este caso, el núcleo de la portadora de microperlas de alginato) y la heparina cargada negativamente; mientras que las funciones de la capa de heparina aniónicos para estabilizar y localizar los factores de crecimiento cargados. El triple capa PEC se ha demostrado que aumenta la capacidad de carga del factor de crecimiento en un modelo porcino 9. Recientemente, portadores PEC han demostrado reducir con éxito la dosis efectiva de BMP-2 en al menos 20 veces en la rata 10 y modelos porcinos de fusión espinal 8.
ntent "> Aquí, se presenta los métodos de fabricación de los PEC para la entrega mejorada del factor de crecimiento en la fusión espinal y las otras cirugías reconstructivas óseas utilizando BMP-2 como un factor de crecimiento osteogénico modelo.Protocolo
1. Preparación de la solución de alginato
- Disolver 200 mg de alginato de sodio (no irradiado) o 400 mg de 8 Mrad irradió alginato de sodio en 10 ml de agua doblemente destilada y agitar durante 1 h para alginato no irradiado y 15 min para alginato irradiado. Almacenar la solución de alginato a 4 ° C durante la noche. Se filtra la solución de alginato con un filtro de jeringa de 0,2 micras estéril antes de la fabricación de microperlas de alginato.
Fabricación 2. El alginato Microbead
- Desinfectar el generador de cuentas electrostática y la bomba de jeringa con 70% de etanol y colocarlos en una Clase II Gabinete de Seguridad Biológica (Figura 1).
- Colocar un recipiente de vidrio con una barra de agitación magnética en el interior del generador de grano.
- Ajuste el brazo del electrodo del generador de talón 9 cm por encima de la cuenca.
- Conectar el cable del electrodo del generador de cuentas para el tornillo moleteado 2 del electrodo del brazo, y verter 80 ml de solución de SrCl2 en elcuenca.
- Carga de 5 ml de 0,2 micras solución de alginato se filtra en el tubo de la jeringa y el caucho. Después de conectar el tubo de goma al electrodo de brazo, encender la bomba de jeringa a 5 ml / h durante 2 min para expulsar el aire dentro de la tubería y entregar la solución de alginato a la punta de la boquilla. Apagar la bomba de jeringa.
- A continuación, encienda el encapsulador y, a continuación, la bomba de jeringa para comenzar generación microbead. Ajuste el caudal de alginato a 5 ml / hora y la tensión en 5,8 kV en el encapsulador. Desechar las microperlas generados durante los primeros dos minutos (o el iniciales de 0,5 ml de solución de alginato bombeado fuera de la jeringa), ya que estas microperlas tienden a ser irregular tamaño y forma.
- Recoger microperlas subsiguientes en solución de cloruro de 0,2 M de estroncio. Apague la bomba de jeringa y el encapsulador (en ese orden) después de bombear el volumen de pre-planificado de solución de alginato. Repita este procedimiento para la fabricación de lotes posteriores microbead. Una vez completado, gire def la bomba de jeringa primero, seguido por el encapsulador.
- Almacenar las microperlas en 20 ml de solución de cloruro de 0,2 M de estroncio a 4 ° C durante la noche para completar la reticulación y estabilizar el gel.
3. Medida del tamaño de las microperlas de alginato
- Recoger 0,5 ml de microesferas de alginato con una pipeta de plástico y colocarla en un portaobjetos de vidrio. Ver las microperlas bajo un microscopio óptico con un aumento de 10X. Tome diez imágenes de las microperlas con una cámara CCD microscopio. Guardar las imágenes con la barra de escala (500 micras) en formato TIFF con una resolución de 2.048 x 1.536.
- El uso de las herramientas de longitud en ImageJ, medir el tamaño de las microperlas y la barra de escala (Figura 2). Convertir la longitud microperlas de pixel a micrómetro.
- Haga clic en las herramientas de línea y trace una línea a través del centro de la esfera de alginato.
- Haga clic en "Analizar" en la barra de menú y seleccione "Medición". Aparecerá una ventana emergente.
- Repita los pasos 3.2.1-3.2.2 para medir todas las esferas de alginato dentro de la imagen. Medir la barra de escala en la imagen.
- Convertir el diámetro de la esfera de alginato a la longitud real usando la fórmula: longitud de la esfera de alginato / longitud de la barra de escala x 500 micras. Por ejemplo, 1.420 (diámetro medido por ImageJ) / 2.657 (escala de longitud de la barra medida por ImageJ) * 500 = 267 micras micras.
- Considere el tamaño medio de 100 microperlas (media ± desviación estándar) como el tamaño representante de cada lote de microperlas.
4. Esterilización
- Recoger las microperlas utilizando un filtro de nylon de 100 micras y lavar las perlas con agua doblemente destilada.
- Usando una espátula, transferir todas las microperlas elaborados a partir de 0,1 ml de solución de alginato en un tubo de microcentrífuga de 2 ml y cubrir con una gasa para evitar que se seque.
- Finalmente, esterilizar las microperlas en autoclave usando el modo de líquido (115 ° C, 15 min) o de acuerdo con mlas especificaciones del anufacturer. Añadir 1,5 L de agua destilada a la cámara para evitar que los granos de secado.
5. protamina y heparina Coating
- Dentro de la BSL-2 capó, incubar las microperlas estériles con 1 ml de 2 mg / ml solución de protamina (esterilizada mediante un filtro de jeringa de 0,2 micras) durante 1 hora a temperatura ambiente.
- Después de la incubación de las microperlas durante 1 hora (Paso 5.1), recoger 150 ml de la solución de protamina para la prueba de micro ácido bicinconınico (de microBCA) (sección 6).
- Se lavan las microesferas de protamina recubierto dos veces con agua doblemente destilada. Girar hacia abajo usando una centrífuga de mesa a 200 xg durante 3 minutos a temperatura ambiente. Después de la centrifugación, aspirar el agua usando una jeringa.
- Incubar microperlas recubierta de protamina con 1 ml de 0,5 mg / ml solución de heparina (esterilizada mediante un filtro de jeringa de 0,2 micras) durante 30 minutos para crear complejo polielectrolito (PEC).
- Después de incubar la recubierto protamina microperlas fo 30 minutos (Paso 5.4), recoge 400 l de la solución de heparina para determinar el contenido de heparina (sección 7).
- Después de la incubación, lavar la heparina no unido de los PEC lavando dos veces con agua doblemente destilada.
6. El contenido de protamina
- Realizar la prueba de microBCA de acuerdo con las instrucciones del fabricante. En pocas palabras, añadir 150 l solución de protamina (recogidos antes y después de la incubación con microperlas) en una placa de 96 pocillos. Añadir 150 l de solución de trabajo de microBCA.
- Utilice solución de albúmina (0, 0,5, 1, 2, 5, 10, 20, 40 y 200 mg / ml) como estándares de calibración.
- Incubar la mezcla durante 60 min a 60 ° C. Medir la absorbancia con un espectrofotómetro a 562 nm.
- Utilice la curva estándar para determinar la concentración de protamina de cada muestra desconocida de acuerdo con las instrucciones del fabricante.
- Determinar el contenido de protamina de las microperlas restando la cantidad total de protamina en elsolución de recubrimiento (antes de la incubación con microperlas) a partir de la cantidad de protamina que queda en la solución de revestimiento (después de la incubación con microperlas).
7. La heparina contenido
- Preparar los 10 ml de solución de trabajo disolviendo 4 mg de azul de toluidina y 20 mg de cloruro de sodio en 0,01 N de ácido clorhídrico.
- Añadir 400 l de muestra (de la etapa 5.5) a la solución de trabajo en una proporción de 2: 3 y agitar durante 30 seg.
- Añadir 600 l de n-hexano (volumen equivalente al de la solución de reactivo de trabajo) y agitar la mezcla para extraer el complejo heparina azul de toluidina.
- Aspirar 200 l de la fase acuosa por la jeringa después de la separación de fases.
- Medir la cantidad de azul de toluidina un-extraída contenido en la fase acuosa usando un espectrofotómetro a 631 nm.
- Preparar soluciones estándar de heparina de 0-20 mg / ml.
- Trazar la lectura de 631 nm de cada estándar de heparina frente a la concentración de heparina en microgramos / ml. Utilice la curva estándar para determinar la concentración de heparina de cada muestra.
8. confocal imagen de la estructura de capa por capa
- Fabrique protamina, heparina y NELL-1 / BMP-2 análogo fluorescente CF-405 de protamina (azul), CF 594 heparina (rojo) y marcado con FITC NELL-1 / marcado con FITC (verde) BMP-2 + heparina + protamina de acuerdo con el fabricante del ficha técnica.
- Escudo 100 g microperlas con 300 l de análogo fluorescente (método de recubrimiento como se describe en 5.3 a 5.6) CF-405 de protamina (azul) (2 mg / ml, 1 hr de incubación), CF 594 heparina (rojo) (0,5 mg / ml, 30 min) y FITC etiquetados NELL-1 / marcado con FITC (verde) BMP-2 (1,5 mg / ml, durante la noche). Lavar las microperlas dos veces con agua destilada para eliminar el no unido protamina fluorescente, la heparina y NELL-1 / BMP-2.
- Observe la estructura de capa por capa (Figura 3) mediante el uso de un microscopio confocal en un aumento de 10X. 7
9. BMP-2y Nell-1 toma y liberación
- Cargar 13,3 l de 1,5 mg / ml de BMP-2 o NELL-1 solución en 100 g de PEC. Incubar PEC a 4 ° C en 30 rpm de remoción durante 10 horas.
- Sumergir las microperlas en 1 ml de solución salina tamponada con fosfato (PBS) a 37 ° C con agitación constante (30 rpm).
- Tomar 1 ml del sobrenadante y reemplazarlo con 1 ml de PBS después de 1, 3, 6, 10 y 14 días.
- Evaluar la absorción y liberación eficiencia de BMP-2 mediante el método de ELISA de acuerdo con el protocolo del fabricante. Evaluar la absorción y liberación eficiencia de NELL-1 utilizando el método de ensayo de proteínas carboxibenzoil quinolina-2-carboxaldehído (CBQCA) de acuerdo con el protocolo del fabricante.
- Determinar la liberación acumulativa en el tiempo (t):
liberación acumulativa en el tiempo (t) = estreno en el tiempo (t) + versión anterior en el tiempo (t-1). - Trazar liberación acumulativa de BMP-2 y Nell-1 contra el tiempo.
10. La bioactividad in vitrode NELL-1
Nota: La bioactividad de NELL-1 liberado de PEC se evaluó midiendo su capacidad para aumentar la expresión de la fosfatasa alcalina (ALP) en células madre de médula ósea de conejo (rBMSC).
- Semilla 20.000 rBMSCs por pocillo en una placa de 24 pocillos y les permiten crecer durante un día con 1 ml de Dulbecco Modificado Medio Eagle (DMEM) + 10% de suero bovino fetal (FBS) a 37 ° C y 5% de CO2.
- Después de 24 h, sustituir el medio con 1 ml de un medio osteogénico (DMEM suplementado con 10% FBS, 2% de penicilina estreptomicina, ácido ascórbico 50 mg / ml, 10 mmol / L beta-glicerofosfato, y 10 -8 mol / L de dexametasona ) durante 7 días a 37 ° C y 5% de CO2.
- Colocar 300 g PEC-NELL-1 (desde el paso 8.2) y PEC dentro de insertos de cultivo celular (inserto TC) para mantener los PEC separado de las células (esto evita el lavado de microesferas de PEC durante el cambio de medio osteogénico). Lugar de inserción de TC en el 24 así plcomió durante 14 días.
- Una vez cada tres días, aspirado de 1 ml del medio osteogénico mediante la colocación de una aguja de inserción fuera de la TC, y reemplazar con 1 ml de medio osteogénico fresco.
- Después de 7 y 14 días de incubación, determinar la actividad de ALP con un kit de ensayo de ALP, de acuerdo con el protocolo del fabricante del kit.
- lisar las células con tampón de ensayo que contenía 0,1% Triton X-100 a 4 ° C durante 10 min. Raspar células adheridas utilizando un rascador de células. Incubar suspensión de células a 4 ° C con agitación durante al menos 60 min.
- Centrifugar la suspensión celular a 2500 xga 4 ° C durante 10 min. Recoger el sobrenadante para el ensayo de ALP.
- Añadir 50 l de solución estándar de fosfatasa alcalina diluido en serie 200-0 ng / ml a los pocillos de una placa de 96 pocillos. Las cantidades finales de fosfatasa alcalina estándar son de 10, 5, 2,5, 1,2, 0,6, 0,3, 0,15 y 0 ng / pocillo.
- Añadir el sobrenadante de la etapa 10.5.2 (50 l / pocillo) y se diluye con dilución bUffer.
- Añadir 50 l de solución de fosfato de sustrato (pNPP) p-nitrofenil en cada pocillo. Mezcle los reactivos sacudiendo suavemente la placa durante 30 segundos. Incubar la mezcla durante 30 min en la oscuridad. Se mide la absorbancia a 405 nm mediante un lector de placas.
- Calcular la actividad de ALP usando la curva de calibración.
- Determinar el contenido de proteína usando el kit de ensayo de proteínas de microBCA de acuerdo con las instrucciones del fabricante. Normalizar la actividad de la ALP dividiendo la actividad de ALP por el contenido de proteína.
11. La viabilidad de la célula
- Incubar 200 mg de PEC-NELL-1 con 1 ml de DMEM + 10% FBS a 37 ° C durante 24 h para la 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio (MTT) ensayo.
- 2.000 semillas rBMSCs por pocillo (en 100 l de DMEM con FBS al 10%) en una placa de 96 pocillos y se incuban durante 1 día a 37 ° C, 5% de CO 2.
- Reemplazar DMEM + 10% FBS con 100 l de extracto de PEC-NELL-1 / PEC e incubara 37 ° C, 5% de CO 2.
- Después de 1 día o 3 días de incubación, se añaden 10 l de solución de MTT 5 mg / ml y se incuba a 37 ° C, 5% de CO 2 durante 4 horas en la oscuridad.
- Añadir 100 l solución DMSO a cada pocillo para disolver los cristales de formazán.
- Determinar la absorbancia a 570 nm utilizando un lector de microplacas.
- Calcular la tasa de crecimiento relativo:
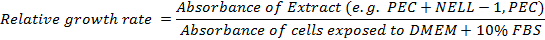
12. Embalaje en Andamios y BMP-2 y NELL-1 Loading
- Paquete de los PEC en los poros de una policaprolactona grado médico biorreabsorbible - fosfato tricálcico (MPCL-TCP) andamio con una espátula esterilizada dentro de una cámara BSL-2.
- Añadir 1,5 mg / ml de solución de BMP-2 o NELL-1 al andamio MPCL-TCP lleno de PEC y se incuba durante la noche a 4 ° C.
Resultados
En nuestro portador, protamina fue elegido como un sustituto de poli-L-lisina, ya que tiene propiedades químicas similares y está aprobado por la FDA como un antídoto de la heparina. resultados microscopio óptico mostró que las microperlas no irradiados eran de forma esférica con un diámetro de 267 ± 14 micras. (Boquilla de 0,35 mm, velocidad de flujo de 5 ml / hr y 5,8 kV). La mayoría de las microperlas irradiados son de forma de lágrima. El diámetro medido en la parte de vuelta de las microperlas irradiados fue (boquilla de 0,35 mm, velocidad de 4 ml / h y 6 kV de flujo) 212 ± 30 micras. (Figura 4).
Las imágenes confocales de las microperlas PEC revelan recubrimiento capa por capa de CF-405 protamina marcado (azul), heparina CF594 marcado (rojo) y FITC-BMP-2 / FITC-NELL-1 (verde). Los resultados indican que los PEC se pueden unir con carga positiva BMP-2 y cargada negativamente NELL-1 a través del bindi heparinang de dominio (Figura 5). Esto sugiere que la interacción entre los PEC y los factores de crecimiento osteogénicos no se carga dependiente.
Para demostrar que los PEC se toma y liberación BMP-2, se utilizó un ensayo ELISA para determinar la cantidad de BMP-2 que queda después de la incubación y la cantidad de BMP-2 en el PBS en el día 1, 3, 6, 10 y 14 . sin embargo, un enfoque similar no funciona bien con la proteína NELL-1, ya que la heparina bloquea el sitio de unión del anticuerpo, lo que reduce significativamente la señal. Por lo tanto, se utilizó el ensayo de proteína CBQCA para determinar la diferencia entre PEC-NELL-1 y PEC. A partir de la curva de liberación acumulativa, PEC no sólo muestran una mayor NELL-1 eficiencia de absorción en comparación con BMP-2, sino también lo liberan mucho más lento que BMP-2 (NELL-1: 20% vs. BMP-2: 25%) (Figura 6). Esto sugiere que los PEC se unen más estrechamente con NELL-1 a BMP-2.
from el ensayo MTT, PEC-NELL-1 no es citotóxica (Figura 7). El resultado coincide con el resultado del ensayo Alamar Blue en un estudio previo 7. La heparina neutraliza la carga positiva de la protamina, que desempeña un papel importante en el mantenimiento de la biocompatibilidad de PEC.
Para determinar si NELL-1 de liberación de PEC afecta a la diferenciación osteogénica a largo plazo, el nivel de expresión de un marcador osteogénico, fosfatasa alcalina (ALP), se investigó mediante un ensayo colorimétrico. NELL-1 de liberación de PEC aumenta la actividad ALP de las células madre de médula ósea de conejo de 2,2 veces en el día 14 en comparación con el grupo de control PEC (Figura 8). BMP-2 muestra el aumento máximo de la actividad de ALP (3,75 veces) en el día 7. Tanto PEC-BMP-2 y BMP-PEC-2 + extra BMP-2 muestran disminución de la actividad en el día 9.
actividad ALP con BMP-2 en el medio sin PEC se muestra en la Figura 8C. Aunque el 70% del factor de crecimiento se mantiene en el PEC, la actividad ALP de PEC grupo BMP-2 es equivalente a la BMP-grupo libre. In vivo, el factor de crecimiento debe ser entregado por el transportista para evitar lavado. De nuestra roedores y modelo porcino, podemos reducir la dosis de BMP-2 por 20 veces y 6 veces, respectivamente. La reducción de no sólo reducen los efectos secundarios no deseados sino que también reduce el costo del uso del factor de crecimiento.

Figura 1: generador electrostático de cuentas y la jeringa de la bomba instalado en el gabinete de bioseguridad BSL-2 (A) Boquilla asegurado el soporte de la boquilla.. (B) cuenca grande para la solución de cloruro de estroncio. (C) del electrodo de cable. (D) la manguera suministra solución de alginato. (E) Portapistola y el brazo. (F) Los electrodos de suministro de tse diferencia de potencial para regular el tamaño de las perlas. (G) agitador magnético. (H) 5 ml jeringa. (I) de la bomba de jeringa para regular el flujo de alginato. Perilla de control (J) Agitador para controlar la velocidad de agitación. Perilla de control (K) de tensión para regular la diferencia de potencial entre 0-10 kV. Por favor, haga clic aquí para ver una versión más grande de esta figura.
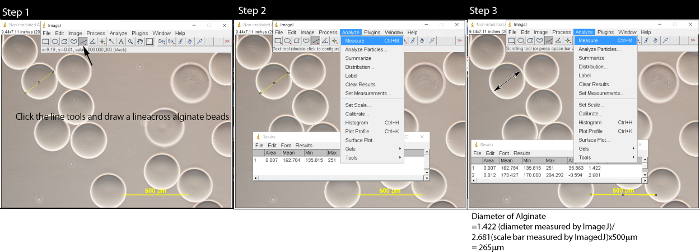
Figura 2: Medición de microesferas de alginato con el software ImageJ Después de abrir el archivo de imagen haciendo clic en Archivo → Abrir, siga el Paso 1:. Haga clic en la herramienta de línea y dibujar una línea en las microesferas de alginato. En el paso 2, haga clic en Analizar en la barra de menú y una ventana pop-up aparecerá. Repita los pasos 1 y 2 hasta que todas las microperlas son meaSured. En el paso 3, haga clic en la herramienta de línea, dibujar una línea a través de la barra de escala y medir la longitud de la barra de escala. Convertir la longitud de microperlas micras utilizando la fórmula:. Longitud de alginato / longitud de barra de escala x 500 micras Haga clic aquí para ver una versión más grande de esta figura.

Figura 3:. Representación esquemática de complejo polielectrolito núcleo de alginato (verde oscuro) capa de carga de protamina positiva (verde pálido), capa de carga heparina negativo (rojo), factor de crecimiento osteogénico, por ejemplo, BMP-2 / NELL-1 en la capa más externa (pálido azul). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. Imágenes de campo claro de microesferas de alginato (A), no irradiados. (B) 8M Rad irradiado. microesferas de alginato no irradiadas son esféricas y el 8M Rad irradiaron contraparte es en forma de lágrima. Un aumento de 100X. (Barra de escala = 500 m.) Haga clic aquí para ver una versión más grande de esta figura.

Figura 5:. Imágenes de microscopía confocal de barrido láser de microperlas de alginato incubadas con los análogos fluorescentes de protamina, heparina, NELL-1 y BMP-2 (A) CF 405 de protamina (azul), (B) CF 594 Heparina (rojo), (C ) FITC NELL-1 (verde), y (D ) FITC BMP-2 (verde). Microperlas permanecen esférica incluso después de la incubación con análogos fluorescentes. Barra de escala = 250 micras. Haga clic aquí para ver una versión más grande de esta figura.
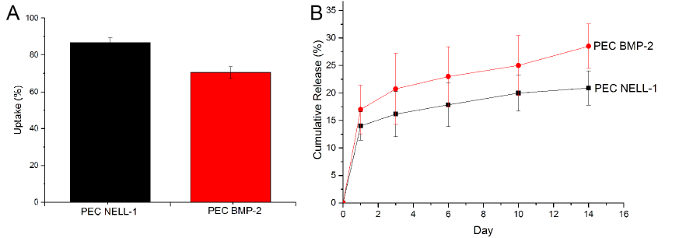
Figura 6:. La captación y liberación de BMP-2 y Nell-1 (A) La absorción de la proteína NELL-1 (negro) BMP-2 (rojo), (B) curva de liberación acumulativa de BMP-2 (rojo) y NELL- 1 (negro) de la portadora PEC. Los resultados se presentan como media ± desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.
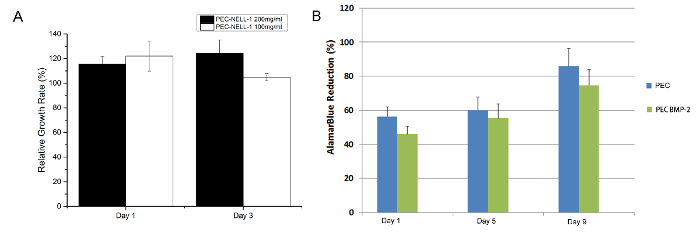
Figura 7:. Ensayo de citotoxicidad (A) ensayo de MTT de hueso de conejo ósea se deriva de células con protamina basado PEC NELL-1 200 mg / ml de extracto (negro), PEC-NELL-1 100 mg / ml de extracto (blanco) a día 1 y 3. (B) de ensayo Alamar blue de médula ósea de conejo tallos celular con PEC BMP-2 (azul), PEC (verde) Los experimentos se realizaron por triplicado y los resultados se presentan como media ± desviación estándar. por favor, haga clic aquí para ver una versión más grande de esta figura.
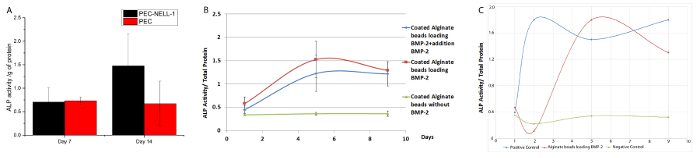
Figura 8: Bioactividad Ensayo para la BMP-2 y Nell-1 de liberación de portador de PEC (A) la actividad de ALP de las células madre de médula ósea de conejo se incubaron con PEC-NELL-1 (negro), PEC (rojo).. actividad de la ALP se midió como absorbancia a 405 nm. 2.2doblez se observó aumento de la actividad de la ALP después de la incubación con el PEC-NELL-1 en el día 14. (B) la actividad de ALP de las células madre de la médula ósea de conejo se incubaron con PEC-BMP-2 (rojo) PEC-BMP-2 + adición de BMP 2 (verde) y PEC (azul). Aumento de la actividad ALP después de la incubación con PEC-BMP-2 y BMP-PEC-2 + adición de BMP-2 en el día 7, la actividad ALP gotas en el Día 9. (C) ALP actividad de células madre de médula ósea de conejo se incubaron con PEC BMP-2 (rojo) BMP-2 (azul) y Medio (verde). Los resultados se presentan como media ± desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 9: fosfato tricálcico policaprolactona (PCL-TCP) andamio lleno de soporte PEC (A) Polycaprola.fosfato tricálcico ctone (PCL-TCP) andamio (tamaño de poro de 1.300 micras) rellena de soporte PEC. andamio (B) PCL-TCP. (C) Gran ampliación: PEC mantiene su forma después de embalar. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo presenta un método para la preparación de los PEC través de la capa por capa de autoensamblaje. La estructura de capa por capa se visualizó usando análogos fluorescentes de protamina, heparina, BMP-2 y Nell-1 y microscopía confocal. La captación y análisis de liberación muestran que la heparina sobre los PEC media la captación del factor de crecimiento osteogénico y liberación. La eficiencia de absorción del método PEC es: NELL-1: 86,7 ± 2,7%, BMP-2: 70,5 ± 3,1%. El portador PEC tiene una mejor modulación de la liberación NELL-1 (20%) en comparación con un vehículo de adsorción pura superficie, tales como partículas de apatita de calcio (40-80%) 11.
Además de la modulación de la liberación, la heparina neutraliza la carga positiva excesiva de policationes tales como protamina para evitar problemas relacionados con la citotoxicidad no deseada 12. Los PEC no muestran ningún signo de citotoxicidad, tal como se determina mediante el ensayo de MTT y el ensayo Alamar Blue 7. El ensayo ALP muestra el portador PEC puede mantener la Bioactivity de ambos NELL-1 y BMP-2. Aunque se desarrolló para el factor de crecimiento osteogénico terapia de BMP-2 en cirugías de fusión espinal, PEC también puede tomar hasta otros factores de crecimiento con dominios de unión a heparina como NELL-1 y PDGF-BB. En comparación con otros métodos de administración tales como la encapsulación de factores de crecimiento en microesferas de ácido poliglicólico, los PEC no requieren disolventes orgánicos que tienden a inactivar factores de crecimiento 13.
Un número de factores en el procedimiento de fabricación PEC puede afectar al rendimiento de soporte. En primer lugar, el tamaño de microperlas afecta a la relación de área de superficie / volumen. Superior factor de carga de crecimiento osteogénico se puede lograr con microperlas pequeñas. En segundo lugar, la concentración de alginato debe ser suficiente para mantener la estabilidad de la estructura de microperlas. estabilidad Microbead depende del tipo de alginato, longitud de la cadena (afectados por la irradiación gamma) y el ion divalente utilizado (bario> estroncio> calcio). Mientras que 2% de solución de alginato es suficiente para manufacture PEC con estructuras microesferas estables, se requiere 4% de alginato siguiente 8 Mrad de irradiación gamma para compensar los efectos de acortamiento de la cadena de alginato durante la irradiación. En tercer lugar, la tasa de degradación in vivo de microesferas de alginato está fuertemente influenciada por la longitud de cadena de alginato. Basándonos en nuestra experiencia de los modelos de rata y de cerdo, el PEC fabricado usando 8 Mrad irradiado alginato muestra rápida (28 días) y la completa degradación del núcleo del alginato (datos no publicados). La degradación del núcleo de alginato proporciona esencial espacio para el crecimiento óseo interno. En cuarto lugar, la incubación durante la noche de BMP-2 y Nell-1 a 4 ° C con agitación constante (por ejemplo, 30 rpm) puede mejorar la eficiencia de absorción. Por último, el espesor del revestimiento de protamina es dependiente del tiempo. Dado que el alcance de la interacción de protamina-heparina determina la liberación de factores de crecimiento osteogénicos tales como BMP-2 o NELL-1, 1 hr de incubación de protamina se adopta para mejorar la estabilidad de la estructura de PEC.
El uso de heparina en esta técnica es fundamental en la estabilización de los factores de crecimiento delicados y por lo tanto importante para la prolongación de bioactividad in vivo. Dada la cantidad muy limitada de heparina involucrado y, junto con la elección del antídoto, es decir, la protamina (un fármaco muy eficaz en la neutralización de las actividades anti-coagulantes de la heparina), tiempo de sangrado prolongado en el hueso decorticado es en gran medida teórica y prácticamente insignificante.
La carga de los PEC en el armazón PCL-TCP mejora la localización de los granos en los sitios de implante. Los andamios proporcionan soporte mecánico necesario que es crucial para la fusión espinal. En los presentes estudios, se utilizó andamios PCL-TCP con 1.300 micras poros para facilitar el embalaje adecuado (Figura 9). Aunque la ilustración muestra la entrega actual del factor de crecimiento osteogénico PEC con el andamio PCL-TCP, nuestro grupo también ha evaluado el rendimiento con un portador polietercetonacetona (PEKK) Cámara de hueso en un estudio de conejo con una eficacia similar.
En este estudio, la falta de comparación con otras compañías previamente evaluadas de rhBMP-2 y Nell-1 podría representar una limitación.
En conclusión, el procedimiento presentado proporciona un soporte útil para controlar la liberación de factores de crecimiento osteogénicos con dominios de heparina, tales como BMP-2 y Nell-1. La estrategia descrita combina muchas ventajas: no se limita a BMP-2 y aplicable a otros factores de crecimiento con los dominios de unión a heparina tales como NELL-1. reducción de la dosis en el factor de crecimiento osteogénico puede reducir los efectos secundarios indeseables tales como seroma, la formación de hueso heterótrofa y reducir el coste global del tratamiento.
Divulgaciones
No tenemos ningún conflicto de intereses.
Agradecimientos
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
Materiales
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
Referencias
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados