Method Article
Polielettrolita complesso per eparina vincolante fattore di crescita Osteogenica dominio di consegna
In questo articolo
Riepilogo
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
Abstract
Durante interventi di chirurgia ricostruttiva di ossa, quantità sovrafisiologici di fattori di crescita sono empiricamente caricati su ponteggi per promuovere fusione ossea successo. Le grandi dosi di agenti biologici molto potenti sono necessari a causa del fattore di crescita instabilità a seguito della degradazione enzimatica rapida nonché inefficienze carrier nella localizzazione di sufficienti quantità di fattore di crescita nei siti implantari. Quindi, le strategie che prolungano la stabilità dei fattori di crescita come la BMP-2 / NELL-1, e controllare il loro rilascio potrebbe effettivamente ridurre il loro dosaggio efficace e quindi ridurre la necessità di dosi più elevate durante i futuri interventi di rigenerazione ossea. Questo a sua volta consentirà di ridurre gli effetti collaterali e costi dei fattori di crescita. PEC auto-assemblati sono stati fabbricati per fornire un migliore controllo della BMP-2 / NELL-1 consegna via vincolante eparina e l'ulteriore crescita potenziare fattore bioattività, migliorando la stabilità in vivo. Qui illustriamo la semplicità di fabbricazione PEC, che aiuta nella delivery di una varietà di fattori di crescita durante chirurgia ricostruttiva ossee.
Introduzione
L'incidenza di pseudoartrosi è stato segnalato per essere alto come 10 a 45% in degenerative fusione spinale e revisione chirurgia spinale 1. Per ridurre il tasso di pseudoartrosi durante la fusione spinale e altri interventi chirurgici ricostruttivi ossa, fattori di crescita osteogeniche come BMP-2, Nell-1 1 e fattore di crescita derivato dalle piastrine (PDGF) sono stati introdotti per la promozione de novo osteogenesi. Tra questi, BMP-2 è una scelta popolare per la fusione spinale 2. Sebbene la potenza di BMP-2 nell'induzione e facilitare la formazione di nuovo osso è stato ben stabilito 3; complicanze clinicamente significative come la formazione di osso eterotopico, sieroma e formazione di ematomi, la risposta infiammatoria, radicolite, vertebrali osteolisi corpo, e eiaculazione retrograda continuano ad essere questioni di interesse a causa degli importi utilizzati sovrafisiologici 4,5.
Pertanto, abbassando la dose di BMP-2 rimane una strategia rilevante in alletenta di ridurre al minimo gli effetti collaterali. Inoltre, i sistemi di trasporto efficienti sono tenuti a sopprimere il rilascio scoppio iniziale di BMP-2 osservata in sistemi di trasporto spugna di collagene contemporanea e rafforzare ulteriormente la consegna prolungata e localizzato di questo potente citochina. Il layer-by-layer autoassemblaggio di alternare polielettroliti cationici ed anionici può essere impiegato come metodo sintonizzabile per costruire complessi polielettroliti sulla superficie delle matrici impalcature o materiali impiantabili 6. A questo proposito, eparina (noto per avere la più alta densità di carica negativa di tutti gli agenti biologici) è stato riconosciuto di impegnare avidamente con una varietà di fattori di crescita tramite domini elettrostatiche ed eparina vincolanti. Infatti, eparina ha dimostrato di prolungare l'emivita e potenziarne la bioattività di diversi fattori di crescita così.
Sulla base di questo, il nostro gruppo adattato un protocollo di auto-assemblaggio layer-by-layer per fabbricare un complesso polielettrolita eparina-based (PEC) che carichi e conserva le bioattività dei fattori di crescita osteogeniche durante l'immobilizzazione 7,8. Il nucleo microbead alginato è stato fabbricato per reticolazione α-L-guluronate (G) residui di alginato con ioni bivalenti cationi di calcio e stronzio. Il nucleo alginato è una matrice scaffold biodegradabili; che dopo l'impianto, viene riassorbito nel letto fusion fornire spazio per crescita ossea. Poly-L-lisina (PLL) o protamina viene utilizzato come strato cationico di intrecciare sia con la matrice scaffold (in questo caso, il nucleo alginato carrier microbead) e l'eparina carica negativa; mentre le funzioni di livello eparina anionici per stabilizzare e localizzare fattori di crescita caricati. Il triplo strato PEC ha dimostrato di aumentare la capacità di carico del fattore di crescita in un modello suino 9. Recentemente, vettori PEC hanno dimostrato di ridurre con successo la dose efficace di BMP-2 di almeno 20 volte nel ratto 10 e modelli suina di fusione spinale 8.
S copi "> Qui, riportiamo i metodi di fabbricazione di PEC per una crescita maggiore consegna fattore di fusione spinale e gli altri interventi di chirurgia ricostruttiva delle ossa utilizzando BMP-2 come fattore di modello di crescita osteogenico.Protocollo
1. alginato Soluzione Preparazione
- Sciogliere 200 mg di alginato di sodio (non irradiati) o 400 mg di 8 MRad irradiato alginato di sodio in 10 ml di acqua bidistillata e agitare per 1 ora per alginato non irradiata e 15 min per alginato irradiato. Conservare la soluzione di alginato a 4 ° C durante la notte. Filtrare la soluzione di alginato con un filtro siringa da 0,2 micron sterile prima alginato fabbricazione microperla.
2. alginato microperla Fabrication
- Disinfettare il generatore elettrostatico tallone e pompa a siringa con il 70% di etanolo e metterli in una classe II Cappa di sicurezza biologica (Figura 1).
- Posizionare un bacino di vetro con un bastoncino magnetico all'interno del generatore tallone.
- Impostare l'elettrodo braccio del generatore tallone 9 cm sopra il bacino.
- Collegare il cavo elettrodo del generatore tallone alla vite zigrinata 2 dell'elettrodo braccio e versare 80 ml di soluzione 2 nel SRCLbacino.
- Carico 5 ml di 0,2 micron soluzione di alginato filtrata nel tubo siringa e gomma. Dopo aver collegato il tubo di gomma all'elettrodo braccio, accendere la pompa a siringa a 5 ml / h per 2 minuti per espellere l'aria all'interno del tubo e fornire la soluzione di alginato alla punta dell'ugello. Spegnere la pompa a siringa.
- Successivamente, accendere encapsulator e poi, la pompa a siringa per iniziare la generazione microperla. Impostare la velocità di flusso di alginato a 5 ml / ora e la tensione a 5,8 kV sul encapsulator. Scartare le microsfere generate durante i primi due minuti (o la soluzione di alginato iniziali 0,5 ml pompato dalla siringa), in quanto queste microsfere tendono ad essere irregolare dimensioni e forma.
- Raccogliere le successive microsfere di soluzione di cloruro di 0,2 M di stronzio. Spegnere sia la pompa a siringa e encapsulator (in questo ordine) dopo il pompaggio il volume pre-pianificata di soluzione di alginato. Ripetere questa operazione per le successive partite di microperla fabbricazione. Al termine, girare dif la pompa a siringa prima, seguita dalla encapsulator.
- Conservare le microsfere in 20 ml di soluzione di cloruro di stronzio 0.2 M a 4 ° C per una notte per completare reticolazione e stabilizzare il gel.
3. Misurazione Dimensioni di microperle alginato
- Raccogliere 0,5 ml di microsfere di alginato con una pipetta di plastica e posizionarlo su un vetrino. Guarda le microsfere sotto un microscopio ottico a 10X di ingrandimento. Prendere dieci immagini delle microsfere con una telecamera CCD microscopio. Salvare le immagini con barra della scala (500 micron) in formato TIFF a una risoluzione di 2.048 x 1.536.
- Utilizzando gli strumenti di lunghezza in ImageJ, misurare le dimensioni delle microsfere e barra di scala (figura 2). Convertire la lunghezza microperle da pixel a micrometro.
- Clicca sugli strumenti di linea e tracciare una linea attraverso il centro del tallone alginato.
- Fai clic su "Analizza" sulla barra dei menu e selezionare "Measure". Viene visualizzata una finestra pop-up.
- Ripetere i punti 3.2.1-3.2.2 per misurare tutte le perline alginato all'interno dell'immagine. Misurare la barra della scala sull'immagine.
- Convertire il diametro del tallone alginato alla lunghezza reale utilizzando la formula: lunghezza del cordone di alginato / lunghezza della barra della scala x 500 um. Ad esempio, 1.420 (il diametro misurato da ImageJ) / 2.657 (scala di lunghezza misurata dal bar ImageJ) * 500 micron = 267 micron.
- Si consideri la dimensione media di 100 microsfere (media ± deviazione standard) come la dimensione rappresentativo di ciascun lotto di microsfere.
4. Sterilizzazione
- Raccogliere le microsfere con un 100 micron nylon colino e lavare le perline con acqua bidistillata.
- Utilizzando una spatola, trasferire tutti i microperle fatte da 0,1 ml di soluzione di alginato in una provetta 2 ml e coprire con una garza per evitare l'essiccazione.
- Infine, sterilizzare le microsfere in autoclave utilizzando la modalità di liquido (115 ° C, 15 min) o in conformità con mle specifiche del fabbricante. Aggiungere 1,5 L di acqua distillata alla camera per evitare perline da essiccazione.
5. protamina e Eparina Coating
- All'interno della cappa BSL-2, incubare le microsfere sterili con 1 ml di 2 mg / ml soluzione protamina (sterilizzato utilizzando un filtro a siringa da 0,2 micron) per 1 ora a temperatura ambiente.
- Dopo l'incubazione le microsfere per 1 ora (Step 5.1), raccogliere 150 ml di soluzione di protamina per il test di micro acido bicinconinico (microBCA) (sezione 6).
- Lavare le microsfere rivestite protamina due volte con acqua bidistillata. Spin giù utilizzando una centrifuga da banco a 200 xg per 3 minuti a temperatura ambiente. Dopo la centrifugazione, aspirare l'acqua con una siringa.
- Incubare rivestito protamina microsfere con 1 ml di 0,5 mg / ml soluzione di eparina (sterilizzato utilizzando un filtro a siringa da 0,2 micron) per 30 minuti per creare complessi polielettrolita (PEC).
- Dopo l'incubazione il rivestito protamina microsfere fo 30 minuti (punto 5.4), raccogliere 400 ml di soluzione di eparina per determinare il contenuto di eparina (sezione 7).
- Dopo l'incubazione, lavare l'eparina non legato dai PEC lavando due volte con acqua bidistillata.
6. protamina contenuti
- Eseguire il test microBCA secondo le istruzioni del produttore. In breve, aggiungere 150 ml soluzione di protamina (raccolti prima e dopo incubazione con microsfere) in una piastra da 96 pozzetti. Aggiungere 150 ml soluzione di lavoro microBCA.
- Utilizzare soluzione di albumina (0, 0,5, 1, 2, 5, 10, 20, 40 e 200 mcg / ml) come standard di calibrazione.
- Incubare la miscela per 60 minuti a 60 ° C. Misurare l'assorbanza con uno spettrofotometro a 562 nm.
- Utilizzare la curva standard per determinare la concentrazione di protamina ciascun campione sconosciuto secondo le istruzioni del produttore.
- Determinare il contenuto protamina delle microsfere sottraendo la quantità totale di protamina nelsoluzione di rivestimento (prima dell'incubazione con microsfere) dalla quantità di protamina rimanente nella soluzione di rivestimento (dopo incubazione con microsfere).
7. eparina contenuti
- Preparare i 10 ml di soluzione di lavoro sciogliendo 4 mg blu di toluidina e 20 mg di cloruro di sodio in 0,01 N di acido cloridrico.
- Aggiungere 400 microlitri di campione (dal punto 5.5) alla soluzione di lavoro con un rapporto di 2: 3 e vortex per 30 sec.
- Aggiungere 600 ml di n-esano (volume equivalente alla soluzione di reagente di lavoro) e agitare la miscela per estrarre il toluidina complesso eparina blu.
- Aspirare 200 ml di fase acquosa di siringa dopo la separazione di fase.
- Misurare la quantità di blu di toluidina un-estratto contenuta nella fase acquosa utilizzando uno spettrofotometro a 631 nm.
- Preparare soluzioni standard con eparina di 0-20 mg / ml.
- Tracciare la lettura 631 nm di ogni standard di eparina vs concentrazione di eparina in mg / ml. Utilizzare la curva standard per determinare la concentrazione di eparina di ciascun campione.
8. confocale Immagine di Struttura Layer-by-layer
- Fabbricare protamina, eparina e Nell-1 / BMP-2 analogico fluorescente CF-405 protamina (blu), CF 594 eparina (rosso) e FITC etichettato Nell-1 / FITC marcato (verde) BMP-2 + eparina + protamina secondo il fornitore di scheda tecnica.
- Coat 100 mcg microsfere con 300 ml di analogico fluorescente (metodo di rivestimento come descritto in 5,3-5,6) CF-405 protamina (blu) (2 mg / ml, incubazione 1 ora), CF 594 eparina (rosso) (0,5 mg / ml, 30 min) e FITC etichettati Nell-1 / FITC marcato (verde) BMP-2 (1,5 mg / ml, durante la notte). Lavare le microsfere due volte con acqua distillata per eliminare la non legato protamina fluorescenti, eparina e Nell-1 / BMP-2.
- Osservare la struttura layer-by-layer (Figura 3) utilizzando un microscopio confocale a ingrandimento 10X. 7
9. BMP-2e Nell-1 assorbimento e di rilascio
- Carico 13.3 ml di 1,5 mg / ml di BMP-2 o NELL-1 soluzione sul 100 mg di PEC. Incubare PEC a 4 ° C sotto i 30 giri che agitano le 10 ore.
- Porre le microsfere in 1 ml di tampone fosfato salino (PBS) a 37 ° C con costante agitazione (30 rpm).
- Raccogliere 1 ml del supernatante e sostituirlo con 1 ml di PBS dopo 1, 3, 6, 10 e 14 giorni.
- Valutare l'assorbimento e il rilascio efficienza della BMP-2 con il metodo ELISA secondo il protocollo del produttore. Valutare l'assorbimento e il rilascio efficienza di Nell-1 utilizzando il metodo di determinazione della proteina carboxybenzoyl chinolina-2-carboxaldehyde (CBQCA) secondo il protocollo del produttore.
- Determinare rilascio progressivo al tempo (t):
rilascio cumulativo al momento (t) = uscita al momento (t) + rilascio precedente al momento (t-1). - Tracciare rilascio cumulativo di BMP-2 e Nell-1 contro il tempo.
10. In Vitro bioattivitàdi Nell-1
Nota: la bioattività di Nell-1 rilasciato dalla PEC è stata valutata misurando la sua capacità di aumentare l'espressione di fosfatasi alcalina (ALP) nelle cellule staminali del midollo coniglio ossee (rBMSC).
- Seed 20.000 rBMSCs per pozzetto in una piastra da 24 pozzetti e consentire loro di crescere per un giorno con 1 ml di Modified mezzo di Eagle Dulbecco (DMEM) + 10% di siero fetale bovino (FBS) a 37 ° C e 5% di CO 2.
- Dopo 24 ore, sostituire il mezzo di 1 ml di un mezzo osteogenico (DMEM supplementato con 10% FBS, 2% di penicillina streptomicina, / ml di acido ascorbico 50 mg, 10 mmol / L beta-glicerofosfato e 10 -8 mol / L desametasone ) per 7 giorni a 37 ° C e 5% di CO 2.
- Mettere 300 mg PEC-nell-1 (dal punto 8.2) e PEC all'interno inserti colture cellulari (TC insert) per mantenere i PEC separati dalle cellule (questo evita il dilavamento delle microsfere PEC durante la osteogenica cambio medio). Luogo TC inserire nel 24 ben plmangiato per 14 giorni.
- Una volta ogni tre giorni, aspirare 1 ml del mezzo osteogenico inserendo un ago al di fuori l'inserto TC, e sostituirlo con 1 ml di mezzo fresco osteogenico.
- Dopo 7 e 14 giorni di incubazione, determinare l'attività ALP con un kit di test ALP secondo il protocollo del produttore del kit.
- cellule Lisare con tampone contenente 0,1% TritonX-100 a 4 ° C per 10 min. Raschiare le cellule aderito con un raschietto cellulare. Incubare sospensione cellulare a 4 ° C sotto agitazione per almeno 60 min.
- Centrifugare la sospensione cellulare a 2500 xga 4 ° C per 10 min. Raccogliere il surnatante per il saggio ALP.
- Aggiungere 50 ml di soluzione standard di fosfatasi alcalina serialmente diluiti 200-0 ng / ml ai pozzetti di una piastra da 96 pozzetti. Gli importi finali delle serie fosfatasi alcalina sono 10, 5, 2.5, 1.2, 0.6, 0.3, 0.15, e 0 ng / pozzetto.
- Aggiungere il surnatante dal punto 10.5.2 (50 ml / pozzetto) e diluire con la diluizione bUffer.
- Aggiungere 50 ml di p -nitrophenyl soluzione di fosfato (pNPP) substrato in ciascun pozzetto. Mescolare i reagenti agitando delicatamente la piastra per 30 sec. Incubare la miscela per 30 minuti al buio. Misurare l'assorbanza a 405 nm con lettore di piastre.
- Calcola l'attività ALP alla curva di taratura.
- Determinare contenuto proteico utilizzando il kit di analisi delle proteine microBCA secondo le istruzioni del produttore. Normalizzare l'attività ALP dividendo l'attività ALP dal contenuto proteico.
11. vitalità cellulare
- Incubare 200 mg di PEC-nell-1 con 1 ml di DMEM + 10% FBS a 37 ° C per 24 ore per la 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio bromuro (MTT) saggio.
- Seme 2.000 rBMSCs per pozzetto (in 100 ml di DMEM con 10% FBS) in una piastra da 96 pozzetti e incubare per 1 giorno a 37 ° C, 5% CO 2.
- Sostituire DMEM + 10% FBS con 100 ml di estratto di PEC-nell-1 / PEC e incubarea 37 ° C, 5% CO 2.
- Dopo 1 giorno o 3 giorni di incubazione, aggiungere 10 ml di 5 mg / ml soluzione MTT e in seguito incubare a 37 ° C, 5% CO 2 per 4 ore al buio.
- Aggiungere 100 ml di DMSO soluzione ad ogni pozzetto per sciogliere i cristalli formazano.
- Determinare l'assorbanza a 570 nm con un lettore di micropiastre.
- Calcolare il tasso di crescita relativo:
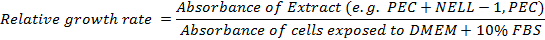
12. Imballaggio in Ponteggio e BMP-2 & NELL-1 Caricamento in corso
- Confezione i PEC nei pori di una bioresorbable grado medico Polycaprolactone - fosfato tricalcico (MPCL-TCP) scaffold usando una spatola sterilizzato all'interno di una camera BSL-2.
- Aggiungere 1,5 mg / ml soluzione di BMP-2 o NELL-1 sul patibolo MPCL-TCP imballato con PEC e incubare una notte a 4 ° C.
Risultati
Nel nostro vettore, protamina stato scelto come sostituto di poli-L-lisina come ha proprietà chimiche simili ed è approvato dalla FDA come antidoto di eparina. Risultati microscopio ottico mostrato che le microsfere non irradiate sono di forma sferica con un diametro di 267 ± 14 micron. (0,35 millimetri ugello, portata di 5 ml / ora e 5,8 kV). La maggior parte delle microsfere irradiati sono di forma a goccia. Il diametro misurato sulla parte turno delle microsfere irradiati era (ugello 0,35 millimetri, il tasso di 4 ml / hr & 6 kV di flusso) 212 ± 30 micron. (Figura 4).
immagini confocali delle microperle PEC rivelano rivestimento layer-by-layer di CF-405 protamina marcato (blu), CF594 marcato eparina (rosso) e FITC-BMP-2 / FITC-nell-1 (verde). I risultati indicano che i PEC possono legarsi con carica positiva BMP-2 e caricati negativamente NELL-1 tramite il bindi eparinadominio ng (Figura 5). Ciò suggerisce che l'interazione tra i PEC ei fattori di crescita osteogeniche non è carica dipendente.
Per dimostrare che i PEC possono assorbimento e rilascio BMP-2, abbiamo utilizzato un saggio ELISA per determinare la quantità di BMP-2 rimane dopo incubazione e la quantità di BMP-2 in PBS il giorno 1, 3, 6, 10 e 14 . Tuttavia, un approccio simile non funziona bene con la proteina NELL-1, poiché eparina blocca il sito di legame dell'anticorpo, riducendo significativamente il segnale. Pertanto, il saggio proteico CBQCA stata utilizzata per determinare la differenza tra PEC-nell-1 e PEC. Dalla curva di rilascio cumulativo, PEC non solo mostrano una maggiore Nell-1 efficienza di assorbimento rispetto a BMP-2, ma anche rilasciare molto più lento di BMP-2 (NELL-1: 20% vs. BMP-2: 25%) (Figura 6). Ciò suggerisce che PEC si legano più strettamente con Nell-1 di BMP-2.
from il test MTT, PEC-nell-1 non è citotossica (Figura 7). Il risultato corrisponde al risultato Alamar blu test in uno studio precedente 7. Eparina neutralizza la carica positiva di protamina che svolge un ruolo importante nel mantenimento della biocompatibilità del PEC.
Per determinare se Nell-1 rilascio dalla PEC influisce differenziazione osteogenico a lungo termine, il livello di espressione di un marcatore osteogenico, fosfatasi alcalina (ALP), è stato studiato mediante saggio colorimetrico. Nell-1 rilascio dalla PEC aumenta l'attività ALP delle cellule staminali del midollo coniglio ossee 2,2 volte al giorno 14 rispetto al gruppo di controllo PEC (Figura 8). BMP-2 mostra il massimo incremento di attività ALP (3,75 volte) il giorno 7. Sia PEC-BMP-2 e PEC-BMP-2 + extra BMP-2 mostrano diminuzione di attività il giorno 9.
attività ALP con BMP-2 nel mezzo senza PEC è mostrato in Figura 8C. Sebbene il 70% del fattore di crescita rimane sul PEC, l'attività ALP del PEC gruppo BMP-2 è equivalente alla libera BMP-gruppo. In vivo, fattore di crescita deve essere consegnata dal vettore per evitare washout. Dal nostro roditore e il modello suino, siamo in grado di abbassare la dose di BMP-2 rispettivamente 20 volte e 6 volte,. La riduzione di non ridurre non solo gli effetti collaterali indesiderati, ma riduce anche i costi di utilizzo del fattore di crescita.

Figura 1: generatore elettrostatico tallone e la siringa pompa istituito nel gabinetto BSL-2 biosicurezza (A) ugello fissato sul portaugello.. (B) Grande bacino di soluzione di cloruro di stronzio. (C) elettrodo cavo. (D) del tubo flessibile fornisce la soluzione di alginato. (E) porta ugello e il braccio. Fornitura t (F) Elettrodiegli differenza di potenziale di regolare la dimensione del tallone. (G) agitatore magnetico. (H) siringa da 5 ml. (I) Pompa siringa per regolare il flusso di alginato. Manopola di regolazione (J) agitatore per controllare velocità di agitazione. Manopola di regolazione (K) di tensione per regolare la differenza di potenziale tra 0-10 kV. Clicca qui per vedere una versione più grande di questa figura.
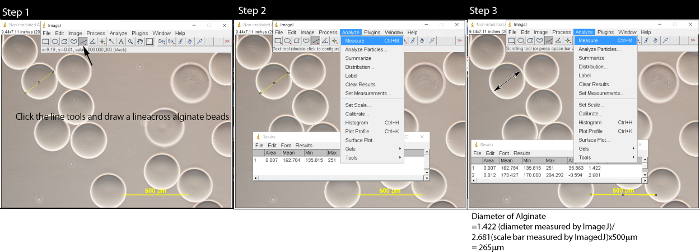
Figura 2: Misurazione microsfere di alginato con il software ImageJ Dopo aver aperto il file immagine facendo clic su File → Apri, seguire Fase 1:. Clic sullo strumento Linea e tracciare una linea sulle microsfere di alginato. Nel passaggio 2, scegliere Analizza sulla barra dei menu e una finestra pop-up apparirà. Ripetere i passaggi 1 e 2 fino a quando tutte le microsfere sono meaassicurata. Nel passaggio 3, fare clic sullo strumento linea, tracciare una linea attraverso la barra di scala e misurare la lunghezza della barra di scala. Convertire la lunghezza microsfere di micron usando la formula:. La durata del alginato / lunghezza della barra di scala x 500 micron Clicca qui per vedere una versione più grande di questa figura.

Figura 3:. Rappresentazione schematica di Polielettrolita Complesso nucleo alginato (verde scuro) strato positiva carica di protamina (verde chiaro), negativo strato di eparina di carica (rosso), il fattore di crescita osteogenico, ad esempio, BMP-2 / NELL-1 sullo strato più esterno (pallido blu). clicca qui per vedere una versione più grande di questa figura.

Figura 4:. Immagini in campo chiaro di microsfere di alginato (A) non irradiati. (B) 8M Rad irradiato. microsfere di alginato non irradiato sono sferici e il 8M Rad irradiati controparte è a forma di goccia. Ingrandimento 100X. (Scala bar = 500 micron.) Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 5:. Scansione laser immagini di microscopia confocale di microsfere di alginato incubate con analoghi fluorescenti di protamina, eparina, Nell-1 e BMP-2 (A) CF 405 protamina (blu), (B) CF 594 eparina (rosso), (C ) FITC NELL-1 (verde), e (D ) FITC BMP-2 (verde). Microsfere rimangono sferica anche dopo incubazione con analoghi fluorescenti. Scala bar = 250 micron. Cliccate qui per vedere una versione più grande di questa figura.
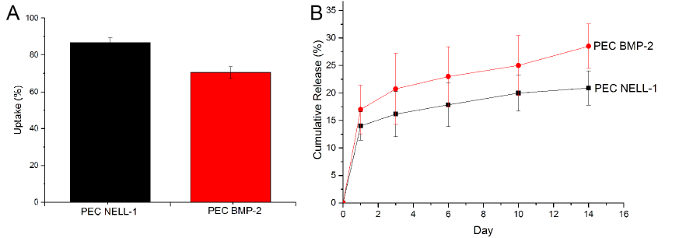
Figura 6:. Assorbimento e il rilascio di BMP-2 e Nell-1 (A) Assorbimento di Nell-1 proteina (nero) BMP-2 (rosso), (B) Curva rilascio cumulativo di BMP-2 (rosso) e NELL- 1 (nero) da PEC portante. I risultati sono presentati come media ± deviazione standard. Cliccate qui per vedere una versione più grande di questa figura.
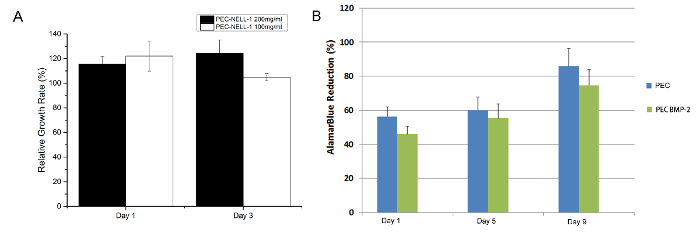
Figura 7:. citotossicità Assay (A) saggio MTT di coniglio midollo osseo deriva cella con a protamina basato PEC NELL-1 200 mg / ml estrarre (nero), PEC-nell-1 100 mg / ml estratto (bianco) giorno 1 e 3. (B) Alamar blu saggio di coniglio midollo osseo steli cella con PEC BMP-2 (blu), PEC (verde) Gli esperimenti sono stati eseguiti in triplicato ed i risultati sono presentati come media ± deviazione standard. clicca qui per vedere una versione più grande di questa figura.
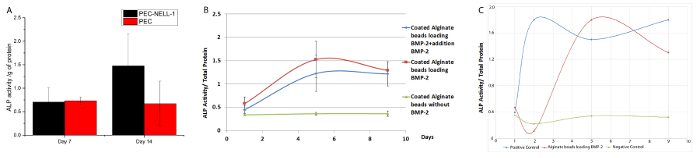
Figura 8: bioattività Assay per BMP-2 e Nell-1 liberazione dalla PEC portante (A) l'attività ALP di coniglio osso cellule staminali del midollo incubate con PEC-nell-1 (nero), PEC (rosso).. attività ALP è stata misurata come assorbanza a 405 nm. 2.2piega aumento dell'attività ALP è stata osservata dopo incubazione con PEC-nell-1 a 14. Giorno (B) l'attività ALP di coniglio osso cellule staminali del midollo incubate con PEC-BMP-2 (rosso) PEC-BMP-2 + aggiunta di BMP- 2 (verde) e PEC (blu). Aumento di attività ALP dopo incubazione con PEC-BMP-2 e PEC-BMP-2 + aggiunta di BMP-2 a 7 giorni, l'attività ALP cade il giorno 9. (C) ALP attività di cellule staminali del midollo osseo di coniglio incubato con PEC- BMP-2 (rosso) BMP-2 (blu) e Medium (verde). I risultati sono presentati come media ± deviazione standard. Cliccate qui per vedere una versione più grande di questa figura.

Figura 9: fosfato Polycaprolactone Tri-calcio (PCL-TCP) impalcatura ricco di PEC portante (A) Polycaprola.ctone fosfato di tri-calcio (PCL-TCP) scaffold (dimensione dei pori 1,300 micron) ricco di PEC vettore. impalcatura (B) PCL-TCP. (C) Alto ingrandimento: PEC mantiene la sua forma dopo l'imballaggio. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Questo protocollo presenta un metodo per la preparazione dei PEC attraverso layer-by-layer autoassemblaggio. La struttura layer-by-layer viene visualizzato per mezzo analoghi fluorescenti di protamina, eparina, microscopia BMP-2 e Nell-1 e confocale. Assorbimento e rilascio prove dimostrano che l'eparina sulla PEC media osteogenica fattore di crescita l'assorbimento e il rilascio. L'efficienza di assorbimento del metodo PEC è: NELL-1: 86,7 ± 2,7%, BMP-2: 70,5 ± 3,1%. Il vettore PEC ha una migliore modulazione di Nell-1 (20%) di rilascio rispetto al vettore adsorbimento pura superficie quali particelle di apatite di calcio (40-80%) 11.
Oltre modulando il rilascio, l'eparina neutralizza la carica positiva eccessiva di policationi quali protamina per evitare problemi legati citotossicità indesiderati 12. I PEC non mostrano alcun segno di citotossicità, come determinato dal test MTT e il test Alamar blu 7. Il test ALP mostra il vettore PEC può mantenere la bioactivity di entrambi NELL-1 e BMP-2. Nonostante sia stato sviluppato per il fattore di crescita osteogenic BMP-2 terapia in chirurgia di fusione spinale, PEC può anche assumere altri fattori di crescita con il legame di eparina domini come NELL-1 e PDGF-BB. Rispetto ad altri metodi di consegna, come l'incapsulamento dei fattori di crescita in microsfere di acido poliglicolico, PEC non richiedono solventi organici che tendono ad inattivare i fattori di crescita 13.
Una serie di fattori nella procedura di fabbricazione PEC può influire sulle prestazioni del vettore. In primo luogo, le dimensioni microbead colpisce il rapporto superficie / volume. Higher fattore di crescita osteogenico carico può essere realizzato con microsfere piccoli. In secondo luogo, la concentrazione alginato dovrebbe essere sufficiente per mantenere la stabilità della struttura microperla. stabilità microperla dipende dal tipo di alginato, lunghezza della catena (colpiti da raggi gamma) e lo ione bivalente utilizzato (bario> di stronzio> calcio). Mentre 2% soluzione di alginato è sufficiente Manufacture PEC con strutture microsfere stabili, 4% alginato è necessaria dopo 8 MRad irradiazione gamma per compensare gli effetti di alginato accorciamento della catena durante l'irradiazione. In terzo luogo, il tasso di degradazione in vivo di microsfere di alginato è fortemente influenzata dalla alginato lunghezza della catena. Sulla base della nostra esperienza da modelli di ratto e suina, PEC fabbricato con 8 MRad irradiato alginato mostra rapido (28 giorni) e la completa degradazione del nucleo alginato (dati non pubblicati). La degradazione del nucleo alginato fornisce essenziale spazio per crescita ossea. In quarto luogo, l'incubazione notturna di BMP-2 e Nell-1 a 4 ° C con agitazione costante (ad esempio, 30 rpm) può migliorare l'efficienza di assorbimento. Infine, lo spessore del rivestimento protamina è dipendente dal tempo. Poiché il grado di interazione protamina-eparina determina il rilascio di fattori di crescita osteogenici come BMP-2 o NELL-1, 1 ora di incubazione protamina è adottato per migliorare la stabilità della struttura PEC.
L'uso di eparina in questa tecnica è fondamentale per stabilizzare i fattori di crescita delicate e quindi importante per prolungare in vivo bioattività. Data la quantità molto limitata di eparina coinvolti e accoppiato con la scelta del antidoto, cioè, protamina (un farmaco altamente efficace nel neutralizzare le attività anticoagulanti di eparina), tempo di sanguinamento prolungato nell'osso decorticata è in larga misura teorica e praticamente irrilevante.
Caricamento dei PEC nel patibolo PCL-TCP migliora la localizzazione di perline in siti implantari. Ponteggi fornire il necessario sostegno meccanico che è cruciale per la fusione spinale. Nel presente studio, abbiamo utilizzato ponteggi PCL-TCP con 1.300 micron pori per facilitare dell'imballaggio adeguato (Figura 9). Anche se l'illustrazione attuale mostra PEC osteogenic consegna fattore di crescita con l'impalcatura PCL-TCP, il nostro gruppo ha anche valutato le prestazioni del vettore con una polyetherketoneketone (PEKK) Camera di osso in uno studio coniglio con efficacia simile.
In questo studio, la mancanza di confronto con altri vettori precedentemente valutati di rhBMP-2 e Nell-1 potrebbe rappresentare un limite.
In conclusione, la procedura presentata fornisce un vettore utile per controllare il rilascio di fattori di crescita osteogenici con domini eparina come BMP-2 e Nell-1. La strategia descritta unisce molti vantaggi: non è limitato a BMP-2, applicabile ad altri fattori di crescita con il legame di eparina domini come NELL-1. riduzione della dose sul fattore di crescita osteogenica può ridurre gli effetti collaterali indesiderati come sieroma, formazione ossea eterotrofi e abbassare il costo complessivo del trattamento.
Divulgazioni
Non abbiamo alcun conflitto di interessi.
Riconoscimenti
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
Materiali
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
Riferimenti
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002(2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.