Method Article
헤파린 결합 도메인 골 형성 성장 인자 전달을위한 고분자 전해질 복합
요약
Self-assembled polyelectrolyte complexes (PEC) fabricated from heparin and protamine were deposited on alginate beads to entrap and regulate the release of osteogenic growth factors. This delivery strategy enables a 20-fold reduction of BMP-2 dose in spinal fusion applications. This article illustrates the benefits and fabrication of PECs.
초록
재건 뼈 수술하는 동안, 성장 인자의 생리적 금액은 경험적으로 성공적으로 뼈 융합을 촉진하는 발판에로드됩니다. 매우 유력한 생물학적 제제의 많은 양이 급격한 효소 분해의 결과로서 성장 인자 불안정성뿐만 아니라 임플란트 부위에서의 성장 인자의 충분한 양의 국산화 캐리어 효율성에 요구된다. 따라서, 이들 릴리스 예컨대 BMP-2 / 넬-1과 성장 인자의 안정성을 연장하고, 제어 전략은 실제로 효과적인 투여 량을 낮출 수 있으며, 따라서 장래의 골 재생 수술시에 더 큰 용량의 필요성을 감소시킨다. 차례로 이것은 부작용 성장 인자 비용을 감소시킬 것이다. 자기 조립 농도 (PEC)는 생체 내 안정성을 향상시킴으로써 헤파린 결합 더욱 강화할 성장 인자의 생리 활성을 통해 BMP-2 / 넬 -1- 전달 나은 제어를 제공하기 위해 제작되었다. 여기에서 우리는 대인 수수 에이즈 PEC 제조의 단순성을 설명재건 수술 중에 뼈의 성장 인자의 다양한 RY.
서문
가관절 발생률은 퇴행성 척추 융합 및 개정 척추 수술 1에서 10 ~ 45 %로 높은 것으로보고되었다. 예컨대 BMP-2, 넬-1 및 혈소판 유래 성장 인자 (PDGF) 등 골 형성 성장 인자가 새로이 골 형성을 촉진하기 위해 도입 된 척추 융합 등 재건 뼈 수술 중에 불유합의 속도를 감소시킨다. 이 중, BMP-2는 척추 융합 2 인기있는 선택입니다. 유도하고 새로운 뼈의 형성을 촉진 BMP-2의 효능이 잘 3 확립되었지만; 이러한 이소성 골 형성, 장액 및 혈종 형성, 염증 반응, radiculitis, 추체의 골 용해 및 역 행성 사정 등 임상 적으로 유의 한 합병증으로 인해 4,5 사용되는 생리적 양에 우려의 문제로 계속합니다.
따라서, BMP-2의 도즈를 낮추는 것은에서의 관련 전략을 유지부작용을 최소화하도록 유혹. 또한, 효율적인 캐리어 시스템은 BMP-2 현대 콜라겐 스폰지 캐리어 시스템에서 관찰되는 초기 파열 방출을 억제하여 더욱 강력한 사이토킨이 연장 된 및 국소 전달을 향상시키기 위해 필요하다. 양이온과 음이온 성 고분자 전해질을 교대의 층별 자기 조립은 지지체 매트릭스 또는 임플란트 재료 (6)의 표면에 고분자 전해질 복합체를 구축하는 동조 방법으로 사용될 수있다. 이러한 관점에서, (모든 생물학적 제제의 가장 높은 음의 전하 밀도를 갖는 알려진) 헤파린 열광적 정전 헤파린 결합 도메인을 통한 성장 인자의 다양한 바인딩 인식되었다. 실제로, 헤파린 반감기를 연장하고, 따라서 여러 가지 성장 인자의 생리 활성을 강화시키는 것으로 밝혀졌다.
이를 바탕으로, 우리 그룹 헤파린 계 고분자 전해질 복합체 (PEC)을 제조하는 데 계층 별 자기 조립 층 프로토콜을 채택 하중 및 고정 7,8시 골 형성 성장 인자의 생리 활성을 유지합니다. 알지네이트 마이크로 비드 코어는 α-L-guluronate (G) 2가 양이온의 칼슘 또는 스트론튬 이온 알긴산 잔기를 가교 결합하여 제조 하였다. 알지네이트 코어는 생분해 성 지지체 매트릭스이고; 이는 이식 한 결과, 골 증식을위한 공간을 제공하는 융합 침대에서 재 흡수된다. 폴리 -L- 라이신 (PLL) 또는 프로타민 (이 경우, 알지네이트 마이크로 비드 담체 코어) 골격 매트릭스 및 음으로 하전 된 헤파린 모두 인터레이스 양이온 층으로서 사용된다; 음이온 성 헤파린 계층 기능은 안정화로드 성장 인자 국산화있다. 삼중 층 PEC는 돼지 모델 9 성장 인자 적재량을 증가시키는 것으로 나타났다. 최근 PEC 캐리어 성공적 쥐 10 척추 융합 8 돼지 모델에서 적어도 20 배 BMP-2의 유효 용량을 감소시키는 것으로 나타났다.
ntent는 "> 여기서는 모델 골 형성 성장 인자로서 BMP-2를 이용하여 척추 융합 향상된 성장 인자 전달 및 다른 골 재건술 실용 제조 페치 방법을보고한다.프로토콜
1. 알긴산 용액의 제조
- 알긴산 나트륨 (비 조사) 또는 8 MRAD 400 ㎎을 200 ㎎을 용해 이중 증류수 10ml에 알긴산 나트륨을 조사 및 비 조사 알긴산 1 시간 및 조사 알긴산 15 분간 흔들어. 밤새 4 ° C에서 알긴산 용액을 저장합니다. 알지네이트 마이크로 비드 제조 전에 멸균 0.2 μm의 주사기 필터 알지네이트 용액 필터.
2. 알긴산 마이크로 비드 제작
- 70 % 에탄올로 정전 비드 발생기와 주사기 펌프를 소독 및 클래스 II 생물 안전 캐비닛 (그림 1)에 배치합니다.
- 비드 발생기 내부의 자기 교반 막대와 유리 분지를 놓습니다.
- 9cm 분지 위의 구슬 발생기의 팔 전극을 설정합니다.
- 아암 전극의 널링 나사 2 비드 발생기의 전극 케이블을 연결하고으로 SrCl 2 용액 80 mL를 부어분지.
- 로드 주사기와 고무 튜브에 0.2 μm의 여과 알긴산 용액 5 ㎖. 아암 전극에 고무 튜브를 접속 한 후, 관 내부의 공기를 배출하고 상기 노즐의 선단에 알지네이트 용액을 제공하기 위해 2 분 동안 5 ㎖ / 시간 주사기 펌프 스위치. 주사기 펌프의 전원을 끄십시오.
- 다음에, 캡슐에 전환 한 다음, 시린지 펌프는 마이크로 비드 생성을 개시. 5 ㎖ / 시간 알긴 유량과 캡슐화 5.8 kV로의 전압을 설정한다. 이러한 마이크로 비드 불규칙한 크기와 모양의 경향으로서, 제 이분 (또는 주사기 밖으로 펌핑 초기 0.5ml를 알지네이트 용액) 중에 생성 된 마이크로 비드를 버린다.
- 0.2 M 염화 스트론튬 용액 후속 마이크로 비드를 모은다. 알긴산 용액의 사전 계획 볼륨을 펌핑 한 후 주사기 펌프 (순서대로)를 캡슐화를 모두 해제합니다. 마이크로 비드 제조의 후속 배치에 대해이 작업을 반복합니다. 완료시의 회전제 시린지 펌프 f를 상기 캡슐화 하였다.
- 가교를 완료하고, 겔을 안정 밤새 4 ℃에서 0.2 M 염화 스트론튬 용액 20 ㎖에 마이크로 비드를 저장한다.
알긴산 마이크로 비드의 3. 크기 측정
- 플라스틱 피펫 알긴산 마이크로 비드의 0.5 ml의 수집 및 유리 슬라이드에 놓습니다. 10 배 배율의 광학 현미경으로 마이크로 비드를 볼 수 있습니다. 현미경 CCD 카메라와 마이크로 비드의 열 이미지를 가져 가라. 해상도 2048 X 1536에서 TIFF 형식으로 스케일 바 (500 μm의)와 함께 이미지를 저장합니다.
- ImageJ에의 길이 도구를 사용하여, 마이크로 비드 및 스케일 바 (도 2)의 크기를 측정한다. 마이크로 미터 픽셀에서 마이크로 비드 길이를 변환합니다.
- 선 도구를 클릭하고 알지네이트 비드의 중간을 가로 지르는 선을 그립니다.
- "측정"을 메뉴 바의 "분석"을 선택 클릭합니다. 팝업 창이 나타납니다.
- 반복 이미지 내의 모든 알긴산 비드를 측정하는 3.2.1-3.2.2 단계를 반복합니다. 이미지의 눈금 막대를 측정한다.
- 스케일 바 X 500 ㎛, 알긴산 비드 / 길이의 길이를 다음 식을 이용하여 실제 길이에 알긴산 비드의 직경 변환. 예를 들어, 1.420 (ImageJ에 의해 측정 직경) / 2.657 (ImageJ에 의해 측정 스케일 바의 길이) * 500 μm의 = 267 μm의.
- 마이크로 비즈의 각 배치의 대표 사이즈로 (평균 ± 표준 편차) 100 마이크로 비드의 평균 크기를 고려하십시오.
4. 살균
- 100 ㎛의 나일론 여과기를 사용하여 마이크로 비드를 수집하고 증류수로 비드를 세척 하였다.
- 주걱을 사용하여이 용액을 마이크로 원심 튜브에 0.1 ml의 알지네이트 용액에서 만든 모든 마이크로 비드를 전송하고 건조를 방지하기 위해 가제 커버.
- 마지막으로, 액정 모드를 이용하여 고온 가압 멸균하여 마이크로 비드를 살균 (115 ℃, 15 분) 또는 m 따른anufacturer의 사양. 건조되는 비드를 방지하기 위해 챔버에 증류수 1.5 L를 추가한다.
5. 프로타민과 헤파린 코팅
- BSL -2- 후드 내에서 2 밀리그램 / 실온에서 1 시간 동안 (0.2 μm의 주사기 필터를 사용하여 멸균) mL의 프로타민 용액 1 ㎖와 멸균 마이크로 비드를 배양한다.
- 1 시간 (단계 5.1)에 대한 마이크로 비드를 배양 한 후, 마이크로 bicinchoninic 산 (microBCA) 시험 (6 절)에 대한 프로타민 용액 150 μl를 수집합니다.
- 두 번 증류수로 두 번 프로타민 코팅 된 마이크로 비드를 씻으십시오. 실온에서 3 분 동안 200 XG에서 벤치 톱 원심 분리기를 사용하여 스핀 다운. 원심 분리 후, 주사기를 이용하여 물을 흡인.
- 0.5 mg을 1 mL의 프로타민 코팅 된 마이크로 비드를 부화 / 고분자 전해질 복합체를 만들기 위해 30 분 (PEC)에 대해 (0.2 μm의 주사기 필터를 사용하여 멸균) ml의 헤파린 용액.
- 프로타민 코팅 된 마이크로 비드 f를 배양 한 후30 분 (단계 5.4), 헤파린 함량 (7)를 결정하기 위해 헤파린 용액 400 μl를 수집합니다.
- 배양 후, 두 번 증류수로 두 번 세척하여 펙스에서 언 바운드 헤파린을 씻어.
6. 프로타민 내용
- 제조업체의 지침에 따라 microBCA 테스트를 수행합니다. 간단히, 96 웰 플레이트에 150 μL 프로타민 용액 (전 마이크로 비드와 배양 후 수집)를 추가합니다. 150 ㎕를 microBCA 작업 솔루션을 추가합니다.
- 교정 표준으로서 알부민 용액 (0, 0.5, 1, 2, 5, 10, 20, 40 및 200 μg의 / ㎖)를 사용한다.
- 60 ° C에서 60 분 동안 인큐베이션 혼합물. 562 nm에서 분광 광도계로 흡광도를 측정한다.
- 제조업체의 지시에 따라 각각의 미지 시료의 프로타민 농도를 결정하는 표준 곡선을 사용한다.
- 에서 프로타민의 합계를 감산하여 마이크로 비드의 프로타민 내용을 결정(마이크로 비드와 인큐베이션 후) 도포 액에 잔존 프로타민의 양 발 (마이크로 비드와 인큐베이션 전) 코팅액.
7. 헤파린 내용
- 블루 4 mg을 톨루이딘 0.01 N 염산 20 mg의 염화나트륨을 용해시켜 작업 용액 10 ㎖를 준비한다.
- 30 초 동안 3 소용돌이 : 2의 비율로 작업 솔루션 (단계 5.5에서) 시료 400 μl를 추가합니다.
- n- 헥산 (작업 시약 액에 해당하는 양)의 600 μl를 추가하고 톨루이딘 블루 헤파린 단지를 추출 혼합물을 소용돌이.
- 대기음 상분리 후, 주사기에 의해 수 성상을 200 μL.
- 631 nm에서 분광 광도계를 사용하여 수성 상에 포함되지 않은 추출 톨루이딘 블루의 양을 측정한다.
- 0 ~ 20 μg의 / ㎖의 헤파린 표준 솔루션을 준비합니다.
- μg의 / m에서 헤파린 농도 대 각 헤파린 표준의 631 nm의 판독 플롯엘. 각 샘플의 헤파린 농도를 결정하는 표준 곡선을 사용한다.
계층 별 계층 구조 8. 공 촛점 이미지
- 프로타민, 헤파린과 넬-1 / BMP-2 형광 아날로그 CF-405 프로타민 (파란색), CF 594 헤파린 (적색) 제작 및 FITC는 넬-1 / FITC가 라벨에 따라 (녹색) BMP-2 + 헤파린 + 프로타민 제조업체의 라벨 기술 데이터 시트.
- 코트 100 형광 아날로그의 300 μL와 μg의 마이크로 비드 (5.3-5.6에 설명 된대로 코팅 방법) CF-405 프로타민 (파란색) (2 ㎎ / ㎖, 1 시간 배양), CF 594 헤파린 (적색) (0.5 ㎎ / ㎖, 30 분)와 FITC 표지는 넬-1 / FITC 표지 (녹색), BMP-2 (1.5 ㎎ / ㎖, 밤새). 언 바운드 형광 프로타민, 헤파린과 넬-1 / BMP-2를 제거하기 위해 증류수로 두 번 마이크로 비드를 씻으십시오.
- 10X 확대 한 공 초점 레이저 주사 현미경을 사용하여 층별 구조 (도 3)을 관찰한다. (7)
9. BMP-2넬-1 통풍 관 및 릴리스와
- 로드 PEC 100 μg의에 BMP-2 또는 넬-1 용액 1.5 ㎎ / ㎖ 13.3 μL. 10 시간 동안 진탕 (30) 회전 수에서 4 ° C에서 PEC을 품어.
- 일정한 진탕 (30 RPM)와 함께 37 ℃에서 인산염 완충 식염수 (PBS) 1 ㎖의 마이크로 비드를 담근다.
- 상청액 1 ㎖를 모아서 1, 3, 6, 10, 14 일 후에 1 ml의 PBS로 대체.
- 흡수를 평가하고 제조자의 프로토콜에 따라 ELISA 방법을 사용하여 BMP-2의 효율을 해제. 흡수를 평가하고 제조자의 프로토콜에 따라, 카복시 퀴놀린 -2- 카르 복스 알데히드 (CBQCA) 단백질의 분석 방법을 사용 넬-1의 효율을 해제.
- 시간 (t)에서 누적 해제를 결정합니다
시간 시간 (t) + 이전 릴리즈에서 시간 (t) = 릴리스의 누적 릴리스 (t-1). - 시간에 대한 BMP-2와 넬-1의 누적 릴리스 플롯.
10. 체외 생물 작용 (Bioactivity)넬 - 1
참고 넬 -1- PEC 해제의 생체 활성은 토끼의 골수 줄기 세포 (rBMSC)의 알칼리성 포스파타제 (ALP)의 발현을 증가시키는 능력을 측정함으로써 평가 하였다.
- 종자 20,000 24- 웰 플레이트에 웰 당 rBMSCs하고 태아 소 혈청 (FBS) CO 2, 37 ℃에서 5 % 둘 베코 변형 이글 배지 (DMEM) + 10 %로 1 ㎖로 하루 동안 증가 할 수있다.
- 24 시간 후에는 10-8 몰 / L의 덱사메타손, 10 % FBS, 2 % 페니실린 스트렙토 마이신, 50 μg의 / ㎖ 아스코르브 산, 10 밀리몰 / L 베타 글리세로 보충 골아 세포 배지 (DMEM 1 ㎖와 함께 배지를 교체하고, ) 37 ° C에서 칠일, 5 % CO 2.
- 세포 (이는 골 형성 매체 변화하는 동안 PEC 마이크로 비드의 유실을 방지)로부터 분리 펙스를 유지하기 위해 300 μg의 PEC-넬-1 세포 배양 삽입 내부와 PEC (단계 8.2에서) (TC 삽입)을 놓습니다. 장소 TC는 PL 아니라 (24)에 삽입14 일 동안 먹었다.
- 일단 3 일, 흡인 1 TC 삽입 외부에 바늘을 삽입하여 골 형성 매체의 ml의 신선한 골 형성 배지 1 ㎖로 교체합니다.
- 배양 7 일, 14 일 후, 상기 키트 제조자의 프로토콜에 따른 ALP 분석 키트 ALP 활성을 결정한다.
- 10 분 동안 4 ℃에서 0.1 % 트리톤-100을 함유하는 분석 완충액를 Lyse 셀. 셀 스크레이퍼를 사용하여 부착 된 세포를 긁어. 적어도 60 분 동안 교반하면서 4 ° C에서 세포 현탁액을 품어.
- 10 분 동안 4 ° C에서 2,500 XG에서 세포 현탁액을 원심 분리기. 노동당 분석을위한 뜨는을 수집합니다.
- 200에서 96 웰 플레이트에 ml의 0 NG / 직렬로 희석 알칼리 포스 파타 아제 표준 용액 50 μl를 추가합니다. 알칼리성 포스파타제 표준의 최종 량은 웰 / 10, 5, 2.5, 1.2, 0.6, 0.3, 0.15 및 0 NG이다.
- 희석와 b 단계 10.5.2에서 뜨는을 추가 (50 μL / 웰) 및 희석uffer.
- 각 웰에 P는 -nitrophenyl 인산 (pNPP) 기질 용액 50 μl를 추가합니다. 부드럽게 30 초 동안 판을 흔들어 시약을 섞는다. 어둠 속에서 30 분 동안 혼합물을 품어. 플레이트 리더로 405 nm에서 흡광도를 측정한다.
- 검량선을 사용 ALP 활성을 계산한다.
- 제조업체의 지시에 따라 microBCA 단백질 분석 키트를 사용하여 단백질 함량을 측정. 단백질 함량에 의해 ALP 활성을 나누어 ALP 활성을 정상화.
11. 세포 생존
- 3- (4,5- 디메틸 티아 졸 -2- 일) 24 시간 -2,5- 디 페닐 테트라 졸륨 브로마이드 (MTT), 37 ° C에서 DMEM + 10 % FBS의 1 ml의 PEC-넬-1 200 mg의 부화 시험.
- 종자 2,000 rBMSCs 잘 당과 96 웰 플레이트에서 (10 % FBS와 DMEM 100 ㎕에서) 37 ° C, 5 % CO 2에서 1 일 동안 배양한다.
- PEC-넬-1 / PEC 추출물 100 ㎕와 DMEM + 10 % FBS를 교체하고 품어37 ° C에서 5 % CO 2.
- 일일 또는 배양 3 일 후, 5 ㎎ / ㎖ MTT 용액 10 μl를 추가 또한 어둠 속에서 4 시간 동안 37 ° C, 5 % CO 2에서 배양한다.
- 포르 마잔 결정을 용해 각 웰에 100 ㎕의 DMSO 솔루션을 추가합니다.
- 마이크로 플레이트 리더를 사용하여 570 nm에서의 흡광도를 결정한다.
- 상대적인 성장 속도를 계산한다 :
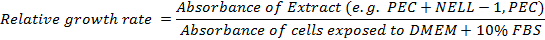
비계와 BMP-2 넬-1로드로 (12) 포장
- BSL-2 챔버 내부의 멸균 주걱을 사용하여 트라이 인산 칼슘 (mPCL-TCP) 비계 - 생 흡수성 의료용 폴리 카프로 락톤의 기공에 펙스를 포장합니다.
- PEC와 함께 제공된 mPCL-TCP 지지체에 1.5 밀리그램 / BMP-2, 넬-1 ml의 솔루션을 추가하고 밤새 4 ° C를 품어.
결과
우리의 캐리어에서, 프로타민은 비슷한 화학적 특성을 가지고로 폴리 -L- 라이신의 대용으로 선정되었다 그것은 FDA는 헤파린의 해독제로 승인 된 것입니다. 광학 현미경 결과는 비 조사 마이크로 비드는 267 ± 14 ㎛의 직경을 갖는 구형 상인 것으로 나타났다. (0.35 mm의 노즐을, 5 ㎖ / hr의 5.8 kV의 유속). 조사 마이크로 비드의 대부분은 눈물 방울 형상이다. 조사 된 마이크로 비드의 원형 부에서 측정 된 직경 (4 ㎖ / hr의 6 kV의 유속 0.35 mm 노즐) 212 ± 30 ㎛의이었다. (그림 4).
PEC 마이크로 비드의 공 촛점 이미지는 CF-405 라벨 프로타민 (파란색), CF594 표지 헤파린 (적색)과 FITC-BMP-2 / FITC-넬-1 (녹색)의 레이어로 레이어 코팅을 알 수있다. 결과 펙스 함께 결합 할 수 있음을 나타내는 긍정적 인 BMP-2 충전 부정적인 헤파린 BINDI 통해 넬 -1- 청구NG 도메인 (그림 5). 이 펙스와 골 형성 성장 인자 사이의 상호 작용에 의존 부과되지 않는다는 것을 의미한다.
펙스는 흡수량 BMP-2를 방출 할 수 있음을 증명하기 위해, BMP-2를 배양 후 잔량 및 1 일, 3, 6, 10 및 14에서 PBS에 BMP-2의 양을 측정하는 ELISA 분석법을 사용 . 그러나, 동일한 방법이 상당히 신호를 감소 블록들, 항체 결합 부위 헤파린 때문에, 넬-1 단백질과 잘 작동하지 않는다. 따라서, CBQCA 단백질 분석은 PEC-넬-1 및 PEC의 차이를 결정하는 데 사용되었다. 누적 방출 곡선으로부터 농도 (PEC)뿐만 아니라 BMP-2에 비해 더 높은 넬 -1- 흡수 효율을 보여줄뿐만 아니라, BMP-2보다 훨씬 느린 방출 (도 (넬-1 : 25 % : BMP-2 대 20 %) 6). 이 페치는 BMP-2보다 넬-1보다 긴밀하게 결합하는 것이 좋습니다.
FR옴 MTT 분석은, PEC는-넬-1 (그림 7) 세포 독성되지 않습니다. 결과는 이전 연구 7에서하는, Alamar 블루 분석 결과와 일치한다. 헤파린은 PEC의 생체 적합성을 유지하는 데 중요한 역할을 프로타민의 양전하를 중화시킨다.
PEC에서 넬-1 릴리스 장기 골 형성 분화, 골아 세포 마커의 발현 수준, 알칼리 포스 파타 아제 (ALP)에 영향 여부를 확인하기 위해, 비색 분석에 의해 조사 하였다. PEC에서 넬-1 릴리스는 PEC 대조군 (그림 8)에 비해 14 일에 2.2 배 토끼 골수 줄기 세포의 ALP 활성을 증가시킨다. BMP-2 일 7 일 9 활동의 두 PEC-BMP-2와 PEC-BMP-2 + 추가 BMP-2는 감소에 ALP 활성의 최대 증가 (3.75 배)를 보여줍니다.
PEC가없는 배지에서 BMP-2와 ALP 활성에 도시 도 8C. 성장 인자의 70 %는 PEC에 남아 있지만, PEC BMP-2 그룹의 ALP 활성은 자유 BMP 그룹에 해당한다. 생체 내 성장 인자는 유실을 방지하기 위해 캐리어에 의해 제공되어야한다. 우리 쥐 및 돼지 모델에서, 우리는 각각 20 배, 6 배 의해 BMP-2의 용량을 낮출 수있다. 감소는 부작용을 줄일뿐만 아니라 성장 인자를 사용하는 비용을 줄인다 않을뿐만 아니라.

그림 1 : 정전기 구슬 발생기와 주사기 펌프는 BSL-2 바이오 안전성 캐비닛에 설치 노즐 홀더에 고정 (A) 노즐을.. (B) 염화 스트론튬 용액 큼 분지. (C) 전극 케이블을 연결합니다. (D) 호스 알지네이트 솔루션을 제공합니다. (E) 노즐 홀더와 팔. (F) 전극 공급 t그 전위차는 비드 크기를 조절한다. (G) 자석 교반기. (H) 5 ml를 주사기. (I) 주사기 펌프는 알긴산 흐름을 조절한다. (J) 교반기 조절기 교반 속도를 제어한다. (K) 전압 조절 노브가 0 ~ 10 kV의 사이의 전위차를 조절 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
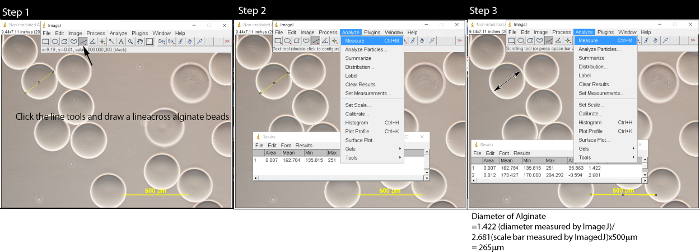
그림 2 : ImageJ에 소프트웨어 알긴산 마이크로 비드를 측정 파일 → 열기를 클릭하여 이미지 파일을 연 후, 1 단계를 수행하십시오. 선 도구를 클릭하고 알긴산 마이크로 비드에 선을 그립니다. 2 단계에서 메뉴 표시 줄이 나타납니다 팝업 창에 분석을 클릭합니다. 1 단계를 반복하고 2 단계 모든 마이크로 비드가 내 잘못입니다 때까지측정 되었. 3 단계에서 선 도구를 클릭 스케일 바에서 선을 그릴과 스케일 바의 길이를 측정합니다. 사용하는 식으로 μm의에 마이크로 비드 길이 변환 :. 스케일 바의 알긴산 / 길이 길이 X 500 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :. 최 외층에 고분자 전해질 복합의 도식 표현 알긴산 코어 (진한 녹색) 양의 전하 프로타민 층 (연한 녹색), 음전하 헤파린 층 (적색), 골 형성 성장 인자, 예를 들어, BMP-2 / 넬-1 (엷은 파란색). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 :. 알긴산 마이크로 비드의 명 시야 이미지 (A) 비 조사. (B) 8M 라드는 조사. 비 조사 알지네이트 마이크로 비드는 구형이며 8M 라드 상대방이 눈물 방울 형상 인 조사. 배율 100 배. (스케일 바 = 500 μm의.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5 :. 넬-1, BMP-2, 프로타민, 헤파린 형광 유사체 배양 알지네이트 마이크로 비드의 공 초점 레이저 주사 현미경 사진 (A) CF (405) 프로타민 (청색), (B) CF 594 헤파린 (적색), (C ) FITC 넬-1 (녹색), 및 (D ) FITC BMP-2 (녹색). 마이크로 비드도 형광 유사체와 배양 후 구형 남아있다. 스케일 바 = 250 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
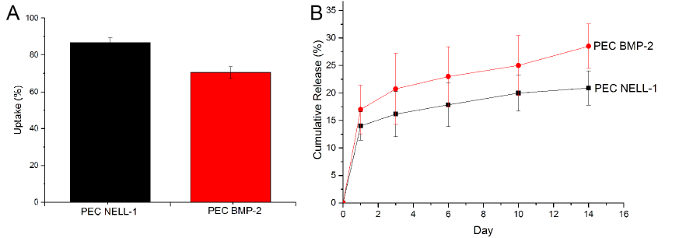
도 6 :. 넬-1 단백질 (블랙)의 흡수량과 BMP-2와 넬-1의 방출 (A) 통풍 BMP-2 (적), (B) BMP-2 (적색)과 NELL- 누적 방출 곡선 PEC 캐리어 1 (검은 색). 결과는 평균 ± 표준 편차로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
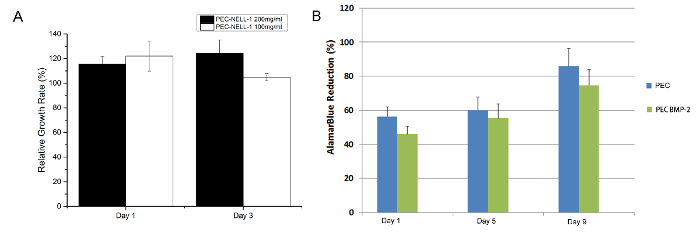
그림 7. 세포 독성 분석은 토끼 골수의 (A) MTT 분석 줄기 프로타민 기반 PEC 넬-1 200 밀리그램 / (검은 색)을 추출 ㎖, PEC-넬-1 100 mg을 추출 / ㎖ (흰색)에서와 세포 1 일, 3 (B) 토끼 골수하는, Alamar 블루 분석이 PEC BMP-2 (파란색)와 세포를 줄기, PEC는 (녹색) 실험이 세중의에서 수행하고, 결과는 평균 ± 표준 편차로 표시됩니다. 보려면 여기를 클릭하십시오 이 그림의 더 큰 버전.
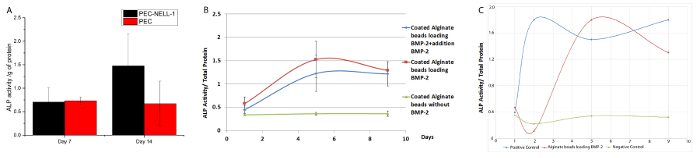
그림 8 : BMP-2와 PEC 캐리어에서 넬-1 릴리스의 생물 작용 (Bioactivity) 분석 (A) PEC-넬-1 (블랙), PEC (빨간색)와 함께 배양 토끼 골수 줄기 세포의 ALP 활성.. ALP 활성은 405 nm에서 흡광도를 측정 하였다. 2.2ALP 활성의 증가는 PEC-넬 - 1 일 14 (B) PEC-BMP-2 (적색) BMP-의 PEC-BMP-2 + 추가로 배양 된 토끼의 골수 줄기 세포의 ALP 활성에와 배양 후 관찰되었다 접어서 2 (녹색) 및 PEC (파란색). PEC-BMP-2와 PEC-BMP-2 7 일에서 BMP-2 + 첨가하여 배양 한 후 ALP 활성의 증가, ALP 활동의 날 (9)에 상품 토끼 골수 줄기 세포의 (C) ALP 활동 PEC- 배양 BMP-2 (적색) BMP-2 (파란색) 및 중간 (녹색). 결과는 평균 ± 표준 편차로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9 : PEC 캐리어로 포장 폴리 카프로 락톤 트라이 인산 칼슘 (PCL-TCP) 비계 (A) Polycaprola.PEC 캐리어로 포장 CTONE 트라이 인산 칼슘 (PCL-TCP) 발판 (기공 크기 1,300 μm의). (B) PCL-TCP 비계. (C) 높은 배율 : PEC는 포장 후 그 모양을 유지한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 층별 자기 조립을 통해 페치 제조 방법을 제공한다. 계층 별 구조는 층 프로타민, 헤파린, BMP-2와 넬-1과 초점 현미경 형광 유사체를 사용하여 가시화된다. 흡수 및 방출 시험은 PEC에 헤파린하는 골 형성 성장 인자 흡수 및 방출을 매개하는 것으로 나타났다. PEC 방법의 흡수 효율은 : 넬-1 : 86.7 ± 2.7 %, BMP-2 : 70.5 ± 3.1 %. PEC 캐리어 칼슘 아파타이트 입자 (40-80%) 11 순수한 표면 흡착 담체에 비해 넬-1 (20 %) 방출 더 변조를 갖는다.
방출 조절 외에, 헤파린은 원치 않는 독성과 관련된 문제를 피하기 12 그러한 프로타민과 같은 폴리 양이온의 과도한 양전하를 중화시킨다. MTT 분석하고하는, Alamar 블루 분석 (7)의 결정에 따라 펙스는 세포 독성의 징후가 표시되지 않습니다. ALP 분석은 PEC 캐리어가 bioact을 유지할 수 있습니다 보여줍니다넬-1, BMP-2 모두의 ivity. 척추 융합 수술에서 골 형성 성장 인자 BMP-2 치료를 위해 개발하지만, PEC는 또한 넬-1, PDGF-BB로 헤파린 결합 도메인과 다른 성장 인자를 취할 수 있습니다. 폴리 글리콜 산 등의 미립자의 성장 인자의 캡슐화와 같은 다른 전달 방법에 비해 농도 (PEC) (13)은 성장 인자 비활성화 경향 유기 용매를 필요로하지 않는다.
PEC 제조 과정에서 다수의 인자 캐리어 성능에 영향을 미칠 수있다. 먼저, 마이크로 비드 크기는 표면적 / 부피 비율에 영향을 미친다. 높은 골 형성 성장 인자로드 작은 마이크로 비드를 달성 할 수있다. 둘째, 알긴산의 농도는 마이크로 비드 구조의 안정성을 유지하기에 충분해야한다. 마이크로 비드 안정성 알긴산 타입 (감마선의 영향) 사슬 길이 및 사용 가의 이온 (바륨> 스트론튬> 칼슘)에 의존한다. 2 % 알지네이트 용액 동안은 manufactu는하기에 충분한안정한 마이크로 비드 구조를 갖는 재 농도 (PEC), 4 %의 알긴산 염은 알긴산 조사시 체인 단축의 효과를 보상하기 위해 8 MRAD 감마 조사에 따라 요구된다. 셋째, 알지네이트 마이크로 비드의 생체 내 분해 속도 강하게 알긴산 사슬 길이에 의해 영향을 받는다. 쥐와 돼지 모델에서 우리의 경험을 바탕으로, PEC 8 MRAD이 알긴산은 알지네이트 코어 (게시되지 않은 데이터)의 (이십팔일) 신속하고 완전한 분해를 보여줍니다 조사하여 제조. 알지네이트 코어의 저하는 골 증식을위한 공간의 핵심을 제공합니다. 넷째, 일정한 흔들림 (예를 들어, 30 RPM)와 4 ° C에서 BMP-2와 넬-1의 하룻밤 배양은 흡수 효율을 향상시킬 수 있습니다. 마지막으로, 프로타민 코팅 두께는 시간 의존적이다. 프로타민 헤파린 상호 작용의 정도는 BMP-2 또는 넬-1과 같은 골 형성 성장 인자의 방출을 결정하기 때문에, 프로타민 배양 1 시간이 PEC 구조의 안정성을 향상시키기 위해 채택된다.
이 기술에 헤파린을 사용함으로써 섬세한 성장 인자 안정화 중요한 생체 내 생체 활성의 연장을위한 것이 중요하다. 헤파린 관여 해독제의 선택 결합의 매우 제한된 양을 감안 즉 프로타민, decorticated 뼈 출혈 시간 연장 (헤파린의 항 응고 활성 및 중화 활성에 매우 효과적인 약물)을 크게 이론적 실제적 하찮은이다.
는 PCL-TCP 지지체에 펙스 넣기 임플란트 사이트에서 구슬의 현지화를 강화한다. 비계는 척추 융합을위한 중요 필요한 기계적인 지원을 제공합니다. 본 연구에서, 우리는 적절한 포장 (그림 9)을 촉진하기 위해 1300 μm의 기공 PCL-TCP 인공 지지체를 사용했다. 현재 그림은 PCL-TCP 비계와 PEC 골 형성 성장 인자 전달을 보여 주지만, 우리 그룹은 PEKK (A polyetherketoneketone와 캐리어 성능을 평가했다비슷한 효능을 가진 하나의 토끼 연구에서) 뼈 실.
본 연구에서는 rhBMP-2 넬-1의 다른 이전에 평가 된 캐리어에 비해 부족은 한계를 나타낼 수있다.
결론적으로, 제시된 절차는 BMP-2 및 넬-1과 헤파린 도메인과 골 형성 성장 인자의 방출을 조절하는 유용한 캐리어를 제공한다. 설명 된 전략은 많은 장점을 결합 :이 BMP-2로 제한 및 넬-1과 헤파린 결합 도메인과 다른 성장 인자에 적용되지 않습니다. 골 형성 성장 인자의 용량 감소는 장액, 영양 뼈 형성과 같은 바람직하지 않은 부작용을 감소 및 치료의 전체 비용을 낮출 수있다.
공개
우리는 관심의 충돌이 없습니다.
감사의 말
These studies were funded by National Medical Research Council Clinician Scientist - Individual Research Grant (CS-IRG) NMRC/CIRG/1372/2013 and NMRC EDG/0022/2008.
자료
| Name | Company | Catalog Number | Comments |
| Life Science Acrodisc 25 mm Syring Filter with 0.2 µm Supor Membrane | PALL | PN4612 | Sterile protamine, heparin solution by ultrafiltration |
| 24 well plate | Cell Star | 662160 | |
| 96 well plate Nuclon Delta Surface | Thermo Fisher Scientific | 167008 | |
| (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide), MTT | Sigma Aldrich | M5655 | Measure cytotoxicity of PEC-NELL-1 |
| Acetone | Fisher Scientific | A/0600/17 | Precipitate CF-405 Labeled protamine |
| Alamar Blue | Invitrogen, Life Technologies | DAL 1025 | Measure cytotoxicity of PEC-BMP-2 |
| Alkaline Phosphatase Assay (ALP) assay kit | Anaspec | AS-72146 | |
| Ammonium Chloride | Merck | Art 1145 | Stop reagent in FITC labeling |
| Anhydrous Dimethyl Sulfoxide (DMSO) | Invitrogen, Life Technologies | D12345 | Solvent for fluorescent isothiocyanate I |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | Dissolve formazan | |
| Autoclave | Hirayama | HU-110 | Sterilize alginate beads by steam |
| Beta-glycerophosphate | Sigma Aldrich | G9422 | |
| BMP-2 (Infuse Bone Graft Large II Kit) | Medtronic Sofarmor Danek, Memphis TN, USA | 7510800 | Osteogenic Growth Factor, dialysis is needed to remove stabilizer component that interferes with FITC coupling |
| Carboxybenzoyl quinoline-2-Carboxaldehyde (CBQCA) | Thermo Fisher Scientific | A-6222 | To quantify NELL-1 protein |
| Cell Strainer (100 µm) | BD Science | 352360 | Hold PEC for ALP assay |
| Cell Scraper 290 mm Bladewide 20 mm | SPL Life Science | 90030 | Detach the cell from 24 well plate |
| CF 405S, Succinimidyl Ester | Sigma Aldrich | SCJ4600013 | Blue fluorescent dye for protamine labeling |
| CF 594, Hydrazide | Sigma Aldrich | SCJ4600031 | Deep red fluorescent dye for heparin labeling |
| Centrifuge | Beckman Coulter | Microfuge 22R | |
| Confocal Microscope | Olympus | FV1000 | |
| Dexamethasone | Sigma Aldrich | D4902 | Component of osteogenic growth medium |
| Dextran Desalting Columns | Pierce (Thermo Scientific) | 43230 | |
| DMEM | Gibco | 12320 | |
| BMP-2 Quantikine ELISA Kit | R&D System | DBP200 | Determine BMP-2 release |
| Fetal Bovine Serum FBS | Hyclone | SV30160.03 | |
| Fluoescein Isothiocyananate, Isomer I | Sigma Aldrich | F7250 | Green fluorescent dye for NELL-1 and BMP-2 labeling |
| ThinCert Cell Culture Inserts, For 24 Well plates, Sterile | Greiner | 662630 | Prevents PEC wash out when changing osteogenic medium |
| Havard Appartus Syringe Pump (11 plus) | Havard Apparatus | 70-2208 | |
| n-Hexane (>99%) | Sigma Aldrich | 139386 | |
| Heparin | Sigma Aldrich | H3149 | Binds with osteogenic growth factor with heparin binding domain |
| Hydrochloric acid (37%) | Merck | 100317 | Highly Corrosive |
| Incubator | Binder | C8150 | |
| MicroBCA Protein Assay kit | Thermoscientific | 23235 | |
| Microplate Reader | Tecan | Infinite M200 | For ALP and microBCA assays |
| Nisco cell encapsulator | Nisco Engineering Inc | Encapsulation unit VAR V1 | |
| Fluorescent Microscope | Olympus | IX71 | |
| mPCL-TCP Scaffold (Pore size is 1.3 mm) | Osteopore | PCL-TCP 0/90 | Hold PEC for in vivo study |
| Penicillin-Streptomycin 10,000 unit/ml, 100 ml | Hyclone Cell Culture | SV30010 | Antibiotic |
| 10x Phosphate Buffered Saline (PBS) | Vivantis | PB0344-1L | 10x Solution, Ultra Pure Grade |
| Poly-L-Lysine MW 15,000-30,000 | Sigma Aldrich | P2568 | Polycation |
| Protamine Sulfate salt, from Salmon | Sigma Aldrich | P4020 | Polycation |
| Shaker | Labnet | S2025 | |
| Snakeskin Dialysis Tubing 3,500 MWCO 22 mm x 35 feet | Thermo Fisher Scientific | 68035 | Remove unreacted FITC by dialysis |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Sodium Hydroxide | Qrec | S5158 | |
| Sodium Bicarbonate | US Biological | S4000 | Buffer |
| Sodium carbonate | Sigma Aldrich | S7795-500G | Buffer |
| Strontium Chloride Hexahydrate | Sigma Aldrich | 255521 | Crosslinker for alginate |
| Spatula | 3dia | ||
| 5 ml syringe | Terumo | 140425R | Diameter of syringe affects the flow rate |
| 75 cm2 Cell Culture Flask Canted Neck | Corning | 730720 | |
| Toluidine Blue | Sigma Aldrich | 52040 | Heparin assay |
| Trypsin 1x | Hyclone Cell Culture | SH30042.01 | |
| Sodium alginate | Novamatrix (FMC Biopolymer, Princeton, NJ) | Pronova UPMVG | Core material of microbeads |
참고문헌
- Yuan, W., et al. NELL-1 based demineralized bone graft promotes rat spine fusion as compared to commercially available BMP-2 product. Orthop Sci. 18, 646-657 (2013).
- Anderson, C. L., Whitaker, M. C. Heterotopic ossification associated with recombinant human bone morphogenetic protein-2 (infuse) in posterolateral lumbar spine fusion: a case report. Spine. 37, 502-506 (2012).
- Glassman, S. D., et al. RhBMP-2 versus iliac crest bone graft for lumbar spine fusion: a randomized, controlled trial in patients over sixty years of age. Spine. 33, 2843-2849 (2008).
- Tannoury, C. A., An, H. S. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J. 14, 552-559 (2014).
- Carragee, E. J., Hurwitz, E. L., Weiner, B. K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 11, 471-491 (2011).
- Abbah, S. A., Lam, C. X., Hutmacher, D. W., Goh, J. C., Wong, H. K. Biological performance of a polycaprolactone-based scaffold used as fusion cage device in a large animal model of spinal reconstructive surgery. Biomaterials. 30, 5086-5093 (2009).
- Abbah, S. A., Liu, J., Lam, R. W., Goh, J. C., Wong, H. K. In vivo bioactivity of rhBMP-2 delivered with novel polyelectrolyte complexation shells assembled on an alginate microbead core template. J. Control. Release. 162, 364-372 (2012).
- Wang, M., et al. Polyelectrolyte Complex Carrier Enhances Therapeutic Efficiency and Safety Profile of Bone Morphogenetic Protein-2 in Porcine Lumbar Interbody Fusion Model. Spine. 40, 964-973 (2015).
- Abbah, S. A., Lam, W. M., Hu, T., Goh, J., Wong, H. K. Sequestration of rhBMP-2 into self-assembled polyelectrolyte complexes promotes anatomic localization of new bone in a porcine model of spinal reconstructive surgery. Tissue Eng. Part A. 20, 1679-1688 (2014).
- Hu, T., et al. Novel Protamine-Based Polyelectrolyte Carrier Enhances Low-Dose rhBMP-2 in Posterolateral Spinal Fusion. Spine. 40, 613-621 (2015).
- Hu, J., Hou, Y., Park, H., Lee, M. Beta-tricalcium phosphate particles as a controlled release carrier of osteogenic proteins for bone tissue engineering. J Biomed Mater Res A. 100, 1680-1686 (2012).
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L-Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Li, X., Min, S., Zhao, X., Lu, Z., Jin, A. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology. Biomed Mater. 10, 015002(2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.