Method Article
Microambientes sanduíche-como aproveitarar Telemóveis / interações materiais
Neste Artigo
Resumo
The following protocol describes the procedure to assemble sandwich-like cultures to be used as an intermediate stage between bi-dimensional (2D) and three-dimensional (3D) cellular environments. The engineered systems can have applications in microscopy, biomechanics, biochemistry and cell biology assays.
Resumo
Cultura celular tem sido tradicionalmente realizada em substratos bidimensionais (2D) onde as células aderem utilizando receptores da superfície ventral para biomaterial. No entanto, in vivo, a maioria das células estão completamente rodeados pela matriz extracelular (MEC), resultando numa distribuição (3D) tridimensional dos receptores. Isto pode provocar diferenças de fora para dentro e, assim, as vias de sinalização no comportamento celular.
Este artigo mostra que a estimulação dos receptores de células dorsais já aderiu a um substrato 2D através da sobreposição de uma película de um material novo (uma cultura de tipo sanduíche) provoca alterações importantes no que diz respeito a culturas 2D padrão. Além disso, a excitação simultânea dos receptores ventrais e dorsais desloca o comportamento da pilha mais próxima daquela encontrada em ambientes 3D. Além disso, devido à natureza do sistema, uma cultura de tipo sanduíche é um instrumento versátil, que permite o estudo de diferentes parâmetros em células / material de interactions, por exemplo, topografia, rigidez e diferentes revestimentos proteicos em ambos os lados ventral e dorsal. Finalmente, uma vez que as culturas sanduíche-como são baseados em substratos 2D, vários procedimentos de análise já desenvolvido para as culturas padrão 2D pode ser usado normalmente, superando procedimentos mais complexos necessários para sistemas 3D.
Introdução
Tradicionalmente, a cultura de células foi realizada em substratos (2D) bidimensional, embora a maior parte das micro-ambientes celulares in vivo têm uma natureza (3D) tridimensional. Este ambiente 2D não natural provoca mudanças no comportamento celular como forma de auto-adaptação a um mundo plano, o que impacta diretamente o destino da pilha 1,2. Assim, os resultados obtidos em culturas de células em 2D não são sempre reprodutível in vivo. Isso tem estimulado o desenvolvimento de novos sistemas de cultura relevantes que procuram proporcionar condições mais fisiológico-gostaria de obter mais insights sobre qualquer dependente da dimensão biológica mecanismo de 3,4.
Uma das principais diferenças entre a cultura 2D e 3D no ambiente in vivo, é a distribuição de receptores de células ancorado à matriz extracelular (ECM): Considerando que, em 2D substratos células aderir ventralmente, a maioria das células in vivo estão completamente cercados pela ECM e assim cell adesão ocorre através de uma distribuição de receptores 3D. Isto provoca diferentes vias de sinalização de adesão celular modulando assim processos importantes, tais como o crescimento celular, diferenciação celular e a expressão do gene. Durante as últimas décadas, muitos sistemas de cultura 3D diferentes foram estabelecidas 5-8, apesar de sua variabilidade e complexidade dificultar a sua padronização nos procedimentos de cultura celular comum. Além disso sistemas 3D geralmente não são fáceis de manusear e procedimentos experimentais atuais sobre substratos 2D não pode ser facilmente estabelecido para culturas 3D. Além disso, a literatura raramente compara culturas 3D com a condição 2D equivalente ou outros sistemas 3D, dificultando a compreensão adequada do comportamento das células nestes modelos.
Uma vez tendo as células aderidas sobre um substrato 2D, a excitação dos receptores dorsais - por sobreposição de uma película de um material novo (cultura de tipo sanduíche) - podem desencadear respostas celulares tanto ambientes 3D. A reafilho por trás disto é a activação simultânea de ambos dorsal e ventral receptores para aderir e se espalhar no ambiente sanduíche (Figura 1) 9,10. Como conseqüência, as células sofrem alterações importantes no que diz respeito às culturas 2D 11,12. Deste modo, o destino da célula é determinado durante a montagem por causa da cultura sanduíche, uma vez que a estimulação dorsal provoca alterações nas vias celulares chave. Portanto, o destino da célula é altamente determinado pelo tempo em que a cultura do tipo sanduíche é montado 11.
Devido à natureza do sistema, uma cultura de tipo sanduíche é uma ferramenta simples e versátil, que permite o estudo de diferentes parâmetros em interacções célula / materiais, tais como revestimentos de química, topografia, rigidez e proteína em ambos os lados dorsal e ventral. Isto oferece um maior grau de versatilidade em comparação com outros sistemas 3D (Figura 2), devido ao independente dorsal e ventral combinação de uma grande variety de condições de superfície. Além disso, as diferentes linhas de células e diferentes tempos para montar a cultura tipo sanduíche pode ser estudado, aumentando a largura espectros de possibilidades.
Um protocolo padrão da cultura tipo sanduíche é detalhado abaixo usando poli-L-ácido láctico (PLLA) electrospun fibras ou películas como substratos dorsais, lamela de vidro como substrato ventral e a fibronectina como o revestimento de proteína. Culturas sanduíche-como foram montados logo após semeadura de células ou depois de 3 horas de cultura 2D. No entanto, note que outros sistemas de materiais e proteínas poderia ser usado; Da mesma forma a cultura tipo sanduíche pode ser montado em diferentes pontos de tempo.
Protocolo
1. Produção de dorsais Substratos
- Produção de um filme plano de PLLA por evaporação de solvente.
- Trabalhar em um exaustor para preparar uma solução de 2% (w / v) de PLLA em clorofórmio (2 g PLLA em 100 ml de clorofórmio) agitando à temperatura ambiente (RT) até que esteja completamente dissolvido (cerca de 3 h).
- Coloque as arruelas em uma placa de Petri de vidro.
Nota: O uso anilhas de aço inoxidável com um diâmetro interno de 10,5 mm (um pouco menor do que o diâmetro da amostra ventral), de modo que a anilha é colocada no topo do substrato ventral. Outros materiais, tais como o politetrafluoroetileno (PTFE) ou anilhas de vidro poderiam ser utilizadas como bem. - Adicionar 200 ul da solução de PLLA na máquina de lavar e deixar evaporar lentamente durante 30 min à TA. A fim de permitir a evaporação lenta do solvente, fechar a caixa de Petri com uma folha de alumínio com alguns furos.
- Aquecer as amostras a 120 ° C durante 5 minutos, a fim de evaporar os vestígios de solvente.
- Vamos amostras legal fazerwn à TA.
- Depois de as amostras terem arrefecido (aproximadamente 30 min), cobrir com 18,2 mohms · cm de água na caixa de Petri e incubar durante 8 minutos à temperatura ambiente.
Nota: Se as amostras não são totalmente fria, que pode levar até 18,2 mohms · cm água e adotar um estado elástico. Além disso, a incubação em 18,2 mohms · cm de água para menos de 8 min podem resultar em desprendimento inadequada, e durante mais de 8 min em desprendimento da máquina de lavar. - Com uma lâmina de barbear, retire as anilhas para descascá-los fora da placa de Petri.
- Remover quaisquer imperfeições da borda da arruela com uma pinça e deixar que as amostras de ar seco.
- Armazenar as amostras num excicador sob vácuo (80 mbar) até ao dia da experiência, porque PLLA é degradável por hidrólise.
- Produção de fibras PLLA por electrospinning.
- Trabalhar em um exaustor para preparar uma solução de 8% (w / v) de PLLA em hexafluoroisopropanol (8 g em 100 ml de PLLA hexafluoroisopropanol) por stirrção à TA até dissolução completa (cerca de 3 h).
- Inserir o politetrafluoretileno (PTFE) anilhas numa folha de alumínio ou de um tambor para o electrospinning, a fim de obter, respectivamente, fibras aleatórias ou alinhadas.
Nota: O uso de politetrafluoretileno (PTFE) anilhas com um diâmetro interno de 10,5 mm (um pouco menor do que o diâmetro da amostra ventral), de modo que a anilha é colocada no topo do substrato ventral. Outros materiais, tais como aço inoxidável ou de vidro anilhas podem ser usados também. O cilindro deve rodar a uma velocidade angular de 160,7 seg -1 (raio = 7 cm) de modo a obter fibras alinhadas. Uma velocidade mais lenta pode não provocar alinhamento de fibras e de uma velocidade mais rápida irá resultar em fibras quebradas. - Carregar a seringa com a solução de polímero e colocá-lo sobre a bomba de seringa.
- Electrospin a solução PLLA utilizando uma taxa de fluxo de 0,9 ml / h com uma tensão de 30 kV e uma distância de 12 cm colector.
- Pare o processo de popa electrospinninger 20-30 minutos, uma vez que uma boa densidade de fibra é obtida (uma vez que as células têm de interagir com várias fibras ao mesmo tempo).
- Aquecer as amostras a 120 ° C durante 5 minutos, a fim de evaporar os vestígios de solvente.
- Armazenar as amostras num excicador sob vácuo (80 mbar) até ao dia da experiência, porque PLLA é degradável por hidrólise.
Cultura 2. Sandwich
- Montar a cultura sanduíche-like uma vez células aderidas ao substrato 2D ventral.
- Trabalho em uma capa de cultura para garantir condições estéreis e esterilizar todos os materiais (lamelas de vidro, substratos dorsais, pinças, etc.) por exposição à radiação UV durante 30 min.
- Brasão, a fim substrato ventral e dorsal com fibronectina para dirigir-adesão proteína celular específica. Para fazer isso, incubar as amostras de 20 ug / ml de fibronectina dissolvidos em Solução Salina Tamponada com Fosfato de Dulbecco (DPBS) contendo Ca 2+ e Mg 2+ (200 ^ l / samplo), durante 1 h.
Nota: Devido ao processo de fabrico, os substratos dorsais tem um lado superior e inferior designados porque as fibras de película e electrospun solvente fundido ligado a um dos lados da máquina de lavar. Esta é, portanto, o lado de frente para uma das células (Figura 3).- Depois de o revestimento de proteína, lavar as amostras duas vezes com DPBS, a fim de remover a proteína em excesso. Em seguida, incubar as amostras em DPBS até à sua utilização, a fim de impedir que as amostras de ficar seco uma vez que isso causa desnaturação de proteínas. Utilização DPBS contendo Ca 2+ e Mg 2+ desde catiões divalentes regular o dobramento de proteínas.
- Células de sementes no vidro lamelas 13.
Observação: Como a cultura tipo sanduíche é baseada em substratos 2D, a sementeira de células será efectuada da mesma forma como no exemplo 2D. Por exemplo, C2C12 de mioblastos são semeadas a 17500 células cm -1 para as experiências de diferenciação e de fibroblastos NIH3T3 foram semeadas a 7000 cells cm -1 para culturas isoladas para estudar a morfologia das células e aderência. - Coloque as amostras em estufa a 37 ° C com 5% de CO 2 e permitir que as células aderem ao substrato ventral durante 3 h.
- Colocar o substrato semeado ventral em um poço de uma nova 12 multi-poços (onde anilhas fit).
Nota: Montagem da cultura tipo sanduíche em um novo poço é uma maneira de se livrar das células que aderiram ao fundo do poço após a semeadura uma vez que estes irão consumir nutrientes e segregam factores de crescimento e de resíduos que influenciam células cultivadas dentro do sanduíche-como sistema. Esta é também uma obrigação para extrações celulares, a fim de lisar apenas as células cultivadas dentro do ambiente de tipo sanduíche. - Cuidadosamente e com a ajuda de um par de pinças, sobrepor o substrato dorsal sobre as células. Recarga com meio (1 ml) e incubar a 37 ° C com 5% de CO 2.
Nota: O peso da anilha vai impedir que o sub dorsalestraté de flutuar. - Mudar o meio duas vezes por semana, como em culturas 2D padrão. Não mova o substrato dorsal desde que isso poderia resultar em danos às células.
- Montar a cultura sanduíche-como logo após semeadura de células.
- Trabalho em uma capa de cultura para garantir condições estéreis e esterilizar todos os materiais (lamelas de vidro, substratos dorsais, pinças, etc.) por exposição à radiação UV durante 30 min.
- Brasão, a fim substrato ventral e dorsal com fibronectina para dirigir-adesão proteína celular específica. Para fazer isso, incubar as amostras de 20 ug / ml de fibronectina dissolvidos em DPBS contendo Ca 2+ e Mg 2+ (200 ul / amostra) durante 1 hora.
- Depois de o revestimento de proteína, lavar as amostras duas vezes com DPBS, a fim de remover a proteína em excesso. Em seguida, incubar as amostras em DPBS até à sua utilização, a fim de impedir que as amostras de ficar seco uma vez que isso causa desnaturação de proteínas. Utilização DPBS contendo Ca 2+ e Mg 2+ desde cátions bivalentes regular dobramento de proteínas.
- Semear as células em lamelas de vidro em um poço de um 12 multi-poços (onde arruelas caber). Para fazer isso, use uma suspensão celular altamente concentrado para evitar a perda de células após a colocação do substrato dorsal.
- Cuidadosamente e com a ajuda de um par de pinças, sobrepor o substrato dorsal sobre as células. Recarga com meio (1 ml) e incubar a 37 ° C com 5% de CO 2.
Nota: O peso da anilha vai impedir que o substrato dorsais de flutuação. - Mudar o meio duas vezes por semana, como em culturas 2D padrão.
Nota: Não mova o substrato dorsal desde que isso poderia resultar em danos às células.
3. Análise
Nota: As culturas tipo sanduíche são baseados em substratos 2D, e assim pode ser vulgarmente analisados por procedimentos já desenvolvidos para culturas 2D padrão. Por exemplo, uma vez que é transparente e de PLLA cells são obrigados a mover-se dentro do plano xy, microscopia é feito como em substratos 2D. A migração celular pode ser, por conseguinte, analisada quanto em culturas 2D, sem a necessidade de rastrear as células no eixo z, como para culturas em 3D, o que simplifica a análise de imagem e experiência. Para estudar o ensaio de cicatrização da ferida por um ensaio zero seguir este protocolo:
- Estudo migração celular (ensaio ferida cura) dentro da cultura sanduíche-like.
- Trabalho em uma capa de cultura para garantir condições estéreis e esterilizar todos os materiais (lamelas de vidro, substratos dorsais, pinças, etc.) por exposição à radiação UV durante 30 min.
- Brasão, a fim substrato ventral e dorsal com fibronectina para dirigir-adesão proteína celular específica. Para fazer isso, incubar as amostras de 20 ug / ml de fibronectina dissolvidos em Solução Salina Tamponada com Fosfato de Dulbecco (DPBS) contendo Ca 2+ e Mg 2+, durante 1 h.
- Depois de o revestimento de proteína, lavar as amostras duas vezes com DPBSa fim de remover a proteína em excesso. Em seguida, incubar as amostras em DPBS até à sua utilização, a fim de impedir que as amostras de ficar seco uma vez que isso poderia causar desnaturação da proteína. Utilização DPBS contendo Ca 2+ e Mg 2+ desde catiões divalentes regular o dobramento de proteínas.
- Células de sementes nas lamelas de vidro em uma alta densidade 13.
- Coloque as amostras em estufa a 37 ° C com 5% de CO 2 e permitir que as células atingir a confluência.
- Use uma ponteira a arranhar a monocamada de células, a fim de obter duas populações de células separadas por um espaço.
- Colocar o substrato semeado ventral em um novo bem adequado para a aquisição de lapso de tempo e onde encaixam substratos dorsais (ou seja, 12 placa de multi-cavidades).
- Cuidadosamente e com a ajuda de um par de pinças, sobrepor o substrato dorsal sobre as células e em seguida, encher com meio (1 ml para uma placa de 12 multi-poços).
Nota: O peso da anilha vai impedir que tele dorsal substrato de flutuar. - Colocar a amostra no microscópio de lapso de tempo (ajustado para 37 ° C e 5% de CO 2) e tomar imagens do fechamento do gap a cada 20 minutos.
- Analisar o fechamento do gap utilizando software específico, como o MiToBo plugin ImageJ. 14
Nota: Proteína e extracção de ácido nucleico é realizada de modo semelhante como em substratos 2D. Existe apenas um passo adicional que consiste em desmontar a cultura tipo sanduíche para adicionar o tampão de lise directamente sobre as células, a fim de aumentar a eficiência da extracção. Por exemplo, para extracção de ARNm:
- Extrato de mRNA a partir de culturas Sandwich-like
- Preparar todas as memórias intermédias do kit comercial de acordo com as instruções do fabricante.
- Pegue a cultura sanduíche-como fora da incubadora.
- Remover o meio de cultura das amostras.
- Lavam-se as amostras de uma vez com DPBS contendo Ca2+ e Mg 2+ (1 ml) e remover toda a solução.
- Com a ajuda de um par de pinças, remover o substrato dorsal e adicionar o tampão de lise (350 ul) para o substrato ventral. Overlay novamente o substrato dorsal sobre o substrato ventral, a fim de lisar as células também aderiram ao substrato dorsal.
- Remover o substrato dorsal para isolar a solução de lise.
- Siga as instruções do fabricante para obter o mRNA.
Nota: A imunodetecção das proteínas pode também ser realizada como em substratos 2D. Uma vez que as culturas tipo sanduíche pode impedir a difusão correcta dos anticorpos e tampões, tempos de incubação deve ser aumentada. Além disso, a sanduíche pode ser desmontado, antes de iniciar o protocolo de coloração, mas neste último caso, algumas células a permanecerem ligadas ao substrato dorsal e alguns ao substrato ventral.
- Immunodetect proteínas dentro de uma cultura sanduíche-like
- Lava-se a amostra uma vez com DPBS e fixar com formaldeído a 4% em PBS durante 20 min a 4 ° C.
Nota: substrato dorsal pode ser removido durante o processo de fixação de modo que os problemas de difusão são evitados. - Lavar com DPBS (1 ml) e, em seguida, permeabilizar com 0,5% de Triton X-100 em DPBS (1 ml) durante 5 min à TA.
- Bloquear locais de ligação não específicos com 1% de albumina em DPBS (1 ml) durante 30 min à TA.
- Incubar com anticorpo primário (2 ug / ml; 1 ml) em solução de bloqueio durante 3 h à TA.
- Lavar três vezes durante 10 min com DPBS / 0,5% de Tween 20 (1 mL).
- Incubar 2 h com anticorpos secundários (2 ug / ml) e 1 ug / ml de DAPI em solução (1 ml) à temperatura ambiente de bloqueio.
- Lavar três vezes durante 10 min em DPBS / 0,5% de Tween 20 (1 mL).
- Lavar em DPBS.
Nota: As amostras pode ser montada numa lamela com Vectashield e selado com unha polonês quando substratos dorsal são removidos antes da imunodetecção. - Observar sob a micro fluorescênciaescopo como substratos para 2D padrão.
- Lava-se a amostra uma vez com DPBS e fixar com formaldeído a 4% em PBS durante 20 min a 4 ° C.
Resultados
A estimulação dos receptores dorsais dentro da cultura tipo sanduíche provoca alterações na morfologia celular, a adesão celular e as vias de sinalização intracelulares (por exemplo, quinase de adesão focal, FAK) 10-12. Como um exemplo, os fibroblastos cultivados no sistema de sanduíche do tipo sobre-expressa a subunidade de integrina α 5 em comparação com a 2D, como observado para outras culturas 3D 15,16.
Destino celular é altamente dependente do tempo em que os receptores são estimulados dorsais e pelas propriedades da interacção dorsal, da mesma forma como acontece noutros sistemas 3D, tais como hidrogéis. Por exemplo, os hidrogéis onde as proteínas são fortemente ligadas geralmente mostram células menores e arredondadas com subdesenvolvido citoesqueleto de actina e difundir adesões focais. Isto pode ser mimetizado em um sanduíche-cultura utilizando como substratos que adsorvem fortemente proteínas, de modo que as células não são capazes de reorganizar mecanicamente esta camada de proteínas e células spreading é prejudicada. Da mesma forma, hidrogéis, onde as células podem remodelar a ECM pode ser imitado com o sistema de sanduíche utilizando substratos que adsorvem proteínas mais frouxamente 10.
A estimulação dos receptores dorsal foi mostrado para modular C2C12 destino celular. Dorsal fibras PLLA electrospun alinhamento celular directa quando revestidos com fibronectina, mas não quando revestidos com albumina de soro de bovino (uma proteína não-adesiva). Este resultado aponta células fazem sentido biologicamente e reagir às entradas dorsal (Figura 4) 9. Além disso, as culturas de tipo sanduíche com PLLA plano dorsal desencadeou um aumento no nível de myogenesis. Isto depende também dos dorsais estímulos biológicos vez que a interacção com as proteínas dorsais diferentes resulta em taxas de diferenciação distintos (Figura 5) 9.
A migração celular na cultura tipo sanduíche é também alterada quando comparada com a cultura 2D. Tem seren demonstrado que, em um ensaio de cicatrização de feridas, as células dentro da cultura sanduíche adotar uma morfologia muito alongada e migrar distâncias mais curtas do que em substratos 2D (Filmes 1 e 2). Taxas de migração celular estão, além disso, relacionada com a natureza da ventral e dorsal estimulação 12.
Da mesma forma como no interior de fibronectina e colagénio géis 3D 17,18, cultura tipo sanduíche aumenta mediada por células reorganização ECM (isto é, a fibronectina ventral) no que diz respeito à condição de 2D (Figura 6) 12. Este processo baseia-se os estímulos mecânicos dorsais e estabilidade citoesqueleto uma vez que o uso de inibidores de contractilidade (blebbistatin, Y27632) impediram o processo. Curiosamente, a fibronectina ventral também foi reorganizado quando usando diferentes revestimentos proteicos dorsal (ou seja, vitronectina e albumina de soro bovino) e mesmo se deixados sem revestimento 12.

Figura 1:.. Esboço da norma (2D) e culturas sanduíche-como estimulação dos receptores dorsais dentro da cultura sanduíche-como desencadeia a sinalização de adesão celular adicional que modula processos celulares importantes Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Cultura de tipo sanduíche é um sistema versátil, que permite o estudo de diferentes parâmetros bem controlados (entradas topográficas, rigidez, gradientes ...) em ambos os substratos ventral e dorsal.
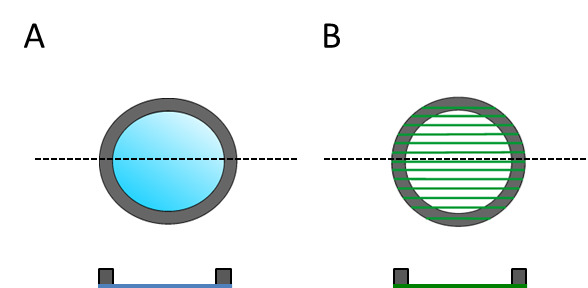
Figura 3:. Substratos dorsais são esboçados para a parte superior e vista em corte transversal, a fim de mostrar que tem uma parte superior e designada lado inferior (A) de filme Plano PLLA e (B) electrospun fibras.

Figura 4:. C2C12 morfologia sob diferentes condições de cultura incluindo plano (P) e fibras alinhadas (a) de PLLA que foram usadas como ventral (subscrito) ou dorsal (sobrescritos) substratos linhas a tracejado representam, fibras de orientação sempre que necessário. Células cultivadas no substrato avião e cobertas com fibras alinhadas de PLLA (SW p a) detectam os estímulos dorsais. Particularmente, as células sentir as fibras dorsais quando revestidas com fibronectina, mas não quando revestidos wipo de albumina de soro de bovino (uma proteína não-adesiva). Consequentemente as células aderir às fibras revestidas com fibronectina e alinhar na mesma direcção. Imagem adaptada de referência 9. Por favor clique aqui para ver uma versão maior desta figura.
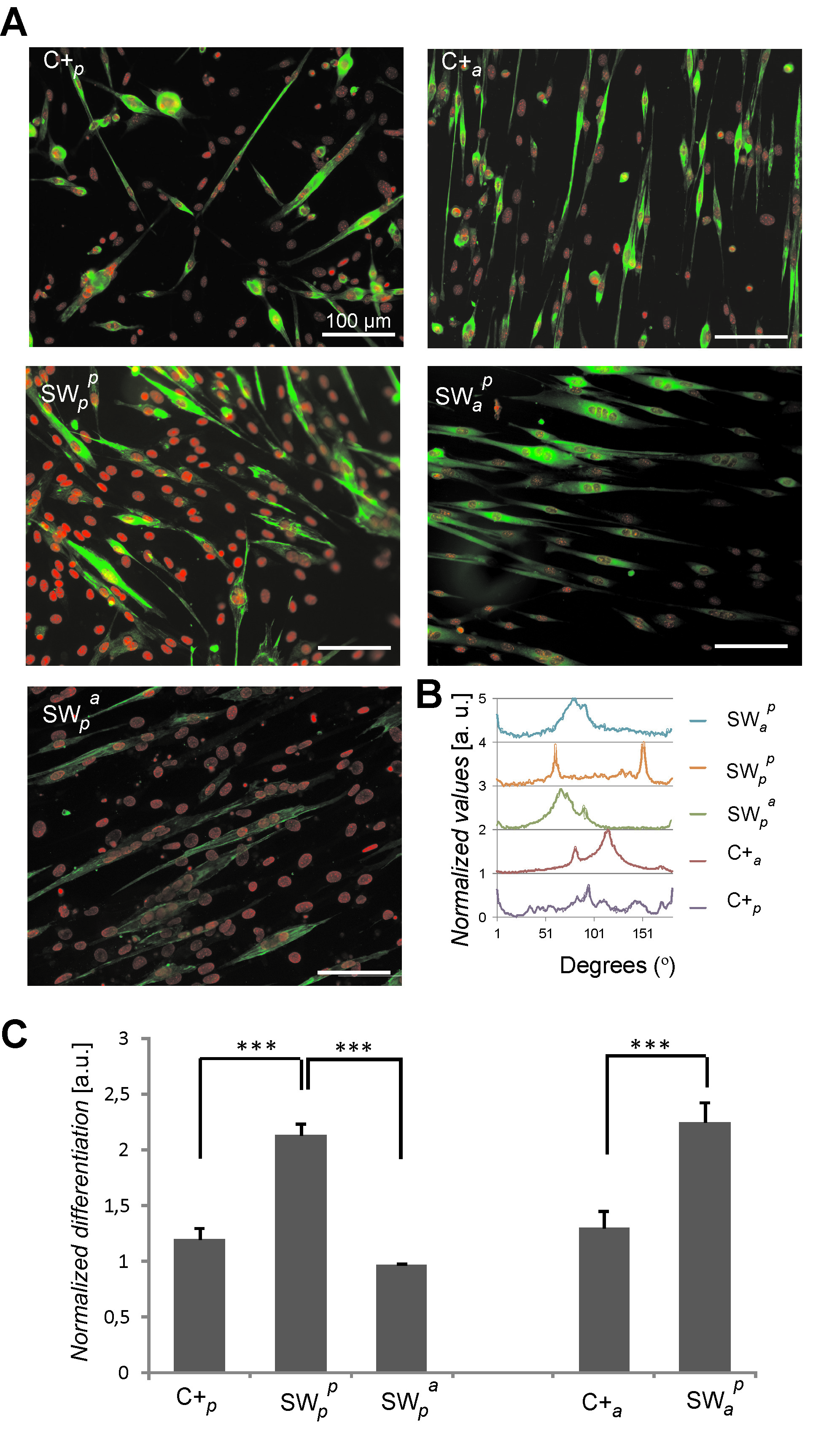
Figura 5: a diferenciação celular em culturas de tipo sanduíche após 4 dias em meio de diferenciação. Diferentes condições de cultura foram analisados incluindo plano (P) e fibras alinhadas (a) de PLLA que foram usadas como ventral (subscrito) ou dorsal (sobrescrito) substratos. As amostras foram revestidas com fibronectina em todos os casos. (A) coloração de fluorescência que mostra células miosina sarcomérica positivos (verde) e núcleos de células (vermelho). (B) Diferenciadocélulas de orientação tal como calculado por Transformada Rápida de Fourier. (C) miogênese como determinada pela percentagem de células de miosina-positivo sarcoméricas. Os dados são normalizados para o controle padrão-ouro. Diferenças estatisticamente significativas são indicadas com *** P <0,001. Imagem adaptada de referência 9. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: Reorganização de fibronectina ventral. Cultura Sandwich desencadeia ventral reorganização FN através da formação de novas fibras de fibronectina (rotulagem escova-like; apontou com setas brancas). Fibronectina Ventral é reorganizada dentro de culturas tipo sanduíche com revestimento diferente proteína dorsal (fibronectina, vitronectina e albumina de soro bovino)ou mesmo quando o substrato dorsal é deixados sem revestimento. Citoesqueleto de actina (verde), núcleos (azul) e FN (vermelho) são mostrados. Por favor clique aqui para ver uma versão maior desta figura.
Filme 1: migração celular em 2D. L929 de fibroblastos migrando em um fibronectina revestido lamela de vidro em uma ferida ensaio de cura. As imagens foram adquiridas durante 16 h (com uma moldura feita a cada 20 minutos). Por favor clique aqui para ver este vídeo.
Filme 2:. A migração celular na cultura de tipo sanduíche L929 de fibroblasto de migrar em um ensaio de cicatrização da ferida dentro de uma cultura de tipo sanduíche foram o substrato ventral foi uma lamela de vidro revestidas a fibronectina e o substrato uma película dorsal de PLLA revestidas a fibronectina. As imagens foram adquiridas durante 16 h (com uma estrutura feita a cada 20 min). Por favor clique aqui para ver este vídeo.
Discussão
Hoje em dia, a cultura 3D é um tópico importante para a indústria farmacêutica e biotecnológica, bem como a investigação em biologia celular, incluindo câncer e células-tronco. Como consequência têm sido desenvolvidos vários sistemas de cultura 3D. Infelizmente, as diferenças entre os sistemas 3D normalmente resultar em um comportamento célula diferente, dificultando a compreensão do destino da célula. Além disso, os procedimentos experimentais geralmente não são tão simples quanto para sistemas de cultura 2D. Por isso o desenvolvimento de novos sistemas de cultura que procuram ultrapassar algumas destas desvantagens é altamente importante.
Sandwich-cultura como foi mostrado para influenciar fortemente os processos celulares importantes, tais como a diferenciação celular, a morfologia celular, a sinalização celular e migração das células. Além disso células compartilham semelhanças com células cultivadas em sistemas 3D, apoiando a afirmação de que a cultura sanduíche-como liga 2D com sistemas de cultura 3D. Tecidos fisiológicas têm poros na gama de 3 a 14 μm essa restrição células e, portanto, influenciar processos celulares como a migração. Isto é de alguma forma recapitulou usando o sistema de tipo sanduíche como dorsal e ventral estímulos representam por si só um ambiente restrito, que limita a morfologia celular e vai necessariamente influenciar a migração celular, independentemente dos revestimentos proteicos.
Devido à estimulação simultânea de dorsal e ventral receptores, cultura tipo sanduíche é uma tecnologia robusta para investigar o papel da dimensionalidade no comportamento das células. Além disso, uma vez que é baseada em substratos 2D, este sistema de cultura é altamente versátil para estudar diferentes propriedades do material e entradas de ECM, permitindo o estudo do comportamento das células em diferentes microambientes. Além do mais, a influência do tempo em que os receptores são dorsais estimulados sobre o destino da célula pode ser investigada através da sobreposição do substrato dorsal em diferentes pontos de tempo. Assim, ao contrário de outros sistemas 3D, o sistema sanduíche-como fornece um amplo espectrode bem controlada microambientes celulares. Por conseguinte, o sistema de tipo sanduíche é uma plataforma de cultura de células interessante para imitar diferentes ambientes fisiológicos, a fim de estudar a biologia celular e o destino da célula de ensaio sob diferentes condições de cultura.
Como mencionado anteriormente, uma vantagem deste sistema é que diferentes substratos ventral e dorsal pode ser estudado pela utilização de revestimentos de proteína diferentes. Portanto, os parâmetros importantes para o destino celular, tais como densidade de ligando pode ser ajustado por controlo da densidade de ligando de cada um dos substratos utilizados 2D (por exemplo, substratos ventral e dorsal). No entanto, note que diferentes substratos podem precisar de alterações no protocolo. Por exemplo, usando substratos dorsais maiores podem resultar na necessidade de ajustar o tempo de incubação adequado para descascar as amostras para fora da placa de Petri. Da mesma forma, os substratos ventrais maiores pode resultar em áreas hipóxicas no centro da amostra, devido à permeabilidade limitada de oxigénio do ventralsubstrato (devido à lamela de vidro). Além disso, os procedimentos de análise irá depender das propriedades do substrato. Por exemplo, utilizando os substratos opacos dorsais irá dificultar protocolos padrão de microscopia embora ainda permitirá proteína / extracção de ácidos nucleicos. Outro factor chave é a permeabilidade do substrato dorsal vez que as células devem ser autorizados a obter nutrientes do meio e descarte de resíduos.
Para resumir, uma cultura sanduíche-como é um sistema simples que oferece a possibilidade de imitar diferentes microambientes 3D-like para investigar o destino da pilha.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The support from ERC through HealInSynergy (306990) and the FPU program AP2009-3626 are acknowledged.
Materiais
| Name | Company | Catalog Number | Comments |
| Ploy(lactic acid) | NatureWorks | 4042D | Reagent |
| Cover glasses (12 mmØ) | Marienfeld | 631-0666 | Equipment |
| Chloroform | Scharlab | CL0200 | Reagent |
| 1,1,1,3,3,3-Hexafluoro-2-propanol (HFIP) | Sigma | 105228 | Reagent |
| Syringe (1 ml) | Henke Sass Wolf | 4010-200V0 | Equipment |
| Syringe pump | New Era Pump Systems | NE1000 | Equipment |
| High Voltage DC Power Supply | Glassman High Voltage | Series FC | Equipment |
| Incubator | Hucoa-Herlös | 3111 | Equipment |
| Laminar flow hood | Telstar | AV30/70 | Equipment |
| Human Fibronectin | Sigma | F2006 | Reagent |
| RNeasy Micro Kit | Qiagen | 74004 | Reagent |
| Inverted microscope | Leica Microsystems | DMI 6000 | Equipment |
| Triton X-100 | Sigma-Aldrich | T8787 | Reagent |
| Albumin | Sigma-Aldrich | A7409 | Reagent |
| Tween 20 | Sigma-Aldrich | P2287 | Reagent |
Referências
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. 125 (Pt 13), 3015-3024 (2012).
- Weiss, P. Rev. Mod. Phys. 31 (1), 11-20 (1959).
- Ruffner, H., Lichtenberg, J. 3D cell culture systems--towards primary drug discovery platforms: an interview with Heinz Ruffner (Novartis) and Jan Lichtenberg (InSphero). Biotechnol J. 7 (7), 833-834 (2012).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Wolf, K., et al. Compensation mechanism in tumor cell migration: mesenchymal-amoeboid transition after blocking of pericellular proteolysis. J Cell Biol. 160 (2), 267-277 (2003).
- Schor, S. L., et al. A novel 'sandwich' assay for quantifying chemo-regulated cell migration within 3-dimensional matrices: wound healing cytokines exhibit distinct motogenic activities compared to the transmembrane assay. Cell Motil Cytoskeleton. 63 (5), 287-300 (2006).
- Lee, E. J., Hwang, C. M., Baek, D. H., Lee, S. H. Fabrication of microfluidic system for the assessment of cell migration on 3D micropatterned substrates. Conf Proc IEEE Eng Med Biol Soc. 2009 (2009), 6034-6037 (2009).
- Zaman, M. H., et al. Migration of tumor cells in 3D matrices is governed by matrix stiffness along with cell-matrix adhesion and proteolysis. Proc Natl Acad Sci U S A. 103 (29), 10889-10894 (2006).
- Ballester-Beltrán, J., Lebourg, M., Salmerón-Sánchez, M. Dorsal and ventral stimuli in sandwich-like microenvironments. Effect on cell differentiation. Biotechnol Bioeng. 110 (11), 3048-3058 (2013).
- Ballester-Beltrán, J., Lebourg, M., Moratal, D., Salmerón-Sánchez, M. Fibronectin-matrix sandwich-like microenvironments to manipulate cell fate. Biomater. Sci. 2 (3), 381-389 (2014).
- Ballester-Beltrán, J., Lebourg, M., Rico, P., Salmerón-Sánchez, M. Dorsal and ventral stimuli in cell-material interactions: effect on cell morphology. Biointerphases. 7 (1-4), 39(2012).
- Ballester-Beltrán, J., Lebourg, M., Rico, P., Salmerón-Sánchez, M. Cell migration within confined sandwich-like nanoenvironments. Nanomedicine. , (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Passaging Cells. J. Vis. Exp. , (2015).
- Glaß, M., et al. Cell Migration Analysis: Segmenting Scratch Assay Images with Level Sets and Support Vector Machines. Pattern Recogn. 45 (9), 3154-3165 (2012).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Huebsch, N., Arany, P. R., Mao, A. S., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Petrie, R. J., Gavara, N., Chadwick, R. S., Yamada, K. M. Nonpolarized signaling reveals two distinct modes of 3D cell migration. J Cell Biol. 197 (3), 439-455 (2012).
- Mao, Y., Schwarzbauer, J. E. Stimulatory effects of a three-dimensional microenvironment on cell-mediated fibronectin fibrillogenesis. J Cell Sci. 118 (Pt 19), 4427-4436 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados