Method Article
Microambienti sandwich di sfruttare Cellulari / Materiale Interazioni
In questo articolo
Riepilogo
The following protocol describes the procedure to assemble sandwich-like cultures to be used as an intermediate stage between bi-dimensional (2D) and three-dimensional (3D) cellular environments. The engineered systems can have applications in microscopy, biomechanics, biochemistry and cell biology assays.
Abstract
Colture cellulari è stata tradizionalmente effettuata su substrati bi-dimensionali (2D) in cui le cellule aderiscono con recettori ventrali alla superficie biomateriale. Tuttavia in vivo, la maggior parte delle cellule sono completamente circondati dalla matrice extracellulare (ECM), risultando in un tridimensionale (3D) distribuzione dei recettori. Questo può innescare differenze nella outside-in vie di segnalazione e quindi nel comportamento delle cellule.
Questo articolo dimostra che la stimolazione dei recettori dorsali di cellule già aderito ad un substrato 2D sovrapponendo una pellicola di un nuovo materiale (una coltura a sandwich) innesca modifiche importanti rispetto a culture 2D standard. Inoltre, l'eccitazione contemporanea dei recettori ventrale e dorsale sposta comportamento delle cellule più vicina a quella che si trova in ambienti 3D. Inoltre, a causa della natura del sistema, una cultura sandwich è uno strumento versatile che permette lo studio di diversi parametri di cella / materiale interactions, ad esempio, la topografia, la rigidità e diversi rivestimenti di proteine su entrambi i lati ventrale e dorsale. Infine, dal momento che le culture sandwich si basano su substrati 2D, diverse procedure di analisi già sviluppati per le culture 2D standard, può essere utilizzato normalmente, superando le procedure più complesse necessarie per i sistemi 3D.
Introduzione
Tradizionalmente, coltura cellulare è stata effettuata su (2D) substrati bi-dimensionali, anche se la maggior parte dei microambienti cellulari in vivo hanno un (3D) natura tridimensionale. Questo ambiente 2D innaturale provoca cambiamenti nel comportamento delle cellule, come un modo di auto-adattamento ad un mondo piatto, che influenza direttamente il destino della cellula 1,2. Pertanto, i risultati ottenuti su colture cellulari 2D non sono sempre riproducibili in vivo. Ciò ha favorito lo sviluppo di nuovi sistemi di coltura interessati cercano di fornire condizioni più fisiologiche simili per ottenere ulteriori approfondimenti qualsiasi meccanismo biologico 3,4 dimensione-dipendente.
Una delle principali differenze tra la cultura 2D e 3D in ambiente vivo è la distribuzione dei recettori cellulari ancorate alla matrice extracellulare (ECM): considerando che il 2D substrati cellule aderiscono ventralmente, la maggior parte delle cellule in vivo sono completamente circondato dal ECM e quindi cell adesione avviene attraverso una distribuzione 3D dei recettori. Questo innesca diverse vie di segnalazione di adesione delle cellule che modulano in tal modo i processi importanti, come la crescita cellulare, la differenziazione cellulare e l'espressione genica. Nel corso degli ultimi decenni, molti diversi sistemi di coltura 3D sono stati stabiliti 5-8, anche se la loro variabilità e complessità ostacolano la loro standardizzazione delle procedure di coltura delle cellule comune. Inoltre sistemi 3D di solito non sono facili da gestire e le attuali procedure sperimentali su supporti 2D non possono essere facilmente stabiliti per le culture 3D. Inoltre, la letteratura a confronto raramente culture 3D con la condizione 2D equivalente o altri sistemi 3D, ostacolando la corretta comprensione del comportamento delle cellule in questi modelli.
Una volta che le cellule aventi aderito su un substrato 2D, l'eccitazione dei recettori dorsali - sovrapponendo una pellicola di un nuovo materiale (coltura a sandwich) - può innescare risposte cellulari simili ambienti 3D. La reafiglio di questo è l'attivazione simultanea di entrambi dorsale e ventrale recettori di aderire e diffondere all'interno dell'ambiente panino (Figura 1) 9,10. Di conseguenza, le cellule subiscono cambiamenti rilevanti rispetto alle colture 2D 11,12. Così, il destino della cellula è determinata durante il montaggio a causa della cultura panino, poiché la stimolazione dorsale provoca variazioni percorsi cellulari chiave. Pertanto, il destino cellulare è fortemente determinato dal tempo in cui la coltura a sandwich è assemblato 11.
A causa della natura del sistema, una cultura sandwich è uno strumento semplice e versatile che consente lo studio dei parametri differenti nelle interazioni cellula / materiale come rivestimenti chimica, topografia, rigidità e proteine ad entrambi i lati ventrale e dorsale. Ciò offre un maggior grado di flessibilità rispetto ad altri sistemi 3D (Figura 2) a causa dorsale indipendente e combinazione ventrale un'ampia variety delle condizioni della superficie. Inoltre, diverse linee cellulari e tempi diversi per assemblare la coltura a sandwich possono essere studiati, aumentando l'ampio spettro di possibilità.
Un protocollo standard della cultura sandwich è di seguito utilizzando poli-L-lattico (PLLA) fibre elettrofilate o film come substrati dorsali, vetrino di vetro come substrato ventrale e fibronectina come rivestimento proteico. Culture sandwich sono stati assemblati subito dopo la semina delle cellule o dopo 3 ore di coltura 2D. Si noti tuttavia che potrebbero essere utilizzati altri sistemi di materiali e proteine; analogamente la cultura sandwich può essere montato a tempi diversi.
Protocollo
1. Produzione di dorsali Substrati
- Produzione di un film piano di PLLA per colata solvente.
- Lavorare in una cappa aspirante per preparare una soluzione di 2% (w / v) PLLA in cloroformio (2 g PLLA in 100 ml di cloroformio) agitando a temperatura ambiente (RT) fino a completa dissoluzione (3 ore circa).
- Mettere le rondelle su una piastra di Petri di vetro.
Nota: Usare rondelle in acciaio inossidabile con un diametro interno di 10,5 mm (leggermente inferiore al diametro del campione ventrale) in modo che la rondella è posto sulla parte superiore del substrato ventrale. Altri materiali quali politetrafluoroetilene (PTFE) o lavabicchieri possono essere usati pure. - Aggiungere 200 microlitri della soluzione di PLLA nella lavatrice e far evaporare lentamente per 30 minuti a RT. Per consentire lenta evaporazione del solvente, chiudere la piastra di Petri con un foglio di alluminio con alcuni fori.
- Riscaldare i campioni a 120 ° C per 5 minuti in modo da far evaporare tracce di solvente.
- Lasciate che i campioni fresca fannown a RT.
- Una volta che i campioni si sono raffreddati (30 min circa), coprire con 18,2 MW · cm di acqua nella scatola di Petri e incubare per 8 minuti a temperatura ambiente.
Nota: Se i campioni non sono completamente raffreddate, possono richiedere fino 18,2 MW · cm di acqua e adottare uno stato gommoso. Inoltre, incubando a 18,2 M · cm di acqua per meno di 8 min può provocare il distacco improprio, e per più di 8 min nel distacco dalla lavatrice. - Con una lama di rasoio, leva le rondelle di toglierle la piastra di Petri.
- Rimuovere eventuali imperfezioni dal bordo della rondella con le pinzette e lasciare che i campioni di aria secca.
- Conservare i campioni in un essiccatore sotto vuoto (80 mbar) fino al giorno dell'esperimento perché PLLA è degradabile per idrolisi.
- Produzione di fibre PLLA da electrospinning.
- Lavorare in una cappa aspirante per preparare una soluzione di 8% (w / v) PLLA in esafluoroisopropanolo (8 g PLLA in 100 ml esafluoroisopropanolo) da stirring a RT fino a completa dissoluzione (3 ore circa).
- Posizionare il politetrafluoroetilene (PTFE) rondelle su un foglio di alluminio o su un tamburo per la electrospinning per ottenere fibre casuale o allineate rispettivamente.
Nota: Utilizzare politetrafluoroetilene (PTFE) rondelle con diametro interno di 10,5 mm (leggermente inferiore al diametro del campione ventrale) in modo che la rondella è posto sulla parte superiore del substrato ventrale. Altri materiali quali rondelle in acciaio inossidabile o di vetro possono essere usati pure. Il tamburo deve ruotare ad una velocità angolare di 160,7 sec -1 (raggio = 7 cm) in modo da ottenere fibre allineate. Una velocità più bassa può non innescare allineamento delle fibre e di velocità comporta fibre rotte. - Caricare la siringa con la soluzione di polimero e posizionarlo sulla pompa a siringa.
- Electrospin soluzione PLLA utilizzando una portata 0,9 ml / h con una tensione di 30 kV e una distanza di collettore di 12 cm.
- Arrestare il processo electrospinning poppaer 20-30 min, una volta una buona densità di fibra è ottenuta (poiché le cellule devono interagire con più fibre contemporaneamente).
- Riscaldare i campioni a 120 ° C per 5 minuti in modo da far evaporare tracce di solvente.
- Conservare i campioni in un essiccatore sotto vuoto (80 mbar) fino al giorno dell'esperimento perché PLLA è degradabile per idrolisi.
Culture 2. Sandwich
- Montare la cultura sandwich volta che le cellule sono rispettate supporto 2D ventrale.
- Lavorare in una cappa coltura per garantire condizioni di sterilità e sterilizzare tutti i materiali (vetrini, substrati dorsali, pinzette, ecc) in caso di esposizione ai raggi UV per 30 min.
- Cappotto il substrato ventrale e dorsale con fibronectina per dirigere specifiche adesione cellulare di proteine. Per fare questo, incubare i campioni in 20 mg / ml di fibronectina disciolti in Dulbecco Phosphate-Buffered Saline (DPBS) contenente Ca 2+ e Mg 2+ (200 pl / sampio) per 1 ora.
Nota: A causa del processo di fabbricazione, substrati dorsali hanno uno designato lati superiore e inferiore perché le fibre film e elettrofilate solvente fusa attaccati ad uno dei lati della rondella. Questo lato è quindi quello rivolto verso le cellule (Figura 3).- Dopo il rivestimento proteico, lavare i campioni due volte con DPBS per rimuovere proteine in eccesso. Poi incubare campioni in DPBS fino al loro utilizzo per evitare di ottenere campioni secco poiché questo provoca proteina denaturalizzazione. Utilizzare DPBS contenenti Ca 2+ e Mg 2+ da cationi bivalenti regolano ripiegamento delle proteine.
- Cellule seme sul vetro coprioggetto 13.
Nota: Siccome la cultura sandwich si basa su substrati 2D, semina cellulare sarà effettuata allo stesso modo come su un campione 2D. Ad esempio, C2C12 mioblasti vengono seminate a 17.500 cellule cm -1 per esperimenti di differenziazione e NIH3T3 fibroblasti vengono seminate a 7000 cells cm -1 per le culture isolate per studiare la morfologia delle cellule e l'adesione. - Porre i campioni in un incubatore a 37 ° C con 5% di CO 2 e consentono alle cellule di aderire al substrato ventrale per 3 ore.
- Posizionare il substrato seminato ventrale in un nuovo pozzo di una piastra 12 multi-pozzo (dove le rondelle).
Nota: Assemblaggio cultura sandwich in un nuovo pozzo è un modo per eliminare le cellule che hanno aderito al fondo del pozzo dopo la semina poiché possono consumare nutrienti e secernere fattori di crescita e rifiuti che influenzano le cellule coltivate all'interno sandwich sistema. Questo è anche un must per estrazioni cellulari per lisare solo le cellule coltivate all'interno dell'ambiente sandwich. - Attenzione e con l'aiuto di un paio di pinzette, sovrapporre il substrato dorsale sulle cellule. Riempire con prodotto (1 ml) e incubare a 37 ° C con 5% di CO 2.
Nota: Il peso della rondella impedirà il sub dorsalistrare da galleggiante. - Cambia il mezzo due volte alla settimana, come nelle culture 2D standard. Non spostare il substrato dorsale in quanto ciò potrebbe causare danni alle cellule.
- Montare la cultura sandwich appena dopo la semina delle cellule.
- Lavorare in una cappa coltura per garantire condizioni di sterilità e sterilizzare tutti i materiali (vetrini, substrati dorsali, pinzette, ecc) in caso di esposizione ai raggi UV per 30 min.
- Cappotto il substrato ventrale e dorsale con fibronectina per dirigere specifiche adesione cellulare di proteine. Per fare questo, incubare i campioni in 20 ug / ml di fibronectina disciolti in DPBS contenenti Ca 2+ e Mg 2+ (200 microlitri / campione) per 1 ora.
- Dopo il rivestimento proteico, lavare i campioni due volte con DPBS per rimuovere proteine in eccesso. Poi incubare campioni in DPBS fino al loro utilizzo per evitare di ottenere campioni secco poiché questo provoca proteina denaturalizzazione. Utilizzare DPBS contenenti Ca 2+ e Mg 2+ da cationi bivalenti regolano ripiegamento delle proteine.
- Cellule seme su vetrini in un pozzetto di una piastra 12 multi-pozzo (dove rondelle adatte). Per fare questo, utilizzare una sospensione cellulare altamente concentrato per evitare perdita di cellule dopo la posa del substrato dorsale.
- Attenzione e con l'aiuto di un paio di pinzette, sovrapporre il substrato dorsale sulle cellule. Riempire con prodotto (1 ml) e incubare a 37 ° C con 5% di CO 2.
Nota: Il peso della rondella impedirà substrato dorsale dal galleggiante. - Cambia il mezzo due volte alla settimana, come nelle culture 2D standard.
Nota: non spostare il substrato dorsale poiché ciò potrebbe causare danni alle cellule.
3. Analisi
Nota: le culture a sandwich si basano su substrati 2D, e quindi può essere comunemente analizzati con procedure già sviluppate per le culture 2D standard. Ad esempio, poiché PLLA è trasparente e cells sono costretti a spostarsi all'interno del piano xy, microscopia avviene come su substrati 2D. La migrazione cellulare può essere quindi analizzato come per culture 2D, senza la necessità di tracciare cellule in asse z come per culture 3D, che semplifica l'analisi dell'esperimento e l'immagine. Per studiare il saggio guarigione della ferita da un saggio di zero seguire questo protocollo:
- La migrazione di studio delle cellule (ferita saggio di guarigione), all'interno della cultura sandwich.
- Lavorare in una cappa coltura per garantire condizioni di sterilità e sterilizzare tutti i materiali (vetrini, substrati dorsali, pinzette, ecc) in caso di esposizione ai raggi UV per 30 min.
- Cappotto il substrato ventrale e dorsale con fibronectina per dirigere specifiche adesione cellulare di proteine. Per fare questo, incubare i campioni in 20 mg / ml di fibronectina disciolti in Dulbecco Phosphate-Buffered Saline (DPBS) contenente Ca 2+ e Mg 2+ per 1 ora.
- Dopo il rivestimento proteico, lavare i campioni due volte con DPBSal fine di rimuovere la proteina in eccesso. Poi incubare campioni in DPBS fino al loro utilizzo per evitare di ottenere campioni secco poiché questo potrebbe causare proteine denaturalizzazione. Utilizzare DPBS contenenti Ca 2+ e Mg 2+ da cationi bivalenti regolano ripiegamento delle proteine.
- Cellule seme sui vetrini in una alta densità 13.
- Porre i campioni in un incubatore a 37 ° C con 5% di CO 2 e consentono alle cellule di raggiungere confluenza.
- Utilizzare un puntale a graffiare il monostrato cellulare, al fine di ottenere 2 popolazioni cellulari separati da uno spazio.
- Posizionare il substrato seminato ventrale in un nuovo pozzo adatto per l'acquisizione time-lapse e dove i substrati dorsali in forma (cioè 12 piastra multi-bene).
- Attenzione e con l'aiuto di un paio di pinzette, sovrapporre il substrato dorsale sulle cellule e poi riempire con terreno (1 ml per una piastra 12 multi-pozzo).
Nota: Il peso della rondella impedirà tegli dorsale supporto a partire da galleggiante. - Porre il campione nel microscopio time-lapse (impostato a 37 ° C e 5% di CO 2) e prendere le immagini della chiusura del gap ogni 20 min.
- Analizzare la chiusura del gap utilizzando un software specifico come il MiToBo plugin dal ImageJ. 14
Nota: Proteine e estrazione degli acidi nucleici avviene allo stesso modo come su substrati 2D. C'è solo un ulteriore passaggio che consiste nello smontare la coltura a sandwich per aggiungere il tampone di lisi direttamente sulle cellule al fine di aumentare l'efficienza di estrazione. Ad esempio, per l'estrazione di mRNA:
- Estratto mRNA da culture sandwich
- Preparare tutti i buffer dal kit commerciale secondo le istruzioni del produttore.
- Prendere la cultura sandwich fuori dal termostato.
- Rimuovere il terreno di coltura dai campioni.
- Lavare i campioni una volta con DPBS contenente Ca2+ e Mg 2+ (1 ml) e rimuovere tutta la soluzione.
- Con l'aiuto di un paio di pinzette, rimuovere il substrato dorsale e aggiungere la soluzione tampone di lisi (350 microlitri) al substrato ventrale. Sovrapporre nuovo substrato dorsale sul substrato ventrale per lisare le cellule anche aderito al substrato dorsale.
- Rimuovere il substrato dorsale per isolare la soluzione di lisi.
- Seguire le istruzioni del produttore per ottenere il mRNA.
Nota: immunorilevazione delle proteine può essere eseguita anche su substrati come 2D. Dal momento che le culture sandwich potevano ostacolare la corretta diffusione degli anticorpi e buffer, tempi di incubazione dovrebbero essere aumentati. Inoltre, il sandwich può essere smontato prima di avviare il protocollo di colorazione, ma in quest'ultimo caso alcune cellule rimarrà attaccato al substrato dorsale e alcuni al substrato ventrale.
- Proteine Immunodetect all'interno di una cultura sandwich
- Lavare il campione una volta con DPBS e fissare con formaldeide al 4% in PBS per 20 minuti a 4 ° C.
Nota: substrato dorsale può essere rimosso durante il processo di fissazione in modo da evitare problemi di diffusione. - Risciacquare con DPBS (1 ml) e quindi permeabilize con 0,5% Triton X-100 in DPBS (1 ml) per 5 minuti a temperatura ambiente.
- Bloccare non specifici siti di legame con 1% di albumina in DPBS (1 ml) per 30 minuti a RT.
- Incubare con l'anticorpo primario (2 mg / ml; 1 ml) in soluzione di bloccaggio per 3 ore a temperatura ambiente.
- Lavare 3 volte per 10 min con DPBS / 0,5% Tween 20 (1 ml).
- Incubare 2 hr con anticorpi secondari (2 mg / ml) e 1 mg / ml DAPI in una soluzione bloccante (1 ml) a temperatura ambiente.
- Lavare 3 volte per 10 minuti in DPBS / 0,5% Tween 20 (1 ml).
- Lavare in DPBS.
Nota: I campioni possono essere montati su una diapositiva con Vectashield e sigillati con smalto quando i substrati dorsali vengono rimossi prima della immunolocalizzazione. - Osservare sotto la micro fluorescenzacampo di applicazione per supporti 2D standard.
- Lavare il campione una volta con DPBS e fissare con formaldeide al 4% in PBS per 20 minuti a 4 ° C.
Risultati
La stimolazione dei recettori dorsali all'interno della cultura sandwich innesca cambiamenti nella morfologia cellulare, adesione cellulare e vie di segnalazione intracellulare (ad es chinasi di adesione focale, FAK) 10-12. Come esempio, colture di fibroblasti nel sistema sandwich overexpressed la α 5 integrina subunità rispetto al 2D, come osservato per altre culture 3D 15,16.
Destino cellulare è strettamente dipendente dal tempo in cui i recettori dorsali vengono stimolati e dalle proprietà dell'interazione dorsale, allo stesso modo come accade in altri sistemi 3D quali idrogel. Ad esempio, gli idrogel dove le proteine sono strettamente legate di solito mostrano celle più piccole e arrotondate con sottosviluppato actina citoscheletro e diffondono adesioni focali. Questo può essere imitate in sandwich di coltura utilizzando substrati adsorbono proteine ermeticamente, in modo che le cellule non sono in grado di riorganizzare meccanicamente questo strato di proteine e sprea celluleding è ostacolato. Allo stesso modo, gli idrogel dove le cellule possono rimodellare la ECM possono essere imitate con il sistema a sandwich utilizzando substrati adsorbono proteine più liberamente 10.
La stimolazione dei recettori dorsali ha dimostrato di modulare destino cellulare C2C12. Dorsale fibre PLLA elettrofilate allineamento delle celle diretta rivestiti con fibronectina, ma non rivestiti con albumina sierica bovina (una proteina non adesivo). Questo risultato indica cellule fanno senso biologicamente e reagiscono agli ingressi dorsali (Figura 4) 9. Inoltre, culture sandwich con PLLA piano dorsale innescato un aumento del livello di miogenesi. Questo dipende anche dalle stimoli biologici dorsali poiché l'interazione con proteine dorsali risultati diversi tassi differenziazione distinti (Figura 5) 9.
La migrazione cellulare all'interno della cultura sandwich è anche alterata rispetto alla cultura 2D. Ha essereen dimostrato che in un saggio di guarigione, cellule all'interno della cultura panino adottano una morfologia altamente allungata e migrano distanze più brevi che su substrati 2D (Video 1 e 2). Tassi di migrazione cellulare sono inoltre legati alla natura del ventrale e dorsale stimolazione 12.
Allo stesso modo come all'interno 3D fibronectina e collagene gel 17,18, cultura sandwich aumenta cellulo-mediata ECM riorganizzazione (cioè la fibronectina ventrale) rispetto alla condizione 2D (Figura 6) 12. Questo processo si basa sulle dorsali stimoli meccanici e stabilità citoscheletro quanto l'uso di inibitori della contrattilità (blebbistatin, Y27632) impedite il processo. È interessante notare che la fibronectina ventrale è stata anche riorganizzata quando si usano diversi rivestimenti proteici dorsale (cioè vitronectina e siero bovino albumina) e anche se lasciato non patinata 12.

Figura 1:.. Abbozzo di standard (2D) e le culture sandwich stimolazione dei recettori dorsali all'interno della cultura sandwich innesca la segnalazione di adesione delle cellule aggiuntivo che modula importanti processi cellulari Clicca qui per vedere una versione più grande di questa figura.

Figura 2: la cultura del panino-come è un sistema versatile che permette lo studio di diversi parametri ben controllati (ingressi topografiche, rigidità, gradienti ...) su entrambi i substrati ventrale e dorsale.
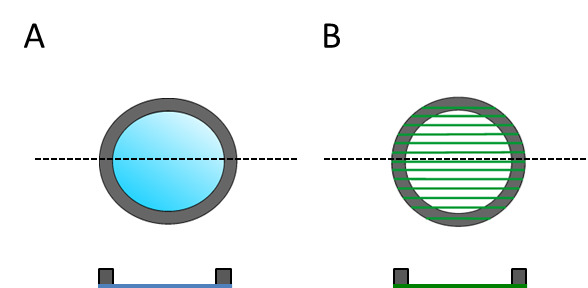
Figura 3:. Substrati dorsali sono abbozzati sia per la parte superiore e vista in sezione, al fine di mostrare che hanno un alto designato e lato inferiore (A) di film piatto PLLA e (B) elettrofilate fibre.

Figura 4:. C2C12 morfologia in diverse condizioni di coltura tra cui piano (p) e fibre allineate (a) di PLLA che sono stati utilizzati come ventrale (pedice) o dorsale (apice) substrati Le linee tratteggiate rappresentano le fibre orientamento, se necessario. Le cellule coltivate sul substrato piano e sovrapposti con fibre allineate di PLLA (SW p a) percepire gli stimoli dorsali. In particolare, le cellule percepiscono le fibre dorsali rivestiti con fibronectina ma non rivestiti with sieroalbumina bovina (una proteina non-adesivo). Di conseguenza le cellule aderiscono alle fibre rivestite con fibronectina e allineare nella stessa direzione. Immagine adattato da riferimento 9. Cliccate qui per vedere una versione più grande di questa figura.
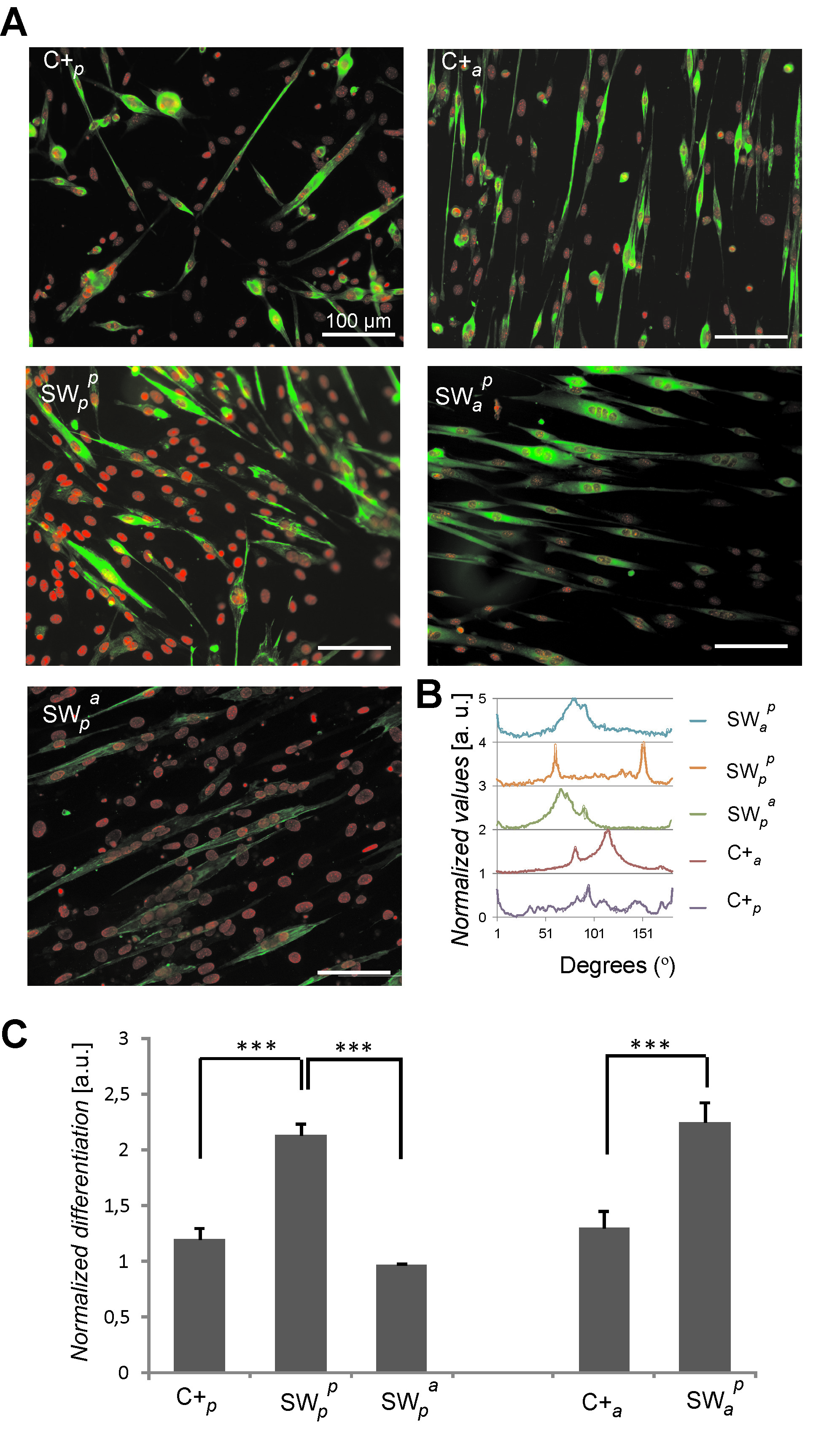
Figura 5: la differenziazione delle cellule in culture sandwich dopo 4 giorni nei media differenziazione. Differenti condizioni di coltura sono stati analizzati compreso piano (p) e fibre allineate (a) di PLLA che sono stati usati come ventrale (pedice) o dorsale (apice) substrati. I campioni sono stati rivestiti con fibronectina in tutti i casi. (A) fluorescenza colorazione che mostra le cellule miosina sarcomerica positivi (verde) e nuclei cellulari (rosso). (B) differenziatacellule orientamento come calcolato da Fast Fourier Transform. (C) Miogenesi come determinato dalla percentuale di cellule positive miosina-sarcomeric. I dati sono normalizzati al controllo gold standard. Differenze statisticamente significative sono indicati con *** p <0.001. Immagine adattato da riferimento 9. Cliccate qui per vedere una versione più grande di questa figura.

Figura 6: Riorganizzazione della fibronectina ventrale. Cultura Sandwich innesca ventrale FN riorganizzazione formando nuove fibrille fibronectina (etichettatura a spazzola, ha sottolineato con frecce bianche). Fibronectina ventrale è riorganizzata all'interno di culture sandwich con rivestimento diverso proteina dorsale (fibronectina, vitronectina e albumina sierica bovina)o anche quando il substrato dorsale è lasciata non rivestito. Citoscheletro (verde), i nuclei (blu) e FN (rosso) sono mostrati. Cliccate qui per vedere una versione più grande di questa figura.
Movie 1: La migrazione cellulare in 2D. L929 fibroblasti migrazione su un fibronectina rivestito di vetro vetrino in una guarigione delle ferite test. Le immagini sono state acquisite per 16 ore (con un telaio preso ogni 20 min). Clicca qui per vedere il video.
Movie 2:. La migrazione cellulare all'interno della cultura sandwich L929 fibroblasti migrazione in una guarigione della ferita test all'interno di una cultura sandwich erano il substrato ventrale era un fibronectina rivestite coprioggetto di vetro e il substrato dorsale un film PLLA fibronectina rivestite. Le immagini sono state acquisite per 16 ore (con un telaio preso ogni 20 min). Cliccate qui per vedere il video.
Discussione
Al giorno d'oggi, la cultura 3D è un tema importante per l'industria farmaceutica e biotecnologica, nonché la ricerca in biologia cellulare, tra cui il cancro e le cellule staminali. Di conseguenza sono stati sviluppati diversi sistemi di coltura 3D. Purtroppo, le differenze tra i sistemi 3D di solito determinano il comportamento cellulare diverso, ostacolando la comprensione del destino delle cellule. Inoltre, le procedure sperimentali di solito non sono così semplice come per sistemi di coltura 2D. Quindi lo sviluppo di nuovi sistemi di coltura che cercano di superare alcuni di questi inconvenienti è molto importante.
Cultura sandwich ha dimostrato di influenzare fortemente processi cellulari chiave, quali la differenziazione cellulare, morfologia cellulare, segnalazione cellulare e la migrazione delle cellule. Inoltre cellule somiglianze con cellule coltivate in sistemi 3D, a sostegno della dichiarazione che la cultura sandwich collega 2D con sistemi di coltura 3D. Tessuti fisiologici hanno pori nell'intervallo da 3 a 14 μm che vincolo cellule e quindi influenzare processi cellulari come la migrazione. Questo è in qualche modo ricapitolato usando il sistema a sandwich come dorsali e ventrali stimoli rappresentano di per sé un ambiente vincolato che limita morfologia cellulare e necessariamente influenzare la migrazione delle cellule indipendentemente rivestimenti proteici.
A causa della stimolazione simultanea di dorsali e ventrali recettori, cultura sandwich è una tecnologia robusta per studiare il ruolo della dimensionalità nel comportamento delle cellule. Inoltre, poiché si basa su substrati 2D, questo sistema di coltura è molto versatile per studiare differenti proprietà del materiale e ingressi ECM consentono lo studio del comportamento cellulare sotto diversi microambienti. Inoltre, l'influenza del tempo in cui i recettori dorsali vengono stimolati sul destino cellulare può essere studiata sovrapponendo substrato dorsale in punti temporali diversi. Quindi, a differenza di altri sistemi 3D, il sistema sandwich fornisce un ampio spettrodi ben controllata microambienti cellulari. Di conseguenza, il sistema a sandwich è una piattaforma di coltura cellulare interessante per simulare diversi ambienti fisiologici al fine di studiare la biologia delle cellule e il destino cella di prova in diverse condizioni di coltura.
Come accennato in precedenza, uno dei vantaggi di questo sistema è che diversi substrati ventrale e dorsale possono essere studiate usando diversi rivestimenti proteici. Pertanto, parametri importanti per il destino della cellula come densità ligando possono essere sintonizzate attraverso il controllo della densità di ligando di ognuno dei substrati 2D utilizzati (per esempio substrati ventrale e dorsale). Si noti tuttavia che diversi substrati possono avere bisogno di cambiamenti nel protocollo. Ad esempio, utilizzando substrati dorsali grandi può comportare la necessità di impostare il tempo di incubazione corretta per sbucciare campioni fuori del piatto Petri. Analogamente, substrati ventrali grandi potrebbero causare aree ipossiche al centro del campione a causa della permeabilità all'ossigeno limitata del ventralesubstrato (a causa del vetrino di vetro). Inoltre, procedure di analisi dipenderanno dalle proprietà del substrato. Ad esempio, utilizzando substrati dorsali opachi ostacolerà i protocolli standard di microscopia anche se continuerà a consentire di proteine / acidi nucleici estrazione. Un altro fattore chiave è la permeabilità del substrato dorsale poiché le cellule dovrebbe essere consentito di ottenere nutrienti dal medio e gettare i rifiuti.
Per riassumere, una cultura di sandwich è un semplice sistema che offre la possibilità di simulare diversi microambienti 3D simile a indagare il destino della cellula.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The support from ERC through HealInSynergy (306990) and the FPU program AP2009-3626 are acknowledged.
Materiali
| Name | Company | Catalog Number | Comments |
| Ploy(lactic acid) | NatureWorks | 4042D | Reagent |
| Cover glasses (12 mmØ) | Marienfeld | 631-0666 | Equipment |
| Chloroform | Scharlab | CL0200 | Reagent |
| 1,1,1,3,3,3-Hexafluoro-2-propanol (HFIP) | Sigma | 105228 | Reagent |
| Syringe (1 ml) | Henke Sass Wolf | 4010-200V0 | Equipment |
| Syringe pump | New Era Pump Systems | NE1000 | Equipment |
| High Voltage DC Power Supply | Glassman High Voltage | Series FC | Equipment |
| Incubator | Hucoa-Herlös | 3111 | Equipment |
| Laminar flow hood | Telstar | AV30/70 | Equipment |
| Human Fibronectin | Sigma | F2006 | Reagent |
| RNeasy Micro Kit | Qiagen | 74004 | Reagent |
| Inverted microscope | Leica Microsystems | DMI 6000 | Equipment |
| Triton X-100 | Sigma-Aldrich | T8787 | Reagent |
| Albumin | Sigma-Aldrich | A7409 | Reagent |
| Tween 20 | Sigma-Aldrich | P2287 | Reagent |
Riferimenti
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. 125 (Pt 13), 3015-3024 (2012).
- Weiss, P. Rev. Mod. Phys. 31 (1), 11-20 (1959).
- Ruffner, H., Lichtenberg, J. 3D cell culture systems--towards primary drug discovery platforms: an interview with Heinz Ruffner (Novartis) and Jan Lichtenberg (InSphero). Biotechnol J. 7 (7), 833-834 (2012).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Wolf, K., et al. Compensation mechanism in tumor cell migration: mesenchymal-amoeboid transition after blocking of pericellular proteolysis. J Cell Biol. 160 (2), 267-277 (2003).
- Schor, S. L., et al. A novel 'sandwich' assay for quantifying chemo-regulated cell migration within 3-dimensional matrices: wound healing cytokines exhibit distinct motogenic activities compared to the transmembrane assay. Cell Motil Cytoskeleton. 63 (5), 287-300 (2006).
- Lee, E. J., Hwang, C. M., Baek, D. H., Lee, S. H. Fabrication of microfluidic system for the assessment of cell migration on 3D micropatterned substrates. Conf Proc IEEE Eng Med Biol Soc. 2009 (2009), 6034-6037 (2009).
- Zaman, M. H., et al. Migration of tumor cells in 3D matrices is governed by matrix stiffness along with cell-matrix adhesion and proteolysis. Proc Natl Acad Sci U S A. 103 (29), 10889-10894 (2006).
- Ballester-Beltrán, J., Lebourg, M., Salmerón-Sánchez, M. Dorsal and ventral stimuli in sandwich-like microenvironments. Effect on cell differentiation. Biotechnol Bioeng. 110 (11), 3048-3058 (2013).
- Ballester-Beltrán, J., Lebourg, M., Moratal, D., Salmerón-Sánchez, M. Fibronectin-matrix sandwich-like microenvironments to manipulate cell fate. Biomater. Sci. 2 (3), 381-389 (2014).
- Ballester-Beltrán, J., Lebourg, M., Rico, P., Salmerón-Sánchez, M. Dorsal and ventral stimuli in cell-material interactions: effect on cell morphology. Biointerphases. 7 (1-4), 39(2012).
- Ballester-Beltrán, J., Lebourg, M., Rico, P., Salmerón-Sánchez, M. Cell migration within confined sandwich-like nanoenvironments. Nanomedicine. , (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Passaging Cells. J. Vis. Exp. , (2015).
- Glaß, M., et al. Cell Migration Analysis: Segmenting Scratch Assay Images with Level Sets and Support Vector Machines. Pattern Recogn. 45 (9), 3154-3165 (2012).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Huebsch, N., Arany, P. R., Mao, A. S., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Petrie, R. J., Gavara, N., Chadwick, R. S., Yamada, K. M. Nonpolarized signaling reveals two distinct modes of 3D cell migration. J Cell Biol. 197 (3), 439-455 (2012).
- Mao, Y., Schwarzbauer, J. E. Stimulatory effects of a three-dimensional microenvironment on cell-mediated fibronectin fibrillogenesis. J Cell Sci. 118 (Pt 19), 4427-4436 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon