Method Article
Ambiente Microfluidic controlada de Investigação dinâmico de Agregação Glóbulo Vermelho
Neste Artigo
Erratum Notice
Resumo
O protocolo descrito detalhes um procedimento experimental para quantificar glóbulos vermelhos (RBC) agregados sob uma velocidade de corte constante e controlado, com base em técnicas de processamento de imagem. O objetivo deste protocolo é relacionar RBC tamanhos agregados à taxa de corte correspondente em um ambiente controlado microfluídico.
Resumo
O sangue, como biofluid não-newtoniano, representa o foco de numerosos estudos no campo hemorreologia. Constituintes do sangue incluem os glóbulos vermelhos, glóbulos brancos e plaquetas, que são suspensos em plasma sanguíneo. Devido à abundância das hemácias (40% a 45% do volume do sangue), o seu comportamento dita o comportamento reológico de sangue especialmente na microcirculação. Com taxas de corte muito baixos, hemácias são vistos de montar e entidades de formulário chamado agregados, o que faz com que o comportamento não-newtoniano de sangue. É importante compreender as condições da formação de agregados de compreender a reologia do sangue na microcirculação. O protocolo aqui descrito detalhes do procedimento experimental para determinar quantitativamente os agregados de RBC na microcirculação sob velocidade de cisalhamento constante, com base no processamento de imagem. Para este efeito, RBC-suspensões são testadas e analisadas em microcanais 120 x 60 mm de poli-dimetil-siloxano (PDMS). As suspensões são RBC-entchover usando um segundo fluido, a fim de obter um perfil de velocidade linear no interior da camada de sangue e, assim, obter uma grande gama de velocidades de cisalhamento constante. A velocidade de corte é determinada usando um sistema de micro partículas velocimetria de imagens (μPIV), enquanto agregados RBC são visualizados utilizando uma câmara de alta velocidade. Os vídeos capturados dos agregados RBC são analisados usando técnicas de processamento de imagem, a fim de determinar os tamanhos de agregados com base nas intensidades de imagens.
Introdução
As células vermelhas do sangue (RBC) desempenham um papel crucial na determinação do comportamento reológico de sangue. Eles são quase singularmente responsável pelas propriedades particulares do sangue in vitro e in vivo. Sob condições fisiológicas, os glóbulos vermelhos ocupar 40% a 45% do volume de sangue. Na microcirculação, hemácias só ocupam até 20% do volume de sangue devido ao diâmetro dos vasos menores e o plasma efeito uma desnatação. Este fenómeno de redução de plasma na microcirculação é conhecido como o efeito Fåhraeus. Em baixas velocidades de corte, os glóbulos vermelhos são capazes de transpor em conjunto e formam um dimensional ou estruturas tridimensionais chamados "rouleaux" ou agregados, por conseguinte, contribuir para o comportamento não newtoniano do sangue. No entanto, o mecanismo de agregação de RBC não é completamente compreendido. Existem duas teorias para modelar a agregação de hemácias: a ponte da teoria células devido à ligação cruzada das macromoléculas 2 ea atrac vigorteoria ção provocada pela depleção das moléculas, devido ao gradiente osmótico 3.
Tipicamente, para o sangue humano, formar agregados com taxas de corte muito baixos 4 variando de 1 a 10 s -1. Acima dessa faixa, hemácias tendem a desagregar e fluxo separadamente dentro do vaso.
Compreender as condições da formação de agregados é de uma grande importância para o campo hemorreologia em termos de definir o comportamento reológico de sangue. Estes agregados são muitas vezes vistos a nível macrocirculação (> 300 mm de diâmetro) 5. Nesta escala, o sangue é considerado como um fluido Newtoniano e de uma mistura homogénea. No entanto, estes agregados são raros no nível capilar (4-10 um de diâmetro) e são geralmente uma indicação de condições patológicas tais como a diabetes e a obesidade 6. Outras condições patológicas que poderiam mudar a agregação RBC incluem condições inflamatórias ou infecciosas,doenças cardiovasculares, como hipertensão ou aterosclerose, doenças genéticas e doenças crônicas 7. Portanto, a compreensão do mecanismo de agregação de glóbulos vermelhos e analisando estas entidades (por definição de uma relação entre o tamanho destes agregados e as condições de fluxo) pode conduzir à compreensão do comportamento microrheological de sangue e, portanto, relacioná-la com aplicações clínicas.
Agregados RBC pode ser alterada por vários factores tais como o hematócrito (volume de glóbulos vermelhos no sangue), a taxa de cisalhamento, o diâmetro do vaso, a rigidez da membrana de RBC e a composição do meio de suspensão 8-10. Por conseguinte, são necessárias condições controladas, a fim de analisar de forma eficaz os agregados de RBC. Vários métodos são capazes de analisar a formação de agregados, fornecendo medições de agregação estáticos (índice de agregação) que oferece informações relevantes sobre o comportamento do sangue. Estes métodos incluem, inter alia, a taxa de sedimentação de eritrócitos11 método, o método de transmissão de luz de 12, o método de reflexão de luz 13 e o método de baixa viscosidade de cisalhamento 14.
Poucos estudos tentaram estudar a agregação de RBC e determinar o grau de agregação em condições de fluxo controladas 15-17. No entanto, estes estudos indirectamente investigar RBC tamanhos de agregados por meio da determinação da relação entre o espaço ocupado em um sistema de corte medida com base em imagens microscópicas sanguíneos que fornecem informação sobre o grau de agregação, bem como a viscosidade local.
Nós, portanto, apresentar um novo procedimento para quantificar directamente RBC agrega na microcirculação, de forma dinâmica, com taxas de corte controlado e constante. Rbc suspensões são arrastadas, num duplo Y-microcanal (tal como ilustrado na Figura 1), com uma solução salina tamponada com fosfato (PBS), criando assim um fluxo de cisalhamento na camada de sangue. Dentro desse sangue camada uma constante de karitétaxa R pode ser obtido. Os RBC-suspensões são testados em hematócrito diferentes (H) níveis (5%, 10% e 15%) e sob taxas de deformação diferentes (2-11 seg -1). A velocidade do sangue e velocidade de cisalhamento são determinados usando um sistema de micro partículas velocimetria de imagens (μPIV), enquanto que o fluxo é visualizada utilizando uma câmara de alta velocidade. Os resultados obtidos são, então, processados com um código MATLAB com base nas intensidades de imagem, a fim de detectar as hemácias e determinar os tamanhos de agregados.
Protocolo
O sangue é coletado de indivíduos saudáveis com a aprovação do comitê de ética da Universidade de Ottawa (H11-13-06).
1. Microchannel Fabrication
Os microcanais são fabricados com base nos métodos de fotolitografia padrão 18.
- Projetar a geometria de microcanais utilizando um design de software assistida por computador (CAD) e imprimir a configuração em uma foto-máscara de transparência. Estas máscaras são cruciais, uma vez que ditam o caminho da luz durante o processo de fabricação. Neste caso, as dimensões são de microcanais 120 um de espessura, 60 mm de profundidade e 7 mm de comprimento.
- Em uma sala de limpeza, revestimento de spin um epóxi negativa baseada foto-resiste em uma pastilha de silício a 2.000 rpm durante 30 segundos para obter a profundidade de microcanais desejado (60 mm).
- Expor a bolacha e o foto-máscara sob uma lâmpada de UV a 650 mJ / cm 2 para 70 segundos. Assegurar a expor apenas as áreas transparentes dofoto-máscara à luz UV. A exposição das áreas transparentes permite a polimerização das cadeias, resultando em um endurecimento de foto-resist. Mergulhe a peça de silício em um desenvolvedor para remover o excesso de foto-resiste.
- Uma vez que o molde é fabricado, misturar um elastómero à base de silício e um agente de cura a uma razão de 10: 1 para criar uma solução de poli-dimetil-siloxano (PDMS). Coloque a solução PDMS em uma câmara de vácuo para desgaseificar. Deite-o no molde e aquecê-la a 60 ° C durante 90 minutos para criar microcanais. Em seguida, ligar os canais individuais para uma lâmina de vidro usando bonding plasma de oxigênio durante 90 segundos.
Nota: o processo de PDMS desgaseifica é realizada a fim de eliminar as bolhas de ar geradas pelo processo de mistura. - Certifique-se de que as dimensões de microcanais para permitir testes bem-sucedidos. Neste protocolo, os microcanais têm uma secção transversal rectangular de 120 x 60 mm. Em comparação, um RBC média tem um diâmetro de 8 um e uma espessura de 2 um. Oguinte, a largura de microcanais é suficiente para observar a agregação adequada e determinar com precisão os perfis de velocidade.
2. Preparação de Sangue
- Recolha de sangue de doadores voluntários saudáveis, após a aprovação de um comitê de ética. Tratar o sangue com ácido etilenodiaminotetracético (EDTA) presente nos tubos de colheita (7,2 mg de EDTA em 4 ml de sangue).
NOTA: O EDTA é utilizado para evitar a coagulação do sangue. - Centrifugar as amostras de sangue três vezes durante 10 minutos a 1400 xg (3000 rpm) de modo a separar os constituintes do sangue. Como resultado da centrifugação, observar três camadas distintas.
NOTA: As três camadas são a camada de RBC (localizado na parte inferior do tubo), o creme leucocitário (consistindo de glóbulos brancos e de plaquetas localizados no topo da camada de glóbulos vermelhos) e a camada de plasma (localizado na parte superior de todas as outras constituintes).- Depois da primeira centrifugação, recolher o plasma sanguíneo, utilizando uma pipeta de sangue. Evite qualquer contato com o creme leucocitário.
- Recolha e descarte o creme leucocitário em um recipiente com água sanitária diluída em 10%.
- Adicionar 3 ml de PBS, pH 7,4 a cada um dos tubos com a camada de glóbulos vermelhos restantes e assegurar um equilíbrio adequado do centrifugador. Misturar suavemente os tubos e centrifugar uma vez a 1400 x g (3000 rpm) durante 10 min.
NOTA: Certifique-se de que a solução PBS não contém qualquer magnésio ou de cálcio, uma vez que poderia alterar a adesão celular. - Descarte o PBS nos tubos após a segunda centrifugação e remover o creme leucocitário restante se presente. Repita os passos 2.2.3 e 2.2.4 para a terceira centrifugação para produzir hemácias limpas.
- Misturar a quantidade requerida (0,05, 0,1 e 0,15 mL) dos GVs limpas com plasma (0,95, 0,9 e 0,85 mL) num tubo de 1 ml, a fim de obter suspensões com RBC-a correspondente (5%, 10% e 15% ) hematócrito. Verifique hematócritos com uma microcentrífuga.
3. Fluidos Preparação
Apresente dois fluidos no duplo Y-microcanais: RBC-suspensões e PBS.
- Adicionar 60 ul da solução de partículas de marcador fluorescente (1% sólido, d partícula = 0. 86 uM, λ abs = 542 nm e λ emissão = 612 nm) para os tubos de 1 ml RBC-suspensão.
NOTA: As partículas de marcador fluorescente (internamente tingidos partículas de poliestireno) são usados para medir a velocidade do fluxo no interior do microcanal. Estas partículas fluorescem quando expostos ao comprimento de onda correspondente do feixe de laser (λ = 542 nm). - Prepara-se uma solução de PBS de pH 7,4 e adicionar 60 uL da mesma solução de partículas de traçador fluorescente em 1 ml de solução de PBS.
4. Agregados Tamanho Medidas
- Para inserir os fluidos (suspensões e RBC-PBS), no microcanal, utilizar duas seringas de vidro de 25 uL e 100 uL. Isso vaiajudar a reduzir a conformidade do sistema. Ligue os microcanais para as seringas através de tubos e conectores enquadrem nas orifícios de entrada. Encha as seringas de vidro utilizando a diferença de pressão existente entre o recipiente de fluido e a seringa. Assegurar não há bolhas de ar no sistema. Como um método alternativo, utilizar um sistema de pressão controlado para conduzir os dois fluidos no microcanal.
- Coloque o microcanal em um palco microscópio invertido conectado a uma câmera de alta velocidade e um sistema μPIV. Programa da bomba de seringa para as taxas de fluxo desejados (por exemplo, Q = 2 l / h para o sangue gerando um caudal de Q = 8 l / h para PBS).
NOTA: Somente uma bomba de seringa é utilizada. Usando duas seringas de vidro diferentes, com dois diâmetros internos diferentes, é possível fazer variar o caudal a que entra em cada ramo do Y-microcanal. - Insira ambos os fluidos no duplo Y-microcanais cada lado, de uma filial de entrada diferente e em diferentes vazões, como mostrado na Figura 1. A fim de testar a diferentes taxas de cisalhamento, mudar o caudal da bomba. Isto mantém a mesma proporção apropriada (4, neste caso) entre os dois ramos 19 (Figuras 2 e 3). Aguarde até que o fluxo para atingir o estado estacionário antes de adquirir as medições: inspecionar visualmente as imagens da câmara de alta velocidade para um fluxo suave.
Observação: A razão é importante na obtenção de um perfil de velocidade linear no interior da camada de sangue. - Visualize as hemácias utilizando a câmera de alta velocidade. Ligue a câmara a um computador para controlar, registrar e guardar as imagens do fluxo de fluido. Uma vez que os dois fluxos de fluido atingir o estado estacionário, iniciar a gravação.
- Adquirir várias imagens para obter melhores resultados de processamento. Determinar um tempo de exposição da câmara óptima para uma imagem clara dos agregados.
NOTA: O tempo de exposição da câmara para este caso foi de 0,5 ms. A escolha do intervalo de tempo entre cada trama baseia-se na taxa de quadros da câmara e a velocidade de fluxo em tele microcanais. O tempo entre cada quadro processado neste procedimento foi de 60 mseg. Por conseguinte, uma câmara capaz de gravar 18 quadros por segundo é suficiente.
NOTA: Evite a sedimentação de sangue no tubo e seringa, que poderia levar a medições erradas.
- Adquirir várias imagens para obter melhores resultados de processamento. Determinar um tempo de exposição da câmara óptima para uma imagem clara dos agregados.
- Utilizando técnicas de processamento de imagens (um programa em Matlab, neste caso) para melhorar a qualidade da imagem, detectar os agregados em cada uma das imagens com base em intensidades de pixel (ilustrada na Figura 4) como se segue:
- Melhorar as imagens de contraste utilizando o método do histograma equalizador para se obter uma melhor qualidade de imagem para cada quadro.
- Converta as imagens em tons de cinza em imagens binárias. Para este efeito, estabelecer um valor limite, que varia de 0 a 1, que determina a conversão de cada pixel. Qualquer pixel na imagem abaixo do valor limiar será detectado como um pixel preto, enquanto os pixels com valores maiores do que o limiar será detectado como pixels brancos.
- Encha ofuros (se presente e necessário) correspondentes para as lacunas dentro de um agregado para obter melhores resultados.
- Detectar as células por determinação pixels brancos vizinhos na imagem binária, de modo que as células adjacentes são associados na forma de agregados.
- Rotular os diferentes agregados detectados e converter a imagem binária em uma imagem de vermelho-verde-azul (RGB) para melhor visualização. Combinam-se as imagens de origem com cada uma das imagens processadas correspondentes para verificar a eficiência da técnica de processamento de imagem e assegurar que todas as células são tomadas em consideração, como mostrado na Figura 5. Execute passos 4.5.1, 4.5.2, 4.5.3 , 4.5.4 e 4.5.5 para todos os quadros capturados.
- Calcula-se a área de cada agregado detectado no quadro com base no número de pixels detectados. Com base na lente de ampliação usado, calcula o factor de conversão, usando uma retícula de calibração, e os resultados para converter 2 uM. Calcular a média dos tamanhos agregadas detectadas em cadaquadro e, em seguida, calcular a média dos resultados para todos os quadros para se obter o tamanho médio do agregado para cada gravação de RBC-suspensões.
- Calcula-se a área de uma RBC para determinar um número representativo estimado de RBCs, em cada agregado detectado. Usando estes resultados, o cálculo da distribuição da percentagem de glóbulos vermelhos, em cada agregado como uma função dos tamanhos de agregado (representadas pelo número estimado de células em cada agregado), como mostrado na Figura 6.
NOTA: Para medir os agregados RBC, software ImageJ poderia ser utilizado (em vez de MATLAB) para executar as mesmas tarefas em cada quadro.
5. velocidade do fluido e cisalhamento Taxa de Medidas
Determinar a velocidade do fluido e, portanto, a taxa de corte usando um sistema μPIV.
- Uma vez que os dados são adquiridos utilizando a câmera de alta velocidade, mudar para a câmera pulsado duplo usado para o sistema μPIV. Use um software de imagem para imagem acaqui- do fluxo do processamento de imagem e para a determinação de campo de velocidade.
- Tomar todas as precauções necessárias, dependendo da classe do laser, antes de ligar o laser. Em seguida, ligar o sistema, a câmara eo laser.
- Calibrar a câmara com base na ampliação da lente utilizada. Para esta finalidade, utilizar uma microescala de 10 um a precisão sob o microscópio e definir o tamanho de um pixel na imagem.
- Iniciar o laser e visualizar as partículas em ambos os fluidos. Encontre o plano médio dos microcanais, concentrando-se sobre as partículas mais rápidas no fluxo (isto é, as partículas mais rápidas deve ser o mais brilhante).
- Definir a DT (intervalo de tempo entre dois quadros consecutivos) para assegurar o deslocamento correcto da partícula. As partículas mais rápidas deve mover-se cerca de 5 a 10 pixels entre ambas as imagens.
- Comece a gravar o fluxo. Defina o software para adquirir 100 pares de imagens, 5 ms de intervalo. Realize os passos 5.4, 5.5 e 5.6 para todo o difrentes RBC-suspensões e para diferentes taxas de cisalhamento.
NOTA: Mais detalhes da metodologia são apresentados no estudo de Pitts e Fenech 20. - Processe as gravações adquiridos utilizando o método de correlação cruzada com o software de imagem.
NOTA: Este consiste em discretizar o par de imagens em pequenas janelas de tamanho pré-determinado (com base no fluxo de fluido e o intervalo de tempo escolhido pelo utilizador) chamado janelas de correlação e seguindo o deslocamento das partículas em cada janela.- Em primeiro lugar, determinar se as imagens obtidas requerem pré-tratamento (incluindo a subtração de fundo, "base-grampeamento" 21 ou imagem sobreposição 22,23) para um melhor processamento de dados.
- Em seguida, escolha o tamanho da janela de correlação e forma, bem como da percentagem de imagens sobrepostas. Um estudo detalhado foi realizada por Pitts et al. 24, para determinar os parâmetros óptimos e técnicas de pré-processamento de imagem para sanguefluir em diferentes configurações de canal. Exprimir os resultados em um campo de velocidade média calculada a partir dos pares de imagem e 100 o erro Root Mean Square (RMS) na velocidade.
- Extrair um perfil de velocidade à saída do canal, a partir dos dados tratados, como mostrado na Figura 7. Para uma melhor perfil, a média do campo de velocidades no espaço.
NOTA: As barras que constituem o perfil de velocidade corresponde ao tamanho da janela de correlação escolhidos em relação à largura do canal. O erro RMS da velocidade também é mostrado na Figura 7, que representa o erro na estimativa de velocidade experimental. - Desligue o laser uma vez que todas as medidas e processamento são executados ,. Desligue todos os componentes do sistema: software, câmeras, fase em movimento, computadores e laser.
- Para calcular a velocidade de corte, primeira detectar e calcular a espessura de sangue nos microcanais com base na câmara de gravação de alta velocidade. Para este efeito, em média todosos quadros no registo específico para obter uma imagem de vídeo de fundo. Delimitar a camada de sangue (como mostrado na Figura 8 para as RBC-suspensões fluidas em 10 ul / h, quando suspenso em 5%, 10% e 15% hematócrito). Obter o valor de velocidade para a espessura da camada de sangue correspondente e calcular a velocidade de corte através da divisão do valor da velocidade por a espessura da camada de sangue.
Resultados
Um exemplo do fluxo de dois fluidos no duplo Y-microcanal é mostrado na Figura 2 para os glóbulos vermelhos humanos suspensos em 5%, 10% e 15% de hematócrito e fluindo a 10 ul / h. A Figura 3 mostra a diferença no tamanho dos agregados quando o fluxo no canal é reduzido de 10 l / h a 5 uL / hr de um hematócrito de 10%. Isto dá uma noção qualitativa dos tamanhos dos agregados ao variar o hematócrito e da taxa de cisalhamento. A Figura 5 segue o deslocamento de quatro agregados RBC humano, por três estruturas consecutivas, fornecendo uma medida qualitativa da taxa de quadros da câmara necessária e qualitativa da noção Agregados de distribuição no interior de cada quadro. Na Figura 5, os pequenos agregados (com glóbulos vermelhos 8 ou menos avaliado) são mostrados a azul, enquanto agregados (médias que variam de 9 a 30 estimativa RBCs) e agregados grandes (maiores do que 30 estimado RBCs) são mostrados em verde e vermelho, respectivamente.
Os perfis de velocidade das diferentes suspensões de RBC-no canal são mostrados na Figura 7, onde as curvas vermelhos, azuis e verdes representam os perfis de velocidade dos glóbulos vermelhos em suspensão em 5%, 10% e 15% de hematócrito respectivamente. Os erros de RMS da velocidade, também apresentados na Figura 7 para cada RBC-suspensão, são relativamente pequenos em comparação com os valores de velocidade, que indica a precisão das medições de velocidade e, portanto, as taxas de cisalhamento. As junções são indicados como 'E' e mostrado como as linhas cheias na mesma figura.
As taxas de corte correspondentes para as diferentes suspensões de RBC-(com base nos perfis de velocidade e a espessura da camada de sangue) são mostrados na Tabela 1. Os agregados de tamanho médios obtidos para cada uma das suspensões de RBC-, com base no método de processamento de imagem para detectar o área dos agregados RBC, são mostrados na Figura 9, como um functião da velocidade de cisalhamento correspondente. Um exemplo da distribuição da percentagem de glóbulos vermelhos, em cada agregado é mostrado na Figura 6. Os tamanhos de agregados são representados como uma estimativa do número de glóbulos vermelhos nos agregados.
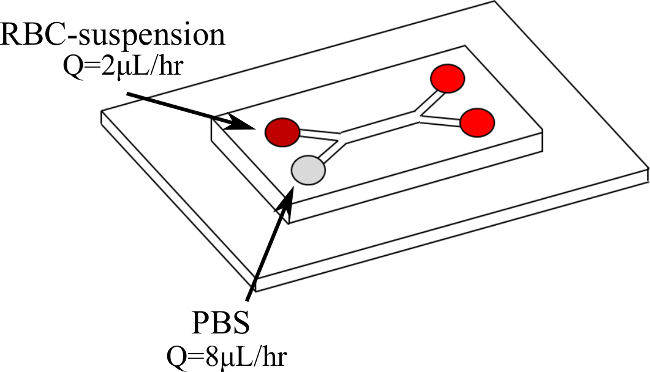
Figura 1. Configuração Y-microcanais e dupla entrada de fluidos. O sangue entra a primeira filial no Q = 2 l / h, enquanto PBS entra na segunda filial em Q = 8 l / h. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2.-RBC humano suspensão no hematócrito diferentes. A figura representa os quadros de RBC-humanos suspensões fluidas em Q = 10 mL / h a capturado (A) 5% (B)10% e (C) 15% do hematócrito. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3.-RBC humano suspensão a diferentes caudais. A figura representa os quadros de os glóbulos vermelhos humanos suspensos em 10% de hematócrito H fluidas (A) Q = 10 l / h e (B) Q = 5 uL / hr capturado. favor aqui para ver uma versão maior desta figura.

Figura 4. Fluxograma do programa de processamento de imagem utilizado para a detecção de agregados. Os passos apresentados descrevem a metodologia de base. A qualidade da imagem é melhorada para ser c onverted para uma imagem binária. Os agregados são detectados e rotuladas com base nos seus respectivos tamanhos. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5. RGB coloração e movimento líquido das várias RBC humano agrega durante três quadros consecutivos. A figura mostra o movimento de líquido de quatro agregados detectados em três estruturas consecutivas em (A) t = 0 ms, (B) T = 60 ms e (C) t = 120 ms. Os grandes agregados (> 30 estimada hemácias), agregados médios (30/09 hemácias estimados) e pequenos agregados (<8 estimada hemácias) são mostrados em vermelho, verde e azul, respectivamente. Cada um dos agregados detectados são marcados com um círculo preto._blank "> Clique aqui para ver uma versão maior desta figura.
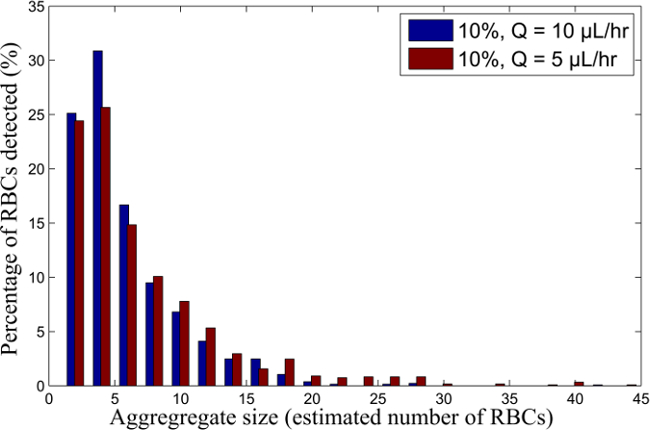
Figura 6. RBC distribuição de tamanho de agregado de 10% H RBC-suspensão para diferentes taxas de fluxo. Distribuição de tamanho de agregado de amostras de sangue em suspensão em 10% H, fluindo em Q = 10, 5 l / h. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7. Comparação da velocidade de perfil para hematócrito diferentes. Os perfis de velocidade para os glóbulos vermelhos são mostrados no plasma em suspensão em 5% H (vermelho), 10% H (azul), 15% H (verde) e de simulação de 19 (linha sólida) para a 120 x 60 mm duplo Y-microcanais com Q = 10 l / h. A localização de interface é indicada por e para oexperimentos. Os erros RMS correspondentes dos diferentes perfis de velocidade são exibidos. Por favor clique aqui para ver uma versão maior desta figura.

Figura 8. fundo da imagem para as diferentes RBC-suspensões e delimitação da espessura da camada de sangue. A figura mostra a delimitação da espessura da camada de sangue dos RBC-suspensões fluidas em 10 mL / hr suspensa às (A) 5%, (B ) e 10% (C) 15% H. Por favor clique aqui para ver uma versão maior desta figura.

Figure 9. agregados de tamanho médio como uma função das taxas de corte correspondentes. Os resultados são obtidos para os diferentes RBC-suspensões que fluem no Q = 10 l / h em 5% (A), 10% (B) e 15% H (C). Por favor clique aqui para ver uma versão maior desta figura.
| Hematócrito | Caudal (l / h) | Velocidade de corte (seg-1) |
| 5% | 10 | 11.02 |
| 5% | 5 | 5.36 |
| 10% | 10 | 8.17 |
| 10% | 5 | 4.47 |
| 15% | 10 | 7,41 |
| 15% | 5 | 2.51 |
Tabela 1. Os valores de taxa de cisalhamento para diferentes casos de fluxo de sangue. Os valores de taxa de corte são obtidos utilizando os dados de imagem e os resultados de processamento μPIV para diferentes RBC-suspensões com 5%, 10% e 15% de H, com um caudal de Q = 10 uL / hr e Q = 5 l / h.
Discussão
Utilizando a presente metodologia, é possível analisar, qualitativamente e quantitativamente, o RBC agrega sob diferentes condições de fluxo e hematócritos. Para os testes de detecção de agregados e bem sucedida, é crucial para determinar a relação da velocidade adequada entre os dois fluidos com a entrada de microcanais. Esta relação é muito importante para se obter uma espessura de camada de sangue ideal onde o perfil de velocidade é quase-linear 19.
Outro fator fundamental para o teste bem sucedido é uma boa qualidade de imagem. Na verdade, uma vez que o método é baseado no processamento de imagem, é muito importante ter um contraste entre o fundo da imagem (o fluido no interior do canal) e as partículas a serem detectados. Aqui, como se mostra nas Figuras 2 e 3, as partículas parecem ser mais escura do que o fundo, o que ajuda na detecção agregado. O parâmetro mais importante a considerar para a técnica de processamento de imagem é o tvalor hreshold. Portanto, com base no contraste obtido é crucial para escolher o valor do limiar óptimo onde irá ser tomados em consideração todos os agregados, como mostrado na Figura 5. A presente segmentação da imagem, utilizada para este estudo, é amplamente utilizado para a detecção de células e contagem 25- 27. Se a qualidade da imagem não é tão desejado e um valor de limiar global não é adequado, pode-se usar um algoritmo diferente para determinar o limiar ideal, tais como o método de Otsu 28 ou um método de limiar adaptativo (discretização da imagem e a obtenção de um limiar local para cada janela discretizado).
Outro factor a ter em conta é o fator de escala para uma conversão apropriada de pixels para um.
Utilizando o factor de conversão adequada, pode determinar-se o diâmetro e a espessura de um RBC que irá servir para determinar a distribuição do tamanho dos agregados (com base na estimativa númer de glóbulos vermelhos em cada agregado). Dependendo da orientação dos agregados, calcular adequadamente a área de um RBC (vista frontal ou lateral). Tal como mencionado na secção 4 (passo 4.4.1), que é importante para determinar o tempo de exposição da câmara adequada e a taxa de frame para assegurar que as propriedades dinâmicas de os agregados são capturados entre cada trama consecutivo. Este valor é baseada na taxa de fluxo utilizado na aquisição de medições. Vários outros factores têm de ser tomadas em consideração aquando da aquisição de resultados que utilizam o sistema μPIV e são discutidos claramente no estudo de Pitts e Fenech 20.
A metodologia foi testada com sucesso em vários RBC-suspensões que fluem no hematócrito diferente. No entanto, devido à limitação da técnica de processamento de imagem e a falta de contraste entre o fundo da imagem e dos agregados, é difícil detectar o RBC agregados para hematócritos mais elevados (a partir de 20% a 45%). Com efeito, como mencionadoanteriormente, a qualidade da imagem é crucial para esta metodologia.
Usando este protocolo, o tamanho dos agregados de RBC pode ser medida num dispositivo de microfluidos controlada e, portanto, é possível obter informação sobre a agregação de glóbulos vermelhos dinamicamente na microcirculação e obter os tamanhos de agregados RBC para uma gama de velocidades de corte fisiológicas. É também possível complementar estudos numéricos e experimentais de reologia sanguínea e relacionar os tamanhos e o comportamento de agregação de estudos clínicos e patológicos.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelas Ciências Naturais e do Conselho de Investigação do Canadá Engenharia. Microfabricação foi realizada com o apoio da academia de McGill Nanotools Microfab na Universidade McGill e do Departamento de Eletrônica da Universidade de Carleton.
Materiais
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
Referências
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. . Red Blood Cell Aggregation. , (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. . Handbook of Hemorheology and Hemodynamics. , (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314 (2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302 (2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados