Method Article
Ambiente controllato Microfluidic per Dynamic Indagine Globulo rosso Aggregazione
In questo articolo
Erratum Notice
Riepilogo
Il protocollo descritto dettagli una procedura sperimentale per quantificare globuli rossi (RBC) aggregati con un gradiente di velocità controllata e costante, basato su tecniche di elaborazione delle immagini. L'obiettivo di questo protocollo è di mettere in relazione le dimensioni aggregate RBC al corrispondente gradiente di velocità in un ambiente controllato microfluidica.
Abstract
Il sangue, come BIOFLUID non newtoniano, rappresenta il fulcro di numerosi studi nel campo hemorheology. Componenti del sangue sono i globuli rossi, globuli bianchi e piastrine sospese in plasma sanguigno. Per l'abbondanza dei globuli rossi (40% al 45% del volume del sangue), il loro comportamento determina il comportamento reologico del sangue soprattutto nel microcircolo. Alla velocità di taglio molto basse, globuli rossi sono visti da montare e entità forma chiamata aggregati, che provoca il comportamento non newtoniano di sangue. È importante comprendere le condizioni di formazione aggregati di comprendere la reologia del sangue nel microcircolo. Il protocollo qui descritto in dettaglio la procedura sperimentale per determinare quantitativamente gli aggregati RBC in microcircolo sotto gradiente di velocità costante, sulla base di elaborazione delle immagini. A questo scopo, RBC-sospensioni sono testati e analizzati in 120 x 60 micron poly-dimetil-silossano (PDMS) microcanali. RBC-sospensioni sono entpiovuto utilizzando un secondo fluido al fine di ottenere un profilo di velocità lineare all'interno del livello del sangue e realizzare una vasta gamma di shear rate costante così. Il gradiente di velocità viene determinato utilizzando un sistema di micro Particle Image Velocimetry (μPIV), mentre gli aggregati RBC sono visualizzate con una fotocamera ad alta velocità. I video catturati degli aggregati RBC vengono analizzati utilizzando tecniche di elaborazione dell'immagine per determinare le dimensioni aggregati basati sulle immagini intensità.
Introduzione
Globuli rossi (RBC) svolgono un ruolo cruciale nel determinare il comportamento reologico del sangue. Sono quasi singolarmente responsabili per le particolari proprietà di sangue in vitro e in vivo. In condizioni fisiologiche, RBC occupano il 40% al 45% del volume del sangue. In microcircolazione, globuli rossi solo occupano fino al 20% del volume di sangue a causa di diametri dei vasi più piccoli e il plasma effetto 1 scrematura. Questo fenomeno di riduzione plasma in microcircolazione è noto come effetto Fahraeus. A bassi tassi di taglio, eritrociti sono in grado di colmare e formare uno dimensionale o strutture tridimensionali denominate "rouleaux" o inerti, contribuendo così al comportamento non newtoniano di sangue. Tuttavia, il meccanismo di aggregazione RBC non è completamente noto. Due teorie esistono per modellare l'aggregazione dei GR: il ponte della teoria cellule causa la reticolazione delle macromolecole 2 e la forza attracteoria zione causata dalla deplezione delle molecole a causa del gradiente osmotico 3.
Tipicamente, per sangue umano, aggregati si formano a basse velocità di taglio 4 che vanno da 1 a 10 sec -1. Sopra questa gamma, globuli rossi tendono a disaggregare e il flusso separatamente all'interno del vaso.
La comprensione delle condizioni di formazione aggregati è di grande importanza per il campo hemorheology in termini di definizione comportamento reologico del sangue. Questi aggregati sono spesso visti a livello macrocircolo (> 300 micron di diametro) 5. A questa scala, il sangue è considerato come un fluido Newtoniano e una miscela omogenea. Tuttavia, questi aggregati sono raramente nel livello capillare (4-10 micron di diametro) e sono solitamente un'indicazione di condizioni patologiche come il diabete 6 e obesità. Altre condizioni patologiche che potrebbero cambiare l'aggregazione RBC includono malattie infiammatorie o infettive,malattie cardiovascolari come l'ipertensione o aterosclerosi, malattie genetiche e le malattie croniche 7. Pertanto, la comprensione del meccanismo di aggregazione RBC e analizzare queste entità (definendo una relazione tra la dimensione di tali aggregati e le condizioni di flusso) potrebbe portare alla comprensione del comportamento microrheological di sangue e quindi in relazione con applicazioni cliniche.
Aggregati RBC possono essere alterate da diversi fattori come il ematocrito (volume di globuli rossi nel sangue), la velocità di taglio, il diametro del vaso, la membrana rigidità RBC e la sospensione tessitura media 8-10. Pertanto, condizioni controllate sono necessari per analizzare efficacemente gli aggregati RBC. Diversi metodi sono in grado di analizzare la formazione di aggregati fornendo misurazioni aggregazione statiche (indice di aggregazione) che offre informazioni utili sul comportamento del sangue. Questi metodi includono, tra l'altro, il tasso di sedimentazione degli eritrocitiMetodo 11, il metodo di trasmissione della luce 12, il metodo di riflessione della luce 13 e il metodo a bassa viscosità di taglio 14.
Pochi studi hanno cercato di studiare l'aggregazione RBC e determinare il grado di aggregazione in condizioni di flusso controllato 15-17. Tuttavia, questi studi indirettamente indagare RBC formati aggregati determinando il rapporto dello spazio occupato in un sistema di taglio misurata basato su immagini microscopiche sanguigni che forniscono informazioni sul grado di aggregazione e la viscosità locale.
Abbiamo quindi presentiamo una nuova procedura per quantificare direttamente RBC aggrega in microcircolo, in modo dinamico, con tassi di taglio controllate e costanti. RBC-sospensioni sono trascinati, in un doppio Y-microchannel (come illustrato in figura 1), con una soluzione di tampone fosfato (PBS) creando così un flusso di taglio nello strato di anima. All'interno di questo sangue strato un costante karitétasso r può essere ottenuto. Gli RBC-sospensioni sono testati a diverso ematocrito (H) livelli (5%, 10% e 15%) e in differenti velocità di taglio (2-11 sec -1). La velocità sanguigna e la frequenza di taglio sono determinati utilizzando un sistema di micro Particle Image Velocimetry (μPIV) mentre il flusso viene visualizzato per mezzo di una telecamera ad alta velocità. I risultati ottenuti vengono poi elaborati con un codice MATLAB sulla base delle intensità di immagine al fine di rilevare i globuli rossi e determinare le dimensioni aggregate.
Protocollo
Il sangue viene raccolto da individui sani, con l'approvazione del comitato etico dell'Università di Ottawa (H11-13-06).
1. Microchannel Fabrication
I microcanali sono fabbricati in base alle tecniche fotolitografiche standard di 18.
- Progettare la geometria microcanali con un design software Computer Aided (CAD) e stampare la configurazione su una trasparenza foto-maschera. Queste maschere sono fondamentali in quanto dettano il percorso della luce durante il processo di fabbricazione. In questo caso, le dimensioni microcanali sono 120 micron di spessore, 60 micron di profondità e 7 mm di lunghezza.
- In una camera bianca, cappotto centrifuga una base epossidica negativo fotoresistenti su un wafer di silicio a 2.000 rpm per 30 secondi per ottenere la profondità desiderata microcanali (60 micron).
- Esporre il wafer e la foto-maschera sotto una lampada UV a 650 mJ / cm 2 per 70 sec. Assicurare per esporre solo le aree trasparentifoto-maschera alla luce UV. L'esposizione delle aree trasparenti consente per la polimerizzazione delle catene con conseguente indurimento della foto-resist. Immergere il pezzo di silicio in uno sviluppatore per rimuovere l'eccesso di foto-resistere.
- Una volta che lo stampo è fabbricato, mescolare un elastomero a base di silicio e un agente indurente in un rapporto di 10: 1 per creare una soluzione di poli-dimetil-silossano (PDMS). Mettere la soluzione PDMS in una camera a vuoto degassare. Versare nello stampo e scaldare a 60 ° C per 90 min per creare microcanali. Poi legare i singoli canali di un vetrino con ossigeno legame plasma per 90 sec.
NOTA: il processo di PDMS degassamento è eseguita al fine di eliminare le bolle d'aria generate dal processo di miscelazione. - Verificare che le dimensioni microcanali consentono per il test di successo. In questo protocollo, i microcanali hanno una sezione rettangolare di 120 x 60 micron. In confronto, un RBC media ha un diametro di 8 micron e spessore di 2 micron. Ilrefore, la larghezza microcanali è sufficiente osservare l'aggregazione adeguato e determinare con precisione i profili di velocità.
2. Il sangue Preparazione
- Prelevare il sangue da donatori volontari sani, dopo l'approvazione di un comitato etico. Trattare il sangue con acido etilendiamminotetraacetico (EDTA) presente nei tubi di raccolta (7,2 mg di EDTA in 4 ml di sangue).
NOTA: L'EDTA viene utilizzato per evitare la coagulazione del sangue. - Centrifugare i campioni di sangue tre volte per 10 min a 1400 xg (3.000 rpm) per separare i costituenti del sangue. Come risultato della centrifugazione, osservare tre strati distinti.
NOTA: I tre strati sono lo strato RBC (situato nella parte inferiore del tubo), il buffy coat (comprensivi di globuli bianchi e piastrine situati sulla parte superiore dello strato RBC) e lo strato di plasma (si trova sulla parte superiore di tutte le altre costituenti).- Dopo la prima centrifugazione, raccogliere il plasma di sangue con una pipetta di sangue. Evitare ogni contact con il buffy coat.
- Raccogliere e smaltire il buffy coat in un contenitore con candeggina diluita al 10%.
- Aggiungere 3 ml di PBS pH 7,4 a ciascuno dei tubi con il restante strato di RBC e garantire il corretto equilibrio della centrifuga. Mescolare delicatamente le provette e centrifugare di nuovo a 1.400 g (3.000 rpm) per 10 minuti.
NOTA: Assicurarsi che la soluzione PBS non contiene magnesio o calcio in quanto potrebbero alterare l'adesione cellulare. - Smaltire il PBS nei tubi dopo la seconda centrifugazione e rimuovere il residuo buffy coat, se presente. Ripetere i punti 2.2.3 e 2.2.4 per la terza centrifugazione a cedere globuli rossi puliti.
- Miscelare la quantità richiesta (0,05, 0,1 e 0,15 ml) dei globuli rossi pulite con plasma (0,95, 0,9 e 0,85 ml) in una provetta 1 ml per ottenere RBC-sospensioni con il corrispondente (5%, 10% e 15% ) ematocrito. Controllare ematocrito con una microcentrifuga.
3. Fluidi Preparazione
Introdurre due fluidi nel doppio Y-microcanali: RBC-sospensioni e PBS.
- Aggiungere 60 ml di soluzione di particelle traccianti fluorescenti (solido 1%, d particella = 0. 86 micron, λ abs = 542 nm ed emissione λ = 612 nm) nelle provette da 1 ml RBC-sospensione.
NOTA: Le particelle traccianti fluorescenti (tinti internamente particelle di polistirene) vengono utilizzati per misurare la velocità del flusso all'interno del microcanale. Queste particelle fluorescenza quando esposto alla corrispondente lunghezza d'onda del fascio laser (λ = 542 nm). - Preparare una soluzione di PBS pH 7,4 e aggiungere 60 ml della stessa soluzione particelle traccianti fluorescenti in 1 ml di soluzione PBS.
4. Aggregati Misure Taglia
- Per inserire i fluidi (RBC-sospensioni e PBS) nel microcanali, utilizzare due siringhe in vetro da 25 ml e 100 ml. Questo saràcontribuire a ridurre la conformità del sistema. Collegare i microcanali alle siringhe con tubi e connettori montaggio i fori di ingresso. Riempire le siringhe di vetro utilizzando la differenza di pressione esistente tra il contenitore del liquido e la siringa. Assicurarsi che nessun bolle sono presenti nel sistema. Come metodo alternativo, utilizzare un sistema di controllo pressione per guidare entrambi i fluidi in microcanali.
- Posizionare il microcanali su una fase microscopio invertito collegato ad una telecamera ad alta velocità e sistema μPIV. Programma la pompa a siringa per le portate desiderate (ad esempio, Q = 2 microlitri / hr per sangue generare una portata di Q = 8 microlitri / hr per PBS).
NOTA: viene utilizzato solo una pompa a siringa. Utilizzando due diverse siringhe di vetro, con due diversi diametri interni, è possibile variare la portata entrare ogni ramo della Y-microcanali. - Inserire entrambi i fluidi nel doppio Y-microcanali ciascuno da un ramo di ingresso diverso e in diverse portate come mostrato in Figura 1. Al fine di testare diverse velocità di taglio, cambiare la portata della pompa. Questo mantiene lo stesso rapporto appropriato (in questo caso 4) fra i due rami 19 (figure 2 e 3). Attendere che il flusso per raggiungere lo stato stazionario prima di acquisire le misure: controllare visivamente le immagini della telecamera ad alta velocità per un flusso regolare.
NOTA: Il rapporto è fondamentale per ottenere un profilo di velocità lineare all'interno dello strato di anima. - Visualizzare i globuli rossi utilizzando la macchina fotografica ad alta velocità. Collegare la fotocamera a un computer per controllare, registrare e salvare le immagini del flusso del fluido. Una volta che i due flussi di fluido si stabilizzano, avviare la registrazione.
- Acquisire diverse immagini per ottenere migliori risultati di trattamento. Determinare un tempo di esposizione ottimale della telecamera per una chiara immagine degli aggregati.
NOTA: Il tempo di esposizione della fotocamera per questo caso era di 0,5 msec. La scelta di intervallo di tempo tra ogni fotogramma si basa sulla velocità di quadro telecamera e la portata in tegli microcanali. Il tempo tra ogni fotogramma trattati in questa procedura è stata di 60 msec. Pertanto una fotocamera in grado di registrare 18 fotogrammi al secondo è sufficiente.
NOTA: Evitare di sedimentazione del sangue nel tubo e la siringa, che potrebbe portare a errori di misurazione.
- Acquisire diverse immagini per ottenere migliori risultati di trattamento. Determinare un tempo di esposizione ottimale della telecamera per una chiara immagine degli aggregati.
- Usando tecniche di elaborazione delle immagini (un programma MATLAB in questo caso) inteso a migliorare la qualità dell'immagine, rilevare gli aggregati in ciascuna delle immagini basato su intensità di pixel (illustrato nella figura 4) come segue:
- Migliorare le immagini contrastano con il metodo istogramma pareggio per ottenere una migliore qualità dell'immagine per ogni fotogramma.
- Convertire le immagini in scala di grigi in immagini binarie. A questo scopo, impostare un valore di soglia, che varia da 0 a 1, che determina la conversione di ciascun pixel. Ogni pixel nell'immagine di sotto del valore di soglia sarà rilevato come un pixel nero, mentre i pixel con valori superiori alla soglia vengono rilevati come pixel bianchi.
- Riempire ilfori (se presente e necessario) corrispondenti alle lacune entro un aggregato per ottenere risultati migliori.
- Rilevare le cellule determinando pixel vicini bianchi nell'immagine binaria in modo che le cellule adiacenti sono associate come aggregati.
- Etichettare i diversi aggregati rilevati e convertire l'immagine binaria in immagine un rosso-verde-blu (RGB) per una migliore visualizzazione. Combinare i fotogrammi originali con ciascuna delle corrispondenti immagini elaborate per verificare l'efficienza della tecnica di elaborazione di immagini e di garantire che tutte le cellule sono presi in considerazione, come mostrato in Figura 5. Eseguire i punti 4.5.1, 4.5.2, 4.5.3 , 4.5.4 e 4.5.5 per tutti i fotogrammi acquisiti.
- Calcolare l'area di ogni aggregato rilevato nel frame in base al numero di pixel rilevati. Sulla base di ingrandimento obiettivo utilizzato, calcolare il fattore di conversione, utilizzando un reticolo di calibrazione, e convertire i risultati micron 2. Calcolare la media dei formati aggregati rilevati in ognitelaio e quindi la media dei risultati per tutti i frame per ottenere la dimensione media aggregata per ogni registrazione di RBC-sospensioni.
- Calcolare l'area di un RBC per determinare un numero rappresentativo stimato di globuli rossi all'interno di ogni aggregato rilevato. Utilizzando questi risultati, calcolare la distribuzione della percentuale di globuli rossi all'interno di ogni aggregato in funzione delle dimensioni di aggregazione (rappresentate dal numero stimato di cellule in ciascun aggregato), come mostrato in Figura 6.
NOTA: Per misurare gli aggregati RBC, il software ImageJ potrebbe essere utilizzato (invece di MATLAB) per eseguire le stesse operazioni in ogni fotogramma.
5. Fluido Velocità e Velocità di taglio Misure
Determinare la velocità del fluido e quindi la velocità di taglio utilizzando un sistema μPIV.
- Una volta che i dati viene eseguita utilizzando la macchina fotografica ad alta velocità, passare alla fotocamera doppio pulsato utilizzato per il sistema μPIV. Utilizzare un software di imaging per un'immagine acquisizione del flusso e l'elaborazione delle immagini per la determinazione campo di velocità.
- Prendere tutte le precauzioni necessarie, a seconda della classe del laser, prima di accendere il laser. Poi accendere il sistema, la fotocamera e il laser.
- Calibrare la fotocamera in base alla ingrandimento dell'obiettivo utilizzato. A questo scopo, utilizzare un microscala di 10 micron precisione al microscopio e impostare la dimensione di 1 pixel nell'immagine.
- Avviare il laser e visualizzare le particelle in entrambi i fluidi. Trova piano medio delle microchannel concentrandosi sulle particelle più veloci nel flusso (vale a dire, le particelle più veloci dovrebbero essere il più luminoso).
- Impostare la dt (intervallo di tempo tra due fotogrammi consecutivi) per garantire il corretto spostamento della particella. Le particelle più veloci devono muoversi circa 5 a 10 pixel tra le due immagini.
- Avviare la registrazione del flusso. Impostare il software per l'acquisizione di 100 coppie di immagini, 5 msec a parte. Eseguire le operazioni 5.4, 5.5 e 5.6 per tutta la difdi- RBC-sospensioni e per diverse velocità di taglio.
NOTA: Maggiori dettagli della metodologia sono riportati nello studio di Pitts e Fenech 20. - Elaborare le registrazioni acquisite utilizzando il metodo cross-correlazione con il software di imaging.
NOTA: Questo consiste discretizzare la coppia di immagini in piccole finestre di dimensioni prefissate (basata sul flusso del fluido e l'intervallo di tempo scelto dall'utente) chiamato finestre di correlazione e seguendo lo spostamento delle particelle in ogni finestra.- In primo luogo, verificare se le immagini acquisite richiedono pre-trattamento (compresa la sottrazione dello sfondo, "base-clipping" 21 o immagine sovrapposizione 22,23) per una migliore elaborazione dei dati.
- Quindi scegliere la dimensione della finestra di correlazione e la forma, nonché della percentuale di immagini sovrapposte. Uno studio dettagliato è stato eseguito da Pitts et al. 24 per determinare i parametri ottimali e le tecniche un'immagine pre-elaborazione per il sanguefluire in diverse configurazioni di canale. Esprimere i risultati come un campo di velocità media calcolata in base alle 100 coppie di immagini e l'errore quadratico medio (RMS) di velocità.
- Estrarre un profilo di velocità all'uscita del canale, dai dati elaborati come mostrato in figura 7. Per un migliore profilo, la media del campo di velocità nello spazio.
NOTA: Le barre che compongono il profilo di velocità corrisponde alla dimensione della finestra di correlazione scelto rispetto alla larghezza del canale. L'errore RMS di velocità è anche mostrato in figura 7, che rappresenta l'errore nella stima della velocità sperimentale. - Spegnere il laser una volta vengono eseguite tutte le misure ed elaborazione ,. Chiudere tutte le componenti del sistema: software, macchine fotografiche, palcoscenico in movimento, computer e laser.
- Per calcolare la velocità di taglio, prima di rilevare e stimare lo spessore sangue nei microcanali basate sulla registrazione telecamera ad alta velocità. A questo scopo, la media di tuttii fotogrammi nella registrazione specifica per ottenere una immagine di sfondo video. Delimitare il livello del sangue (come mostrato in figura 8 per i RBC sospensioni fluide a 10 microlitri / hr quando sospeso al 5%, 10% e 15% di ematocrito). Ottenere il valore di velocità per il corrispondente spessore dello strato di anima e calcolare la velocità di taglio dividendo il valore velocity lo spessore dello strato di anima.
Risultati
Un esempio di flusso a due fluidi nel doppio Y-microcanali è mostrato in Figura 2 per globuli rossi umani in sospensione al 5%, 10% e 15% di ematocrito e scorre a 10 microlitri / hr. La figura 3 mostra la differenza di dimensioni aggregazione quando il flusso nel canale si riduce da 10 microlitri / hr a 5 microlitri / hr per un ematocrito del 10%. Questo dà una nozione qualitativa delle dimensioni degli aggregati al variare l'ematocrito e velocità di taglio. Figura 5 segue lo spostamento dei quattro aggregati umane RBC, per tre fotogrammi consecutivi, fornendo una misura qualitativa del frame rate telecamera richiesta e la nozione qualitativa aggrega distribuzione all'interno di ogni fotogramma. In Figura 5, i piccoli aggregati (con RBC 8 o stimati) sono mostrati in blu, mentre aggregati medi (vanno 9-30 stimati RBC) e grandi aggregati (maggiore di 30 stimato RBC) sono mostrate rispettivamente in verde e rosso.
I profili di velocità delle diverse RBC-sospensione in tale canale vengono visualizzati in figura 7, dove le curve rossi, blu e verdi rappresentano i profili di velocità dei globuli rossi sospesi al 5%, 10% e 15% dell'ematocrito rispettivamente. Gli errori RMS della velocità, anche mostrata in Figura 7 per ogni RBC-sospensione, sono relativamente piccoli rispetto ai valori di velocità, che indica la precisione delle misure di velocità, e quindi tranciare tassi. Le posizioni di interfaccia sono indicati come 'E' e mostrati come linee continue nella stessa figura.
Le corrispondenti velocità di taglio per le diverse RBC sospensioni (in base ai profili di velocità e lo spessore dello strato di sangue) sono mostrati in Tabella 1. Le dimensioni aggregati medi determinati per ciascuna delle RBC sospensioni, in base al metodo di elaborazione delle immagini per rilevare la superficie degli aggregati RBC, sono mostrati in Figura 9, come functione del gradiente di velocità corrispondente. Un esempio della distribuzione della percentuale di globuli rossi all'interno di ogni aggregato è mostrato in Figura 6. Le dimensioni aggregati sono rappresentati come un numero stimato di RBC negli aggregati.
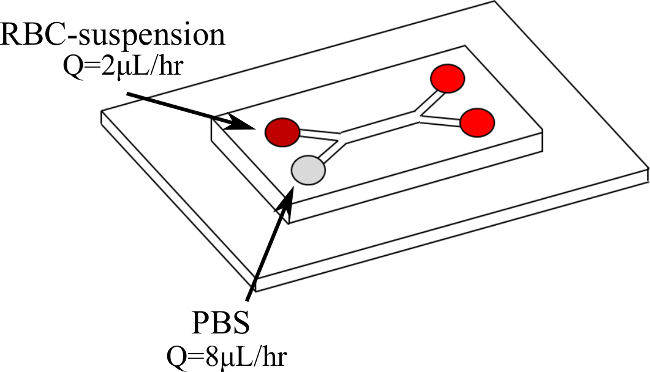
Figura 1. Doppia configurazione Y-microcanali e l'ingresso di fluidi. Il sangue entra il primo ramo a Q = 2 ml / h mentre PBS entra nel secondo ramo a Q = 8 ml / ora. Clicca qui per vedere una versione più grande di questa figura.

Figura 2. umana RBC-sospensione a differenti ematocrito. La cifra rappresenta cornici dei RBC-sospensioni umani che scorre a Q = 10 ml / ora a catturato (A) 5% (B)10% e (C) 15% di ematocrito. Cliccate qui per vedere una versione più grande di questa figura.

Figura 3. umana RBC-sospensione a diverse portate. La cifra rappresenta cornici dei globuli rossi umani in sospensione al 10% di ematocrito H fluide (A) Q = 10 ml / hr e (B) Q = 5 ml / h catturato. Cliccate qui per visualizzare una versione più grande di questa figura.

Figura 4. Diagramma di flusso del programma di elaborazione immagine utilizzata per la rilevazione di aggregazione. I passaggi indicati descrivono la metodologia di base. La qualità dell'immagine è aumentata ad essere c onverted a un'immagine binaria. Gli aggregati sono rilevati ed etichettati in base alle loro rispettive dimensioni. Clicca qui per vedere una versione più grande di questa figura.

Figura 5. RGB colorazione e il movimento netto dei vari RBC umana aggrega per tre fotogrammi consecutivi. La figura mostra il movimento netto di quattro aggregati rilevati in tre fotogrammi consecutivi in (A) t = 0 msec, (B) t = 60 msec e (C) t = 120 msec. I grandi aggregati (> 30 stimati globuli rossi), aggregati medi (9-30 RBC stimato) e piccoli aggregati (<8 stimati globuli rossi) sono indicati rispettivamente rosso, verde e blu. Ciascuno degli aggregati rilevati sono contrassegnati con un cerchio nero._blank "> Clicca qui per vedere una versione più grande di questa figura.
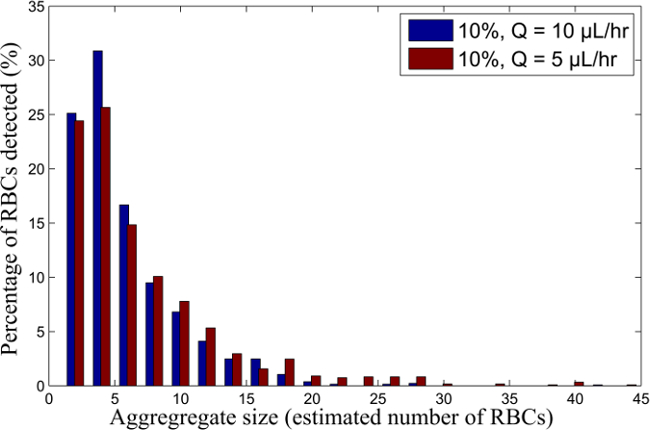
Figura 6. RBC distribuzione di dimensione aggregata per il 10% H RBC-sospensione per diverse portate. Distribuzione della dimensione aggregata per i campioni di sangue in sospensione al 10% H, che scorre a Q = 10 e 5 ml / h. Cliccate qui per vedere una versione più grande di questa figura.

Figura 7. Velocity confronto profilo di diversa ematocrito. I profili di velocità sono presenti per eritrociti nel plasma sospesi al 5% H (rosso), 10% H (blu), 15% H (verde) e simulazione 19 (linea continua) per la 120 x 60 micron doppio Y-microcanali con una Q = 10 ml / h. La posizione interfaccia è indicato con E per ilesperimenti. Vengono visualizzati i corrispondenti errori RMS dei diversi profili di velocità. Cliccate qui per vedere una versione più grande di questa figura.

Figura 8. Immagine di sfondo per le diverse RBC-sospensioni e delimitazione dello spessore dello strato di sangue. La figura mostra la delimitazione dello spessore dello strato sangue dei RBC-sospensioni fluide a 10 ml / ora sospesa in (A) del 5%, (B ) 10% e (C) 15% H. Cliccate qui per vedere una versione più grande di questa figura.

Figure 9. dimensioni medio complessivo in funzione dei corrispondenti shear rate. I risultati sono ottenuti per i diversi RBC-sospensioni fluide a Q = 10 ml / h al 5% (A), 10% (B) e il 15% H (C). Cliccate qui per vedere una versione più grande di questa figura.
| Ematocrito | Portata (ml / h) | Tasso Shear (sec -1) |
| 5% | 10 | 11.02 |
| 5% | 5 | 5.36 |
| 10% | 10 | 8.17 |
| 10% | 5 | 4.47 |
| 15% | 10 | 7.41 |
| 15% | 5 | 2.51 |
Tabella valori della frequenza 1. Shear per i diversi casi di flusso di sangue. I valori di taglio sono ottenuti utilizzando i dati e le immagini μPIV risultati di elaborazione per i diversi RBC-sospensioni con il 5%, il 10% e il 15% H, che scorre a Q = 10 ml / h e Q = 5 ml / h.
Discussione
Utilizzando il presente metodo, è possibile analizzare qualitativamente e quantitativamente la RBC aggrega in diverse condizioni di flusso e ematocriti. Per le prove di successo e rilevamento aggregato, è cruciale per determinare il rapporto di trasmissione appropriato tra i due fluidi all'ingresso microcanali. Questo rapporto è molto importante per ottenere uno spessore strato sangue ottimale in cui il profilo di velocità è quasi lineare 19.
Un altro fattore chiave per il test di successo è una buona qualità dell'immagine. Infatti, dato che il metodo si basa sulla elaborazione delle immagini, è molto importante avere un contrasto tra lo sfondo dell'immagine (il fluido all'interno del canale) e le particelle da rilevare. Qui, come mostrato nelle figure 2 e 3, le particelle sembrano essere più scuro dello sfondo, che aiuta nella rilevazione aggregata. Il parametro più importante da considerare per la tecnica di elaborazione delle immagini è il tValore hreshold. Pertanto, sulla base del contrasto ottenuto è fondamentale scegliere il valore di soglia ottimale per la presa tutti gli aggregati in considerazione, come mostrato in Figura 5. La presente segmentazione di immagini, utilizzato per questo studio, è ampiamente utilizzato per il rilevamento e il conteggio delle cellule 25- 27. Se la qualità dell'immagine non è come desiderato e un valore soglia globale non è appropriato, si può usare un algoritmo diverso per determinare il valore di soglia ottimale come metodo di Otsu 28 o un metodo di soglia adattativa (discretizzare l'immagine e ottenendo una soglia locale per ogni finestra discretizzata).
Un altro fattore da tenere in considerazione è il fattore di scala per una corretta conversione da pixel a micron.
Utilizzando il fattore di conversione corretto, si può determinare il diametro e lo spessore di uno RBC che servirà per determinare la distribuzione aggregata dimensioni (basata sulla stima number di globuli rossi in ogni aggregato). A seconda dell'orientamento degli aggregati, calcolare correttamente l'area su un RBC (frontale o laterale). Come menzionato nella sezione 4 (fase 4.4.1), è importante determinare il tempo di esposizione della fotocamera corretta e il frame rate per garantire che le proprietà dinamiche degli aggregati vengono catturati tra ogni frame consecutivi. Questo valore è basato sulla velocità di flusso utilizzato quando l'acquisizione delle misurazioni. Diversi altri fattori devono essere presi in considerazione quando acquisire risultati utilizzando il sistema μPIV e sono discussi chiaramente nello studio di Pitts e Fenech 20.
La metodologia è stata testata con successo su diversi RBC-sospensioni fluide a diversi ematocrito. Tuttavia, a causa della limitazione della tecnica di elaborazione delle immagini e la mancanza di contrasto tra lo sfondo dell'immagine e gli aggregati, è difficile rilevare la RBC aggrega per ematocriti elevati (dal 20% al 45%). Infatti, come accennatoprecedenza, la qualità dell'immagine è fondamentale per questa metodologia.
Usando questo protocollo, le dimensioni aggregate RBC può essere misurata in un dispositivo di microfluidica controllata e quindi è possibile ottenere informazioni sulla aggregazione RBC dinamicamente nella microcircolazione e ottenere le dimensioni aggregate RBC per una gamma di velocità di taglio fisiologici. E 'anche possibile integrare studi numerici e sperimentali della reologia del sangue e riguardano le dimensioni e il comportamento di aggregazione per studi clinici e patologici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dai scienze naturali e ingegneria Research Council del Canada. Microfabbricazione è stata effettuata con il supporto della struttura McGill Nanotools MicroFab alla McGill University e il Dipartimento di Elettronica presso la Carleton University.
Materiali
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
Riferimenti
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. . Red Blood Cell Aggregation. , (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. . Handbook of Hemorheology and Hemodynamics. , (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314 (2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302 (2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon