Method Article
Controlled Environment Mikrofluidik für dynamische Untersuchung der Aggregation roter Blutzellen
In diesem Artikel
Erratum Notice
Zusammenfassung
Das Protokoll beschriebenen Einzelheiten ein experimentelles Verfahren, um rote Blutzellen (RBC) Aggregate unter einer kontrollierten und konstanten Scherrate zu quantifizieren, auf Basis von Bildverarbeitungstechniken. Das Ziel des Protokolls ist es, RBC Aggregatgrößen an den entsprechenden Schergeschwindigkeit kontrolliert mikrofluidischen Umwelt beziehen.
Zusammenfassung
Blut als nicht-Newtonsche Biofluid, stellt die Gegenstand zahlreicher Studien im Hämorheologie Feldes. Blutbestandteile sind rote Blutkörperchen, weiße Blutkörperchen und Blutplättchen, die im Blutplasma suspendiert sind. Aufgrund der Fülle der RBCs (40% bis 45% des Blutvolumens) diktiert ihr Verhalten, das rheologische Verhalten von Blut besonders in der Mikrozirkulation. Bei sehr niedrigen Scherraten werden RBCs gesehen zu montieren und Form Entitäten, die als Aggregate, die das nicht-Newtonsche Verhalten von Blut bewirkt. Es ist wichtig, die Bedingungen der Granulatbildung zu verstehen, um die Rheologie des Blutes in die Mikrozirkulation zu verstehen. Das hier beschriebene Protokoll beschreibt die experimentelle Vorgehensweise, um die RBC-Aggregate in der Mikrozirkulation unter konstanten Scherrate quantitativ zu bestimmen, basierend auf Bildverarbeitung. Zu diesem Zweck werden RBC-Suspensionen geprüft und 120 x 60 & mgr; m Poly-Dimethyl-Siloxan (PDMS) Mikrokanäle analysiert. Die RBC-Suspensionen sind entregnete es mit einem zweiten Fluid, um eine lineare Geschwindigkeitsprofil innerhalb des Blutschicht zu erhalten und somit eine Vielzahl von konstanten Scherraten. Die Schergeschwindigkeit ist mit einem Mikro Particle Image Velocimetry (μPIV) Systems bestimmt, während RBC Aggregate werden mit einer Hochgeschwindigkeitskamera sichtbar gemacht. Die der RBC Aggregate aufgenommenen Videos unter Verwendung von Bildverarbeitungstechniken, um die Aggregatgrößen basierend auf den Bildern Intensitäten zu bestimmen.
Einleitung
Rote Blutkörperchen (Erythrozyten) spielen eine entscheidende Rolle bei der Bestimmung des rheologischen Verhaltens von Blut. Sie sind fast einzigartig für die besonderen Eigenschaften von Blut in vitro und in vivo verantwortlich ist. Unter physiologischen Bedingungen RBCs besetzen 40% bis 45% des Blutvolumens. Der Mikrozirkulation, RBCs nur besetzen bis zu 20% des Blutvolumens durch kleinere Gefäßdurchmesser und dem Plasma skimming effect 1. Dieses Phänomen der Plasmareduktion in der Mikrozirkulation als Fahraeus Wirkung bekannt. Bei niedrigen Schergeschwindigkeiten sind RBCs in der Lage über die Bridge und bilden eine oder dreidimensionale Strukturen genannt "Geldrollen" oder Aggregaten, die damit verbundenen Auswirkungen auf die nicht-Newtonsche Verhalten von Blut. Jedoch ist der Mechanismus der RBC Aggregation nicht vollständig verstanden. Zwei Theorien existieren, um die Aggregation von Erythrozyten zu modellieren: die Überbrückung von Zellen Theorie aufgrund der Quervernetzung der Makromoleküle 2 und dem Kraft attraktion Theorie durch Verarmung der Moleküle aufgrund der osmotischen Gradienten 3 verursacht.
Typischerweise ist für menschliches Blut, Aggregate bilden bei sehr niedrigen Scherraten 4 im Bereich von 1 bis 10 s -1 aufweist. Oberhalb dieses Bereichs neigen Erythrozyten zu zerlegen und separat zu fließen innerhalb des Gefäßes.
Das Verständnis der Bedingungen der Aggregate Bildung eines großen Wert auf die Hämorheologie Bereich in Bezug auf die Definition rheologische Verhalten Blut. Diese Aggregate werden oft an der Makrozirkulation Niveau (> 300 & mgr; m Durchmesser) 5 zu sehen. An diesem Maßstab wird Blut als Newtonsche Flüssigkeit und einer homogenen Mischung berücksichtigt. Jedoch werden diese Aggregate seltener im Kapillarebene (4-10 & mgr; m im Durchmesser) zu sehen sind und in der Regel ein Hinweis auf pathologische Zustände wie Diabetes 6 und Fettleibigkeit. Andere pathologische Zustände, die verändern könnten RBC Aggregation gehören entzündlich oder infektiös Bedingungenkardiovaskuläre Erkrankungen wie Bluthochdruck oder Arteriosklerose, genetischen Erkrankungen und chronische Erkrankungen 7. Daher steht die RBC Aggregationsmechanismus und Analysieren dieser Entitäten (durch Definition einer Beziehung zwischen der Größe dieser Aggregate und der Strömungsverhältnisse) könnte zum Verständnis der microrheological Verhalten von Blut führen und somit in Beziehung zu klinischen Anwendungen.
RBC Aggregate kann durch verschiedene Faktoren wie der Hämatokrit (Volumen von RBCs in Blut), der Scherrate, des Gefäßdurchmessers, der RBC-Membransteifigkeit und dem Suspendiermedium Zusammensetzung 8-10 verändert werden. Daher werden kontrollierten Bedingungen, um die RBC-Aggregate effektiv zu analysieren erforderlich. Mehrere Verfahren sind in der Lage, die Aggregatbildung durch statische Messungen Aggregation (Aggregationsindex) zu analysieren, die relevanten Informationen über Blut Verhalten bietet. Diese Verfahren umfassen unter anderem die BlutsenkungsgeschwindigkeitVerfahren 11, die Lichtübertragungsverfahren 12, die Lichtreflexionsverfahren 13 und die niedrige Scherviskosität Verfahren 14.
Einige Studien haben versucht, RBC Aggregation untersuchen und bestimmen den Grad der Aggregation in kontrollierten Strömungsverhältnissen 15-17. Allerdings sind diese Studien indirekt untersuchen RBC Aggregatgrößen durch Bestimmen des Verhältnisses der belegten Raum in einem Schersystem gemessen basierend auf mikroskopische Blutbilder die Informationen über den Grad der Aggregation als auch der lokalen Viskosität.
Wir stellen daher ein neues Verfahren, um direkt zu quantifizieren RBC-Aggregate in der Mikrozirkulation, dynamisch, unter kontrollierten und konstanten Scherraten. RBC-Suspensionen werden mitgerissen, in einem doppelten Y-Mikrokanal (wie in Figur 1 dargestellt), mit einer phosphatgepufferten Salzlösung (PBS) somit die Schaffung einer Scherströmung in der Blutschicht. Innerhalb dieser Blutschicht eine konstante Shear Rate erhalten werden kann. Die RBC-Suspensionen bei verschiedenen Hämatokrit (H) Ebenen (5%, 10% und 15%) und unter verschiedenen Scherraten (2-11 sec -1) getestet. Die Blutgeschwindigkeit und Schergeschwindigkeit werden mit einem Mikro Particle Image Velocimetry (μPIV) System, während die Strömung visualisiert mit einer Hochgeschwindigkeitskamera bestimmt. Die erhaltenen Ergebnisse werden dann mit einem MATLAB-Code basierend auf den Bildintensitäten, um die RBCs erfassen und Aggregatgrößen verarbeitet.
Protokoll
Blut von gesunden Personen mit Zustimmung der Ethikkommission der Universität Ottawa (H11-13-06) gesammelt.
1. Mikrokanal Fabrication
Die Mikrokanäle werden basierend auf den Standard-Photolithographieverfahren 18 hergestellt.
- Entwerfen Sie die Mikrokanalgeometrie mit einem Design-Software Computer Aided (CAD) und drucken Sie die Konfiguration auf einer Transparenz Photomaske. Diese Masken sind von entscheidender Bedeutung, da sie die Lichtpfad aufgrund während des Herstellungsprozesses. In diesem Fall sind die Mikrokanalabmessungen betragen 120 & mgr; m in der Dicke, 60 & mgr; m in der Tiefe und 7 mm in der Länge.
- In einem Reinraum, Schleuderbeschichtung ein Epoxidharz auf der Basis negativer Photoresist auf einem Siliciumwafer bei 2000 Upm für 30 s, um die gewünschte Mikrokanaltiefe (60 um) zu erhalten.
- Aussetzen des Wafers und der Photomaske unter einer UV-Lampe bei 650 mJ / cm 2 für 70 sec. Stellen Sie sicher, dass nur die transparenten Bereiche des ExposesPhotomaske auf die UV-Licht. Die Belichtung der lichtdurchlässigen Bereiche können für die Polymerisation der Ketten, was zu einer Härtung der Photolack. Tauchen Sie die Siliziumstück in einen Entwickler, um mehr als Photolack zu entfernen.
- Sobald die Form gefertigt, Mix ein Siliciumbasiertes Elastomer und ein Härtungsmittel in einem Verhältnis von 10: 1, um eine Lösung von Poly-Dimethyl-Siloxan (PDMS) zu erstellen. Legen Sie die PDMS-Lösung in einer Vakuumkammer zu entgasen. Gieße es in die Form und erhitzt bei 60 ° C für 90 min, um Mikrokanäle zu schaffen. Dann binden die einzelnen Kanäle auf einem Glasobjektträger unter Verwendung von Sauerstoffplasma Ausgleich für 90 sec.
HINWEIS: Die PDMS entgasen Vorgang ist notwendig, um die Luftblasen durch den Mischvorgang erzeugt beseitigen geführt. - Stellen Sie sicher, dass die Mikrokanalabmessungen ermöglichen die erfolgreiche Prüfung. In diesem Protokoll werden die Mikrokanäle einen rechteckigen Querschnitt von 120 x 60 um. Im Vergleich dazu hat eine durchschnittliche RBC einen Durchmesser von 8 um und einer Dicke von 2 um. DieDaher liegt der Mikrokanalbreite ausreichend, um angemessene Aggregation zu beobachten und genau zu bestimmen, die Geschwindigkeitsprofile.
2. Blut Vorbereitung
- Sammeln Blut von gesunden freiwilligen Spendern, nach Zustimmung einer Ethikkommission. Behandeln Sie das Blut mit Ethylendiamintetraessigsäure (EDTA) in den Sammelröhrchen vorhanden (7,2 mg EDTA in 4 ml Blut).
HINWEIS: Das EDTA wird verwendet, um die Blutgerinnung zu vermeiden. - Zentrifugieren Sie die Blutproben dreimal für 10 Minuten bei 1.400 xg (3000 rpm), um die Blutbestandteile zu trennen. Als Folge der Zentrifugation beobachten drei unterschiedliche Schichten.
HINWEIS: Die drei Schichten sind die RBC-Schicht (an der Unterseite des Rohres angeordnet ist), der Leukozytenfilm (bestehend aus weißen Blutkörperchen und Blutplättchen auf der RBC-Schicht angeordnet ist) und der Plasmaschicht (über allen der anderen befindet Bestandteile).- Nach der ersten Zentrifugation, sammeln Blutplasma mit Hilfe eines Blut Pipette. Vermeiden Sie contakt mit der Buffy-Coat.
- Sammeln und entsorgen der Buffy-Coat in einem Behälter mit Bleichmittel auf 10% verdünnt.
- 3 ml PBS, pH 7,4, zu jeder der Röhren mit dem restlichen RBC-Schicht und sorgen für die richtige Balance zwischen der Zentrifuge. Wieder sanft die Rohre und Zentrifuge bei 1.400 xg mischen (3.000 rpm) für 10 min.
HINWEIS: Stellen Sie sicher, dass die PBS-Lösung keine Magnesium oder Calcium enthalten, da sie die Zelladhäsion verändern könnten. - Entsorgen Sie die PBS in den Rohren nach der zweiten Zentrifugation und entfernen Sie die restlichen Speckhaut, falls vorhanden. Wiederholen Sie die Schritte 2.2.3 und 2.2.4 für die dritte Zentrifugation, um saubere RBCs ergeben.
- Mischen Sie die erforderliche Menge (0,05, 0,1 und 0,15 ml) der Rein RBCs mit Plasma (0,95, 0,9 und 0,85 ml) in einem 1-ml-Röhrchen, um RBC-Suspensionen mit der entsprechenden (5% zu erhalten, 10% und 15% ) Hämatokrit. Überprüfen Hämatokritwerte mit einer Mikrozentrifuge.
3. Flüssigkeiten Vorbereitung
Führen Sie zwei Flüssigkeiten im Doppel Y-Mikrokanal: RBC-Suspensionen und PBS.
- In 60 ul des fluoreszierenden Tracerpartikel-Lösung (1% Feststoff, d Partikel = 0 ist. 86 & mgr; m, ABS λ = 542 nm und λ = 612 nm Emissions) in die 1 ml RBC-Suspension Röhren.
HINWEIS: Die fluoreszierenden Markierungspartikel (intern gefärbte Polystyrol-Partikel) verwendet werden, um die Geschwindigkeit der Strömung innerhalb des Mikrokanals zu messen. Diese Partikel fluoreszieren, wenn auf die entsprechende Wellenlänge des Laserstrahls (λ = 542 nm) belichtet. - Vorbereitung einer PBS pH 7,4-Lösung und mit 60 ul der gleichen fluoreszierenden Markierungspartikel-Lösung in 1 ml PBS-Lösung.
4. Aggregates Größenmessungen
- Um die Flüssigkeiten (RBC-Suspensionen und PBS) in den Mikrokanal einzufügen, verwenden Sie zwei Glasspritzen von 25 ul und 100 ul. Dies wirddazu beitragen, die Einhaltung des Systems zu verringern. Schließen Sie die Mikrokanal, um die Spritzen über Schläuche und Anschlüsse Montage der Eintrittslöcher. Füllen Sie die Glasspritzen mit der Druckdifferenz, die zwischen dem Flüssigkeitsbehälter und die Spritze. Achten Sie darauf, keine Luftblasen in dem System vorhanden sind. Als ein alternatives Verfahren ist ein Druckregelstrecke, beide Flüssigkeiten in den Mikrokanal zu treiben.
- Setzen Sie den Mikrokanal auf einem inversen Mikroskop Bühne zu einer Hochgeschwindigkeitskamera und einem μPIV System verbunden. Programm die Spritzenpumpe mit den gewünschten Flussraten (beispielsweise Q = 2 & mgr; l / h für Blut verleihen eine Strömungsrate von Q = 8 & mgr; l / h für PBS).
HINWEIS: Nur eine Spritzenpumpe verwendet wird. Verwendung von zwei unterschiedlichen Glasspritzen mit zwei verschiedenen Innendurchmessern, ist es möglich, auf die Strömungsrate der Eingabe jedes Zweig des Y-Mikrokanal zu variieren. - Stecken Sie die beiden Flüssigkeiten im Doppel Y-Mikrokanal jeweils von einem anderen Eintrag Zweig und bei verschiedenen Durchflussmengen, wie in 1. Um die unterschiedlichen Schergeschwindigkeiten zu testen, ändern Sie den Pumpendurchfluss. Dies hält die gleichen geeigneten Verhältnis (4 in diesem Fall), die zwischen den beiden Zweigen 19 (2 und 3). Warten Sie auf den Fluss zu stabilen Zustand vor dem Erwerb der Messungen zu erreichen: Sichtprüfung der Hochgeschwindigkeitskamera Bilder für einen reibungslosen Ablauf.
ANMERKUNG: Das Verhältnis ist wesentlich, um eine lineare Geschwindigkeitsprofil innerhalb des Blutschicht. - Visualisieren Sie die RBCs mit der Hochgeschwindigkeitskamera. Schließen Sie die Kamera an einen Computer zu steuern, aufnehmen und speichern Sie die Bilder der Fluidströmung. Sobald die beiden Flüssigkeitsströme zu erreichen steady state, starten Sie die Aufnahme.
- Erwerben Sie mehrere Bilder für eine bessere Bearbeitungsergebnisse. Bestimmen Sie die optimale Kamerabelichtungszeit für ein klares Bild der Aggregate.
HINWEIS: Die Belichtungszeit der Kamera für diesen Fall beträgt 0,5 msec. Die Wahl des Zeitintervalls zwischen jedem Rahmen auf der Kamerageschwindigkeit und der Strömungsgeschwindigkeit in t basierender Mikrokanal. Die Zeit zwischen jeder in diesem Verfahren verarbeiteten Rahmen betrug 60 msec. Daher ist eine Kamera zum Aufzeichnen von 18 Bildern pro Sekunde ausreichend.
Hinweis: Vermeiden Sie Blut Absetzen in dem Rohr und Spritze, die zu Fehlmessungen führen können.
- Erwerben Sie mehrere Bilder für eine bessere Bearbeitungsergebnisse. Bestimmen Sie die optimale Kamerabelichtungszeit für ein klares Bild der Aggregate.
- Verwendung von Bildverarbeitungstechniken (a MATLAB-Programm in diesem Fall), die Bildqualität zu verbessern, detektieren die Aggregate in jedem der Bilder basierend auf Pixelintensitäten (in 4 dargestellt), wie folgt:
- Verbessern Sie die Bilder mit Hilfe der Histogramm Kontrast Equalizer Methode, um eine bessere Bildqualität für jeden Rahmen erhalten.
- Konvertieren Sie die Graustufenbilder in binäre Bilder. Zu diesem Zweck einen Schwellenwert, die von 0 bis 1, die die Umwandlung eines jeden Pixels bestimmt. Jeder Pixel in dem Bild unter dem Schwellenwert werden als schwarze Pixel erkannt werden, während die Bildelemente mit Werten größer als der Schwellenwert wird als weißes Pixel erkannt werden.
- Füllen Sie dasLöcher (falls vorhanden und notwendig), die den Lücken in einem Aggregat für bessere Ergebnisse.
- Detektieren die Zellen durch Bestimmen benachbarter weiße Pixel in dem binären Bild, so daß benachbarte Zellen als Aggregate verbunden.
- Beschriften Sie die verschiedenen Aggregate detektiert und konvertieren Sie die binäre Bild in eine Rot-Grün-Blau (RGB) Bild zur besseren Visualisierung. Verbinden die Originalrahmen mit jeder der entsprechenden verarbeiteten Bilder, um die Effizienz der Bildverarbeitungstechnik zu überprüfen und sicherzustellen, dass alle Zellen in Betracht gezogen werden, wie in Figur 5 gezeigt ist. Die Schritte 4.5.1, 4.5.2, 4.5.3 , 4.5.4 und 4.5.5 für alle Frames eingefangen.
- Berechnen der Fläche jeder der Rahmen basierend auf der Anzahl von Pixeln detektiert Aggregat. Auf der Basis der Linsenvergrößerung verwendet, berechnen Sie den Umrechnungsfaktor, mit Hilfe einer Eichfadenkreuz, und konvertieren Sie die Ergebnisse in & mgr; m 2. Der Mittelwert der Aggregatgrößen in jeder erkanntRahmen und dann der Mittelwert der Ergebnisse für alle Rahmen, um die durchschnittliche Aggregatgröße für jede Aufnahme der RBC-Suspensionen zu erhalten.
- Berechnung der Fläche eines RBC einen Vertreter geschätzte Anzahl von RBCs innerhalb jedes detektierten Gesamt bestimmen. Unter Verwendung dieser Ergebnisse, die Berechnung der Verteilung der Prozentsatz der RBCs innerhalb jedes Aggregats in Abhängigkeit von der Aggregatgrößen (durch die geschätzte Anzahl der Zellen in jeder Sammel dargestellt), wie in 6 gezeigt.
ANMERKUNG: Um die RBC Aggregate zu messen, könnte ImageJ Software (anstelle von MATLAB) verwendet, um dieselben Aktionen für jeden Rahmen durchzuführen.
5. Fluidgeschwindigkeit und Schergeschwindigkeit Messungen
Bestimmen Sie die Strömungsgeschwindigkeit und damit die Schergeschwindigkeit mit einem μPIV System.
- Sobald die Daten unter Verwendung des Hochgeschwindigkeitskamera erfasst, schaltet der Doppelimpuls Kamera zum μPIV System verwendet. Verwenden Sie eine Bildverarbeitungssoftware für die BildwechselErwerb der Strömung und der Bildverarbeitung für die Feldgeschwindigkeitsbestimmung.
- Nehmen Sie alle notwendigen Vorsichtsmaßnahmen, abhängig von der Klasse des Lasers, bevor Sie den Laser. Dann schalten Sie das System, die Kamera und den Laser.
- Kalibrieren der Kamera auf der Basis der Linsenvergrößerung eingesetzt. Zu diesem Zweck verwenden Sie eine Mikro von 10 um Präzision unter dem Mikroskop und stellen Sie die Größe von 1 Pixel im Bild.
- Starten Sie den Laser und visualisieren die Partikel in den beiden Flüssigkeiten. Suche nach der Mittelebene der Mikrokanal durch die Konzentration auf die schnellsten Teilchen in der Strömung (das heißt, die schnellste Partikel sollten das hellste sein).
- Gesetzt den dt (Zeitintervall zwischen zwei aufeinanderfolgenden Frames), um die richtige Versetzung der Partikel zu gewährleisten. Die schnellsten Partikel sollten zwischen den beiden Bildern zu bewegen etwa 5 bis 10 Pixel.
- Starten Sie die Aufnahme der Strömung. Legen Sie die Software auf 100 Bildpaare, 5 ms auseinander zu erwerben. Führen Sie die Schritte 5.4, 5.5 und 5.6 für die ganze difschiedlichen RBC-Suspensionen und für verschiedene Scherraten.
HINWEIS: Weitere Details der Methode sind in der Studie von Pitts und Fenech 20 angegeben. - Verarbeiten Sie die mit dem Kreuzkorrelationsverfahren mit der Bildbearbeitungssoftware erworben Aufnahmen.
ANMERKUNG: Diese besteht aus der Diskretisierung des Paares von Bildern in kleine Fenster von vorbestimmter Größe (bezogen auf den Fluidstrom und dem durch den Benutzer ausgewählten Zeitintervall) genannt Korrelationsfenstern und nach der Verschiebung der Teilchen in jedem Fenster.- Erstens, festzustellen, ob die erfassten Bilder die Vorverarbeitung (einschließlich Hintergrundabzug, "base-Clipping" 21 oder überlappenden Bild 22,23) für eine bessere Datenverarbeitung.
- Dann wählen Sie den Korrelationsfenster Größe und Form, sowie der Prozentsatz der Bilder überlappen. Eine detaillierte Studie wurde von Pitts et al 24 durchgeführt., Um die optimalen Parameter und Bildvorverarbeitung Techniken zum Blut zu bestimmenfließen in verschiedenen Kanalkonfigurationen. Die Ergebnisse sind als eine durchschnittliche Geschwindigkeitsfeld von den 100 Bildpaare und die Fehler Root Mean Square (RMS) in der Geschwindigkeit berechnet.
- Extrahieren eines Geschwindigkeitsprofils am Kanalausgang, aus den verarbeiteten Daten, wie in Abbildung 7 dargestellt. Für ein besseres Profil, ist der Mittelwert der Geschwindigkeitsfeld im Raum.
HINWEIS: Die Balken Zusammensetzen des Geschwindigkeitsprofils entsprechen der relativ zu der Kanalbreite gewählt Korrelationsfenstergröße. Der Fehler in der Geschwindigkeit RMS ist auch in Figur 7 gezeigt, die den Fehler in der experimentellen Geschwindigkeitsschätzung. - Den Laser auszuschalten, wenn alle Messungen und die Verarbeitung durchgeführt werden ,. Beenden Sie alle Komponenten des Systems: Software, Kameras, Bewegung Bühne, Computer und Laser.
- Um die Schergeschwindigkeit zu berechnen, zuerst erkennen und schätzen die Blutdicke in den Mikrokanal auf der Grundlage des Hochgeschwindigkeitskamera-Aufzeichnung. Zu diesem Zweck, ist der Mittelwert allerdie Rahmen in der spezifischen Aufzeichnungs ein Hintergrundbild des Videos zu erzielen. Begrenzen die Blutschicht (wie in Figur 8 für die RBC-Suspensionen bei 10 ul / h fließt, wenn bei 5%, 10% und 15% Hämatokrit suspendiert gezeigt). Besorgen Sie sich die Velocity-Wert für das entsprechende Blutschichtdicke und die Berechnung der Scherrate durch Teilen der Geschwindigkeitswert durch das Blut Schichtdicke.
Ergebnisse
Ein Beispiel der Zwei-Fluid-Strömung in der doppelten Y-Mikrokanal ist in Abbildung 2 für die menschliche RBCs bei 5%, 10% und 15% Hämatokrit suspendiert und bei 10 & mgr; l / h fließt gezeigt ist. Figur 3 zeigt den Unterschied in der Aggregatgrößen, wenn die Strömung in dem Kanal wird aus 10 & mgr; l / h bis 5 & mgr; l / h für einen Hämatokrit von 10% reduziert. Dies ergibt eine qualitative Vorstellung von der Grße der Aggregate beim Variieren der Hämatokrit und der Schergeschwindigkeit, Fig. 5 folgt der Verschiebung der vier menschlichen RBC Aggregate, in drei aufeinanderfolgenden Rahmen, die eine qualitative Messung der Kamerageschwindigkeit erforderlich ist, und qualitative Vorstellung vom Aggregate Verteilung innerhalb jedes Rahmens. In Abbildung 5 sind die kleine Aggregate (mit 8 oder weniger voraus Erythrozyten) in blau dargestellt, während mittlere Aggregate (von 9-30 geschätzt, Erythrozyten) und große Aggregate (größer als 30 geschätzt, RBC) in grün und rot dargestellt.
Die Geschwindigkeitsprofile der verschiedenen RBC-Suspensionen im Kanal sind in Figur 7, wo die roten, blauen und grünen Kurven stellen die Geschwindigkeitsprofile der RBCs bei 5%, 10% und 15% Hämatokrit suspendiert angezeigten jeweils. Im Vergleich mit den Geschwindigkeitswerten der RMS-Fehler der Geschwindigkeit, auch in Figur 7 für jede RBC-Suspension angezeigt wird, relativ klein sind, was die Genauigkeit der Geschwindigkeitsmessung, und daher Scherraten. Den Schnittstellen werden als "E" bezeichnet und als die durchgezogenen Linien in derselben Figur gezeigt.
Die entsprechenden Schergeschwindigkeiten für die verschiedenen RBC-Suspensionen (basierend auf der Geschwindigkeitsprofile und der Blutschichtdicke) sind in Tabelle 1 dargestellt. Die durchschnittliche Aggregatgrößen für jeden der RBC-Suspensionen bestimmt, basierend auf dem Bildverarbeitungsverfahren, um die Erfassungs Bereich der RBC-Aggregate sind in Figur 9 gezeigt, als FunktIonen des entsprechenden Scherrate. Ein Beispiel der Verteilung der Prozentsatz der RBCs in jedem Aggregat wird in 6 gezeigt. Die Aggregatgrößen werden als eine geschätzte Anzahl von RBC in den Aggregaten dargestellt.
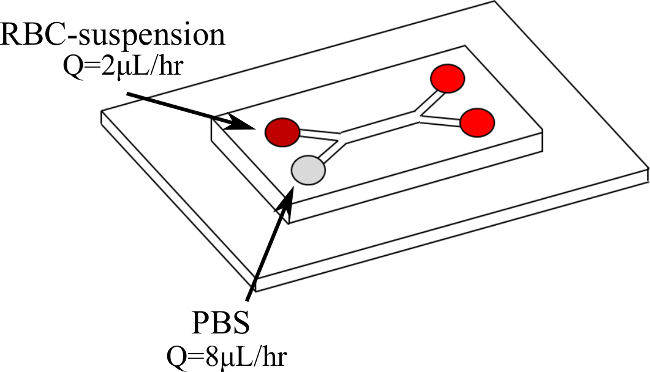
Abbildung 1. Double Y-Mikrokanalkonfiguration und Eintrag Flüssigkeiten. Blut tritt in die erste Zweigstelle in Q = 2 & mgr; l / h, während PBS in den zweiten Zweig bei Q = 8 & mgr; l / Std. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Menschen RBC-Suspension bei verschiedenen Hämatokrit. Die Figur stellt aufgenommenen Bilder der menschlichen RBC-Suspensionen bei fließenden bei Q = 10 & mgr; l / h (A) 5% (B)10% und (C) 15% Hämatokrit. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Menschen RBC-Suspension bei verschiedenen Fließgeschwindigkeiten. Die Figur stellt aufgenommenen Bilder der menschlichen roten Blutkörperchen bei 10% Hämatokrit H ausgesetzt fließt (A) Q = 10 & mgr; l / h und (B) Q = 5 & mgr; l / Std. Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.

Abbildung 4. Flussdiagramm des Bildverarbeitungsprogramm für die Gesamterfassung verwendet. Die gezeigten beschreiben die grundlegende Methodik Schritte. Die Qualität des Bildes wird verbessert, um C in ein Binärbild onverted. Die Aggregate werden erkannt und auf der Grundlage ihrer jeweiligen Größen gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5: Rgb-Farben und Nettobewegung der verschiedenen menschlichen RBC Aggregate in drei aufeinanderfolgenden Rahmen. Die Abbildung zeigt die Nettobewegung von vier in drei aufeinander folgenden Frames an (A) t = 0 ms, (B) t = 60 ms erkannt und Aggregate (C) t = 120 ms. Die große Aggregate (> 30 geschätzt Erythrozyten), mittlere Aggregate (9-30 geschätzt Erythrozyten) und kleine Aggregate (<8 geschätzt Erythrozyten) sind rot, grün und blau dargestellt. Jedes der detektierten Aggregate sind mit einem schwarzen Kreis gekennzeichnet._blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
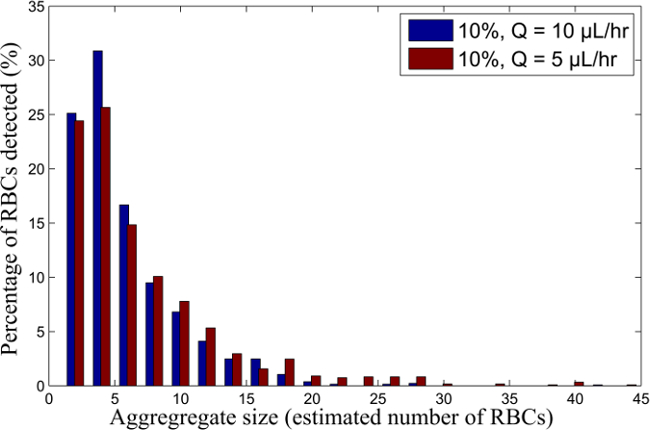
Abbildung 6. RBC Aggregatgrößenverteilung von 10% H RBC-Suspension für verschiedene Durchflussraten. Aggregatgrößenverteilung für Blutproben mit 10% H ausgesetzt, bei Q = 10 fließt und 5 ul / h. Bitte klicken Sie hier, um eine größere Version zu sehen von dieser Figur.

Abbildung 7. Geschwindigkeitsprofil Vergleich für verschiedene Hämatokrit. Die Geschwindigkeitsprofile sind für Erythrozyten in Plasma bei 5% H (rot), 10% H (blau), 15% H (grün) und Simulation 19 (durchgezogene Linie) für die aufgehängt gezeigt 120 x 60 & mgr; m Doppel Y-Mikrokanal mit einem Q = 10 & mgr; l / h. Die Schnittstelle Standort wird durch E für die bezeichneteExperimente. Die entsprechenden RMS-Fehler der verschiedenen Geschwindigkeitsprofilen angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 8. Hintergrundbild für die verschiedenen RBC-Suspensionen und Abgrenzung des Blutschichtdicke. Die Abbildung zeigt die Begrenzung des Blutschichtdicke der RBC-Suspensionen bei 10 & mgr; fließt / h bei (A) 5%, (B suspendiert ) 10% und (C) 15% H. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Figure 9. Durchschnittliche Aggregatgrößen in Abhängigkeit von den entsprechenden Scherraten. Die Ergebnisse werden für die verschiedenen RBC-Suspensionen bei 5% (A), 10% (B) und 15% H (C) fließt bei Q = 10 & mgr; l / h erhalten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Hämatokrit | Durchfluss (ul / h) | Scherrate (s -1) |
| 5% | 10 | 11.02 |
| 5% | 5 | 5.36 |
| 10% | 10 | 8.17 |
| 10% | 5 | 4.47 |
| 15% | 10 | 7.41 |
| 15% | 5 | 2.51 |
Tabelle 1 Schergeschwindigkeit Werte für verschiedene Blutfluss Fällen. Die Scherrate Werte werden unter Verwendung der μPIV Daten- und Bildverarbeitungsergebnisse für verschiedene RBC-Suspensionen mit 5%, 10% und 15% H erhalten, bei Q = 10 & mgr; l / h fließt und Q = 5 & mgr; l / h beträgt.
Diskussion
Unter Verwendung der vorliegenden Methode ist es möglich, qualitativ und quantitativ analysiert die RBC-Aggregate unter verschiedenen Strömungsbedingungen und Hämatokritwerten. Für die erfolgreiche Prüfung und Aggregat Detektion ist es von entscheidender Bedeutung, um den entsprechenden Geschwindigkeitsverhältnis zwischen den beiden Fluiden an der Mikrokanaleintrag zu bestimmen. Dieses Verhältnis ist sehr wichtig, um eine optimale Blutschichtdicke, wo das Geschwindigkeitsprofil quasi lineare 19 erhalten.
Ein weiterer wichtiger Faktor für die erfolgreiche Prüfung ist eine gute Bildqualität. In der Tat, da das Verfahren auf der Bildverarbeitung basiert, ist es sehr wichtig, um einen Kontrast zwischen der Hintergrundbild (der Flüssigkeit im Inneren des Kanals) und der zu erfassenden Partikel haben. Hier, wie in den 2 und 3 gezeigt ist, erscheinen die Teilchen dunkler als der Hintergrund, die im Aggregat Detektions hilft sein. Der wichtigste Parameter für die Bildverarbeitungstechnik prüfen, ist die threshold Wert. Daher, basierend auf dem Kontrast erhalten ist es wichtig, den optimalen Schwellenwert, wo alle Aggregate werden in Betracht gezogen werden, wie in 5 gezeigt zu wählen. Die vorliegende Bildsegmentierung für diese Untersuchung verwendet wird, wird weit verbreitet für eine Zellenerfassung und Zählen verwendet 25- 27. Wenn die Qualität des Bildes ist nicht wie gewünscht, und ein globaler Schwellenwert nicht geeignet ist, kann man einen anderen Algorithmus, um den optimalen Schwellenwert zu ermitteln, wie Otsu-Verfahren 28 oder einer adaptiven Schwellenwertmethode (Diskretisierung des Bildes und Erhalt einer lokalen Schwelle für jeden diskretisierten Fenster).
Ein weiterer Faktor zu berücksichtigen, ist der Skalierungsfaktor für eine korrekte Konvertierung von Pixel um.
Mit dem richtigen Umrechnungsfaktor kann man den Durchmesser und die Dicke von einem RBC, die dazu dienen, um die Aggregatgrößenverteilung zu bestimmen, zu bestimmen (basierend auf dem geschätzten number von Erythrozyten in jedem Aggregat). Je nach Orientierung der Aggregate ordnungsgemäßen Berechnung der Fläche auf einem RBC (Frontal- oder Seitenansicht). Wie in Abschnitt 4 (Schritt 4.4.1) erwähnt, ist es wichtig, die richtige Belichtungszeit der Kamera und die Bildrate zu bestimmen, um sicherzustellen, dass die dynamischen Eigenschaften der Aggregate zwischen jedem aufeinanderfolgenden Rahmen erfasst. Dieser Wert wird von der Strömungsgeschwindigkeit verwendet, beim Erwerb der Messungen. Mehrere andere Faktoren müssen berücksichtigt werden, wenn den Erwerb Ergebnisse mit dem μPIV System genommen werden und sind deutlich in der Studie von Pitts und Fenech 20 diskutiert.
Die Methodik wurde erfolgreich an mehreren RBC-Suspensionen bei verschiedenen Hämatokrit fließt getestet. Aufgrund der Begrenzung der Bildverarbeitungstechnik und der Mangel an Kontrast zwischen den Bildhintergrund und der Aggregate ist es jedoch schwierig zu ermitteln die RBC-Aggregate für höhere Hämatokritwerte (20% bis 45%). In der Tat, wie erwähntZuvor ist die Bildqualität entscheidend für diese Methodik.
Mit diesem Protokoll können die RBC Aggregatgrößen in einer kontrollierten Mikrofluidik-Vorrichtung gemessen werden und daher ist es möglich, Informationen über RBC Aggregation dynamisch in die Mikrozirkulation für eine Reihe von physiologischen Scherraten zu erzielen und zu erhalten, die RBC Aggregatgrößen. Es ist auch möglich, numerische und experimentelle Untersuchungen von Blutrheologie ergänzen und betreffen die Aggregatgrößen und des Verhaltens, klinische und pathologische Studien.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Natural Sciences and Engineering Research Council of Canada unterstützt. Mikrofabrikation wurde mit Unterstützung der McGill Nanotools Microfab Anlage an der McGill Universität und der Abteilung für Elektronik an der Carleton University durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
Referenzen
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. . Red Blood Cell Aggregation. , (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. . Handbook of Hemorheology and Hemodynamics. , (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314 (2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302 (2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten