Method Article
Medio Ambiente Microfluidic controlada de Investigación Dinámica de agregación de glóbulos rojos
En este artículo
Erratum Notice
Resumen
El protocolo describe los detalles de un procedimiento experimental para cuantificar de glóbulos rojos (RBC) agregados bajo un régimen de cizalladura controlada y constante, basado en técnicas de procesamiento de imágenes. El objetivo de este protocolo es relacionar tamaños de agregados de glóbulos rojos a la velocidad de cizallamiento correspondiente en un entorno controlado de microfluidos.
Resumen
La sangre, como biofluido no newtoniano, representa el foco de numerosos estudios en el campo Hemorreología. Constituyentes de la sangre incluyen glóbulos rojos, glóbulos blancos y plaquetas que se encuentran suspendidas en el plasma sanguíneo. Debido a la abundancia de los glóbulos rojos (40% a 45% del volumen de sangre), su comportamiento dicta el comportamiento reológico de la sangre especialmente en la microcirculación. A velocidades de cizallamiento muy bajas, los glóbulos rojos se ven de montar y entidades forma llamada agregados, lo que provoca el comportamiento no newtoniano de la sangre. Es importante entender las condiciones de la formación de agregados de comprender la reología de la sangre en la microcirculación. El protocolo descrito aquí detalla el procedimiento experimental para determinar cuantitativamente los agregados de glóbulos rojos en la microcirculación bajo velocidad de cizallamiento constante, basado en procesamiento de imágenes. Para este propósito, RBC-suspensiones se prueban y se analizaron en microcanales 120 x 60 micras de poli-dimetil-siloxano (PDMS). Los RBC-suspensiones son entllovió usando un segundo fluido con el fin de obtener un perfil de velocidad lineal dentro de la capa de sangre y así lograr una amplia gama de velocidades de cizalladura constantes. La velocidad de cizallamiento se determina usando un sistema de micro velocimetría por imágenes de partículas (μPIV), mientras que los agregados de glóbulos rojos se visualizaron utilizando una cámara de alta velocidad. Los vídeos capturados de los agregados de glóbulos rojos se analizaron utilizando técnicas de procesamiento de imágenes con el fin de determinar los tamaños de los agregados basados en las imágenes de intensidades.
Introducción
Glóbulos rojos (GR) juegan un papel crucial en la determinación del comportamiento reológico de la sangre. Son casi singularmente responsable de las propiedades particulares de la sangre in vitro e in vivo. En condiciones fisiológicas, los glóbulos rojos ocupan 40% a 45% del volumen de sangre. En la microcirculación, los glóbulos rojos solamente ocupar hasta el 20% del volumen de la sangre debido a diámetros de los vasos más pequeños y el efecto plasma 1 descremado. Este fenómeno de reducción de plasma en la microcirculación se conoce como el efecto Fåhraeus. A bajas velocidades de cizalla, los glóbulos rojos son capaces de tender un puente juntos y formar uno dimensional o estructuras tridimensionales denominadas "rouleaux" o agregados, por lo tanto, contribuir al comportamiento no newtoniano de la sangre. Sin embargo, el mecanismo de la agregación de RBC no se entiende completamente. Existen dos teorías para modelar la agregación de glóbulos rojos: el puente de la teoría de las células debido a la reticulación de las macromoléculas 2 y la fuerza attracla teoría de la causada por el agotamiento de las moléculas debido al gradiente osmótico 3.
Típicamente, para la sangre humana, los agregados forman a velocidades de cizallamiento muy bajas 4 que van de 1 a 10 seg -1. Por encima de este rango, los glóbulos rojos tienden a desagregar y fluir por separado dentro del recipiente.
La comprensión de las condiciones de la formación de agregados es de una gran importancia para el campo Hemorreología en términos de definir el comportamiento reológico de la sangre. Estos agregados se ven a menudo en el nivel macrocirculation (> 300 m de diámetro) 5. A esta escala, la sangre se considera como un fluido newtoniano y una mezcla homogénea. Sin embargo, estos agregados se ven raramente en el nivel capilar (4-10 micras de diámetro) y son por lo general una indicación de condiciones patológicas tales como la diabetes y la obesidad 6. Otras condiciones patológicas que podrían cambiar la agregación de glóbulos rojos incluyen condiciones inflamatorias o infecciosas,enfermedades cardiovasculares tales como hipertensión o aterosclerosis, trastornos genéticos y las enfermedades crónicas 7. Por lo tanto, la comprensión del mecanismo de agregación de RBC y análisis de estas entidades (mediante la definición de una relación entre el tamaño de estos agregados y las condiciones de flujo) podría conducir a la comprensión del comportamiento microrheological de la sangre y por lo tanto relacionarlo con aplicaciones clínicas.
Agregados de glóbulos rojos pueden ser alterados por diversos factores tales como el hematocrito (volumen de glóbulos rojos en la sangre), la velocidad de cizallamiento, el diámetro del vaso, la rigidez de la membrana RBC y la composición de medio de suspensión 8-10. Por lo tanto, se requieren condiciones controladas con el fin de analizar de forma eficaz los agregados de glóbulos rojos. Varios métodos son capaces de analizar la formación de agregados al proporcionar mediciones de agregación estáticos (índice de agregación) que ofrece información relevante sobre el comportamiento de la sangre. Estos métodos incluyen, entre otras cosas, la velocidad de sedimentación globularmétodo 11, el método de transmisión de la luz 12, el método de reflexión de la luz 13 y el método de la viscosidad de baja cizalladura 14.
Pocos estudios han tratado de estudiar la agregación de glóbulos rojos y determinar el grado de agregación en condiciones de flujo controladas 15-17. Sin embargo, estos estudios investigan indirectamente RBC tamaños de agregados mediante la determinación de la proporción de espacio ocupado en un sistema de cizallamiento medido basado en imágenes microscópicas de sangre que proporcionan información sobre el grado de agregación, así como la viscosidad local.
Por lo tanto, presentamos un nuevo procedimiento para cuantificar directamente RBC agregados en la microcirculación, de forma dinámica, bajo velocidades de cizallamiento controladas y constantes. RBC-suspensiones son arrastradas, en una doble Y-microcanal (como se ilustra en la Figura 1), con una solución tampón fosfato salino (PBS) por lo tanto la creación de un flujo de cizallamiento en la capa de sangre. Dentro de esta sangre capa un karité constantetasa r puede ser obtenida. Los RBC-suspensiones se ensayaron a diferente hematocrito (H) niveles (5%, 10% y 15%) y bajo diferentes velocidades de cizallamiento (2-11 seg -1). La velocidad de la sangre y la velocidad de cizallamiento se determinan mediante un sistema de micro Velocimetría imágenes de partículas (μPIV), mientras que el flujo se visualizaron utilizando una cámara de alta velocidad. Los resultados obtenidos se procesan entonces con un código MATLAB basado en las intensidades de imagen con el fin de detectar los glóbulos rojos y determinar tamaños de agregados.
Protocolo
La sangre se recoge de los individuos sanos, con la aprobación del comité de ética de la Universidad de Ottawa (H11-13-06).
1. Microchannel Fabrication
Los microcanales son fabricados en base a los métodos estándar de fotolitografía 18.
- Diseñar la geometría microcanal utilizando un diseño (CAD) asistido por ordenador e imprimir la configuración en una transparencia foto-máscara. Estas máscaras son cruciales ya que dictan la trayectoria de la luz durante el proceso de fabricación. En este caso, las dimensiones de microcanales son 120 micras de espesor, 60 micras de profundidad y 7 mm de longitud.
- En una sala blanca, capa giro un epoxi basada negativo fotorresistente sobre una oblea de silicio a 2000 rpm durante 30 segundos para obtener la profundidad deseada microcanal (60 micras).
- Exponer la oblea y la foto-máscara bajo una lámpara UV a 650 mJ / cm 2 para 70 seg. Asegurar para exponer sólo las áreas transparentes de lafoto-máscara a la luz UV. La exposición de las áreas transparentes permite para la polimerización de las cadenas resultantes en un endurecimiento de la foto-resistir. Sumergir la pieza de silicio en un desarrollador para eliminar el exceso de foto-resistencia.
- Una vez que el molde se fabrica, mezclar un elastómero a base de silicio y un agente de curado en una proporción de 10: 1 para crear una solución de poli-dimetil-siloxano (PDMS). Ponga la solución de PDMS en una cámara de vacío para desgasificar. Vierta en el molde y se calienta a 60 ° C durante 90 min para crear microcanales. Luego unir los canales individuales a un portaobjetos de vidrio utilizando oxígeno unión de plasma durante 90 segundos.
Nota: El proceso de PDMS desgasificar se lleva a cabo con el fin de eliminar las burbujas de aire generadas por el proceso de mezcla. - Asegúrese de que las dimensiones microcanales permiten pruebas con éxito. En este protocolo, los microcanales tienen una sección transversal rectangular de 120 x 60 m. En comparación, un RBC promedio tiene un diámetro de 8 micras y un espesor de 2 micras. Losrefore, el ancho de microcanales es suficiente para observar la agregación adecuada y determinar con precisión los perfiles de velocidad.
2. Preparación de Sangre
- Recoger la sangre de donantes voluntarios sanos, después de la aprobación de un comité de ética. Tratar la sangre con ácido etilendiaminotetraacético (EDTA) presente en los tubos de recogida (7,2 mg de EDTA en 4 ml de sangre).
NOTA: El EDTA se utiliza para evitar la coagulación de la sangre. - Centrifugar las muestras de sangre tres veces durante 10 min a 1.400 xg (3.000 rpm) con el fin de separar los constituyentes de la sangre. Como resultado de la centrifugación, observar tres capas distintas.
NOTA: Las tres capas son la capa de RBC (situado en la parte inferior del tubo), la capa leucocitaria (que consiste en células blancas de la sangre y plaquetas situadas en la parte superior de la capa de RBC) y la capa de plasma (que se encuentra en la parte superior de todos los demás constituyentes).- Después de la primera centrifugación, recoger plasma de sangre usando una pipeta de sangre. Evite cualquier contacto con la capa leucocitaria.
- Recoger y disponer de la capa leucocitaria en un recipiente con lejía diluida al 10%.
- Añadir 3 ml de PBS pH 7,4 a cada uno de los tubos con la capa de RBC restante y garantizar el equilibrio apropiado de la centrífuga. Mezclar suavemente los tubos de centrífuga y una vez más en 1.400 xg (3.000 rpm) durante 10 min.
NOTA: Asegúrese de que la solución de PBS no contiene magnesio o calcio ya que podrían alterar la adhesión celular. - Deseche la PBS en los tubos después de la segunda centrifugación y retire la capa leucocitaria restante si está presente. Repita los pasos 2.2.3 y 2.2.4 para la tercera centrifugación para producir glóbulos rojos limpios.
- Mezclar la cantidad requerida (0,05, 0,1 y 0,15 ml) de los glóbulos rojos limpias con plasma (0.95, 0.9 y 0.85 ml) en un tubo de 1 ml a fin de obtener RBC-suspensiones con el correspondiente (5%, 10% y 15% ) hematocrito. Compruebe hematocritos con una microcentrífuga.
3. Líquidos Preparación
Introducir dos fluidos en el doble Y-microcanal: RBC-suspensiones y PBS.
- Añadir 60 l de la solución de partículas de trazador fluorescente (1% sólido, partícula d = 0. 86 m, λ = 542 nm abs y emisión λ = 612 nm) en los tubos de suspensión RBC-1 ml.
NOTA: Las partículas de trazador fluorescente (teñidos internamente partículas de poliestireno) se utilizan para medir la velocidad del flujo dentro del microcanal. Estas partículas son fluorescentes cuando se exponen a la longitud de onda correspondiente del haz de láser (λ = 542 nm). - Preparar una solución de PBS pH 7,4 y añadir 60 l de la misma solución de partículas de trazador fluorescente en 1 ml de la solución de PBS.
4. Agregados Tamaño Mediciones
- Para insertar los fluidos (RBC-suspensiones y PBS) en el microcanal, utilice dos jeringas de vidrio de 25 ly 100 l. Esto haráayudar a reducir el cumplimiento del sistema. Conecte los microcanales a las jeringas a través de tubos y conectores encajan los orificios de entrada. Llenar las jeringuillas de vidrio utilizando la diferencia de presión existente entre el recipiente de fluido y la jeringa. Asegúrese de que no hay burbujas presentes en el sistema. Como un método alternativo, utilizar un sistema de presión controlada para conducir ambos fluidos en el microcanal.
- Coloque el microcanal en un escenario microscopio invertido conectado a una cámara de alta velocidad y un sistema μPIV. La bomba de jeringa a los caudales deseados (por ejemplo, Q = 2 l / h para la sangre engendrar un caudal de Q = 8 l / h para PBS) Programa.
NOTA: sólo se utiliza una bomba de jeringa. El uso de dos jeringas de vidrio diferentes, con dos diámetros internos diferentes, es posible variar el caudal que entra en cada rama de la Y-microcanal. - Inserte los dos fluidos en el doble Y-microcanal cada uno de una rama de entrada diferente y en diferentes caudales como se muestra en Figura 1. Con el fin de probar diferentes velocidades de cizallamiento, cambiar el caudal de la bomba. Esto mantiene la misma proporción adecuada (4 en este caso) entre las dos ramas 19 (Figuras 2 y 3). Espere a que el flujo de alcanzar el estado de equilibrio antes de la adquisición de las mediciones: inspeccionar visualmente las imágenes de la cámara de alta velocidad para un flujo suave.
NOTA: La relación es crucial en la obtención de un perfil de velocidad lineal dentro de la capa de sangre. - Visualice los glóbulos rojos con la cámara de alta velocidad. Conecte la cámara a un ordenador para controlar, registrar y guardar las imágenes del flujo de fluido. Una vez que los dos flujos de fluidos alcanzan el estado de equilibrio, iniciar la grabación.
- Adquirir varias imágenes para mejores resultados del tratamiento. Determine un tiempo de exposición de la cámara óptimo para una imagen clara de los agregados.
NOTA: El tiempo de exposición de la cámara para este caso fue de 0,5 mseg. La elección del intervalo de tiempo entre cada trama se basa en la velocidad de cuadros de la cámara y la velocidad de flujo en tque microcanal. El tiempo entre cada fotograma procesado en este procedimiento fue de 60 mseg. Por lo tanto una cámara capaz de grabar 18 fotogramas por segundo es suficiente.
NOTA: Evite el asentamiento de sangre en el tubo y la jeringa, lo que podría conducir a mediciones erróneas.
- Adquirir varias imágenes para mejores resultados del tratamiento. Determine un tiempo de exposición de la cámara óptimo para una imagen clara de los agregados.
- Usando técnicas de procesamiento de imágenes (un programa MATLAB en este caso) para mejorar la calidad de la imagen, detectar los agregados en cada una de las imágenes sobre la base de intensidades de los píxeles (ilustrados en la Figura 4) como sigue:
- Mejorar las imágenes contrastan con el método de ecualización del histograma para obtener una mejor calidad de imagen para cada cuadro.
- Convertir las imágenes en escala de grises en imágenes binarias. Para este propósito, establecer un valor umbral, que van desde 0 a 1, que dicta la conversión de cada píxel. Cualquier píxel en la imagen debajo del valor umbral será detectado como un píxel negro, mientras que los píxeles con valores mayores que el umbral serán detectados como píxeles blancos.
- Llenar elagujeros (si está presente y necesario) que corresponden a las lagunas dentro de un agregado para obtener mejores resultados.
- Detectar las células mediante la determinación de vecinos píxeles blancos en la imagen binaria de modo que las células adyacentes están asociados como agregados.
- Etiquetar los diferentes agregados detectados y convertir la imagen binaria en una imagen verde-azul-rojo (RGB) para una mejor visualización. Combinar los fotogramas originales con cada una de las correspondientes imágenes procesadas para verificar la eficiencia de la técnica de procesamiento de imagen y asegurar que todas las células se toman en consideración, como se muestra en la Figura 5. Realice los pasos 4.5.1, 4.5.2, 4.5.3 , 4.5.4 y 4.5.5 para todas las tramas capturadas.
- Calcular el área de cada agregado detectado en el marco basado en el número de píxeles detectados. Sobre la base de la ampliación de la lente utilizada, calcular el factor de conversión, utilizando una retícula de calibración, y convertir los resultados a 2 micras. La media de los tamaños de los agregados detectadas en cadamarco y luego un promedio de los resultados para todos los marcos para obtener el tamaño total promedio para cada grabación de RBC-suspensiones.
- Calcular el área de un RBC para determinar un número representativo estimado de glóbulos rojos dentro de cada agregado detectado. El uso de estos resultados, calcular la distribución del porcentaje de glóbulos rojos dentro de cada agregado como una función de los tamaños de los agregados (representados por el número estimado de células en cada agregado), como se muestra en la Figura 6.
NOTA: Para medir los agregados de RBC, el software ImageJ podría ser utilizado (en lugar de MATLAB) para realizar las mismas tareas en cada fotograma.
5. velocidad del fluido y Shear Puntúa Mediciones
Determinar la velocidad del fluido y por lo tanto la velocidad de cizallamiento utilizando un sistema de μPIV.
- Una vez que los datos se adquiere mediante la cámara de alta velocidad, cambiar a la cámara de doble pulsado utilizado para el sistema μPIV. Utilice un software de imagen para una imagen acquisition del flujo y el procesamiento de imágenes para la determinación de campo de velocidad.
- Tome todas las precauciones necesarias, en función de la clase de láser, antes de encender el láser. A continuación, encienda el sistema, la cámara y el láser.
- Calibrar la cámara basada en la ampliación del objetivo utilizado. Para este propósito, utilizar una microescala de 10 micras de precisión bajo el microscopio y establecer el tamaño de 1 pixel en la imagen.
- Inicie el láser y visualizar las partículas en ambos fluidos. Encuentra el plano medio de los microcanales, centrándose en las partículas más rápidos del caudal (es decir, las partículas más rápidas deben ser el más brillante).
- Ajuste el dt (intervalo de tiempo entre dos tramas consecutivas) para garantizar el desplazamiento adecuado de la partícula. Las partículas más rápidas deben moverse aproximadamente 5 a 10 pixeles entre ambas imágenes.
- Comienza la grabación del flujo. Ajuste el software para adquirir 100 pares de imágenes, 5 ms de diferencia. Realice los pasos 5.4, 5.5 y 5.6 para toda la difdife- RBC-suspensiones y para diferentes velocidades de cizallamiento.
NOTA: Más detalles de la metodología se dan en el estudio de Pitts y Fenech 20. - Procesar las grabaciones adquiridos utilizando el método de correlación cruzada con el software de imágenes.
NOTA: Este consiste en discretizar el par de imágenes en ventanas pequeñas de tamaño predeterminado (basado en el flujo de fluido y el intervalo de tiempo elegido por el usuario) llamado ventanas de correlación y siguiendo el desplazamiento de las partículas en cada ventana.- En primer lugar, determinar si las imágenes adquiridas requieren pre-tratamiento (incluida la sustracción de fondo, "base-clipping" 21 o una imagen superpuestos 22,23) para un mejor tratamiento de la información.
- A continuación, seleccione el tamaño y la forma de la ventana de correlación, así como del porcentaje de imágenes superpuestas. Un estudio detallado se realizó por Pitts et al. 24 para determinar los parámetros óptimos y las técnicas de pre-procesamiento de imagen para la sangrefluir en diferentes configuraciones de canal. Exprese los resultados como un campo de velocidad media calculada a partir de los pares de 100 imágenes y el error cuadrático medio (RMS) de la velocidad.
- Extraer un perfil de velocidad en la salida del canal, a partir de los datos procesados como se muestra en la Figura 7. Para un mejor perfil, promediar el campo de velocidad en el espacio.
NOTA: Las barras que componen el perfil de velocidad se corresponde con el tamaño de la ventana de correlación elegido con relación a la anchura del canal. También se muestra el error RMS de la velocidad en la Figura 7, que representa el error en la estimación experimental velocidad. - Apague el láser una vez que se llevan a cabo todas las medidas y el procesamiento ,. Apague todos los componentes del sistema: software, cámaras, fase móvil, computadoras y láser.
- Para calcular la velocidad de cizallamiento, primero detectar y estimar el espesor de la sangre en los microcanales en función de la grabación de la cámara de alta velocidad. Para este propósito, promedio Todoslos fotogramas de la grabación específica para obtener una imagen de fondo del vídeo. Delimitar la capa de sangre (como se muestra en la Figura 8 para los RBC-suspensiones que fluye a 10 l / hr cuando se suspenden en 5%, 10% y 15% de hematocrito). Obtener el valor de velocidad para el espesor de la capa de sangre correspondiente y calcular la velocidad de cizallamiento dividiendo el valor de la velocidad por el espesor de la capa de sangre.
Resultados
Un ejemplo del flujo de dos fluidos en la doble Y-microcanal se muestra en la Figura 2 para los glóbulos rojos humanos en suspensión en 5%, 10% y 15% de hematocrito y que fluye a 10 l / hr. La Figura 3 muestra la diferencia en tamaños de agregados cuando el flujo en el canal se reduce de 10 l / hr a 5 l / h para un hematocrito de 10%. Esto da una idea cualitativa de los tamaños de los agregados cuando se varía el hematocrito y la velocidad de cizallamiento. La figura 5 sigue el desplazamiento de cuatro agregados de glóbulos rojos humanos, para tres tramas consecutivas, proporcionando una medida cualitativa de la velocidad de fotogramas de la cámara requerida y noción cualitativa de la agregados de distribución dentro de cada trama. En la Figura 5, los pequeños agregados (con RBCs 8 o menos estimado) se muestran en azul, mientras que los agregados medianas (que van 9-30 estimaron los glóbulos rojos) y agregados grandes (más de 30 estima RBCs) se muestran en verde y rojo respectivamente.
Los perfiles de velocidad de los diferentes RBC-suspensiones en el canal se muestran en la Figura 7, donde las curvas de color rojo, azul y verde representan los perfiles de velocidad de los glóbulos rojos suspendidos en el 5%, 10% y 15% de hematocrito respectivamente. Los errores RMS de la velocidad, también mostradas en la Figura 7 para cada RBC-suspensión, son relativamente pequeños en comparación con los valores de velocidad, lo que indica la precisión de las mediciones de la velocidad, y por lo tanto las tasas de cizalla. Las ubicaciones de interfaz se designan como 'E' y se muestran como las líneas continuas en la misma figura.
Las velocidades de cizallamiento correspondientes para los diferentes RBC-suspensiones (basados en los perfiles de velocidad y el espesor de la capa de sangre) se muestran en la Tabla 1. Los tamaños medios de agregados determinados para cada uno de los RBC-suspensiones, basado en el método de procesamiento de imágenes para detectar la área de los agregados de glóbulos rojos, se muestran en la Figura 9, como funcion de la velocidad de cizallamiento correspondiente. Un ejemplo de la distribución del porcentaje de glóbulos rojos en cada agregado se muestra en la Figura 6. Los tamaños de los agregados se representan como un número estimado de RBC en los agregados.
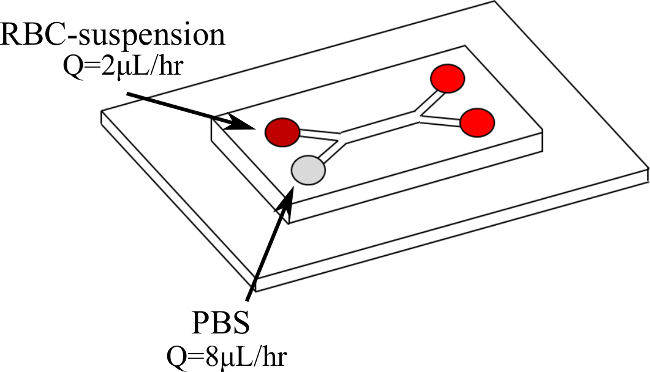
Figura 1. dobles fluidos de configuración Y-microcanal y de entrada. La sangre entra en la primera sucursal en Q = 2 l / h mientras PBS entra en la segunda rama en Q = 8 l / hr. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2. humano RBC-suspensión a diferentes hematocrito. La cifra representa marcos de los RBC-suspensiones humanos fluyen en Q = 10 l / hora a capturado (A) 5% (B)10% y (C) 15% de hematocrito. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. humano RBC-suspensión a diferentes caudales. La cifra representa marcos de los glóbulos rojos humanos en suspensión en el 10% de hematocrito H fluyen (A) Q = 10 l / h, y (B) Q = 5 l / hr capturado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Diagrama de flujo del programa de procesamiento de imagen que se utiliza para la detección de agregado. Los pasos que se muestran describir la metodología básica utilizada. La calidad de la imagen se ha mejorado para ser c onverted a una imagen binaria. Los agregados se detectan y se etiquetan en función de sus respectivos tamaños. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5. RGB colorante y el movimiento neto de la varios RBC humano Agregados de tres tramas consecutivas. La figura muestra el movimiento neto de cuatro agregados detectados en tres tramas consecutivas en (A) t = 0 ms, (B) t = 60 mseg y (C) t = 120 ms. Los grandes agregados (> 30 estima glóbulos rojos), agregados medianos (9-30 GR estimados) y pequeños agregados (<8 estima glóbulos rojos) se muestran en rojo, verde y azul, respectivamente. Cada uno de los agregados detectados están marcados con un círculo negro._blank "> Haga clic aquí para ver una versión más grande de esta figura.
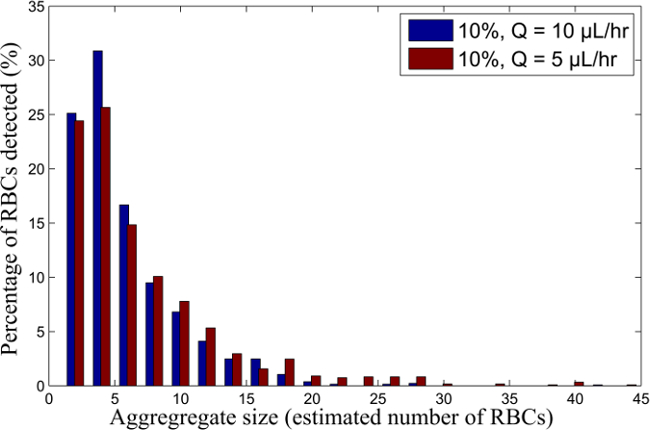
Figura 6. RBC distribución del tamaño de agregado de 10% de H RBC-suspensión para diferentes caudales. Distribución del tamaño agregado de las muestras de sangre en suspensión al 10% de H, que fluye a Q = 10 y 5 l / hr. Haga clic aquí para ver una versión más grande de esta cifra.

Figura 7. Velocidad comparación de perfiles para diferentes hematocrito. Los perfiles de velocidad se muestran para los glóbulos rojos en el plasma en suspensión en el 5% H (rojo), 10% H (azul), 15% H (verde) y la simulación 19 (línea continua) para el 120 x 60 micras doble Y-microcanal con un Q = 10 l / h. La ubicación interfaz se denota por E para elexperimentos. Se muestran los errores RMS correspondientes de los diferentes perfiles de velocidad. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8. fondo de imagen para los diferentes RBC-suspensiones y delimitación del espesor de la capa de sangre. La figura muestra la delimitación del espesor de la capa de la sangre de los RBC-suspensiones que fluyen a 10 l / h suspendido en (A) 5%, (B ) 10% y (C) 15% H. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figure 9. El tamaño promedio de agregados en función de las tasas de corte correspondientes. Los resultados se obtuvieron para los diferentes RBC-suspensiones que fluyen en Q = 10 l / hora a 5% (A), 10% (B) y 15% de H (C). Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Hematocrito | Caudal (l / h) | Velocidad de cizallamiento (s -1) |
| 5% | 10 | 11.02 |
| 5% | 5 | 5.36 |
| 10% | 10 | 8.17 |
| 10% | 5 | 4.47 |
| 15% | 10 | 7.41 |
| 15% | 5 | 2.51 |
Tabla valores de tasa 1. corte para diferentes casos de flujo de sangre. Los valores de tasa de cizallamiento se obtienen utilizando los datos y resultados con imágenes procesamiento μPIV para diferentes RBC-suspensiones con 5%, 10% y 15% de H, que fluye a Q = 10 l / h y Q = 5 l / hr.
Discusión
Utilizando la presente metodología, es posible analizar cualitativa y cuantitativamente el RBC agregados bajo diferentes condiciones de flujo y hematocritos. Para las pruebas de éxito y la detección agregada, es crucial para determinar la relación de velocidad apropiada entre los dos fluidos en la entrada de microcanal. Esta relación es muy importante para obtener un espesor de capa de sangre óptimo donde el perfil de velocidad es casi lineal 19.
Otro factor clave para la prueba con éxito es una buena calidad de imagen. De hecho, ya que el método se basa en el procesamiento de la imagen, es muy importante tener un contraste entre el fondo de la imagen (el líquido en el interior del canal) y las partículas a detectar. Aquí, como se muestra en las Figuras 2 y 3, las partículas parecen ser más oscuro que el fondo, lo que ayuda en la detección agregada. El parámetro más importante a considerar para la técnica de procesamiento de imágenes es el tvalor hreshold. Por lo tanto, basado en el contraste obtenido es crucial para elegir el valor umbral óptimo en el que se toman todos los agregados en consideración, como se muestra en la Figura 5. La presente segmentación de la imagen, utilizado para este estudio, se utiliza ampliamente para la detección y el recuento de células 25- 27. Si la calidad de la imagen no es tan deseado y un valor umbral global no es adecuada, se puede usar un algoritmo diferente para determinar el valor de umbral óptimo, como el método de Otsu 28 o un método de umbralización adaptativa (discretizar la imagen y la obtención de un umbral local para cada ventana discretizado).
Otro factor a tener en cuenta es el factor de escala para una correcta conversión de píxeles a micras.
Utilizando el factor de conversión apropiado, se puede determinar el diámetro y espesor de una RBC que servirá para determinar la distribución de tamaño de los agregados (basado en la numbe estimador de los glóbulos rojos en cada agregado). Dependiendo de la orientación de los agregados, calcular correctamente la zona en uno RBC (vista frontal o lateral). Como se ha mencionado en la sección 4 (etapa 4.4.1), es importante para determinar el tiempo de exposición de la cámara adecuada y la velocidad de fotogramas para asegurar que las propiedades dinámicas de los agregados son capturados entre cada fotograma consecutivo. Este valor se basa en la tasa de flujo utilizado en la adquisición de las mediciones. Varios otros factores deben ser tenidos en cuenta a la hora de adquirir los resultados utilizando el sistema μPIV y se discuten claramente en el estudio de Pitts y Fenech 20.
La metodología fue probado con éxito en varias RBC-suspensiones que fluyen a diferentes hematocrito. Sin embargo, debido a la limitación de la técnica de procesamiento de imágenes y la falta de contraste entre el fondo de la imagen y los agregados, es difícil detectar el RBC Agregados de hematocritos más altos (de 20% a 45%). De hecho, como se ha mencionadoanteriormente, la calidad de la imagen es crucial para esta metodología.
Usando este protocolo, los tamaños de los agregados de glóbulos rojos pueden medirse en un dispositivo de microfluidos controlada y por lo tanto es posible obtener información sobre la agregación de RBC dinámicamente en la microcirculación y obtener los tamaños de agregados de glóbulos rojos para una gama de velocidades de cizallamiento fisiológicas. También es posible complementar estudios numéricos y experimentales de la reología de la sangre y relacionar los tamaños y comportamiento agregado a los estudios clínicos y patológicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por las Ciencias Naturales e Ingeniería de Investigación de Canadá. Microfabricación se realizó con el apoyo de la instalación McGill nanoherramientas Microfab en la Universidad McGill y el Departamento de Electrónica de la Universidad de Carleton.
Materiales
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
Referencias
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. Red Blood Cell Aggregation. , Taylor and Francis. Florida. (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. Handbook of Hemorheology and Hemodynamics. , IOS Press. Netherlands. (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , CRC Press. Boca Raton, Florida. (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314(2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302(2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados