Method Article
微流控控制环境的红细胞聚集动态调查
Erratum Notice
摘要
该协议描述细节的实验步骤,根据一个控制的和恒定的剪切速率量化红血细胞(RBC)的聚集体的基础上,图像处理技术。这个协议的目标是涉及红细胞聚集体尺寸,以在受控的微流体环境中的相应的剪切速率。
摘要
血液,作为一个非牛顿生物流体,表示了大量的研究,在血液流变学领域的焦点。血液成分包括红血细胞,白血细胞和血小板是悬浮在血浆中。由于红细胞的丰度(40%至45%的血液量),它们的行为决定尤其在微循环的血液的流变行为。在非常低的剪切速率下,红细胞被视为组装和形式的实体称为聚集体,这会导致血液的非牛顿行为。重要的是要了解的聚集体形成的条件领悟血液流变学微循环是很重要的。这里描述的协议详细的实验程序来确定定量的红细胞聚集体在微循环在恒定剪切速率,基于图像处理。为了这个目的,红细胞悬浮液测试,并在120×60微米的聚二甲基硅氧烷(PDMS)微通道进行分析。该红细胞悬浮液耳鼻喉科下雨,以获得血液层内的线速度信息,从而实现了广泛的恒定剪切速率下使用的第二流体。剪切速率是使用微粒子图像测速(μPIV)系统测定,而红细胞聚集体使用高速照相机可视化。捕获的红细胞聚集的视频使用图像处理技术,以确定基于所述图像强度的聚集体尺寸进行分析。
引言
红血细胞(红细胞)在决定血液的流变行为了至关重要的作用。它们几乎单独地负责的血液在体外和体内的特定性质。在生理条件下,红细胞占40%至45%的血液量。在微循环,红细胞仅占到血量的20%,由于更小的血管直径和等离子体掠过效果1。这种现象在微等离子体还原的被称为Fåhræus效果。在低剪切速率,红细胞能够桥接在一起,形成一维或三个所谓"红细胞钱串"或聚集维结构,从而有助于血液的非牛顿行为。然而,红细胞聚集的机制尚未完全了解。两种理论存在红细胞的聚集模型:细胞理论的桥接由于交联的大分子2和力attrac由于渗透压梯度3所引起的分子的耗尽化的理论。
通常,对于人血,聚集体在非常低的剪切速率4从1到10秒-1形成。高于此范围,红细胞倾向于分解和在容器内分开流动。
了解的聚集形成的条件是一个非常重要的领域血液流变学在确定血液的流变行为的条款。这些聚集经常看到在大循环水平(> 300直径微米)5。以该刻度,血液被认为是作为牛顿流体和均匀的混合物。然而,这些聚集体很少见到在毛细管水平(4-10微米直径),通常的病理状况如糖尿病6和肥胖的指示。等病理状态下可能会改变红细胞聚集包括炎症或感染的条件,心血管疾病如高血压或动脉粥样硬化,遗传性疾病和慢性疾病7。因此,了解红细胞聚集机制和分析这些实体(通过定义这些聚集和流动条件的大小之间的关系)可能导致血液的微观流变行为的理解,因此涉及到临床应用。
红细胞聚集体可以由几个因素来改变,例如血细胞比容(血液中红细胞的体积),剪切速率,血管直径,红细胞的膜刚度和悬浮介质的组合物8-10。因此,控制的条件是必需的,以便有效地分析红细胞聚集体。有几种方法可以提供静态汇聚测量(聚集索引)分析聚集形成,提供约血行为的相关信息。这些方法包括,除其他外,血沉法如图11所示,光传输方法12中,光反射法13和低剪切粘度方法14。
很少有研究试图研究红细胞聚集,并确定聚集在控制流动条件15-17度。然而,这些研究间接调查红细胞聚集体尺寸通过确定基于微观血图像提供关于聚集程度以及本地粘度信息测定的剪切系统的占用空间的比率。
因此,我们提出了一个新的程序直接量化红细胞聚集的微循环,动态的,在可控制的恒定剪切速率。红细胞悬液被夹带,在双Y型微通道( 如图1),与磷酸盐缓冲盐水(PBS)中的溶液,因此产生在血液层的剪切流动。在这血层恒定乳木果ř速率可以得到。的红细胞悬浮液在不同血细胞比容(H)的水平(5%,10%和15%),并在不同的剪切速率(2-11秒-1)进行测试。的血流速度和剪切速率使用的微粒子图像测速(μPIV)系统流被使用高速照相机显现而确定的。所得到的结果然后被处理以基于图像强度,以检测RBC和确定聚集体尺寸一个MATLAB代码。
研究方案
血液从健康人与渥太华大学(H11-13-06)的伦理委员会的批准收集。
1.制造微通道
微通道是基于标准光刻方法18制造。
- 设计使用计算机辅助设计(CAD)软件的微通道的几何形状和打印在透明光掩模的配置。这些掩码是至关重要的,因为它们在制造过程中决定了光路。在这种情况下,微通道尺寸是120微米厚,60微米的深度和7毫米的长度。
- 在硅晶片上在洁净室,旋涂的环氧基的负光致抗蚀剂以2000rpm进行30秒,以获得所需微通道的深度(60微米)。
- 暴露出晶片和在UV灯下的光掩模,在650毫焦/厘米2为70秒。确保暴露的唯一透明区域光掩膜的UV光。的透明区域的曝光使得导致的硬化链的聚合光致抗蚀剂。沉浸在硅片成显影剂以除去过量的光致抗蚀剂。
- 一旦模具被制造,混合的硅系弹性体和固化剂以10:1的比例以创建聚二甲基硅氧烷(PDMS)的溶液中。放入真空室脱气了的PDMS溶液。倒入模具中并加热它在60℃90分钟,以创建微通道。然后使用氧等离子体结合90秒粘合的各声道到一个载玻片。
注意:为了消除由混合过程所产生的气泡进行的PDMS脱气过程。 - 确保微型槽尺寸允许测试成功。在这个协议中,微通道具有120×60微米的矩形横截面。相比较而言,平均红细胞的直径为8微米,厚度为2微米。该refore,微通道宽度足以遵守适当的聚集和准确地判断速度剖面。
2.血液制剂
- 采集血液健康志愿者的捐助者,伦理委员会的批准后。治疗存在于收集管的血液与乙二胺四乙酸(EDTA)(7.2毫克乙二胺四乙酸的4ml血液)。
注:使用EDTA来避免血液凝固。 - 以分离的血液成分离心血样三次10分钟,1400×g离心(3000转)。作为离心分离的结果,观察三个不同的层。
注:三个层是红细胞层(位于该管的底部),血沉棕黄层(由位于RBC层的顶部白血细胞和血小板)和血浆层(位于所有其他顶成分)。- 第一次离心后,收集使用血液吸管血浆。避免任何Contact与棕黄色的外套。
- 收集并在容器中处理的棕黄层的与漂白稀释在10%以上。
- 添加3mL的PBS pH为7.4的每个与剩余的红细胞层的管子和保证离心机的适当的平衡。轻轻再次混合管和离心机在1400×g离心(3000 rpm)离心10分钟。
注:确保PBS溶液不含有任何镁或钙,因为它们可能会改变的细胞粘附。 - 在第二次离心后在管处置的PBS和如果存在的话除去剩余的血沉棕黄层。重复步骤2.2.3和2.2.4第三离心产生干净的红细胞。
- 混合需要在1ml管洁净红细胞与血浆(0.95,0.9和0.85毫升)的量(0.05,0.1和0.15毫升),以获得红细胞悬液与相应的(5%,10%和15% )红细胞压积。检查血球计数用的离心。
3.流体准备
介绍了双Y型微通道两种流体:红细胞悬液和PBS。
- 添加60微升荧光示踪粒子的溶液(1%固体,D 粒径 = 0。86微米,λ 腹肌 = 542纳米 和λ 发射 = 612纳米)到1ml的红细胞悬浮液管。
注:荧光示踪粒子(内部染色聚苯乙烯粒子)被用来测量所述微通道内的流动的速度。这些颗粒发荧光时暴露于激光束(λ= 542纳米)的相应波长。 - 准备一个pH 7.4的PBS溶液,并在1ml的PBS溶液中添加60微升同样的荧光示踪粒子溶液。
4.骨料的三围尺寸
- 插入在微通道中的流体(RBC-混悬剂和PBS),使用25微升和100微升两个玻璃注射器。这将有助于减少该系统的顺应性。通过管道和接头装配入孔连接到微注射器。补使用流体容器和注射器之间存在的压力差的玻璃注射器。确保无气泡存在于系统中。作为一种替代方法,使用一个压力控制系统中的微通道以驱动两种流体。
- 放置在微通道上倒置显微镜阶段连接到一个高速照相机和μPIV系统。程序注射器泵到所需的流速( 例如,Q = 2微升/小时血液编发Q = 8微升/小时的PBS中的流速)。
注意:只有一个注射泵被使用。使用两种不同的玻璃注射器,有两个不同内径,有可能会发生变化,以进入Y型微通道的每个分支的流速。 - 插入两种流体在双Y型微通道各自从不同的入口分支,并在不同的流速,如图的图1,为了测试不同的剪切速率,改变泵的流速。这保持了两个分支19之间(在这种情况下4)同样的适当的比例( 图2和3)。等待流量获取测量前达到稳定状态:目视检查高速摄像机图像的畅通。
注:该比率是在血液层内获得一个线性速度分布是至关重要的。 - 使用可视化的高速摄像机的红细胞。将相机连接到计算机控制,记录和保存流体流动的图像。一旦两个流体流动达到稳定状态,开始录制。
- 获得多个图像获得更好的处理结果。确定最优照相机曝光时间为聚集体的清晰的图像。
注:相机曝光时间这种情况下为0.5毫秒。每个帧之间的时间间隔的选择是基于相机帧速率和流量在叔他的微通道。在此过程中处理的各帧之间的时间为60毫秒。因此能够每秒记录18帧的相机是足够的。
注:避免血液沉降在管和注射器,这可能导致错误的测量结果。
- 获得多个图像获得更好的处理结果。确定最优照相机曝光时间为聚集体的清晰的图像。
- 利用图像处理技术(在这种情况下,一个MATLAB程序),以改善图像质量,检测聚集在基于像素强度( 图4中示出)如下每个图像:
- 提高使用直方图均衡处理方法,以获得针对每个帧一个更好的图像质量的图像对比。
- 灰度图像转换成二进制图像。为了这个目的,设置一个阈值,范围从0到1,即决定每个像素的转换。任何像素低于阈值的图像中会被检测为一个黑象素,而其值大于阈值的像素将被检测为白色像素。
- 填写孔(如果存在的和必要的)对应于所述间隙内的一个骨料获得更好的结果。
- 通过确定,使得相邻小区相关联的聚集体的二进制图象相邻白色像素检测所述细胞。
- 标记检测的不同的聚集体,并转换二进制图象成红 - 绿 - 蓝(RGB)图像以便更好地观察。结合的原始帧与每个相应的处理的图像,以验证的图像处理技术的效率,并确保所有的细胞被考虑, 如图5。执行步骤4.5.1,4.5.2,4.5.3 ,4.5.4和4.5.5的所有捕获的帧。
- 计算在基于检测到的像素的数目的帧中检测到的每个聚集体的区域。基于所使用的镜头倍率,计算出转换系数,使用校正手 提袋,并将结果转换为μm2以下。平均每个检测到的聚集体尺寸帧,然后平均化结果的所有帧以获得对红细胞悬液各记录的平均聚集体尺寸。
- 计算一个无线闭塞中心的区域来确定每个所检测的集合中红细胞的代表估计数目。利用这些结果,计算出的红细胞的百分比每个聚合中的分布为聚集体尺寸(通过细胞在每个聚合所估计的数表示)的函数, 如图6。
注意:为了测量红细胞聚集体,可以使用(而不是MATLAB)的ImageJ软件对每一帧执行相同的任务。
5.流体流速和剪切速率测量
确定流体速度,然后利用一个μPIV系统的剪切速率。
- 一旦使用高速摄像机获得的数据,切换到用于μPIV系统的双脉冲相机。使用图像交流的成像软件quisition流和图像处理速度场的决心。
- 采取所有的预防措施必要,这取决于类激光器,开启激光之前。然后打开系统,相机和激光上。
- 校准基于所使用的透镜倍率的相机。为了这个目的,使用10微米精度的微尺度在显微镜下,并设置1个像素的尺寸的图像中。
- 启动激光和可视化在两种流体的粒子。通过专注于最快颗粒在流动发现微通道的中间平面( 即,最快的颗粒应该是最亮的)。
- 置中的dt(两个连续帧之间的时间间隔),以确保该颗粒的适当位移。最快颗粒应移动这两个图像之间约5至10个像素。
- 开始录制流程。设置为获得100对图像,5毫秒间隔的软件。执行所有的DIF步骤5.4,5.5和5.6同的红细胞悬浮液和对不同的剪切速率。
注:更多的方法的详细情况在皮特和芬内克20的研究。 - 处理使用互相关方法与成像软件获取的记录。
注意:这包括离散图像对成预定大小的小窗口(基于流体流动和由用户选择的时间间隔)称为相关窗和以下在每个窗口中的粒子的位移。- 首先,确定是否获取的图像需要预处理(包括背景减法,"基地剪报"21或图像重叠22,23)更好的数据处理。
- 然后选择相关窗口的大小和形状,以及对图像重叠的百分比。由皮茨等人进行了详细研究。24,以确定最佳参数和图像预处理技术用于血液流入不同的通道配置。表达的结果作为从100图像对和速度的均方根(RMS)误差计算的平均速度场。
- 提取的速度分布在通道出口,从处理后的数据, 如图7。为了更好地信息,在空间平均的速度场。
注意:构成所述速度分布的条对应于选择的相对于通道宽度的相关窗口尺寸。在速度RMS误差也示于图7中 ,表示在实验速度估计的误差。 - 关闭激光一旦所有的测量和处理被执行,。关闭系统的所有组件:软件,照相机,移动台,计算机和激光。
- 为了计算剪切速率,第一检测和估算血液厚度在基于高速摄像机拍摄所述微通道。为此,所有平均在特定的记录帧,以获得所述视频的一个背景图像。划定血液层( 如图8的红细胞悬浮在10微升/小时时悬浮在5%,10%和15%血细胞比容流动)。获得用于相应血液层厚度的速度值和由血液层厚度除以速度值计算的剪切速率。
结果
在双Y型微通道中的双流体流程的例子示于图2人类红细胞悬浮在5%,10%和15%的血细胞比容和流速为10微升/小时。 图3示出了聚集体尺寸时的差在通道中的流动是从10微升/小时降低到5微升/小时的10%的血细胞比容。这使这些聚集体的尺寸的定性概念不同的血细胞比容和剪切速率时, 图5所示的四种人红细胞聚集体的位移,对三个连续帧,从而提供所需的相机帧速率和定性概念的定性测量聚集在每个帧内的分布。在图5中,小聚集体(具有8个或更少的估计红细胞)以蓝色显示,而介质聚集体(范围从9到30估计红细胞)和大聚集体(大于30估计红细胞)分别示于绿色和红色。
不同红细胞悬浮在通道的速度分布被显示在图7中,其中,红色,蓝色和绿色的曲线代表的红细胞悬浮在5%,10%和15%血细胞比容的速度分布分别。速度的均方根误差,也显示在图7中的每个红细胞悬浮液相比,速度值都比较小,这表明速度测量的精确度,并且因此剪切速率。界面位置被表示为"E"和示为在相同的图中的实线表示。
相应的剪切速率对不同红细胞悬液(基于所述速度分布和血液层厚)示于表1。确定每个红细胞悬浮液的平均聚集体尺寸的基础上,图像处理方法,以检测红细胞聚集体的区域,显示在图9中 ,作为一个FUNCT离子的相应的剪切速率。每个集料内的RBC的百分比分布的一个例子示于图6的聚集体尺寸被表示为红细胞中的聚集体的估计数目。
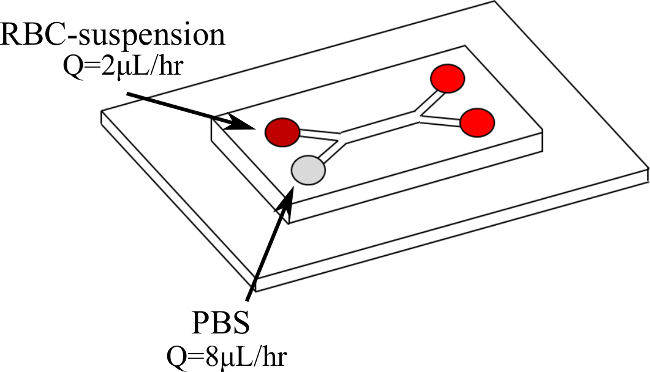
图1.双Y型微通道配置和入门的液体 。进入血液,在Q = 2微升/小时的第一家分行,而进入PBS在Q = 8微升/小时的第二支。 请点击此处查看该图的放大版本。

图2.人类红细胞悬浮液在不同的血细胞比容。这个数字代表捕获人类红细胞悬液在Q = 10微升/小时,在流动的帧(A)的5%(B)10%和(C)15%的血细胞比容。 请点击此处查看该图的放大版本。

图3.人类红细胞悬浮液在不同流速,这个数字代表捕获人类红细胞悬浮在10%血细胞比容^ h流(A)Q = 10微升/小时和(B)Q = 5微升/小时的框架。 请点击这里查看该图的放大版本。

图4.流程图用于骨料的检测的图像处理程序的。所示描述所使用的基本方法的步骤。图像的质量得到增强,可为c onverted为二进制图像。这些聚集体检测,并根据各自的尺寸标注。 请点击此处查看该图的放大版本。

图5. RGB着色和几个人RBC的净运动聚集三个连续帧。该图显示了在(A) 的 t = 0的毫秒,(B)中 T = 60毫秒在三个连续帧中检测4聚集体和净运动(C)T = 120毫秒。的大的聚集体(> 30估计红细胞),介质聚集体(9-30估计红细胞)和小聚集体(<8估计红细胞)示于红,绿和蓝分别。每个检测到的聚集体都标有一个黑圈。_blank">点击此处查看该图的放大版本。
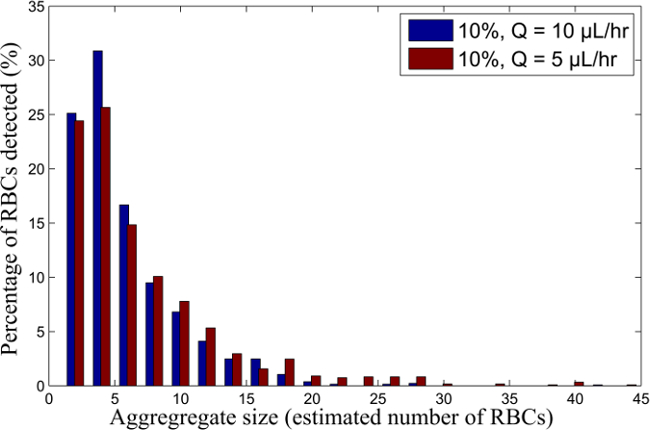
图6.红细胞聚集粒径分布为10%H红细胞悬液不同的流量。血样悬挂在10%H骨料粒度分布,流动在Q = 10和5微升/小时。 请点击此处查看大图这个数字。

对于不同的血细胞比容图7速度曲线比较。的速度曲线示出在等离子体红细胞悬浮在5%的H(红色),10%的H(蓝色),15%的H(绿色)和模拟19(实线)的120×60微米的双Y型微通道与Q = 10微升/小时。接口位置记作e为实验。屏幕上显示的不同速度曲线相应的均方根误差。 请点击此处查看该图的放大版本。

图8.图像背景的不同红细胞悬液的血层厚度和划界。该图显示了红细胞悬液流动在10微升的血液层厚度的划界/小时悬浮在(A) 的 5%,( 乙 )10%和(C)15%H. 请点击此处查看该图的放大版本。

Figu重9, 平均聚集体尺寸与相应的剪切速率的函数 。结果在不同的红细胞悬液在Q = 10微升/小时,在5%(A),10%(B)和15%H(C)获得流动。 请点击此处查看该图的放大版本。
| 红细胞压积 | 流速(微升/小时) | 剪切速率(秒-1) |
| 5% | 10 | 11.02 |
| 5% | 五 | 5.36 |
| 10% | 10 | 8.17 |
| 10% | 五 | 4.47 |
| 15% | 10 | 7.41 |
| 15% | 五 | 2.51 |
表1剪切率值不同的血流量的情况下的剪切速率值是使用μPIV数据和图像处理结果而不同红细胞悬液,用5%,10%和15%的H得到的,流动的在Q = 10微升/小时及Q = 5微升/小时。
讨论
使用本方法,有可能以定性分析和定量红细胞聚集不同流动条件和血细胞比容下。对于成功的测试和总检测,关键的是要确定在所述微通道入口在两种流体之间的适当速度比。这个比例是非常重要的,以获得最佳的血层厚度,其中的速度分布是准线性19。
成功测试的另一个关键因素是一个不错的成像质量。实际上,由于该方法是基于图像处理,这是非常重要的是要有图像背景(信道内的流体)和待检测的粒子之间的对比。这里, 如图2和3所示,颗粒表现为比背景,这有助于在总体检测暗。考虑用于图像处理技术是最重要的参数是吨hreshold值。因此,基于该对比度获得关键的是要选择其中所有的聚集体将被考虑, 如图5中的最佳的阈值。本图像分割,用于该研究中,被广泛用于小区检测及数量25- 27,如果图像的质量是不理想的和全局阈值是不恰当的,可以使用不同的算法,以确定最佳阈值,如大津的方法28或自适应阈值法(分割图像和获得局部阈值的每个离散窗口)。
另一个因素要考虑到是用于从像素到微米的正确的转换比例因子。
使用适当的转换因子,可以确定的直径和厚度1红细胞,这将有助于确定聚集粒径分布(基于所估计的numbe红细胞中的每个集合r)的。取决于聚集体的方向,适当地计算在一个红细胞(正面或侧面视图)的区域。正如在第4(步骤4.4.1),它以确定适当的相机的曝光时间和帧速率,以确保聚集体的动态属性的每个连续的帧之间被捕获的是重要的。这个值是基于取得的测量时所使用的流速。需要几个其它因素取得使用μPIV系统的结果时,必须考虑到与在皮茨和芬内克20的研究清楚地进行了讨论。
该方法是在几个红细胞悬浮液流动在不同的血细胞比容试验成功。但是,由于该图像处理技术和缺少的图像背景和聚集体之间的对比度的限制,所以很难检测红细胞聚集更高的血细胞比容(20%至45%)。事实上,如前所述先前,图像质量是这种方法的关键。
使用此协议,红细胞聚集体尺寸可以受控的微流体装置来测量,因此它是可以动态地获取信息,红细胞聚集在微循环,将获得的红细胞聚集体尺寸为一系列生理剪切速率。另外,也可以补充血液流变学的数值模拟和实验研究,并涉及所述聚集体尺寸和行为,临床和病理研究。
披露声明
作者什么都没有透露。
致谢
这项工作是由加拿大自然科学和工程研究理事会的支持。与麦吉尔纳米工具MICROFAB设施麦吉尔大学和电子部卡尔顿大学的支持下进行微细加工。
材料
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
参考文献
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. . Red Blood Cell Aggregation. , (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. . Handbook of Hemorheology and Hemodynamics. , (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314 (2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302 (2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。