Method Article
Environnement microfluidique contrôlée pour Dynamic Investigation of Blood Red Cell Agrégation
Dans cet article
Erratum Notice
Résumé
Le protocole décrit les détails d'une procédure expérimentale pour quantifier Red Blood Cell (RBC) agrégats sous un taux de cisaillement contrôlé et constant, basé sur des techniques de traitement d'image. L'objectif de ce protocole est de relier RBC tailles d'agrégats au taux de cisaillement correspondant dans un environnement microfluidique contrôlée.
Résumé
Le sang, comme un fluide biologique non newtonien, représente l'objet de nombreuses études dans le domaine de hémorhéologie. les constituants du sang comprennent les globules rouges, les globules blancs et de plaquettes qui sont en suspension dans le plasma sanguin. En raison de l'abondance des globules rouges (40% à 45% du volume du sang), leur comportement détermine le comportement rhéologique du sang en particulier dans la microcirculation. A taux de cisaillement très faibles, les globules rouges sont perçus à assembler et entités forment des agrégats appelés, ce qui provoque le comportement non-newtonien du sang. Il est important de comprendre les conditions de la formation d'agrégats de comprendre la rhéologie du sang dans la microcirculation. Le protocole décrit ici en détail la procédure expérimentale pour déterminer quantitativement les agrégats de RBC dans la microcirculation sous taux de cisaillement constant, basée sur le traitement d'image. A cet effet, RBC-suspensions sont testés et analysés en 120 x 60 um poly-diméthyl-siloxane (PDMS) microcanaux. Les suspensions sont RBC-entplu l'aide d'un deuxième fluide, afin d'obtenir un profil de vitesse linéaire à l'intérieur de la couche de sang et de réaliser ainsi une large gamme de taux de cisaillement constant. Le taux de cisaillement est déterminée en utilisant un système de micro Particle Image Velocimetry (μPIV), tandis que les agrégats de RBC sont visualisées en utilisant une caméra à haute vitesse. Les vidéos capturées des agrégats RBC sont analysées en utilisant des techniques de traitement d'image afin de déterminer les dimensions globales sur la base des intensités des images.
Introduction
Les globules rouges (hématies) jouent un rôle crucial dans la détermination du comportement rhéologique de sang. Ils sont presque singulièrement responsable des propriétés particulières du sang in vitro et in vivo. Dans des conditions physiologiques, les RBC occupent 40% à 45% du volume sanguin. Dans la microcirculation, les globules rouges ne occupent jusqu'à 20% du volume de sang en raison de diamètre des vaisseaux plus petits et le plasma écrémage effet 1. Ce phénomène de réduction du plasma dans la microcirculation est connu comme l'effet Fahraeus. A des taux de cisaillement faibles, les globules rouges sont en mesure de combler ensemble et former une ou dimensions des structures tridimensionnelles appelés "rouleaux" ou agrégats, contribuant ainsi au comportement non-newtonien du sang. Cependant, le mécanisme d'agrégation RBC est pas complètement compris. Deux théories existent pour modéliser l'agrégation des globules rouges: le pontage de la théorie des cellules due à la réticulation des macromolécules 2 et l'attrac de forcethéorie de l'épuisement tion provoquée par des molécules due au gradient osmotique 3.
Typiquement, pour le sang humain, des agrégats se forment à des taux de cisaillement très faibles 4 allant de 1 à 10 s -1. Au-dessus de cette gamme, les globules rouges ont tendance à désagréger et de débit séparément dans le navire.
Comprendre les conditions de la formation d'agrégats est d'une grande importance pour le domaine de hémorhéologie en termes de définition comportement rhéologique de sang. Ces agrégats sont souvent vus au niveau de macrocirculation (> 300 um de diamètre) 5. A cette échelle, le sang est considéré comme un fluide newtonien et d'un mélange homogène. Cependant, ces agrégats sont rarement observés dans le niveau capillaire (4-10 um de diamètre) et sont habituellement une indication d'états pathologiques tels que le diabète et l'obésité 6. Autres conditions pathologiques qui pourraient changer l'agrégation RBC inclut conditions inflammatoires ou infectieuses,les maladies cardiovasculaires telles que l'hypertension ou l'athérosclérose, les maladies génétiques et des maladies chroniques 7. Par conséquent, la compréhension du mécanisme d'agrégation RBC et l'analyse de ces entités (en définissant une relation entre la taille de ces agrégats et les conditions d'écoulement) peut conduire à la compréhension du comportement microrhéologiques de sang et par conséquent le relier à des applications cliniques.
RBC agrégats peuvent être modifiés par plusieurs facteurs tels que l'hématocrite (volume de globules rouges dans le sang), le taux de cisaillement, le diamètre du récipient, la raideur de la membrane RBC et la composition du milieu de mise en suspension 10.8. Par conséquent, des conditions contrôlées sont nécessaires afin d'analyser efficacement les agrégats de RBC. Plusieurs méthodes sont capables d'analyser la formation d'agrégats en fournissant des mesures d'agrégation statiques (indice d'agrégation) qui offre des informations pertinentes sur le comportement de sang. Ces procédés comprennent, entre autres, la vitesse de sédimentationProcédé selon 11, le procédé de transmission de lumière 12, le procédé de réflexion de lumière 13 et la méthode de viscosité à faible cisaillement 14.
Peu d'études ont tenté d'étudier l'agrégation RBC et de déterminer le degré d'agrégation dans des conditions d'écoulement contrôlées 15-17. Cependant, ces études examinent indirectement RBC tailles agrégées par la détermination du rapport de l'espace occupé dans un système de cisaillement mesurée à partir d'images microscopiques du sang fournissant des informations sur le degré d'agrégation, ainsi que la viscosité locale.
Nous présentons donc une nouvelle procédure de quantifier directement RBC regroupe la microcirculation, dynamiquement, en vertu des taux de cisaillement constante et contrôlée. RBC-suspensions sont entraînés, dans un double Y-microcanaux (comme cela est illustré sur la figure 1), avec un tampon phosphate salin (PBS) créant ainsi un écoulement de cisaillement dans la couche de sang. Dans ce sang couche A karité constantetaux de r peut être obtenue. Les suspensions de RBC sont testés à différents hématocrite (H) des niveaux (5%, 10% et 15%) et sous différents taux de cisaillement (11/02 sec -1). La vitesse du sang et le taux de cisaillement sont déterminées en utilisant un système de micro Particle Image Velocimetry (μPIV) tandis que le flux est visualisée à l'aide d'une caméra à haute vitesse. Les résultats obtenus sont ensuite traités avec un code MATLAB sur la base des intensités de l'image afin de détecter les globules rouges et de déterminer les dimensions globales.
Protocole
Le sang est prélevé d'individus sains avec l'approbation du comité d'éthique de l'Université d'Ottawa (H11-13-06).
1. Microchannel Fabrication
Les microcanaux sont fabriqués selon les méthodes classiques de photolithographie 18.
- Concevoir la géométrie de microcanaux en utilisant une conception (CAO) assistée par ordinateur et imprimer la configuration sur un transparent photo-masque. Ces masques sont essentiels car ils déterminent le trajet de lumière pendant le processus de fabrication. Dans ce cas, les dimensions de microcanaux sont de 120 um d'épaisseur, 60 um de profondeur et 7 mm de longueur.
- Dans une salle blanche, dépôt à la tournette une résine époxy à base de résine photosensible négative sur une plaquette de silicium à 2000 tours par minute pendant 30 secondes pour obtenir la profondeur désirée de microcanaux (60 um).
- Exposer la tranche et le photo-masque sous une lampe UV à 650 mJ / cm 2 à 70 sec. Assurez-vous d'exposer uniquement les zones transparentes de laphoto-masque à la lumière UV. L'exposition des zones transparentes permet la polymérisation des chaînes aboutissant à un durcissement de la résine photosensible. Immerger la pièce de silicium en un développeur pour enlever l'excès de résine photosensible.
- Une fois que le moule est fabriqué, mélanger un élastomère à base de silicium et un agent de durcissement dans un rapport de 10: 1 pour créer une solution de poly-diméthyl-siloxane (PDMS). Mettre la solution PDMS dans une chambre à vide pour dégazer. Verser dans le moule et faire chauffer à 60 ° C pendant 90 min pour créer microcanaux. Puis lier les canaux individuels à une lame de verre en utilisant une liaison par plasma d'oxygène pendant 90 secondes.
REMARQUE: le processus de dégazage PDMS est effectuée afin d'éliminer les bulles d'air engendrés par le processus de mélange. - Veiller à ce que les dimensions de microcanaux permettent de tests avec succès. Dans ce protocole, les micro-canaux ont une section rectangulaire de 120 x 60 um. En comparaison, une moyenne de RBC a un diamètre de 8 um et une épaisseur de 2 um. Lerefore, la largeur de microcanaux suffit d'observer l'agrégation appropriée et de déterminer avec précision les profils de vitesse.
2. Préparation de sang
- Prélever le sang de donneurs volontaires en bonne santé, après l'approbation d'un comité d'éthique. On traite le sang avec de l'acide éthylènediaminetétraacétique (EDTA) présent dans les tubes de collecte (7,2 mg d'EDTA dans 4 ml de sang).
NOTE: L'EDTA est utilisé pour éviter la coagulation du sang. - Centrifuger les échantillons de sang trois fois pendant 10 min à 1400 x g (3000 rpm) en vue de séparer les constituants du sang. À la suite de la centrifugation, observer trois couches distinctes.
REMARQUE: Les trois couches sont la couche de RBC (situé au fond du tube), la couche leucocyto-plaquettaire (constitué par les cellules et les plaquettes sanguines blanches situées sur le dessus de la couche RBC) et la couche de plasma (qui se trouve au-dessus de tous les autres constituants).- Après la première centrifugation, recueillir le plasma sanguin à l'aide d'une pipette de sang. Eviter tout contactez avec la couche leucocytaire.
- Ramasser et éliminer la couche leucocytaire dans un récipient avec l'eau de Javel diluée à 10%.
- Ajouter 3 ml de PBS pH 7,4 à chacun des tubes de la couche de RBC restant et assurer le bon équilibre de la centrifugeuse. Mélanger délicatement les tubes et centrifuger une fois de plus à 1400 xg (3000 rpm) pendant 10 min.
NOTE: Assurez-vous que la solution de PBS ne contient pas de magnésium ou de calcium, car ils pourraient modifier l'adhésion cellulaire. - Éliminer le PBS dans les tubes après la deuxième centrifugation et retirer la couche leuco-plaquettaire résiduelle si elle est présente. Répétez les étapes 2.2.3 et 2.2.4 pour la troisième centrifugation pour obtenir des globules rouges propres.
- Mélanger la quantité requise (0,05, 0,1 et 0,15 ml) de globules rouges propres avec plasma (0,95, 0,9 et 0,85 ml) dans un tube de 1 ml pour obtenir RBC-suspensions avec le correspondant (5%, 10% et 15% ) hématocrite. Vérifiez hématocrites avec une microcentrifugeuse.
3. Fluides Préparation
Présentez deux fluides dans la double Y-microcanaux: RBC-suspensions et PBS.
- Ajouter 60 ul de la solution de particules de traceur fluorescent (1% de matières solides, particules d = 0. 86 pm, λ = 542 nm abs et λ = 612 nm émission) dans les tubes 1 ml RBC-suspension.
REMARQUE: Les particules traceuses fluorescentes (teints à l'intérieur des particules de polystyrène) sont utilisés pour mesurer la vitesse de l'écoulement à l'intérieur du microcanal. Ces particules fluorescent lorsqu'il est exposé à la longueur d'onde correspondante du faisceau laser (λ = 542 nm). - Préparer une solution de PBS à pH 7,4 et ajouter 60 ul de la solution de même fluorescent particules de traceur dans 1 ml de la solution PBS.
4. Granulats Taille Dimensions
- Pour insérer les fluides (RBC-suspensions et PBS) dans le microcanal, utiliser deux seringues en verre de 25 pi et 100 pi. Cette volontécontribuer à réduire la conformité du système. Connecter les microcanaux aux seringues via un tube et des connecteurs ajustés les trous d'entrée. Remplir les seringues en verre à l'aide de la différence de pression existant entre le réservoir de fluide et la seringue. Assurez-vous qu'aucun des bulles sont présentes dans le système. Comme méthode alternative, utiliser un système à pression contrôlée à conduire les deux fluides dans le microcanal.
- Placez le microcanal sur une platine du microscope inversé relié à une caméra à grande vitesse et un système μPIV. Programme de la pompe de la seringue pour les débits souhaités (par exemple, Q = 2 pl / h pour le sang engendrant un débit de Q = 8 pi / h pour PBS).
NOTE: Une seule pompe à seringue est utilisée. L'utilisation de deux seringues en verre différents, avec deux diamètres intérieurs différents, il est possible de faire varier le débit à l'entrée de chaque branche de l'Y-microcanal. - Insérer les deux fluides dans la double Y-microcanaux chacun d'une entrée branche différente et à différents débits comme indiqué dans Figure 1. Afin de tester différents taux de cisaillement, changer le débit de la pompe. Cela permet de maintenir le même ratio approprié (4 dans ce cas) entre les deux branches 19 (figures 2 et 3). Attendez que le débit pour atteindre l'état d'équilibre avant d'acquérir les mesures: inspecter visuellement les images de la caméra à haute vitesse pour un flux lisse.
Remarque: Le ratio est crucial pour obtenir un profil de vitesse linéaire à l'intérieur de la couche de sang. - Visualisez les globules rouges à l'aide de la caméra haute vitesse. Branchez l'appareil photo à un ordinateur pour contrôler, enregistrer et enregistrer les images de l'écoulement du fluide. Une fois que les deux écoulements de fluides atteignent l'état d'équilibre, commencer l'enregistrement.
- Acquérir plusieurs images pour de meilleurs résultats de traitement. Déterminez un temps d'exposition de la caméra optimale pour une image claire des agrégats.
NOTE: Le temps d'exposition de la caméra pour ce cas est de 0,5 ms. Le choix de l'intervalle de temps entre chaque trame est basée sur la fréquence d'image de la caméra et le débit en til microcanaux. Le temps entre chaque trame traitée dans cette procédure était de 60 msec. Par conséquent, un appareil capable d'enregistrer 18 images par seconde est suffisante.
REMARQUE: Évitez décantation de sang dans le tube et la seringue, ce qui pourrait conduire à des mesures erronées.
- Acquérir plusieurs images pour de meilleurs résultats de traitement. Déterminez un temps d'exposition de la caméra optimale pour une image claire des agrégats.
- En utilisant des techniques de traitement d'image (un programme MATLAB dans ce cas) pour améliorer la qualité d'image, de détecter les agrégats dans chacune des images sur la base des intensités de pixels (représentés sur la figure 4) comme suit:
- Améliorer les images contrastent avec la méthode histogramme de l'égaliseur pour obtenir une meilleure qualité d'image pour chaque trame.
- Convertir les images en niveaux de gris en images binaires. A cet effet, définir une valeur de seuil, compris entre 0 et 1, qui dicte la conversion de chaque pixel. Tout pixel dans l'image ci-dessous de la valeur seuil sera détecté comme un pixel noir, tandis que les pixels avec des valeurs plus grandes que le seuil sera détecté comme pixels blancs.
- Remplissez ledes trous (si elle est présente et nécessaire) correspondant aux écarts dans l'agrégat pour de meilleurs résultats.
- Détecter les cellules en déterminant des pixels blancs voisins dans l'image binaire de sorte que les cellules adjacentes sont associés sous forme d'agrégats.
- Étiqueter les différents agrégats détectés et convertir l'image binaire en une image rouge-vert-bleu (RVB) pour une meilleure visualisation. Combiner les trames originales avec chacune des images traitées correspondant à vérifier l'efficacité de la technique de traitement d'image et de veiller à ce que toutes les cellules sont prises en considération, comme le montre la Figure 5. Effectuer les étapes 4.5.1, 4.5.2, 4.5.3 , 4.5.4 et 4.5.5 pour toutes les trames capturées.
- Calculer l'aire de chaque agrégat détecté dans la trame sur la base du nombre de pixels détectés. Basé sur le grossissement de l'objectif utilisé, calculer le facteur de conversion, en utilisant un réticule d'étalonnage, et de convertir les résultats de 2 um. La moyenne des tailles d'agrégats détectés dans chaquecadre, puis la moyenne des résultats pour tous les cadres pour obtenir la taille moyenne globale pour chaque enregistrement de RBC-suspensions.
- Calculer l'aire d'un RBC pour déterminer un nombre estimatif représentant de globules rouges dans chaque agrégat détecté. A partir de ces résultats, le calcul de la répartition du pourcentage de globules rouges à l'intérieur de chaque agrégat en fonction de la taille d'agrégat (représentés par une estimation du nombre de cellules dans chaque agrégat), comme représenté sur la Figure 6.
NOTE: Pour mesurer les agrégats de RBC, le logiciel ImageJ pourrait être utilisé (au lieu de MATLAB) pour effectuer les mêmes tâches sur chaque trame.
5. Fluide de vitesse et la vitesse de cisaillement Mesures
Déterminer la vitesse du fluide et donc le taux de cisaillement en utilisant un système μPIV.
- Une fois que les données sont acquises en utilisant la caméra haute vitesse, passer à la caméra à double pulsé utilisé pour le système μPIV. Utilisez un logiciel d'imagerie pour l'image acquisition de l'écoulement et le traitement d'image pour la détermination du champ de vitesse.
- Prenez toutes les précautions nécessaires, en fonction de la classe du laser, avant de se tourner sur le laser. Puis tourner sur le système, la caméra et le laser.
- Calibrer l'appareil en fonction de l'agrandissement de l'objectif utilisé. A cet effet, utiliser un micro-précision de 10 um sous le microscope et définir la taille de 1 pixel dans l'image.
- Lancer le laser et de visualiser les particules dans les deux fluides. Trouver le plan médian des microcanaux en se concentrant sur les particules les plus rapides dans le débit (à savoir, les particules les plus rapides devraient être les plus brillants).
- Réglez le dt (intervalle de temps entre deux trames consécutives) pour assurer le bon déplacement de la particule. Les particules les plus rapides doivent se déplacer environ 5 à 10 pixels entre les deux images.
- Commencer l'enregistrement du flux. Réglez le logiciel à acquérir 100 paires d'images, 5 ms d'intervalle. Effectuer les étapes 5.4, 5.5 et 5.6 pour tous les difdiffé- RBC-suspensions et pour les différents taux de cisaillement.
NOTE: Plus de détails de la méthode sont donnés dans l'étude de Pitts et Fenech 20. - Traiter les enregistrements acquis en utilisant la méthode de corrélation croisée avec le logiciel d'imagerie.
REMARQUE: Elle consiste à discrétiser la paire d'images en petites fenêtres de taille prédéterminée (par rapport à l'écoulement de fluide et l'intervalle de temps choisi par l'utilisateur) appelé de fenêtres de corrélation et en suivant le déplacement des particules dans chaque fenêtre.- Tout d'abord, de déterminer si les images acquises nécessitent de pré-traitement (y compris la soustraction de fond, "base-clipping" 21 ou l'image se chevauchent 22,23) pour un meilleur traitement des données.
- Ensuite, choisissez la taille de la fenêtre de corrélation et la forme, ainsi le pourcentage des images qui se chevauchent. Une étude détaillée a été réalisée par Pitts et al. 24 afin de déterminer les paramètres optimaux et techniques image pré-traitement pour le sangcirculer dans des configurations de canaux différents. Exprimer les résultats en un champ de vitesse moyenne calculée à partir des 100 paires d'images et l'erreur quadratique moyenne (RMS) de la vitesse.
- Extraire un profil de vitesse à la sortie du canal, à partir des données traitées comme montré sur la figure 7. Pour un meilleur profil, en moyenne le champ de vitesse dans l'espace.
REMARQUE: Les barres qui composent le profil de vitesse correspond à la taille de fenêtre de corrélation choisi par rapport à la largeur du canal. L'erreur RMS de la vitesse est également représenté sur la figure 7, représentant l'erreur dans l'estimation de vitesse expérimentale. - Éteignez le laser une fois que toutes les mesures et les traitements sont effectués ,. Arrêtez tous les composants du système: logiciels, caméras, stade déplacement, les ordinateurs et laser.
- Pour calculer la vitesse de cisaillement, d'une part détecter et estimer l'épaisseur de sang dans le microcanal sur la base de l'enregistrement de la caméra grande vitesse. A cet effet, la moyenne de toutesles trames spécifique dans l'enregistrement afin d'obtenir une image d'arrière-plan de la vidéo. Délimiter la couche de sang (comme représenté sur la figure 8 pour les RBC-suspensions fluides à 10 ul / h lorsqu'il est en suspension à 5%, 10% et 15% hématocrite). Obtenir la valeur de la vitesse de l'épaisseur de la couche de sang correspondant et calculer la vitesse de cisaillement en divisant la valeur de la vitesse par l'épaisseur de la couche de sang.
Résultats
Un exemple de l'écoulement à deux fluides dans le double Y-microcanal est représenté sur la Figure 2 pour les globules rouges humains en suspension à 5%, 10% et 15% d'hématocrite et circulant à 10 ul / h. La Figure 3 montre la différence dans les tailles agrégées lorsque l'écoulement dans le canal est réduite de 10 ul / h à 5 ul / h pour un hématocrite de 10%. Cela donne une notion qualitative de la taille des agrégats en variant l'hématocrite et du taux de cisaillement. La figure 5 suit le déplacement de quatre agrégats RBC humains, pour trois trames consécutives, fournissant une mesure qualitative de la fréquence d'images de la caméra requis et notion qualitative de la agrégats distribution au sein de chaque trame. Dans la Figure 5, les petits agrégats (avec les globules rouges 8 ou estimés) sont indiqués en bleu, tandis que les agrégats moyennes (allant de 9 à 30 estimés globules rouges) et de grands agrégats (supérieure à 30 estimé globules rouges) sont représentés en vert et rouge respectivement.
Les profils de vitesse des différents RBC-suspensions dans le canal sont affichés dans la Figure 7, où les courbes rouges, bleues et vertes représentent les profils des globules rouges de vitesse en suspension à 5%, 10% et 15% d'hématocrite respectivement. Les erreurs RMS de la vitesse, également affichés à la figure 7 pour chaque RBC-suspension, sont relativement faibles par rapport aux valeurs de vitesse, indiquant la précision des mesures de vitesse, et donc des taux de cisaillement. Les emplacements d'interface sont désignés en tant que "E" et représentés par les traits pleins sur la même figure.
Les vitesses de cisaillement correspondantes pour les différentes RBC-suspensions (sur la base des profils de vitesse et de l'épaisseur de la couche de sang) sont présentés dans le tableau 1. Les dimensions globales moyennes déterminées pour chacun des RBC-suspensions, par rapport au procédé de traitement d'image pour détecter la zone des agrégats RBC, sont présentés dans la figure 9, comme un fonction de la vitesse de cisaillement correspondante. Un exemple de la répartition du pourcentage de globules rouges dans chaque agrégat est représenté sur la Figure 6. Les dimensions globales sont représentées comme un nombre estimé de RBC dans les agrégats.
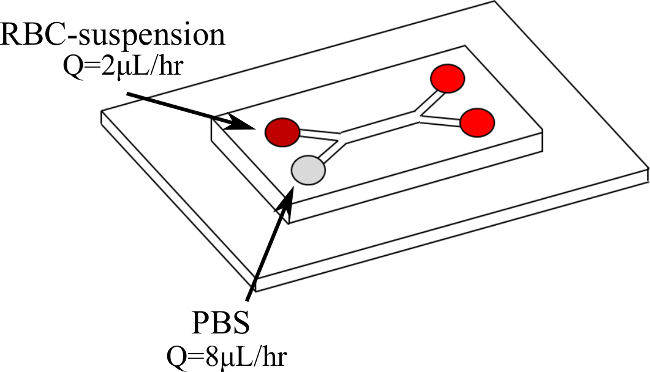
Figure 1. Double configuration Y-canal et entrée fluides. Le sang entre dans la première branche à Q = 2 pl / h tout en PBS entre dans la deuxième succursale à Q = 8 pi / h. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 2. Human RBC-suspension à hématocrite différent. Le chiffre représente les images des RBC suspensions de droits découlant pour Q = 10 pl / h à capturé (A) 5% (B)10% et (C) 15% d'hématocrite. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 3. Human RBC-suspension à différents débits. La figure représente les images des globules rouges humains en suspension à 10% d'hématocrite H fluides (A) Q = 10 pi / h et (B) Q = 5 pi / h capturé. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 4. Organigramme du programme de traitement d'image utilisée pour la détection globale. Les étapes indiquées décrire la méthodologie de base utilisée. La qualité de l'image est améliorée pour c onverted à une image binaire. Les agrégats sont détectés et étiquetés en fonction de leurs tailles respectives. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 5. RVB coloration et le mouvement net de la RBC plusieurs humaine agrège pour trois trames consécutives. La figure montre le mouvement net de quatre agrégats détectés dans trois trames consécutives en (A) t = 0 ms, (B) t = 60 ms et (C) t = 120 ms. Les grands agrégats (> 30 estimé globules rouges), d'agrégats moyennes (9-30 hématies estimés) et de petits agrégats (<8 estimée globules rouges) sont présentés respectivement en rouge, vert et bleu. Chacune des agrégats détectés sont marqués par un cercle noir._blank "> S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
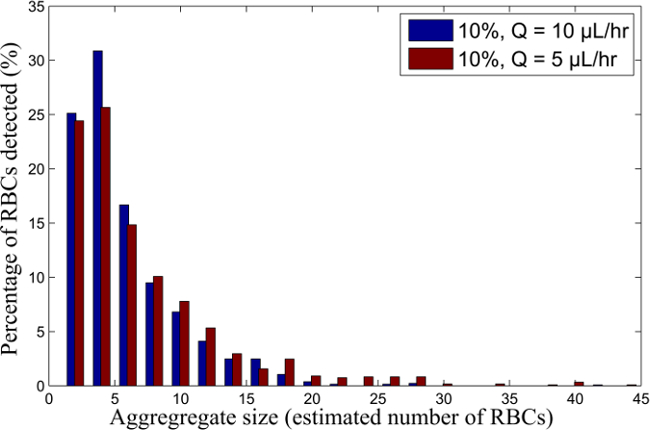
Figure 6. RBC distribution de la taille globale de 10% H RBC-suspension pour des débits différents. Répartition de la taille globale des échantillons de sang en suspension à 10% de H, circulant à Q = 10 et 5 pi / h. S'il vous plaît, cliquez ici pour voir une version plus grande de ce chiffre.

Figure 7. Velocity comparaison de profil pour l'hématocrite différente. Les profils de vitesse sont indiquées pour les globules rouges dans le plasma en suspension à 5% H (Rouge), 10% H (bleu), 15% H (vert) et de la simulation 19 (ligne solide) pour la 120 x 60 um à double Y-microcanaux présentant un Q = 10 pi / h. L'emplacement d'interface est désignée par E de laexpériences. Les RMS erreurs correspondants des différents profils de vitesse sont affichées. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 8. fond de l'image pour les différents RBC-suspensions et la délimitation de l'épaisseur de la couche de sang. La figure montre la délimitation de l'épaisseur de la couche de sang des RBC-suspensions circulant à 10 pl / h suspendue à (A) 5%, (B ) 10% et (C) 15% H. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 9. tailles d'agrégats moyens en fonction des taux de cisaillement correspondant. Les résultats sont obtenus pour les différents RBC-suspensions circulant à Q = 10 pl / h à 5% (A), 10% (B) et 15% H (C). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Hématocrite | Débit (pi / h) | taux de cisaillement (s -1) |
| 5% | 10 | 11.02 |
| 5% | 5 | 5,36 |
| 10% | 10 | 8.17 |
| 10% | 5 | 4.47 |
| 15% | 10 | 7,41 |
| 15% | 5 | 2.51 |
Tableau 1. cisaillement valeurs de taux pour les différents cas d'écoulement de sang. Les valeurs de taux de cisaillement sont obtenus en utilisant les données et l'image des résultats μPIV de traitement pour les différents RBC-suspensions avec 5%, 10% et 15% H, circulant à Q = 10 pi / h et Q = 5 ul / h.
Discussion
En utilisant la méthodologie actuelle, il est possible d'analyser qualitativement et quantitativement la RBC regroupe sous différentes conditions d'écoulement et hématocrites. Pour le test avec succès et la détection globale, il est essentiel de déterminer le rapport de vitesse approprié entre les deux fluides à l'entrée du microcanal. Ce rapport est très important pour obtenir une épaisseur de couche de sang optimal où le profil de vitesse est quasi-linéaire 19.
Un autre facteur clé pour le test réussi est une bonne qualité d'image. En fait, étant donné que la méthode est basée sur le traitement d'image, il est très important d'avoir un contraste entre l'arrière-plan de l'image (le fluide à l'intérieur du canal) et des particules à détecter. Ici, comme représenté sur les figures 2 et 3, les particules semblent être plus foncé que l'arrière-plan, ce qui contribue à la détection globale. Le paramètre le plus important à prendre en considération pour la technique de traitement d'image est le te seuil de valeur. Par conséquent, sur la base du contraste obtenu, il est essentiel de choisir la valeur de seuil optimal où tous les agrégats sont pris en considération, comme illustré sur la figure 5. La segmentation d'image présent, utilisé pour cette étude, est largement utilisé pour la détection de cellules et de comptage 25- 27. Si la qualité de l'image est pas comme souhaitée et une valeur globale de seuil ne convient pas, on peut utiliser un algorithme différent pour déterminer la valeur de seuil optimal tel que la méthode d'Otsu 28 ou une méthode de seuillage adaptatif (discrétisation de l'image et l'obtention d'un seuil local pour chaque fenêtre discrétisé).
Un autre facteur à prendre en compte est le facteur d'échelle pour la conversion correcte de pixels à um.
En utilisant le facteur de conversion approprié, on peut déterminer le diamètre et une épaisseur de RBC, qui servira à déterminer la distribution de taille d'agrégat (basé sur le numbe estiméer des globules rouges dans chaque agrégat). Selon l'orientation des agrégats, calculer correctement la zone sur un RBC (vue frontale ou latérale). Comme mentionné dans la section 4 (étape 4.4.1), il est important de déterminer le temps d'exposition correct de la caméra et le taux de trame pour veiller à ce que les propriétés dynamiques des agrégats sont capturés entre chaque trame consécutive. Cette valeur est basée sur le débit utilisé lors de l'acquisition des mesures. Plusieurs autres facteurs doivent être pris en considération lors de l'acquisition des résultats en utilisant le système μPIV et sont discutées clairement dans l'étude de Pitts et Fenech 20.
La méthodologie a été testée avec succès sur plusieurs RBC-suspensions circulant à hématocrite différente. Toutefois, en raison de la limitation de la technique de traitement d'images et l'absence de contraste entre le fond de l'image et les agrégats, il est difficile de détecter les agrégats RBC pour hématocrites supérieurs (de 20% à 45%). En effet, comme mentionnéprécédemment, la qualité de l'image est crucial pour cette méthodologie.
En utilisant ce protocole, les tailles d'agrégats de RBC peuvent être mesurés dans un dispositif microfluidique contrôlée et donc il est possible d'obtenir des informations sur l'agrégation RBC dynamiquement dans la microcirculation et obtenir les tailles d'agrégats de RBC pour une gamme de taux de cisaillement physiologiques. Il est également possible de compléter les études numériques et expérimentales de la rhéologie du sang et rapporter les dimensions et le comportement d'agrégation pour les études cliniques et pathologiques.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Ce travail a été soutenu par le Conseil de recherches en génie du Canada en sciences naturelles et. Microfabrication a été réalisée avec le soutien de l'installation McGill Nanotools Microfab à l'Université McGill et le département d'électronique de l'Université Carleton.
matériels
| Name | Company | Catalog Number | Comments |
| SU8-50 epoxy based negative Photo-resist | MicroChem Corp. | ||
| SU8-50 developer | MicroChem Corp. | ||
| Poly(dimethylsiloxane) (PDMS) Sylgard-184 | Dow-Corning | 3097358-1004 | |
| PE-50 series Plasma system | Plasma Etch | PE-50 series | |
| Blood collection tubes with K2-EDTA (ethylenediaminetetraacetic acid) | FisherSci | B367861 | |
| Centrifuge, i.e. Thermo Scientific CL2 | Thermo Scientific | 004260F | |
| Poshpate buffered saline (PBS) | Sigma Aldrich | P5368-10PAK | |
| Tracer fluorescent particles solution (15 ml) | FisherSci | R800 | |
| Aggregometer | RheoMeditech | Rheo Scan AnD300 | |
| Glass syringes (50 µl) | Hamilton | 80965 | |
| Tubing (Tygon) | FisherSci | AAA00001 | |
| High speed camera (Basler) | Graftek Imaging Inc. | basler acA2000-340km | A camera capable of recording 18 frames per second could be used. |
| Double pulsed camera | LaVision | Imager Intense | |
| Microscope MITAS | LaVision | MITAS | |
| Nd:YAG laser | New Wave Research | Solo-II | |
| Syringe pump (Nexus3000 and PicoPlus) | Chemyx Inc. and Harvard Apparatus | Nexus3000 and PicoPlus | |
| DaVis software | LaVision | Davis |
Références
- Perkkio, J., Keskinen, R. Hematocrit reduction in bifurcations due to plasma skimming. Bull. Math. Biol. 45 (1), 41-50 (1983).
- Chien, S., Jan, K. Ultrastructural basis of the mechanism of rouleaux formation. Microvasc. Res. 5 (2), 155-166 (1973).
- Neu, B., Meiselman, H. J. Depletion-mediated red blood cell aggregation in polymer solutions. Biophys. J. 83 (5), 2482-2490 (2002).
- Schmid-Schönbein, H., Gaehtgens, P., Hirsch, H. On the shear rate dependence of red cell aggregation in vitro. J. Clin. Invest. 47 (6), 1447-1454 (1968).
- Pries, A. R., Secomb, W. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29 (3-4), 143-148 (2003).
- Baskurt, O. K., Neu, B., Meiselman, H. J. Red Blood Cell Aggregation. , Taylor and Francis. Florida. (2011).
- Cho, Y. I., Mooney, M. P., Cho, D. J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2 (6), 1130-1138 (2008).
- Baskurt, O. K., Hardeman, M. R., Rampling, M. W., Meiselman, H. J. Handbook of Hemorheology and Hemodynamics. , IOS Press. Netherlands. (2007).
- Lindqvist, T. The viscosity of the blood in narrow capillary tubes. Am. J. Physiol.-Legacy Content. 96, 562-568 (1931).
- Goldsmith, H. L., Cokelet, G. R., Gaehtgens, P. R. Fåhraeus: Evolution of his concepts in cardiovascular physiology. Am. J. Physiol. 257 (3), H1005-H1015 (1989).
- Fåhraeus, R. The suspension stability of the blood. Physiol. Rev. 9 (2), 241-274 (1929).
- Bauersachs, R. M., Wenby, R. B., Meiselman, H. J. Determination of specific red blood cell aggregation indices via an automated system. Clin. Hemorheol. 9 (1), 1-25 (1989).
- Hardeman, M. R., Dobbe, J. G., Ince, C. The laser-assisted optical rotational cell analyzer (lorca) as red blood cell aggregometer. Clin. Hemorheol. Microcirc. 25 (1), 1-11 (2001).
- Rampling, M. W. Red cell aggregation and yield stress. Clinical Blood Rheology. , CRC Press. Boca Raton, Florida. (1988).
- Dusting, J., Kaliviotis, E., Balabani, S., Yianneskis, M. Coupled human erythrocyte velocity field and aggregation measurements at physiological haematocrit levels. J. Biomech. 42 (10), 1438-1443 (2009).
- Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity: modelling using shear fields measured by a µPIV based technique. Med. Eng. Phys. 33 (7), 824-831 (2011).
- Sherwood, J. M., Kaliviotis, E., Dusting, J., Balabani, S. Spatial variation of blood viscosity and velocity distributions of aggregating and non-aggregating blood in a bifurcating microchannel. Biomech. Model. Mechan. 13 (2), 259-273 (2014).
- Chen, S., Barshtein, G., Gavish, B., Mahler, Y., Yedgar, S. Monitoring of red blood cell aggregability in a flow chamber by computerized image analysis. Clin. Hemorhol. Microcirc. 14 (4), 497-508 (1994).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie International Edition England. , 551-577 (1998).
- Mehri, R., Mavriplis, C., Fenech, M. Design of a microfluidic system for red blood cell aggregation investigation. J. Biomech. Eng. 136 (6), 064501-1-064501-5 (2014).
- Pitts, K. L., Fenech, M. Micro-particle image velocimetry for velocity profile measurements of micro blood flows. J. Vis. Exp. (74), e50314(2013).
- Bitsch, L., Oleson, L. H., Westergaard, C. H., Bruus, H., Klank, H., Kutter, J. P. Micro particle-image velocimetry of bead suspensions and blood flows. Exp. Fluids. 39 (3), 507-513 (2005).
- Wereley, S. T., Gui, L., Meinhart, C. D. Advanced algorithms for microscale particle image velocimetry. AIAA J. 40 (6), 1047-1105 (2002).
- Nguyen, C. V., Fouras, A., Carberry, J. Improvement of measurement accuracy in micro PIV by image overlapping. Exp. Fluids. 49 (3), 701-712 (2010).
- Pitts, K. L., Mehri, R., Mavriplis, C., Fenech, M. Micro-particle image velocimetry measurement of blood flow: validation and analysis of data pre-processing and processing methods. Meas. Sci. Technol. 23 (10), 105302(2012).
- Bhamare, M. G., Patil, D. S. Automatic blood cell analysis by using digital image processing: a preliminary study. Int. J. Eng. Res. Tech. 2 (9), 3135-3141 (2013).
- Maitra, M., Gupta, R. K., Mukherjee, M. Detection and counting of red blood cells in blood cell images using hough transform. Int. J. Comput. Appl. 53 (16), 18-22 (2012).
- Jambhekar, N. D. Red blood cells classification using image processing. Sci. Res. Repot. 1 (3), 151-154 (2011).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans. Syst. Man. Cybern. 9 (1), 62-66 (1979).
Erratum
Formal Correction: Erratum: Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation
Posted by JoVE Editors on 11/30/2015. Citeable Link.
An erratum was issue for Controlled Microfluidic Environment for Dynamic Investigation of Red Blood Cell Aggregation. The introduction section was updated.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon