Method Article
Em tempo real de Citotoxicidade em Sangue Total Humano
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O ensaio de citotoxicidade de sangue total (WCA) é um ensaio de citotoxicidade desenvolvido mediante a incorporação de alto rendimento tecnologia de posicionamento de célula com microscopia de fluorescência e de processamento de imagem automatizado. Aqui, nós descrevemos como células de linfoma tratadas com um anticorpo anti-CD20 pode ser analisada em tempo real no sangue humano inteiro para fornecer uma análise quantitativa da citotoxicidade celular.
Resumo
Um ensaio baseado em células vivo de sangue total citotoxicidade (WCA) que permite o acesso à informação temporal da citotoxicidade celular global é desenvolvida com a tecnologia de alto rendimento de posicionamento de célula. As populações de células tumorais alvo são primeiro pré-programado para imobilização num formato de array, e marcadas com corantes fluorescentes verdes citosólicas. Na sequência da formação de matriz celular, drogas de anticorpo são adicionados em combinação com sangue total humano. Iodeto de propídio (PI) é então adicionado para avaliar a morte celular. A matriz de células é analisado com um sistema de imagem automática. Embora as etiquetas corante citosólica populações de células tumorais visadas, as etiquetas PI populações de células tumorais mortas. Assim, a percentagem de morte de células de cancro alvo pode ser quantificada por cálculo do número de células sobreviventes direccionadas para o número de células alvo mortas. Com este método, os pesquisadores são capazes de acessar dependente do tempo e informações citotoxicidade celular dependente de dose. Notavelmente, sem rádio perigososprodutos químicos são utilizados. O WCA aqui apresentada foi testado com linfoma, leucemia e linhas celulares de tumores sólidos. Portanto, WCA permite aos pesquisadores para avaliar a eficácia da droga em uma condição altamente relevante ex vivo.
Introdução
Recentes avanços na indústria farmacêutica têm levado a um aumento do interesse em realizar as identificações específicas de anticorpos contra as células do tumor e tratamentos personalizados de câncer; No entanto, vários obstáculos são encontrados no processo. Apenas 5% dos agentes que têm actividade anti-cancerígena em desenvolvimento pré-clínico são licenciados depois de mostrar eficácia suficiente em fase de testes II-III 1,2. As estratégias de pré-clínicos (tanto in vitro como in vivo) são sub-óptima como muitos exemplos têm mostrado que os medicamentos anti-tumorais se comportam de maneira diferente em humanos e em animais de laboratório, principalmente devido aos seus diferentes componentes do sangue de 3-5.
Para abordar a necessidade de uma plataforma de rastreio de drogas anti-tumor e para fornecer um ponto de verificação antes de experiências com animais e ensaios clínicos dispendiosa, um ensaio de citotoxicidade de sangue total humano (WCA) é proposto para avaliar a eficácia do fármaco anti-tumoral num ambiente biológico mais relevante. Oensaio de citotoxicidade de sangue total pode ser utilizada para avaliar a resposta de células individuais de anticorpos e outros candidatos a fármacos no sangue humano inteiro.
A WCA é desenvolvido através da incorporação de tecnologia de alto rendimento posicionamento de células com alta taxa de transferência e de alto teor de imagem 6. Através da utilização de um sistema de imagem automatizado, o número de ambas as células vivas e mortas pode ser determinada com um elevado grau de precisão. Devido ao facto de que as células-alvo são imobilizadas no mesmo plano focal, WCA é capaz de fornecer uma análise quantitativa citotoxicidade em tempo real, sem a remoção de células vermelhas do sangue. Além disso, o sistema de imagem automática, oferece várias vantagens, como a que apenas as células-alvo que atingiram os critérios especificados (ex., Células com marcação fluorescente, e morfologia das células) são fechados e processados. Além disso, ele permite a produção de placas de 144 por dia. Consequentemente, esta capacidade de imagem e taxa de transferência permite um funcionamento de alta content e experiências de alto rendimento simultaneamente. Ao combinar WCA eo sistema de imagem automatizado, alto rendimento análise de citotoxicidade celular quantitativa pode ser alcançada dentro de um ambiente mais relevante biológica.
Protocolo
1. Alvo celular Preparação
- Manter (por exemplo, células de linfoma. Raji) células alvo em meio de crescimento RPMI 1640 (meio de cultura, com 10% inactivado pelo calor de soro fetal bovino (FBS), L-glutamina 4 nM, e 500 UI / ml de penicilina / estreptomicina), a 37 ° C 5% num incubador de CO2.
- Centrifuga-se a amostra para sedimentar as células-alvo em um tubo de 15 ml. Tempo de centrifugação varia de acordo com diferentes tipos de células; centrifuga-se durante 3 min a 468 xg durante células Raji.
- Primeiro aspirar quaisquer bolhas formadas na superfície do sobrenadante, e remover todo o sobrenadante.
- Adicionar 10 ml de PBS ao tubo. Re-suspender as células por pipetagem a solução para cima e para baixo várias vezes para quebrar o amontoado de células.
- Centrifugar a amostra durante 3 minutos a 468 x g.
- Aspirar as bolhas formadas na superfície do sobrenadante, e remover todo o sobrenadante.
2. Preparação de Microarrays celular
- Ofixação das células btain 96 kits placa bem ou conjunto de células 8 lâminas único bem de câmara (ver tabela de materiais / reagentes).
- Aplicar 1,2 ul do Activador para o reagente de ADN a partir do kit. Tampe o frasco, invertê-lo, e agitar suavemente para misturar a solução.
- Permitir que a solução a reagir durante 20 min à temperatura ambiente.
- Aplicar a solução misturada ao sedimento de células alvo (no tubo de 15 ml).
- Adicionar corantes de fluorescência verde citosólicas a uma concentração final de 500 nM.
- Incubar as células-alvo com a solução mista e o corante durante 30 min à temperatura ambiente num agitador orbital.
- Lavar as células duas vezes com 5 ml de PBS, e voltar a suspender as células em 10 ml de meios de crescimento.
- Adicionar 100 ul da solução a partir do passo 2.7 em cada poço. Contar o número de células utilizando um hemacitómetro. Adicione os números de células certeza variar entre 5 × outubro 04-01 × 10 6 células por poço.
- Após 10-15 min de incubação à temperatura ambiente, lavar suavemente as amostras duas vezes com 200-300 meio de crescimento ul para remover as células não ligadas.
NOTA: Cerca de 5-10 ul de meio de crescimento permanece em cada poço após lavagem.
3. Sangue Total de Citotoxicidade
- Adicionar 180 ul de sangue humano inteiro para cada poço de amostra.
- Obter solução de anticorpo anti-CD20, a 5 mg / ml, e realizar diluição em série para fazer 50, 20, 10, 5, 2, 1, 0,5 ug / ml de solução de anticorpo anti-CD20 em tubos de 1,5 ml. Adicionar 20 ul de cada concentração do anticorpo anti-CD20 para cada poço de amostra tomada de triplicados.
- Adicionar iodeto de propídio, a uma concentração final de 500 nM para cada poço.
- Incubar a placa resultante a 37 ° C com 5% de CO 2 durante 16 horas.
- Imagem das células nas lâminas ou placas de 96 poços com um sistema automático de imagem com ampliação de 8X.
- Use o programa de contagem de células do sistema de imagem automático para quantificar os resultados.
NOTA: O software do sistema de imagens automático fornece simplespasso-a-passo para as operações de contagem das células. O protocolo de usar este software pode ser encontrado no site do provedor. - Selecione [Resultados revisão] da página principal do software.
- Selecione [o arquivo salvo para as amostras].
- Primeiro portão FITC intensidade média> 50, então portão TxRed intensidade> 20 significam.
- Selecione [Placa Overview].
- Selecione [Tabelas de exportação].
NOTA: A fórmula de morte celular percentagem do programa é mostrada abaixo:
Assassinato% célula-alvo = (número de células coradas tanto verde e vermelho / # de células coradas verde) * 100%
Resultados
Anti-CD20 Os anticorpos e células de linfoma (células Raji e MC / CAR) foram escolhidos como um sistema modelo para demonstrar o ensaio de citotoxicidade de sangue total (WCA) 7,8. Células Raji teve alta do número de cópias de CD20 na superfície celular, enquanto que as células MC / CAR tinha baixo número de cópias de CD20 na sua membrana. Células-alvo foram coradas primeiro verde com corantes de fluorescência citossólicas verdes e formou na placa de 96 poços. 10.000 - 50.000 células de linfoma alvo foram imobilizados em cada poço. 180 ul de sangue humano inteiro recentemente extraído foi adicionado em cada poço. O anticorpo anti-CD20 foi então adicionada a cada poço de uma placa de 96 poços com concentrações de gradiente. Após 16 h de incubação a 37 ° C, os números de células foram analisados quantitativamente, através do gerador de imagens automático através da análise do número de células fluorescentes verdes e células vermelhas fluorescentes. Uma vez que as células de linfoma alvo foram todas dispostas no mesmo plano focal, a fluorescência de cada célula foi detectada directamente, mesmo sem removing as células do sangue no poço.
Como mostrado na Figura 1, foi realizada a detecção das células de linfoma de Raji alvo (tanto vivos e mortos). Pontos verdes na Figura 1 indicam o número de células alvo apresentados. As células mortas (pontos vermelhos) na Figura 1, foram analisados quantitativamente, através da intensidade da fluorescência vermelha, porque eles foram coradas com vermelho fluorescente PI. Citotoxicidade anticorpo foi analisada por meio da razão de células mortas (coradas tanto verde e vermelho) para as células apresentadas (pontos verdes). O número de pontos vermelhos fluorescentes diminuiu à medida que a concentração do anticorpo anti-CD20 diminuiu em concentração.
Cada concentração de anticorpos foi testado de forma independente em triplicata. Para cada concentração de anticorpo, mais do que 400 células alvo por poço foram fotografadas para fornecer o valor médio e o desvio padrão dos resultados de citotoxicidade. Com base em nossos dados, com 400 pontos de dados per concentração de anticorpos, obtivemos resultados estatísticos, com valor de p <0,01. A eficácia da droga dependente da dose foi obtido na Figura 2. As células MC / CAR com baixo número de cópias do antigénio CD20 foram utilizados como uma linha celular de controlo. Um valor de EC 50 de 0,12 ug / ml foi obtido para o resultado WCA contra células de linfoma de Raji, que estava na faixa com o valor obtido nos ensaios de citotoxicidade anticorpo regulares, incluindo ensaio de citotoxicidade dependente do complemento (CDC) ou dependente de anticorpos citotoxicidade celular ( ADCC) ensaio de 9-11.
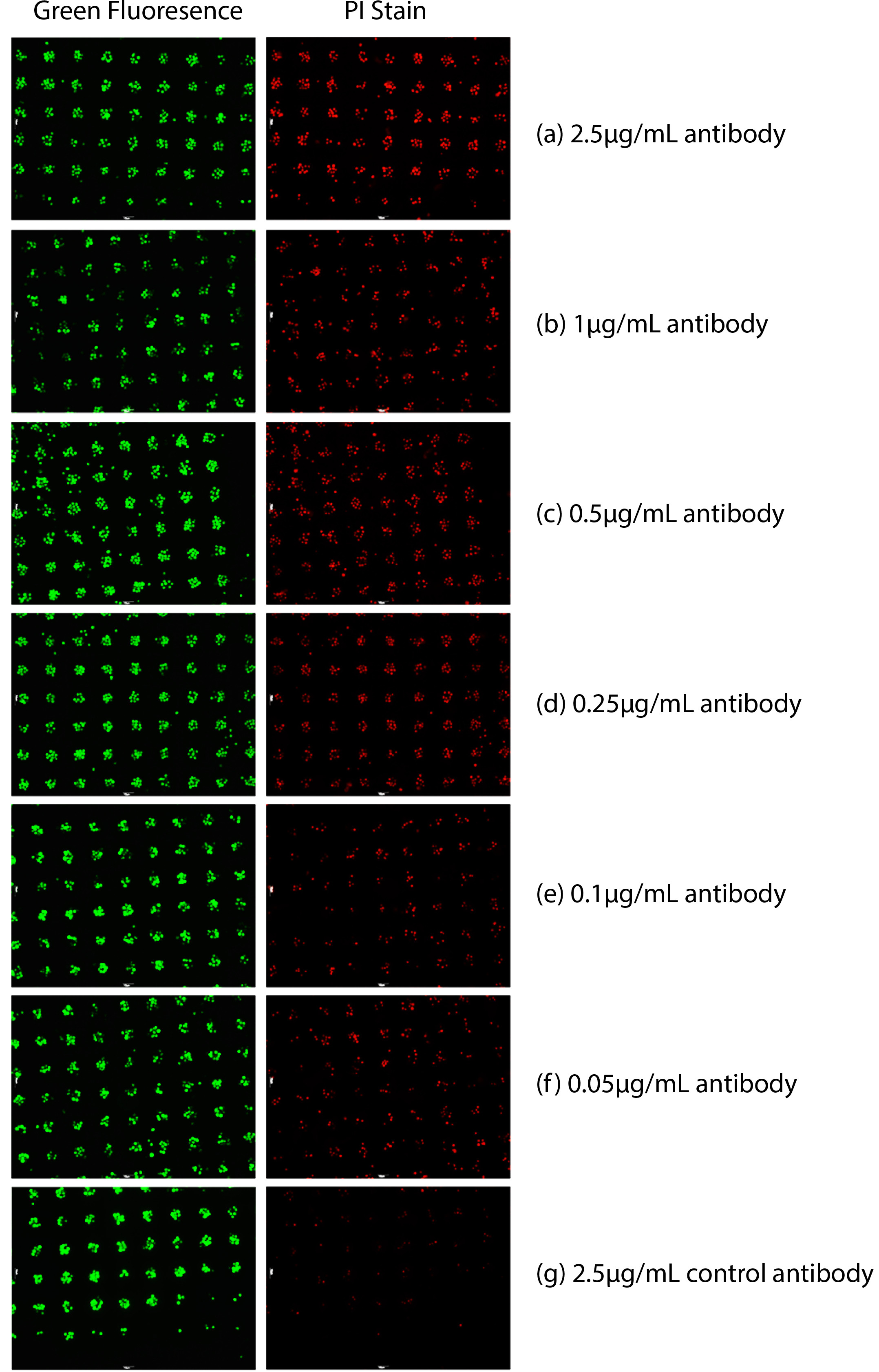
Figura 1. citotoxicidade à base de anticorpos medidos em sangue total. Células Raji foram marcadas com um corante verde citosólico e, em seguida imobilizada. PI também foi adicionado para aceder a morte celular. As células mortas foram manchadas de vermelho por PI. Variando concentratiões de anticorpo anti-CD20 foram adicionados com a adição de sangue total. (A) 2,5 ug / ml de anticorpo anti-CD20 16 horas depois, (b) 1 ug / ml de anticorpo anti-CD20 16 horas depois, (c) de 0,5 ug / ml de anticorpo anti-CD20 16 horas depois, (d) de 0,25 ug / ml de anticorpo anti-CD20 16 horas depois, (e), 0,1 ug / ml de anticorpo anti-CD20 16 horas depois, (f) de 0,05 ug / ml de anticorpo anti-CD20 16 horas depois, (g) 2,5 ug / ml de anticorpo de controlo 16 h depois.
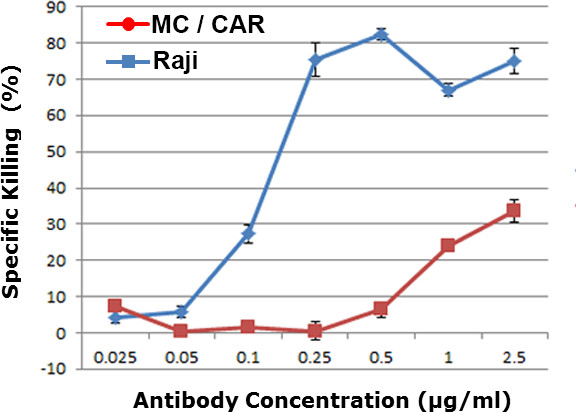
Figura 2. dependente da dose citotoxicidade contra diferentes linhagens de células no sangue total humano. Raji foi um células de linfoma positivas para CD20, e MC / carro era um linhagens de células CD20 negativo. O nível de citotoxicidade sangue total foi mostrado para diferentes concentrações de anticorpo α-CD20 (o anticorpo anti-CD20).
Discussão
WCA é uma crítica em ferramenta de triagem anti-câncer vitro com resolução única célula 12-16, idealmente utilizado após exames alvo tradicionais, como o CDC e ensaios ADCC 11/09, e antes de testes em animais pré-clínicos. Atualmente, alvo primário testes de rastreio, como CDC ou ensaios ADCC são todos realizados em uma mídia simplificado ou um sistema de buffer. No entanto, os candidatos de droga que mostram eficácia no sistema tampão simplificada estes nem sempre são eficazes no sistema mais complexo de sangue total. Portanto, WCA pode fazer a ponte entre exames alvo tradicionais e estudos com animais caros, reduzir os falsos positivos e, assim, evitar que as falhas evitáveis em testes com animais ou em ensaios clínicos humanos. O WCA será benéfico para os investigadores que trabalham nos estudos pré-clínicos, a fim de testar a eficácia da droga no conteúdo de sangue total humano. Contando as células mortas e vivas usando citometria de fluxo requer a lise completa do ce vermelho sanguells, a fim de detectar células alvo. A vantagem da técnica de citometria de fluxo ao longo da WCA é que ele pode identificar células alvo sem a lise das células vermelhas do sangue. É difícil para lisar completamente todos os glóbulos vermelhos na amostra de sangue, e as células-alvo também são parcialmente lisadas durante o procedimento de lise.
Mesmo mais oportunidades emocionantes surgir se painéis de triagem pode ser gerado utilizando as células primárias vivas obtidas a partir de pacientes individuais, abrindo o caminho para tratamentos contra o cancro personalizado, a avaliação da heterogeneidade da célula dentro de um determinado tumor, e a identificação de células que são resistentes a um dado tratamento da toxicodependência. Movendo-se o sistema de saúde para uma abordagem que é "personalizada, preditiva, preventiva e centrada nas necessidades do paciente" é o futuro da medicina 17,18. Inúmeras iniciativas no âmbito do Departamento de Saúde e Serviços Humanos dos Estados Unidos, incluindo o FDA, os Centros de Controle de Doenças, o NIH, os Centrospara Serviços Medicare e Medicaid, e de Recursos e Serviços de Administração de Saúde existem para apoiar as iniciativas para promover atendimento personalizado. A realização da medicina personalizada depende de tecnologias e produtos confiáveis que podem capturar e manter todas as células humanas, mantendo-os em um estado biológico relevante. Podemos prever a aplicação WCA para rastrear drogas contra células tumorais do paciente de câncer na matriz de sua / seu próprio sangue para aplicações de medicina personalizada.
Os passos críticos no protocolo estão os preparativos da matriz celular. Os utilizadores precisam de remover todo o sobrenadante sem perder as células durante a etapa de lavagem das células. Além disso, os utilizadores precisam de fazer uma curta centrifugação, se o líquido não pode ser visto nos frascos. Uma vez que o ADN solução reagente tenha sido preparada, ela deve ser utilizada com as células em 30 min.
A eficiência de formação de matriz de célula é tipo de célula dependente. Houve mais de100 tipos de células testadas com este protocolo; No entanto, ainda é possível que alguns tipos de células específicas que não irá formar a matriz de células de forma eficiente. Se não há formas de matriz celular, uma maior concentração de reagente de DNA é recomendado para executar o mesmo protocolo para se obter uma melhor formação de matriz celular.
Divulgações
Autores não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos programa IMAT Instituto Nacional do Câncer do NIH para financiar este trabalho [R33 CA174616-01A1].
Materiais
| Name | Company | Catalog Number | Comments |
| Cell attachment 96 well plate kits | Adheren | AP9601 | |
| Suspension Single cell array 8 well chamber slide | Adheren | SS0801 | |
| Adherent Single cell array 8 well chamber slide | Adheren | SS0802 | |
| Lymphoma cell line CD20+ | ATCC | CCL-86 | Raji cells |
| Lymphoma cell line CD20- | ATCC | CRL-8083 | MC/CAR |
| RPMI 1640 with L-glutamine | Life Technologies | 11875-119 | |
| Fetal Bovine Serum | Thermo | SH30070.01HI | |
| Peni/Strep | Life Technologies | 15070063 | |
| Cytosolic dye | Life Technologies | C7025 | Cell Tracker Green |
| Rituxan (Biosimilar) | Eureka Therapeutics | ||
| Human whole blood | Allcells | WB001 | |
| Propidium Iodide | Sigma | P4170-10MG | |
| Automatic imaging system | Molecular Devices | Contact Vendor | Cell Reporter |
| Cell counting program | Molecular Devices | Contact Vendor | Cell Reporter |
Referências
- Hutchinson, L., Kirk, R. High drug attrition rates--where are we going wrong. Nat Rev Clin Oncol. 8, 189-1890 (2011).
- Moreno, L., Pearson, A. D. Attrition rates be reduced in cancer drug discovery. Informa healthcare. 8, 363-368 (2013).
- Seok, J., et al. Inflammation and Host Response to Injury, Large Scale Collaborative Research Program. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110, 3507-3512 (2013).
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355, 1018-1028 (2006).
- Eastwood, D., et al. Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells. Br J Pharmacol. 161, 512-526 (2010).
- Hsiao, S. C., Liu, H., Holstlaw, T. A., Liu, C., Francis, C. Y., Francis, M. B. Real time assays for quantifying cytotoxicity with single cell resolution. PLoS One. 8, 10-1371 (2013).
- Wang, S. Y., Weiner, G. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukemia. Expert Opin Biol Ther. 8, (2008).
- Dalle, S., Thieblemont, C., Thomas, L., Dumontet, C. Monoclonal antibodies in clinical oncology. Anticancer Agents Med Chem. 8, 523-532 (2008).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14, 181-196 (1968).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64, (1983).
- Gerlier, D., Thomasset, N. J. Use of MTT colorimetric assay to measure cell activation. Immunol Methods. 94, 57-63 (1986).
- Toriello, N. M., et al. Integrated microfluidic bioprocessor for single-cell gene expression analysis. Proc Natl Acad Sci U S A. 105, (2008).
- Douglas, E. S., Hsiao, S. C., Onoe, H., Bertozzi, C. R., Francis, M. B., Mathies, R. A. DNA-barcode directed capture and electrochemical metabolic analysis of single mammalian cells on a microelectrode array. Lab on a Chip. 9, 2010-2015 (2008).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Current opinion in pharmacology. 9, 580 (2009).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Coelho, J., P, L., Quinn, S., Murphy, R. F. Automated image analysis for high-content screening and analysis. J Biomol Screen. 15, 726-734 (2010).
- Sundberg, S. A. High-throughput and ultra-high-throughput screening: solution- and cell-based approaches. Current Opinion in Biotechnology. 11, 47 (2000).
- Simmons, L. A. Personalized medicine is more than genomic medicine: confusion over terminology impedes progress towards personalized healthcare. PERS MED. 9, 85 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados