Method Article
Echtzeit-Zytotoxizitätsassays in menschlichem Vollblut
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Vollblut Zytotoxizitätsassay (WCA) ist ein Zytotoxizitätstest durch Einbau Hochdurchsatz-Zellpositionierungstechnologie mit Fluoreszenzmikroskopie und automatisierte Bildverarbeitung entwickelt. Hier beschreiben wir, wie Lymphom-Zellen mit einem anti-CD20-Antikörper behandelt werden können, in Echtzeit in menschlichem Vollblut zur quantitativen Analyse bereitzustellen zelluläre Zytotoxizität untersucht werden.
Zusammenfassung
Ein Live-zellbasierten Vollblut Zytotoxizitätstest (WCA), die Zugriff auf Zeitinformation des gesamten Zell-Cytotoxizität kann mit Hochdurchsatz-Zellpositionierungstechnologie entwickelt. Die gezielten Tumorzellpopulationen werden zuerst die Immobilisierung in ein Array-Format vorprogrammiert und mit grün fluoreszierenden cytosolischen Farbstoffen markiert. Im Anschluss an die Zellenanordnung Bildung werden Antikörper-Medikamenten in Kombination mit menschlichem Vollblut zugegeben. Propidiumiodid (PI) wird dann zugegeben, um den Zelltod zu bewerten. Die Zellenanordnung ist mit einem automatischen Abbildungssystem analysiert. Während cytosolischen Farbstoff beschriftet die gezielte Tumorzellpopulationen, Etiketten PI die toten Tumorzellpopulationen. Somit kann der Anteil der Ziel-Krebszelltötung durch die Berechnung der Anzahl der überlebenden Zellen gezielt auf die Anzahl der toten Zielzellen zu quantifizieren. Mit diesem Verfahren können die Forscher zeitabhängig und dosisabhängige Zell-Cytotoxizität Informationen zuzugreifen. Bemerkenswert ist, keine gefährliche RadioChemikalien verwendet werden. Die hier vorgestellte WCA hat mit Lymphom, Leukämie und soliden Tumorzelllinien getestet. Daher ermöglicht WCA Forscher Wirksamkeit von Medikamenten in einem hoch relevanten ex vivo Zustand zu beurteilen.
Einleitung
Jüngste Fortschritte in der Pharmaindustrie haben zu einem erhöhten Interesse an der Verwirklichung der spezifischen Identifikationen von Tumorzell-Antikörper und personalisierte Krebstherapien führten; sind jedoch mehrere Hindernisse in dem Verfahren auftreten. Nur 5% der Mittel, die Antikrebsaktivität in der präklinischen Entwicklung haben werden, nachdem dafür ausreichende Wirksamkeit in Phase II-III Test 1,2 lizenziert. Die vorklinische Strategien (sowohl in vitro als auch in vivo) sind suboptimal, wie viele Beispiele wurden aufgrund ihrer unterschiedlichen Blutkomponenten 3-5 gezeigt, dass die Antitumor-Arzneimittel in der Human- und vor allem in Labortieren unterschiedlich verhalten.
Um die Notwendigkeit eines Antitumor Wirkstoff-Screening-Plattform zu wenden und eine Check-Punkt vor kostspielige Tierversuche und klinische Studien zu schaffen, ist eine menschliche Vollblut Zytotoxizitätsassay (WCA) zur Auswertung antitumorale Wirksamkeit von Medikamenten in einer relevanten biologischen Umgebung vorgeschlagen. DieVollblut-Zytotoxizitätstests können verwendet werden, um die Reaktion einzelner Zellen, Antikörper und andere Wirkstoffkandidaten in menschlichem Vollblut zu bewerten.
Der WCA wird durch den Einbau von Hochdurchsatz-Zellpositionierungstechnologie mit hohem Durchsatz und High-Content-Imaging-6 entwickelt. Durch Verwendung eines automatischen Abbildungssystem kann sowohl die Anzahl der lebenden und toten Zellen, die mit einem hohen Grad an Genauigkeit bestimmt werden. Aufgrund der Tatsache, dass die Zielzellen auf der gleichen Brennebene immobilisiert ist WCA Lage, quantitative Zytotoxizität Analyse in Echtzeit ohne die Entfernung der roten Blutzellen bereitzustellen. Darüber hinaus stellt die automatische Abbildungssystem mehrere Vorteile, wie dass nur Zielzellen, die die angegebenen Kriterien erreicht haben (z. B. fluoreszenzmarkierten Zellen und Zellmorphologie) sind geschlossene und verarbeitet. Auch ermöglicht es die Produktion von 144 Platten pro Tag. Folglich diese Abbildungsfähigkeit und Durchsatz ermöglicht Betrieb von High-cNHALT und Hochdurchsatz-Experimenten gleichzeitig. Durch die Kombination von WCA und der Automated Imaging System können hohe Durchsatz quantitative Zellcytotoxizität Analyse innerhalb einer biologisch relevanten Umwelt erreicht werden.
Protokoll
1. Zielzellpräparation
- Aufrechtzuerhalten Zielzellen (z. B. Raji-Lymphomzellen) in Wachstumsmedium (RPMI 1640-Kulturmedium, das mit 10% hitzeinaktiviertem fötalem Rinderserum (FBS), 4 nM L-Glutamin und 500 IU / ml Penicillin / Streptomycin) bei 37 o C in einer 5% CO 2 -Inkubator.
- Zentrifugieren Sie die Probe auf die Zielzellen zu pelletieren in einer 15 ml Tube. Zentrifugation Zeit schwankt mit verschiedenen Zelltypen; Zentrifuge für 3 Minuten bei 468 × g für Raji-Zellen.
- Zuerst absaugen alle Blasen auf der Oberfläche des Überstandes gebildet, und entfernen Sie das gesamte Überstand.
- 10 ml PBS auf die Röhre. Re-suspend die Zellen durch Pipettieren der Lösung nach oben und unten mehrmals zum Aufbrechen der Zellklumpen.
- Zentrifugen die Probe für 3 Minuten bei 468 x g.
- Saugen Sie keine Blasen an der Oberfläche des Überstandes gebildet, und entfernen Sie das gesamte Überstand.
2. Herstellung von Zellmikroarrays
- Obtain Zellhaftung 96er Platte Kits oder Einzelzellenanordnung 8 auch Kammer-Objektträgern (siehe Tabelle der Werkstoffe / Reagenzien).
- Gelten 1,2 & mgr; l des Aktivators zu der DNA-Reagens aus dem Satz. Verschließe das Röhrchen, invertieren, und schütteln, um die Lösung zu mischen.
- Die Lösung wird für 20 min bei RT reagieren.
- Anwendung der gemischten Lösung auf den Zielzellen Pellet (in der 15-ml-Röhrchen).
- Hinzufügen grüne Fluoreszenz cytosolischen Farbstoffe in einer Endkonzentration von 500 nM.
- Inkubieren der Zielzellen mit der gemischten Lösung und des Farbstoffs 30 Minuten lang bei RT auf einem Orbitalschüttler.
- Mit 5 ml PBS Waschen Sie die Zellen zweimal, und die Zellen resuspendieren in 10 ml Wachstumsmedium.
- Anwendung 100 ul der Lösung aus Schritt 2.7 in jede Vertiefung. Zählen Sie die Zellzahl durch Verwendung eines Hämacytometers. Sicherstellen Zellzahlen im Bereich zwischen 5 x 10 4 bis 1 × 10 6 Zellen pro Vertiefung.
- Nach 10-15 min Inkubation bei RT, vorsichtig waschen die Proben zweimal mit 200-300 ul Wachstumsmedien, um alle ungebundenen Zellen zu entfernen.
HINWEIS: Über 5-10 ul Wachstumsmedien bleibt in jeder Vertiefung nach dem Waschen.
3. Vollblut Zytotoxizitätsassays
- In 180 ul menschlichem Vollblut zu jeder Probe auch.
- Erhalten Anti-CD20-Antikörper-Lösung auf 5 mg / ml, und führen serielle Verdünnung um 50, 20, 10, 5, 2, 1, 0,5 ug / ml Anti-CD20-Antikörper-Lösung in 1,5-ml-Röhrchen. In 20 ul jeder Konzentration der Anti-CD20-Antikörper zu jeder Probe und machen dreifach.
- Hinzufügen Propidiumiodid in einer Endkonzentration von 500 nM zu jeder Vertiefung.
- Inkubieren der resultierenden Platte bei 37 ° C mit 5% CO 2 für 16 Stunden.
- Bild der Zellen auf dem Objektträger oder 96-Well-Platten mit einer automatischen Bildsystem mit 8-facher Vergrößerung.
- Verwenden Sie die Zellzählung Programm des automatischen Imaging-System, um die Ergebnisse zu quantifizieren.
Hinweis: Die Software des automatischen Imaging-System bietet eine einfacheSchritt-für-Schritt-Operationen zur Zellzählung. Das Protokoll für die Verwendung dieser Software kann auf der Website Anbieters finden. - Wählen Sie [Rückblick Ergebnisse] von der Hauptseite der Software.
- Wählen Sie [die gespeicherte für die Proben Datei].
- Erstes Tor FITC mittlere Intensität> 50, dann Gate TxRed mittlere Intensität> 20.
- Wählen Sie [Teller Übersicht].
- Wählen Sie [Tabellen exportieren].
HINWEIS: Die prozentuale Zellabtötung Formel des Programms ist unten gezeigt:
% Zielzelle Tötung = (Anzahl der Zellen gefärbt grün und rot / Anzahl der Zellen gefärbt grün) * 100%
Ergebnisse
Anti-CD20-Antikörper und Lymphomzellen (Raji-Zellen und MC / CAR) wurden als Modellsystem, um die Vollblut Zytotoxizitätsassay (WCA) 7,8 demonstrieren gewählt. Raji-Zellen hatte eine hohe Kopienzahl von CD20 auf der Zelloberfläche, während MC / CAR Zellen hatten niedrige Kopienzahl von CD20 auf ihrer Membran. Zielzellen wurden zunächst grün mit grünen Fluoreszenz cytosolischen Farbstoffen gefärbt und auf der 96-Well-Platte angeordnet. 10,000 - 50,000 Ziellymphomzellen wurden in jede Vertiefung immobilisiert. 180 ul frisch gezogenen menschlichen Vollblut wurde in jede Vertiefung gegeben. Anti-CD20-Antikörper wurden dann in jede Vertiefung einer Platte mit 96 Vertiefungen mit Gradienten-Konzentrationen. Nach 16 h Inkubation bei 37 ° C, die Zellzahlen wurden quantitativ durch die automatische Abbildungsvorrichtung durch Analysieren der Anzahl von grün fluoreszierenden Zellen und roten fluoreszierenden Zellen beurteilt. Da die Ziel-Lymphom-Zellen wurden alle auf der gleichen Brennebene angeordnet sind, wurde die Fluoreszenz jeder Zelle direkt auch ohne Remo erkanntVING die Blutzellen in dem Bohrloch.
Wie in 1 gezeigt, wurde der Nachweis der Ziel Raji-Lymphomzellen (beide lebendig und tot) durchgeführt. Grüne Punkte in 1 angegeben die Anzahl von Zielzellen präsentiert. Toten Zellen (rote Punkte) in Abbildung 1 wurden quantitativ durch die Intensität der roten Fluoreszenz analysiert, da sie fluoreszierenden rot mit PI angefärbt. Antikörper Zytotoxizität wurde durch das Verhältnis von toten Zellen (Bunt grün und rot) zu den Zellen präsentiert (grüne Punkte) analysiert. Die Anzahl von fluoreszierenden roten Punkte verringert, wie die Konzentration des Anti-CD20-Antikörper in der Konzentration verringert.
Jedes Antikörperkonzentration wurde unabhängig dreifach getestet. Für jede Antikörperkonzentration, wurden mehr als 400 Zielzellen pro Vertiefung abgebildet, um den Mittelwert und die Standardabweichung der Zytotoxizität Ergebnisse. Basierend auf unseren Daten mit 400 Datenpunkten per Antikörperkonzentration, erhalten wir die statistischen Ergebnisse mit p-Wert <0,01. Die Dosis-abhängigen Arzneimittelwirksamkeit wurde in Figur 2 erhalten wird. Die MC / CAR Zellen mit niedriger Kopienzahl der CD20-Antigen wurden als Kontrollzelllinie verwendet. Ein EC 50 -Wert von 0,12 & mgr; g / ml wurde für die WCA Ergebnis gegen Raji-Lymphomzellen, die im Bereich der in den regulären Antikörper Zytotoxizitätstests einschließlich komplementabhängigen Zytotoxizitätstest (CDC) oder Antikörper-abhängige zelluläre Zytotoxizität erhaltene Wert (erhalten ADCC) Assay. 9-11
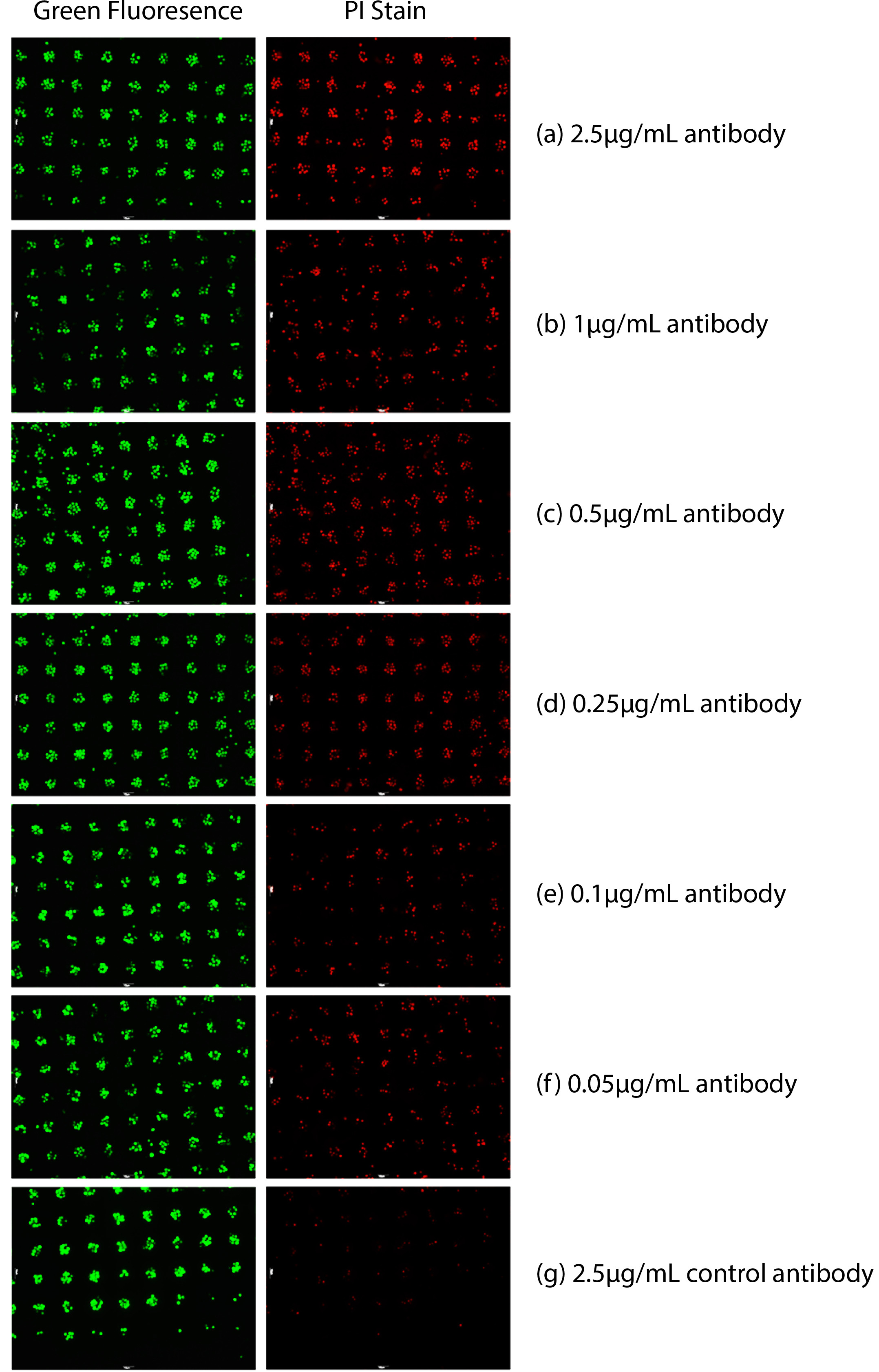
Abbildung 1. Antikörper-basierte Zytotoxizität in Vollblut gemessen. Raji-Zellen wurden mit einem grünen Farbstoff markiert cytosolischen und dann immobilisiert. PI wurde ebenfalls zugegeben, um den Zelltod zu gelangen. Tote Zellen wurden rot gefärbt von PI. Unterschiedliche KonzentratIonen von Anti-CD20-Antikörper wurden durch die Zugabe von Vollblut zugegeben. (A) 2,5 & mgr; g / ml Anti-CD20-Antikörper 16 Stunden nach der, (b) 1 & mgr; g / ml Anti-CD20-Antikörper 16 Stunden nach der, (c) 0,5 & mgr; g / ml Anti-CD20-Antikörper 16 Stunden nach der, (d) 0,25 & mgr; / ml Anti-CD20-Antikörper 16 Stunden später, (e) 0,1 & mgr; g / ml Anti-CD20-Antikörper 16 Stunden nach, (f) 0,05 & mgr; g / ml Anti-CD20-Antikörper 16 Stunden nach, (g) 2,5 & mgr; g / ml Antikörper 16 steuern h nach.
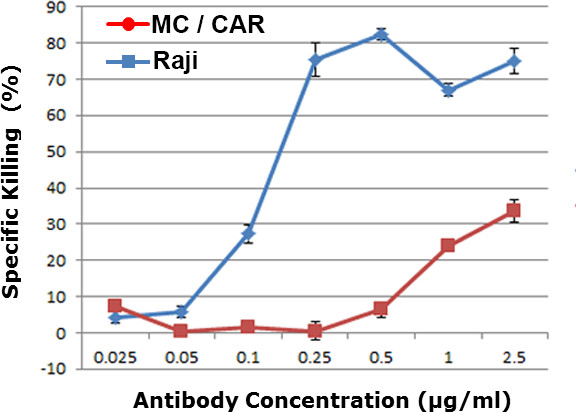
Abbildung 2. Dosis-abhängige Zytotoxizität gegen verschiedene Zelllinien in menschlichem Vollblut. Raji war ein CD20 positiven Lymphomzellen und MC / Auto war ein CD20 negativen Zelllinien. Die Höhe des Vollbluts Zytotoxizität wurde für unterschiedliche Konzentration von α-CD20-Antikörper (Anti-CD20-Antikörper) gezeigt.
Diskussion
WCA ist ein kritischer in vitro Anti-Krebs-Screening-Tool mit Einzelzellauflösung 12-16, idealerweise nach traditionellen Zielvorführungen wie CDC und ADCC-Assays 9-11, und vor präklinischen Tierversuchen verwendet. Derzeit sind primäre Ziel Screening-Assays wie CDC oder ADCC-Assays alle in einer vereinfachten Medien oder eines Puffersystems durchgeführt. , Wirkstoffkandidaten, die Wirksamkeit in diesen vereinfachten Puffersystem zeigen, sind jedoch nicht immer wirksam in der komplexeren Vollblut-System. Daher kann WCA die Lücke zwischen traditionellen Zielvorführungen und kostspielige Tierversuche zu überbrücken, Fehlalarme zu reduzieren, und damit verhindern, dass die vermeidbaren Fehlern in Tierversuchen oder in klinischen Studien am Menschen. Der WCA wird vorteilhaft für die Forscher, die an den präklinischen Studien, um die Wirksamkeit von Medikamenten in den Inhalt der menschlichen Vollblut testen. Zählen der toten und lebenden Zellen mittels Durchflusszytometrie erfordert die vollständige Lyse der roten Blut cells, um Zielzellen zu detektieren. Der Vorteil der WCA-Technik über Durchflusszytometrie ist, dass es Zielzellen ohne Lyse der roten Blutzellen zu identifizieren. Es ist schwierig, alle roten Blutkörperchen vollständig lysieren in der Blutprobe und die Zielzellen werden auch teilweise während des Lyseverfahren lysiert.
Entstehen noch mehr spannende Möglichkeiten, wenn Screening-Panels können mit Hilfe der Live-Primärzellen aus einzelnen Patienten gewonnen erzeugt werden, die den Weg zur personalisierten Krebstherapien, die Bewertung der Zell Heterogenität innerhalb eines bestimmten Tumors und der Identifizierung von Zellen, die resistent gegen eine gegebene sind medikamentöse Behandlung. Bewegen des Gesundheitssystems zu einem Ansatz, die "personalisierte, prädiktive, präventive und auf die Bedürfnisse des Patienten zentriert" ist die Zukunft der Medizin 17,18. Zahlreiche Initiativen innerhalb des US Department of Health and Human Services, einschließlich der FDA, die Centers for Disease Control, dem NIH, der Centersfür Medicare und Medicaid Services, und der Health Resources and Services Administration existieren, um Initiativen zu unterstützen, um individuelle Betreuung zu fördern. Die Realisierung der personalisierten Medizin ist abhängig von zuverlässigen Technologien und Produkte, die zu erfassen und halten keine menschlichen Zellen können, während in einem relevanten biologischen Zustand Beibehaltung. Wir können voraussehen Anwendung WCA auf Medikamente gegen die Krebspatienten Tumorzellen Bildschirm in der Matrix sein / ihr eigenes Blut für die personalisierte Medizin-Anwendungen.
Die kritischen Schritte in dem Protokoll sind die Vorbereitungen des Zellenfeldes. Die Anwender brauchen, um all des Überstands, ohne die Zellen während des Zellwaschschritt verlieren entfernen. Darüber hinaus muss der Benutzer ein kurzes Zentrifugieren, wenn die Flüssigkeit nicht in den Phiolen zu sehen. Sobald DNA Reagenzlösung hergestellt worden ist, muss sie mit den Zellen innerhalb von 30 min verwendet werden.
Die Zellenanordnung Bildungseffizienz ist Zelltyp abhängig. Es wurden mehr als100 Typen von Zellen, die mit diesem Protokoll getestet; Allerdings ist es immer noch möglich, daß einige spezifische Zelltypen wird die Zellenanordnung effizient bilden. Wenn keine Zellenanordnung bildet, ist eine höhere Konzentration von DNA-Reagens empfohlen, das gleiche Protokoll durchgeführt, um eine bessere Zellenanordnung Bildung zu erhalten.
Offenlegungen
Autoren haben keine konkurrierenden finanziellen Interessen.
Danksagungen
Wir danken National Cancer Institute IMAT Programm von NIH für die Finanzierung dieser Arbeit [R33 CA174616-01A1].
Materialien
| Name | Company | Catalog Number | Comments |
| Cell attachment 96 well plate kits | Adheren | AP9601 | |
| Suspension Single cell array 8 well chamber slide | Adheren | SS0801 | |
| Adherent Single cell array 8 well chamber slide | Adheren | SS0802 | |
| Lymphoma cell line CD20+ | ATCC | CCL-86 | Raji cells |
| Lymphoma cell line CD20- | ATCC | CRL-8083 | MC/CAR |
| RPMI 1640 with L-glutamine | Life Technologies | 11875-119 | |
| Fetal Bovine Serum | Thermo | SH30070.01HI | |
| Peni/Strep | Life Technologies | 15070063 | |
| Cytosolic dye | Life Technologies | C7025 | Cell Tracker Green |
| Rituxan (Biosimilar) | Eureka Therapeutics | ||
| Human whole blood | Allcells | WB001 | |
| Propidium Iodide | Sigma | P4170-10MG | |
| Automatic imaging system | Molecular Devices | Contact Vendor | Cell Reporter |
| Cell counting program | Molecular Devices | Contact Vendor | Cell Reporter |
Referenzen
- Hutchinson, L., Kirk, R. High drug attrition rates--where are we going wrong. Nat Rev Clin Oncol. 8, 189-1890 (2011).
- Moreno, L., Pearson, A. D. Attrition rates be reduced in cancer drug discovery. Informa healthcare. 8, 363-368 (2013).
- Seok, J., et al. Inflammation and Host Response to Injury, Large Scale Collaborative Research Program. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110, 3507-3512 (2013).
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355, 1018-1028 (2006).
- Eastwood, D., et al. Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells. Br J Pharmacol. 161, 512-526 (2010).
- Hsiao, S. C., Liu, H., Holstlaw, T. A., Liu, C., Francis, C. Y., Francis, M. B. Real time assays for quantifying cytotoxicity with single cell resolution. PLoS One. 8, 10-1371 (2013).
- Wang, S. Y., Weiner, G. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukemia. Expert Opin Biol Ther. 8, (2008).
- Dalle, S., Thieblemont, C., Thomas, L., Dumontet, C. Monoclonal antibodies in clinical oncology. Anticancer Agents Med Chem. 8, 523-532 (2008).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14, 181-196 (1968).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64, (1983).
- Gerlier, D., Thomasset, N. J. Use of MTT colorimetric assay to measure cell activation. Immunol Methods. 94, 57-63 (1986).
- Toriello, N. M., et al. Integrated microfluidic bioprocessor for single-cell gene expression analysis. Proc Natl Acad Sci U S A. 105, (2008).
- Douglas, E. S., Hsiao, S. C., Onoe, H., Bertozzi, C. R., Francis, M. B., Mathies, R. A. DNA-barcode directed capture and electrochemical metabolic analysis of single mammalian cells on a microelectrode array. Lab on a Chip. 9, 2010-2015 (2008).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Current opinion in pharmacology. 9, 580 (2009).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Coelho, J., P, L., Quinn, S., Murphy, R. F. Automated image analysis for high-content screening and analysis. J Biomol Screen. 15, 726-734 (2010).
- Sundberg, S. A. High-throughput and ultra-high-throughput screening: solution- and cell-based approaches. Current Opinion in Biotechnology. 11, 47 (2000).
- Simmons, L. A. Personalized medicine is more than genomic medicine: confusion over terminology impedes progress towards personalized healthcare. PERS MED. 9, 85 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten