Method Article
En temps réel cytotoxicité dans le sang total humain
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L'ensemble du test de cytotoxicité de sang (WCA) est un test de cytotoxicité au point en incorporant la technologie de positionnement cellulaire à haut débit à la microscopie par fluorescence et un traitement d'image automatique. Ici, nous décrivons comment les cellules de lymphomes traitées avec un anticorps anti-CD20 peuvent être analysés en temps réel dans le sang total humain pour fournir une analyse quantitative de la cytotoxicité cellulaire.
Résumé
Un essai de cytotoxicité sang total à base de cellules vivantes (WCA) qui permet l'accès à l'information temporelle de la cytotoxicité cellulaire global est développé avec une technologie de positionnement cellulaire à haut débit. Les populations de cellules tumorales cibles sont d'abord pré-programmés de l'immobilisation dans un format de réseau, et marquées avec des colorants fluorescents verts cytosoliques. Après la formation de la matrice de cellules, des médicaments anticorps sont ajoutés en combinaison avec du sang total humain. L'iodure de propidium (PI) est ensuite ajouté à évaluer la mort cellulaire. Le réseau de cellules est analysée avec un système d'imagerie automatique. Bien que les étiquettes de colorant cytosolique populations de cellules tumorales ciblées, PI étiquettes des populations de cellules tumorales mortes. Ainsi, le pourcentage de cancer de la destruction des cellules cibles peut être quantifiée par le calcul du nombre de cellules survivantes ciblées pour le nombre de cellules cibles mortes. Avec cette méthode, les chercheurs peuvent accéder en fonction du temps et de l'information de la cytotoxicité cellulaire dépendant de la dose. Remarquablement, pas de radio dangereuxproduits chimiques sont utilisés. Le WCA présenté ici a été testée avec le lymphome, la leucémie, et les lignées cellulaires de tumeurs solides. Par conséquent, l'AOC permet aux chercheurs d'évaluer l'efficacité des médicaments dans un état très pertinente ex vivo.
Introduction
Les progrès récents dans l'industrie pharmaceutique ont conduit à un intérêt accru dans la réalisation des identifications spécifiques des anticorps contre les cellules de la tumeur et des traitements personnalisés du cancer; Toutefois, plusieurs obstacles sont rencontrés dans le processus. Seulement 5% des agents qui ont une activité anticancéreuse en développement préclinique sont autorisés après avoir montré une efficacité suffisante dans la phase des essais II-III 1,2. Les stratégies précliniques (à la fois in vitro et in vivo) sont sous-optimaux comme de nombreux exemples ont montré que les médicaments anti-tumoraux chez les humains se comportent différemment et chez les animaux de laboratoire, principalement en raison de leurs différents composants sanguins 3-5.
Pour répondre à la nécessité d'une plate-forme de criblage de médicaments anti-tumorale et de fournir un point de contrôle avant l'expérimentation animale coûteux et des essais cliniques, tout un test de cytotoxicité de sang humain (WCA) est proposé pour évaluer antitumorale l'efficacité des médicaments dans un environnement biologique plus pertinente. Leessai de cytotoxicité de sang total peut être utilisé pour évaluer la réponse de cellules individuelles à des anticorps et d'autres médicaments candidats dans le sang total humain.
L'AOC est développé en intégrant la technologie à haut débit positionnement cellulaire avec à haut débit et à haute teneur en imagerie 6. En utilisant un système d'imagerie automatisée, le nombre de deux cellules vivantes et mortes peut être déterminée avec un degré élevé de précision. En raison du fait que les cellules cibles sont immobilisées sur le même plan focal, WCA est capable de fournir une analyse de cytotoxicité quantitative en temps réel sans l'élimination des globules rouges. En outre, le système d'imagerie automatique offre plusieurs avantages tels que que seules les cellules cibles qui ont atteint les critères spécifiques (par exemple, les cellules. Marquées par fluorescence, et la morphologie des cellules) sont bloquées et transformés. De plus, il permet la production de 144 plaques par jour. Par conséquent, cette capacité d'imagerie et de débit permet l'exécution de haute contenu et expériences à haut débit simultanément. En combinant WCA et le système de formation d'image automatisé, à haut débit analyse quantitative de la cytotoxicité cellulaire peut être réalisée dans un environnement plus pertinent biologique.
Protocole
1. Préparation cellulaire cible
- Maintenir (cellules par exemple. Raji du lymphome) Les cellules cibles dans des milieux de croissance (milieu RPMI 1640 de la culture, avec 10% de sérum inactivé par la chaleur bovin fœtal (FBS), 4 nM de L-glutamine et 500 UI / ml de pénicilline / streptomycine) à 37 ° C dans un incubateur à CO2 à 5%.
- Centrifuger l'échantillon pour former un culot des cellules cibles dans un tube de 15 ml. durée de centrifugation varie en fonction de différents types de cellules; centrifuger pendant 3 min à 468 g pendant cellules Raji.
- Première aspirer les bulles formées sur la surface du surnageant, et enlever toute surnageant.
- Ajouter 10 ml de PBS dans le tube. Re-suspendre les cellules par pipetage la solution de haut en bas plusieurs fois pour briser la motte de cellule.
- Centrifuger l'échantillon pendant 3 min à 468 x g.
- Aspirer les bulles formées sur la surface du surnageant, et enlever toute surnageant.
2. Préparation de puces à cellules
- Ola fixation des cellules btenir 96 kits de plaques puits ou réseau de cellules 8 diapositives de la chambre de bien simples (voir tableau des matériaux / réactifs).
- Appliquer 1,2 ul de l'activateur pour le réactif de l'ADN à partir du kit. Boucher le flacon, l'inverser, et mélanger délicatement la solution.
- Laisser la solution réagir pendant 20 minutes à température ambiante.
- Appliquer la solution mélangée à la pastille de cellules cibles (dans le tube de 15 ml).
- Ajouter les colorants verts de fluorescence cytosolique à une concentration finale de 500 nM.
- Incuber les cellules cibles à la solution mélangée et le colorant pendant 30 min à température ambiante sur un agitateur orbital.
- Laver les cellules deux fois avec 5 ml de PBS, et remettre en suspension les cellules dans des milieux 10 ml de croissance.
- Appliquer 100 ul de la solution de l'étape 2.7 dans chaque puits. Compter le nombre de cellules en utilisant un hématimètre. Assurez-vous que le nombre de cellules comprises entre 5 x 10 4 à 1 x 10 6 cellules par puits.
- Après 10-15 minutes d'incubation à température ambiante, laver délicatement les échantillons deux fois avec 200-300 média de croissance ul pour enlever les cellules non liées.
NOTE: À propos de 5-10 milieux de croissance ul reste dans chaque puits après le lavage.
3. Sang cytotoxicité
- Ajouter 180 ul de sang humain pour chaque échantillon.
- Obtenir une solution d'anticorps anti-CD20 à 5 mg / ml, et d'effectuer des dilutions en série pour faire 50, 20, 10, 5, 2, 1, 0,5 ug / ml de solution d'anticorps anti-CD20 dans des tubes de 1,5 ml. Ajouter 20 ul de chaque concentration de l'anticorps anti-CD20 à chaque puits d'échantillon faisant triple.
- Ajouter de l'iodure de propidium à une concentration finale de 500 nM dans chaque puits.
- Incuber la plaque résultante à 37 ° C avec 5% de CO2 pendant 16 heures.
- Image les cellules sur les lames ou plaques à 96 puits avec un système d'imagerie automatique avec un grossissement de 8x.
- Utiliser le programme de comptage de cellules du système de formation d'image automatique pour quantifier les résultats.
REMARQUE: Le logiciel du système d'imagerie automatique offre simple,étape par étape des opérations de comptage des cellules. Le protocole de l'utilisation de ce logiciel se trouve sur le site Web du fournisseur. - Sélectionnez [Résultats de l'examen] de la page principale du logiciel.
- Sélectionnez [Le fichier sauvegardé pour les échantillons].
- Première porte signifie FITC intensité> 50, puis porte TxRed intensité> 20 signifie.
- Sélectionnez [Plate Aperçu].
- Sélectionnez [Tables d'exportation].
NOTE: La formule de la destruction des cellules pourcentage du programme est le suivant:
Meurtre% de la cellule cible = (nombre de cellules colorées à la fois vert et rouge / Nombre de cellules colorées en vert) * 100%
Résultats
Des anticorps anti-CD20 et des cellules de lymphome (cellules Raji et MC / CAR) a été choisi comme système modèle pour montrer l'ensemble de dosage de cytotoxicité de sang (WCA) 7,8. Cellules Raji eu grand nombre de copies de CD20 sur la surface des cellules, tandis que les cellules MC / CAR avaient un faible nombre de copies de CD20 sur leur membrane. Cellules ciblées ont d'abord été colorées en vert avec des colorants verts fluorescence cytosoliques et disposés sur la plaque de 96 puits. 10.000 - 50.000 cellules de lymphome de cibles ont été immobilisés dans chaque puits. 180 pi de sang total humain fraîchement prélevé ont été ajoutés dans chaque puits. L'anticorps anti-CD20 a été ensuite ajouté dans chaque puits d'une plaque à 96 puits avec des concentrations de gradient. Après 16 h d'incubation à 37 ° C, le nombre de cellules a été évaluée quantitativement par l'imageur automatique en analysant le nombre de cellules fluorescentes vertes et les cellules fluorescentes rouges. Etant donné que les cellules de lymphome cibles ont été tous disposés sur le même plan focal, la fluorescence de chaque cellule a été détectée directement, même sans RemoVing les cellules sanguines dans le puits.
Comme le montre la Figure 1, la détection des cellules de lymphome Raji ciblés (à la fois vivantes et mortes) a été effectuée. Les points verts sur la figure 1 indiquent le nombre de cellules cibles présentées. Les cellules mortes (points rouges) de la figure 1 ont été analysés quantitativement par l'intensité de la fluorescence rouge parce qu'ils ont été colorés en rouge fluorescent avec PI. Cytotoxicité anticorps a été analysée par le rapport des cellules mortes (teinté à la fois vert et rouge) pour les cellules présentées (points verts). Le nombre de points rouges fluorescents diminue lorsque la concentration de l'anticorps anti-CD20 a diminué à la concentration.
Chaque concentration d'anticorps a été testé en triple indépendamment. Pour chaque concentration d'anticorps, plus de 400 cellules cibles par puits ont été imagées pour fournir la valeur moyenne et l'écart type des résultats de cytotoxicité. Sur la base de nos données, avec 400 points de données peconcentration d'anticorps r, nous avons obtenu des résultats statistiques avec une valeur de p <0,01. L'efficacité du médicament dépendante de la dose a été obtenu à la figure 2. Les cellules MC / de la RCA à faible nombre de copies de l'antigène CD20 ont été utilisés en tant que lignée cellulaire témoin. Une valeur de CE50 de 0,12 ng / ml a été obtenue par le résultat WCA contre des cellules de lymphome Raji, ce qui est dans la plage de la valeur obtenue dans les essais anticorps de cytotoxicité réguliers, y compris dosage complément de cytotoxicité dépendante (CDC) ou la cytotoxicité cellulaire dépendante des anticorps ( ADCC) dosage. 9-11
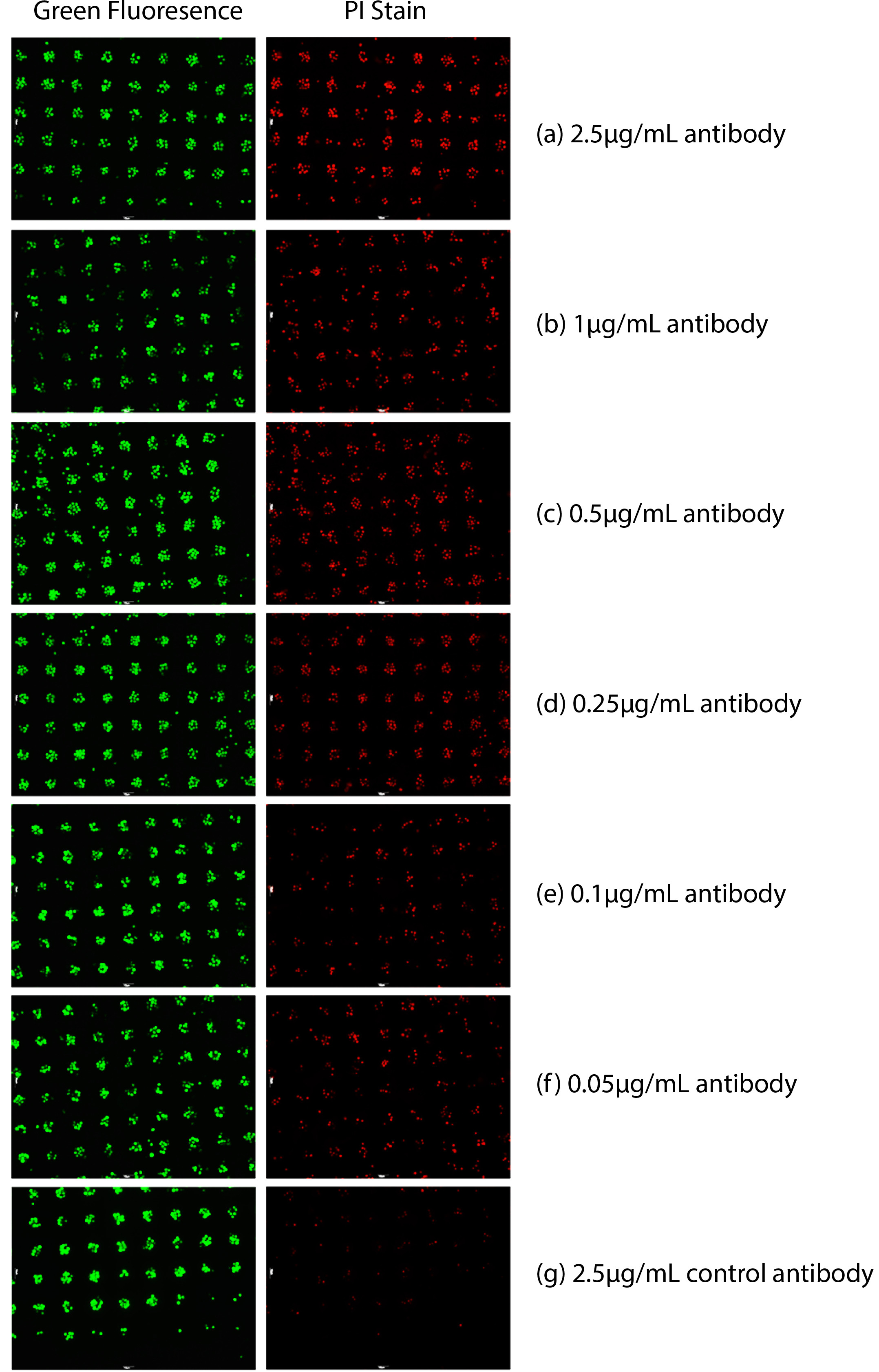
Figure 1. cytotoxicité à base d'anticorps mesurée dans le sang total. Cellules Raji ont été marquées avec un colorant vert cytosolique et ensuite immobilisés. PI a également été ajouté pour accéder à la mort cellulaire. Les cellules mortes sont colorées en rouge par PI. Concentrat variabledes ions d'anticorps anti-CD20 ont été ajoutés avec l'ajout de sang entier. (A) 2,5 pg / ml d'anticorps anti-CD20 16 heures après, (b) 1 pg / ml d'anticorps anti-CD20 16 heures après, (c) de 0,5 pg / ml d'anticorps anti-CD20 16 heures après, (d) 0,25 pg / ml d'anticorps anti-CD20 16 heures après, (e) de 0,1 pg / ml d'anticorps anti-CD20 16 heures après, (f) 0,05 pg / ml d'anticorps anti-CD20 16 heures après, (g) 2,5 pg / ml d'anticorps 16 contrôle h après.
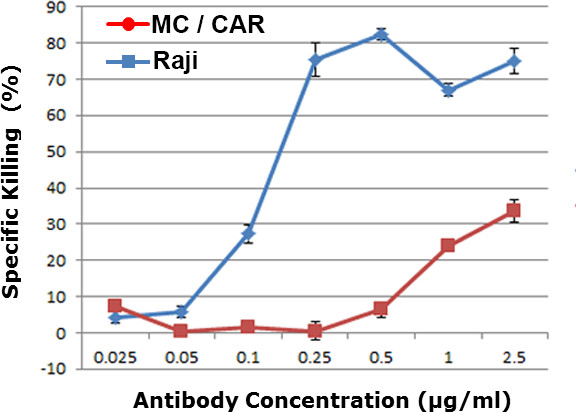
Figure 2. cytotoxicité dépendante de la dose contre différentes lignées de cellules dans le sang total humain. Raji est un lymphome des cellules positives CD20, et MC / voiture était une des lignées de cellules CD20 négatives. Le niveau de cytotoxicité de sang total a été montré pour les différentes concentrations d'anticorps α-CD20 (anticorps anti-CD20).
Discussion
AOC est une critique en outil de dépistage anti-cancer in vitro avec une résolution cellulaire unique 12-16, idéalement utilisé après des projections de cibles traditionnels tels que CDC et analyses ADCC 9-11, et avant que les tests précliniques animales. Actuellement, les tests de dépistage de cibles primaires tels que CDC ou ADCC essais sont effectués par un support simplifiés ou un système tampon. Toutefois, les candidats médicaments qui montrent une efficacité dans ces systèmes de tampon simplifié ne sont pas toujours efficace dans le système de sang total plus complexe. Par conséquent, l'AOC peut combler l'écart entre les projections de cibles traditionnelles et coûteuses études sur les animaux, réduire les faux positifs, et d'éviter ainsi les échecs évitables chez les animaux ou dans des essais cliniques humains. L'AOC sera bénéfique pour les chercheurs travaillant sur les études précliniques afin de tester l'efficacité des médicaments dans le contenu de sang total humain. Compter les cellules mortes et vivantes en utilisant la cytométrie en flux nécessite la lyse complète de rouge CE de sanglls afin de détecter des cellules cibles. L'avantage de la technique WCA sur la cytométrie en flux est de pouvoir identifier les cellules cibles sans lyse des globules rouges. Il est difficile à lyser complètement les globules rouges dans l'échantillon de sang, et les cellules cibles sont également partiellement lysées au cours de la procédure de lyse.
Même opportunités plus intéressantes se posent si les panneaux de dépistage peuvent être générés en utilisant les cellules primaires vivants issus de patients individuels, ouvrant la voie à des traitements personnalisés du cancer, l'évaluation de l'hétérogénéité des cellules dans une tumeur donnée, et l'identification des cellules qui sont résistantes à une donnée traitement de la toxicomanie. Déplacement du système de soins de santé à une approche "personnalisée, prédictive, préventive et centrée sur les besoins du patient" est l'avenir de la médecine 17,18. De nombreuses initiatives au sein de l'US Department of Health and Human Services, y compris la FDA, les Centers for Disease Control, le NIH, les centrespour Medicare et Medicaid Services, et la santé des ressources et d'administration des services existent pour soutenir les initiatives visant à promouvoir des soins personnalisés. La réalisation de la médecine personnalisée dépend des technologies et des produits fiables qui peuvent capter et retenir des cellules humaines tout en les maintenant dans un état biologique pertinent. Nous ne pouvons prévoir l'application de l'AOC à l'écran médicaments contre les cellules tumorales de patients atteints de cancer dans la matrice de sa / son propre sang pour les applications de la médecine personnalisée.
Les étapes critiques dans le protocole sont les préparations de la matrice de cellules. Les utilisateurs doivent retirer tout le surnageant sans perdre les cellules au cours de l'étape de lavage de la cellule. En outre, les utilisateurs ont besoin de faire une courte centrifugation si le liquide ne peut être vu dans les flacons. Une fois que la solution de réactif d'ADN a été préparé, il doit être utilisé avec des cellules à l'intérieur de 30 min.
L'efficacité de la formation de réseaux de cellules est dépendante du type de cellule. Il ya eu plus de100 types de cellules testées avec ce protocole; Cependant, il est encore possible que certains types de cellules spécifiques ne se formeront pas efficacement la matrice de cellules. Si aucune forme de matrice de cellules, une concentration plus élevée de réactif d'ADN est recommandé d'effectuer le même protocole pour obtenir une meilleure formation de réseau de cellules.
Déclarations de divulgation
Les auteurs ont aucun intérêt financier concurrents.
Remerciements
Nous remercions programme IMAT National Cancer Institute des NIH pour le financement de ce travail [R33 CA174616-01A1].
matériels
| Name | Company | Catalog Number | Comments |
| Cell attachment 96 well plate kits | Adheren | AP9601 | |
| Suspension Single cell array 8 well chamber slide | Adheren | SS0801 | |
| Adherent Single cell array 8 well chamber slide | Adheren | SS0802 | |
| Lymphoma cell line CD20+ | ATCC | CCL-86 | Raji cells |
| Lymphoma cell line CD20- | ATCC | CRL-8083 | MC/CAR |
| RPMI 1640 with L-glutamine | Life Technologies | 11875-119 | |
| Fetal Bovine Serum | Thermo | SH30070.01HI | |
| Peni/Strep | Life Technologies | 15070063 | |
| Cytosolic dye | Life Technologies | C7025 | Cell Tracker Green |
| Rituxan (Biosimilar) | Eureka Therapeutics | ||
| Human whole blood | Allcells | WB001 | |
| Propidium Iodide | Sigma | P4170-10MG | |
| Automatic imaging system | Molecular Devices | Contact Vendor | Cell Reporter |
| Cell counting program | Molecular Devices | Contact Vendor | Cell Reporter |
Références
- Hutchinson, L., Kirk, R. High drug attrition rates--where are we going wrong. Nat Rev Clin Oncol. 8, 189-1890 (2011).
- Moreno, L., Pearson, A. D. Attrition rates be reduced in cancer drug discovery. Informa healthcare. 8, 363-368 (2013).
- Seok, J., et al. Inflammation and Host Response to Injury, Large Scale Collaborative Research Program. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110, 3507-3512 (2013).
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355, 1018-1028 (2006).
- Eastwood, D., et al. Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells. Br J Pharmacol. 161, 512-526 (2010).
- Hsiao, S. C., Liu, H., Holstlaw, T. A., Liu, C., Francis, C. Y., Francis, M. B. Real time assays for quantifying cytotoxicity with single cell resolution. PLoS One. 8, 10-1371 (2013).
- Wang, S. Y., Weiner, G. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukemia. Expert Opin Biol Ther. 8, (2008).
- Dalle, S., Thieblemont, C., Thomas, L., Dumontet, C. Monoclonal antibodies in clinical oncology. Anticancer Agents Med Chem. 8, 523-532 (2008).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14, 181-196 (1968).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64, (1983).
- Gerlier, D., Thomasset, N. J. Use of MTT colorimetric assay to measure cell activation. Immunol Methods. 94, 57-63 (1986).
- Toriello, N. M., et al. Integrated microfluidic bioprocessor for single-cell gene expression analysis. Proc Natl Acad Sci U S A. 105, (2008).
- Douglas, E. S., Hsiao, S. C., Onoe, H., Bertozzi, C. R., Francis, M. B., Mathies, R. A. DNA-barcode directed capture and electrochemical metabolic analysis of single mammalian cells on a microelectrode array. Lab on a Chip. 9, 2010-2015 (2008).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Current opinion in pharmacology. 9, 580 (2009).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Coelho, J., P, L., Quinn, S., Murphy, R. F. Automated image analysis for high-content screening and analysis. J Biomol Screen. 15, 726-734 (2010).
- Sundberg, S. A. High-throughput and ultra-high-throughput screening: solution- and cell-based approaches. Current Opinion in Biotechnology. 11, 47 (2000).
- Simmons, L. A. Personalized medicine is more than genomic medicine: confusion over terminology impedes progress towards personalized healthcare. PERS MED. 9, 85 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon