Method Article
בזמן אמת Cytotoxicity מבחני בדם כל אדם
* These authors contributed equally
In This Article
Summary
Assay כל cytotoxicity הדם (אש"ל) הוא assay cytotoxicity שפותח על ידי שילוב טכנולוגיית מיקום תא תפוקה גבוהה עם מיקרוסקופ פלואורסצנטי ועיבוד תמונה אוטומטי. כאן, אנו מתארים כיצד ניתן לנתח תאי הלימפומה שטופלו בנוגדן anti-CD20 בזמן אמת בכל דם אדם כדי לספק ניתוח cytotoxicity סלולארי כמותי.
Abstract
Assay חי המבוסס על תא כולו דם רעיל (אש"ל), המאפשר גישה למידע זמני של cytotoxicity התא הכוללת הוא פותח עם טכנולוגיית מיקום תא תפוקה גבוהה. אוכלוסיות התאים סרטניים הממוקדות מתוכנות מראש ראשונה לחוסר מעש לתבנית מערך, ושכותרתו עם צבעי ניאון cytosolic ירוקים. לאחר הקמת מערך תאים, תרופות נוגדנים מתווספות בשילוב עם כל דם אנושי. יודיד Propidium (PI) הוא הוסיף אז להעריך מוות של תאים. מערך התאים מנותח עם מערכת הדמיה אוטומטית. בעוד צבע cytosolic תוויות אוכלוסיות תאים סרטניים הממוקדות, PI תוויות אוכלוסיות תאי גידול המתים. כך, שיעור הרג תאים סרטני היעד ניתן לכמת על ידי חישוב המספר של הישרדות בתאים ממוקדים למספר התאים הממוקדים מתים. בשיטה זו, חוקרים יכולים לגשת תלוי זמן ומידע cytotoxicity התא תלוי במינון. למרבה הפלא, אין רדיו מסוכןכימיקלים המשמשים. אש"ל מוצג כאן נבדק עם לימפומה, לוקמיה, ושורות תאי גידולים מוצקות. לכן, אש"ל מאפשר לחוקרים להעריך את יעילות תרופה במצב רלוונטי ביותר ex vivo.
Introduction
התקדמות שחלה באחרונה בתעשיית התרופות הובילה להתעניינות גוברת במימוש ההזדהויות הספציפיות של נוגדני תאים סרטניים וטיפולים בסרטן מותאמים אישית; עם זאת, כמה מכשולים נתקלו בתהליך. רק 5% מסוכנים שיש להם פעילות אנטי-סרטנית בפיתוח פרה-קליני ברישיון לאחר שהציג יעילות מספיקה בשלב הבדיקות השנייה-שלישית 1,2. האסטרטגיות פרה-קליני (הן במבחנה in vivo) הן הכי מוצלחות כדוגמאות רבות הראו כי תרופות אנטי-סרטניות מתנהגות באופן שונה באדם ובחיות מעבדה בעיקר בשל מרכיבי הדם השונים שלהם 3-5.
כדי לתת מענה לצורך של פלטפורמת הקרנת סמים אנטי-סרטנית ולספק ביצוע צ'ק-אין נקודה לפני ניסויים בבעלי חיים יקרים וניסויים קליניים, assay אדם שלם cytotoxicity הדם (אש"ל) מוצע להערכת יעילות תרופה אנטי-סרטנית בסביבה ביולוגית רלוונטית יותר.assay cytotoxicity דם כל יכול לשמש כדי להעריך את התגובה של תאים בודדים לנוגדנים ותרופות פוטנציאליים אחרות בכל דם אנושי.
אש"ל הוא פותח על ידי שילוב טכנולוגיית מיקום תא תפוקה גבוהה עם תפוקה גבוהה וגבוה-תוכן הדמיה 6. על ידי ניצול מערכת הדמיה אוטומטית, מספר שני תאי החיים ומתים ניתן לקבוע ברמה גבוהה של דיוק. בשל העובדה שתאי המטרה הם משותקים באותו מישור המוקד, אש"ל הוא מסוגל לספק ניתוח רעיל כמותי בזמן אמת, ללא ההסרה של תאי דם אדומים. יתר על כן, מערכת ההדמיה האוטומטית מספקת מספר יתרונות כגון שרק תאי היעד שהגיעו לקריטריונים שצוינו (לדוגמא., תאים שכותרתו fluorescently, ומורפולוגיה של תאים) הם מגודרים ומעובד. כמו כן, היא מאפשרת הייצור של 144 צלחות ביום. כתוצאה מכך, יכולת הדמיה זו ותפוקה מאפשרת ריצה של ההיי-גontent וניסויים תפוקה גבוהה בו זמנית. על ידי שילוב של אש"ל ומערכת ההדמיה האוטומטית, ניתוח cytotoxicity תא כמותית גבוהה תפוקה ניתן להשיג בסביבה רלוונטית יותר ביולוגית.
Protocol
1. תא יעד הכנה
- לשמור (תאים למשל. ראג'י לימפומה) תאי מטרה בתקשורת צמיחה (תרבות בינונית 1640 RPMI, עם 10% בסרום חום מומת שור העובר (FBS), 4nM L- גלוטמין, ו -500 IU / פניצילין מיליליטר / סטרפטומיצין) ב 37 o C ב5% CO 2 באינקובטור.
- צנטריפוגה המדגם לגלולת תאי היעד בשפופרת 15 מיליליטר. זמן צנטריפוגה משתנה עם תאים מסוגים שונים; צנטריפוגות 3 דקות ב 468 XG לתאי ראג'י.
- לשאוב ראשון כל בועות נוצרו על פני השטח של supernatant, ולהסיר את כל supernatant.
- להוסיף 10 מיליליטר של PBS על הצינור. Re- להשעות תאים על ידי pipetting את הפתרון ומטה מספר פעמים כדי לשבור את גוש התא.
- צנטריפוגה מדגם 3 דקות ב 468 x גרם.
- לשאוב כל בועות נוצרו על פני השטח של supernatant, ולהסיר את כל supernatant.
2. הכנת Microarrays הסלולרי
- Oמצורף תא btain 96 ערכות צלחת גם או מערך תאים 8 שקופיות קאמריות גם אחד (ראה טבלה של חומרים / חומרים כימיים).
- החל 1.2 μl של Activator למגיב DNA מהערכה. מכסה את הבקבוקון, להפוך אותו, ובעדינות לנער כדי לערבב את הפתרון.
- אפשר הפתרון להגיב במשך 20 דקות ב RT.
- ליישם את הפתרון המעורב לגלולת תאי היעד (בצינור 15 מיליליטר).
- להוסיף צבעי cytosolic הקרינה ירוקים בריכוז סופי של 500 ננומטר.
- דגירה תאי היעד עם הפתרון המעורב והצבע למשך 30 דקות ב RT על שייקר מסלולית.
- לשטוף את התאים פעמיים עם 5 מיליליטר PBS, וresuspend תאי תקשורת 10 מיליליטר צמיחה.
- החל מהפתרון 100 μl מצעד 2.7 היטב כל אחד. לספור את מספר התאים על ידי שימוש בhemacytometer. הפוך מספרים סלולריים בטוחים בטווח שבין 5 × 4-1 אוקטובר × 10 6 תאים לכל טוב.
- לאחר 10-15 דקות של דגירה על RT, לשטוף בעדינות את הדגימות פעמיים עם 200-300 תקשורת צמיחת μl להסיר כל תאים מאוגד.
הערה: על 5-10 תקשורת צמיחת μl נשארה בכל אחד גם לאחר כביסה.
3. דם מלא Cytotoxicity מבחני
- להוסיף 180 μl של כל דם אנושי לכל דגימה היטב.
- השג פתרון נוגדן Anti-CD20 בשעה 5 מ"ג / מיליליטר, ולבצע דילול סדרתי לעשות 50, 20, 10, 5, 2, 1, 0.5 מיקרוגרם / מיליליטר של תמיסת נוגדן Anti-CD20 בצינורות 1.5 מיליליטר. הוסף 20 μl של כל ריכוז של נוגדני Anti-CD20 מדגם זה גם מה שהופך את triplicates.
- להוסיף יודיד Propidium בריכוז סופי של 500 ננומטר היטב כל אחד.
- דגירה את הצלחת וכתוצאה מכך ב 37 ° C עם 5% CO 2 במשך 16 שעות.
- תמונת התאים בשקופיות או 96 צלחות גם עם מערכת הדמיה אוטומטית עם הגדלה 8X.
- השתמש בתכנית ספירת תאים של מערכת ההדמיה האוטומטית לכמת את התוצאות.
הערה: התוכנה של מערכת ההדמיה האוטומטית מספקת פשוטהצעד אחר צעד פעולות לספירת תאים. ניתן למצוא בפרוטוקול של שימוש בתוכנה זו באתר האינטרנט של הספק. - בחר [תוצאות סקירה] מהדף הראשי של התוכנה.
- בחר [הקובץ שנשמר לדוגמות].
- השער הראשון FITC אומר עוצמה> 50, אז שער TxRed אומרת עוצמה> 20.
- בחר [סקירת פלייט].
- בחר [שולחנות יצוא].
הערה: נוסחת הרג תא אחוז של התכנית מוצגת להלן:
הרג% תא המטרה = (# של תאים המוכתמים שניהם ירוקים ואדום / # של תאים מוכתמים ירוק) * 100%
תוצאות
אנטי-CD20 נוגדנים ותאים לימפומה (תאי ראג'י וMC / CAR) נבחר כמודל למערכת כדי להדגים את כל assay cytotoxicity הדם (אש"ל) 7,8. היו תאי ראג'י מספר עותק גבוה של CD20 על פני התא, ואילו תאי MC / CAR מספר נמוך עותק של CD20 על הממברנה שלהם. תאים ממוקדים הוכתמו ראשון ירוקים עם צבעי cytosolic הקרינה ירוקים ומסודרים על צלחת 96-היטב. 10,000 - 50,000 תאי הלימפומה היעד היו משותקים בכל טוב. 180 μl של כל דם אנושי טרי נמשך נוספה לתוך זה גם. הנוגדן אנטי CD20 נוספו לאחר מכן לבאר כל צלחת גם 96 עם ריכוזי שיפוע. אחרי 16 שעות של דגירה על 37 מעלות צלזיוס, מספרים סלולריים הוערכו כמותית באמצעות תרמי האוטומטי על ידי ניתוח מספר תאי ניאון ירוקים ותאי ניאון אדומים. מכיוון שכל תאי הלימפומה היעד היו מסודרים על אותו מישור המוקד, הקרינה של כל תא זוהתה באופן ישיר גם ללא רמווינג תאי הדם בבאר.
כפי שניתן לראות בתרשים 1, זיהוי של התאים הממוקדים ראג'י לימפומה (חיים ומתים) בוצע. נקודות ירוקות באיור 1 מצביעות על מספר תאי היעד שהוצגו. תאים מתים (נקודות אדומות) באיור 1 נותחו כמותית באמצעות עוצמת הקרינה האדומה בגלל שהם היו מוכתמים באדום ניאון עם PI. cytotoxicity נוגדן נותחה באמצעות היחס של תאים מתים (מוכתמת שניהם ירוקים ואדום) לתאים הציגו (נקודות ירוקות). מספר הנקודות אדומות ניאון ירד כריכוז של נוגדני Anti-CD20 הירידה בריכוז.
כל ריכוז נוגדנים נבדק באופן עצמאי בtriplicates. לכל ריכוז נוגדנים, יותר מ -400 תאי מטרה לכל גם הם צילמו לספק הערך הממוצע וסטיית התקן של תוצאות רעילות. בהתבסס על הנתונים שלנו, עם 400 נקודות נתונים peריכוז נוגדני r, השגנו תוצאות סטטיסטיות עם ערך p <0.01. יעילות התרופה תלויה במינון הושגה באיור 2. תאי MC / מכונית עם מספר נמוך עותק של אנטיגן CD20 שמשו כקו תא שליטה. ערך EC 50 של 0.12 מיקרוגרם / מיליליטר הושג לתוצאת אש"ל נגד תאי הלימפומה ראג'י, אשר היה בטווח עם הערך המתקבל במבחני cytotoxicity הנוגדן הרגילים כולל assay cytotoxicity התלוי המשלים (CDC) או רעיל סלולארי נוגדן תלוי ( ADCC assay). 9-11
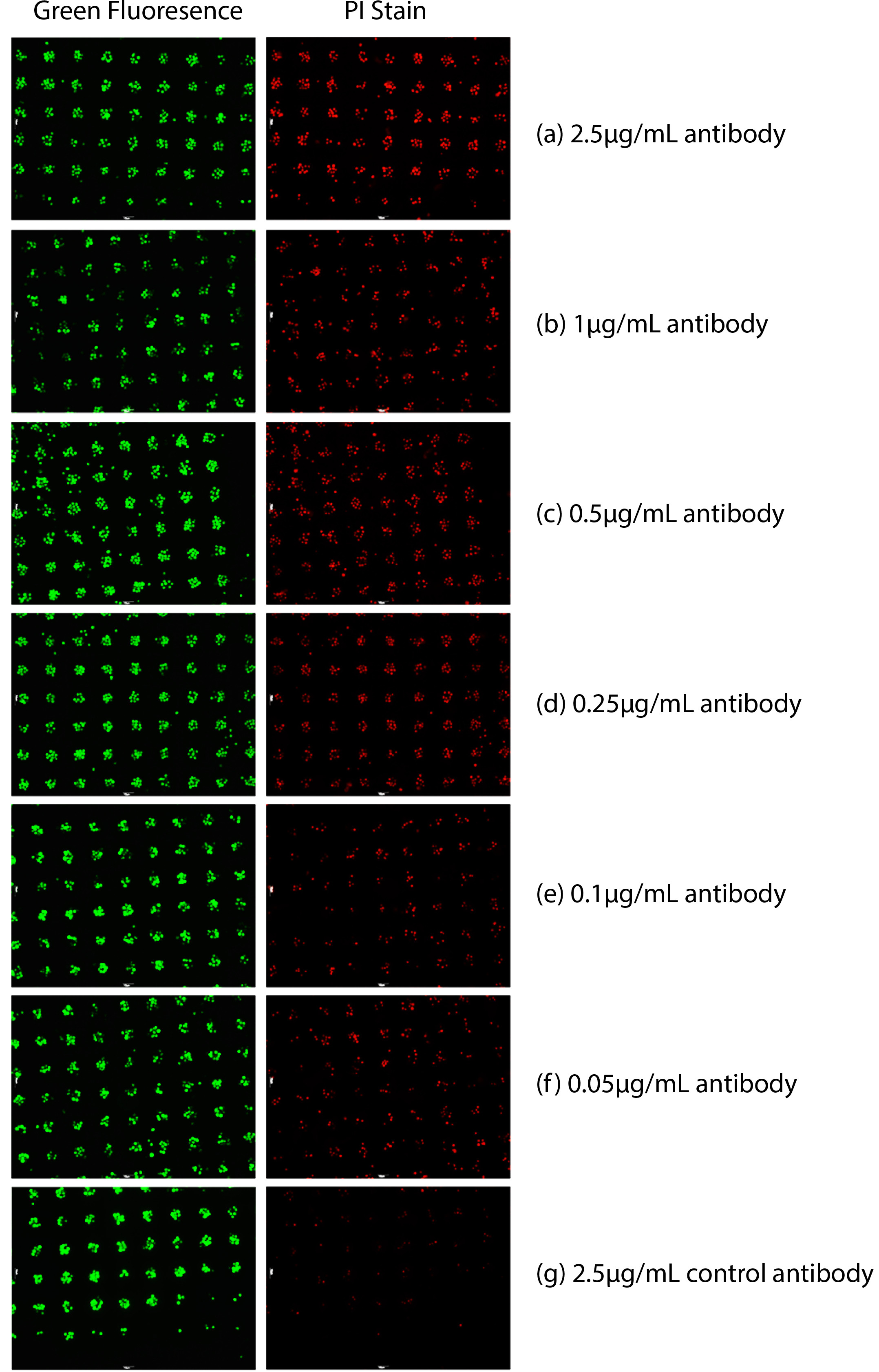
1. cytotoxicity מבוססת נוגדני איור נמדדה בדם מלא. תאי ראג'י תויגו עם צבע cytosolic ירוק ולאחר מכן משותק. PI היה גם הוסיף לגשת מוות של תאים. תאים מתים, נצבעו באדום על ידי צרכן. תרכיזי שוניםיונים של נוגדן Anti-CD20 נוספו בתוספת של דם מלא. (א) 2.5 מיקרוגרם / שעה 16 נוגדן מיליליטר Anti-CD20 לאחר, (ב) 1 מיקרוגרם / hr נוגדן 16 נגד CD20 מיליליטר לאחר, (ג) 0.5 מיקרוגרם לשעה Anti-CD20 / מיליליטר נוגדן 16 אחרי, (ד) 0.25 מיקרוגרם שעה 16 נוגדן לאחר, (ה) מיקרוגרם / מיליליטר Anti-CD20 0.1 / hr מיליליטר Anti-CD20 נוגדן 16 אחרי, (ו) 0.05 מיקרוגרם / hr נגד CD20 מיליליטר נוגדן 16 אחרי, (ז) 2.5 מיקרוגרם / מיליליטר לשלוט נוגדן 16 שעות לאחר.
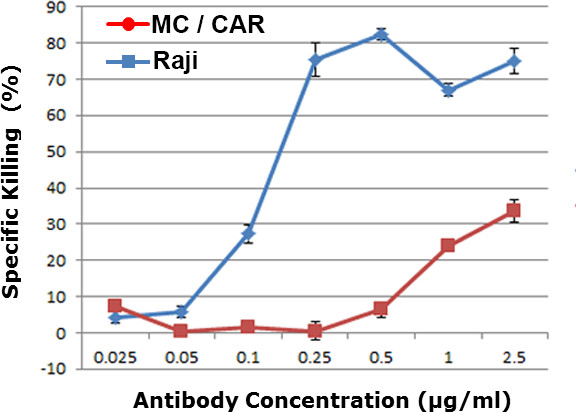
איור 2. cytotoxicity תלויה-מינון נגד שורות תאים שונות בכל דם אנושי. ראג'י היה תאים לימפומה חיוביים CD20, וMC / מכונית שורות תאים שליליים CD20. רמת cytotoxicity דם כל הוצגה לריכוז שונה של נוגדן α-CD20 (נוגדן Anti-CD20).
Discussion
אש"ל הוא קריטי בכלי סינון אנטי-סרטני במבחנה עם רזולוציה תא בודדת 12-16, מנוצלת באופן אידיאלי לאחר הקרנות יעד מסורתיות כגון ה- CDC ומבחני ADCC 9-11, ולפני ניסויים בבעלי חיים פרה-קליניים. נכון לעכשיו, מבחני סינון המטרה העיקרית כגון CDC או מבחני ADCC כולם מבוצעים בתקשורת פשוטה או מערכת חיץ. עם זאת, לתרופות שמראות יעילות במערכת החיץ הפשוטה אלה לא תמיד יעילות במערכת הדם כל המורכבת יותר. לכן, אש"ל יכול לגשר על הפער בין הקרנות יעד מסורתיות ומחקרים בבעלי חיים יקרים, הפחתת זיהוי חיוביים שגוי, ובכך למנוע כישלונות למניעה בניסויים בבעלי חיים או בניסויים קליניים בבני אדם. אש"ל יהיה מועיל עבור החוקרים עובדים על המחקרים פרה-קליניים על מנת לבחון את יעילות התרופה בתוכן של כל דם אנושי. ספירת התאים המתים וחיים באמצעות cytometry זרימה דורשת תְמוּגָה של ce דם האדום השלמהLLS כדי לזהות תאי יעד. היתרון של שיטת אש"ל על הזרימה cytometry הוא שזה יכול לזהות תאי יעד מבלי תמוגה של תאי דם אדומים. קשה lyse לחלוטין את כל תאי הדם האדומים בדגימת הדם, ותאי המטרה גם lysed באופן חלקי במהלך הליך תמוגה.
אפילו הזדמנויות יותר מרגשות להתעורר אם יכולים להיות שנוצרו לוחות הקרנה באמצעות התאים ראשוניים חיים המתקבלים ממטופלים בודדים, וסללו את הדרך לטיפולים בסרטן אישית, ההערכה של ההטרוגניות תאים בתוך גידול נתון, וזיהוי של תאים שעמידים לניתן טיפול תרופתי. העברת מערכת הבריאות לגישה זו היא "אישי, חיזוי, מניעה ומתמקד בצרכימים של המטופל" הוא העתיד של הרפואה 17,18. יוזמות רבות בתוך משרד החוץ האמריקאי בריאות ושירותי אנוש, כולל ה- FDA, המרכז לבקרת מחלות, NIH, המרכזיםלרפואי Medicaid Services, ושירותים למשאבי בריאות המינהל קיים כדי לתמוך ביוזמות לקידום טיפול אישי. מימוש הרפואה אישית תלוי במוצרים וטכנולוגיות אמינות שיכול לתפוס ולהחזיק את כל תאים אנושיים תוך שמירה על אותם במצב ביולוגי רלוונטי. אנחנו יכולים לחזות יישום אש"ל למסך תרופות כנגד תאי הגידול של חולה הסרטן במטריצה של / הדם שלו עבור יישומי רפואה מותאמים אישית.
השלבים הקריטיים בפרוטוקול הם ההכנות של מערך התאים. המשתמשים צריכים להסיר את כל supernatant מבלי לאבד התאים בשלב הכביסה תא. בנוסף, משתמשים צריכים לעשות צנטריפוגה קצרה אם הנוזל לא ניתן לראות בבקבוקונים. ברגע שפתרון מגיב DNA הוכן, זה חייב להיות בשימוש עם התאים בתוך 30 דקות.
יעילות היווצרות מערך תאים היא סוג התא תלויה. יש יותר משל תאים שנבדקו עם פרוטוקול זה 100 סוגים; עם זאת, זה עדיין אפשרי שכמה סוגים מסוימים תא לא יוצרים מערך התאים ביעילות. אם אין טפסי מערך תאים, ריכוז גבוה יותר של מגיב DNA מומלץ לבצע באותו פרוטוקול כדי לקבל היווצרות מערך תאים טובה יותר.
Disclosures
יש סופרים לא אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים לתכנית IMAT מכון הלאומי לסרטן מNIH למימון עבודה זו [R33 CA174616-01A1].
Materials
| Name | Company | Catalog Number | Comments |
| Cell attachment 96 well plate kits | Adheren | AP9601 | |
| Suspension Single cell array 8 well chamber slide | Adheren | SS0801 | |
| Adherent Single cell array 8 well chamber slide | Adheren | SS0802 | |
| Lymphoma cell line CD20+ | ATCC | CCL-86 | Raji cells |
| Lymphoma cell line CD20- | ATCC | CRL-8083 | MC/CAR |
| RPMI 1640 with L-glutamine | Life Technologies | 11875-119 | |
| Fetal Bovine Serum | Thermo | SH30070.01HI | |
| Peni/Strep | Life Technologies | 15070063 | |
| Cytosolic dye | Life Technologies | C7025 | Cell Tracker Green |
| Rituxan (Biosimilar) | Eureka Therapeutics | ||
| Human whole blood | Allcells | WB001 | |
| Propidium Iodide | Sigma | P4170-10MG | |
| Automatic imaging system | Molecular Devices | Contact Vendor | Cell Reporter |
| Cell counting program | Molecular Devices | Contact Vendor | Cell Reporter |
References
- Hutchinson, L., Kirk, R. High drug attrition rates--where are we going wrong. Nat Rev Clin Oncol. 8, 189-1890 (2011).
- Moreno, L., Pearson, A. D. Attrition rates be reduced in cancer drug discovery. Informa healthcare. 8, 363-368 (2013).
- Seok, J., et al. Inflammation and Host Response to Injury, Large Scale Collaborative Research Program. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110, 3507-3512 (2013).
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355, 1018-1028 (2006).
- Eastwood, D., et al. Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells. Br J Pharmacol. 161, 512-526 (2010).
- Hsiao, S. C., Liu, H., Holstlaw, T. A., Liu, C., Francis, C. Y., Francis, M. B. Real time assays for quantifying cytotoxicity with single cell resolution. PLoS One. 8, 10-1371 (2013).
- Wang, S. Y., Weiner, G. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukemia. Expert Opin Biol Ther. 8, (2008).
- Dalle, S., Thieblemont, C., Thomas, L., Dumontet, C. Monoclonal antibodies in clinical oncology. Anticancer Agents Med Chem. 8, 523-532 (2008).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14, 181-196 (1968).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64, (1983).
- Gerlier, D., Thomasset, N. J. Use of MTT colorimetric assay to measure cell activation. Immunol Methods. 94, 57-63 (1986).
- Toriello, N. M., et al. Integrated microfluidic bioprocessor for single-cell gene expression analysis. Proc Natl Acad Sci U S A. 105, (2008).
- Douglas, E. S., Hsiao, S. C., Onoe, H., Bertozzi, C. R., Francis, M. B., Mathies, R. A. DNA-barcode directed capture and electrochemical metabolic analysis of single mammalian cells on a microelectrode array. Lab on a Chip. 9, 2010-2015 (2008).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Current opinion in pharmacology. 9, 580 (2009).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Coelho, J., P, L., Quinn, S., Murphy, R. F. Automated image analysis for high-content screening and analysis. J Biomol Screen. 15, 726-734 (2010).
- Sundberg, S. A. High-throughput and ultra-high-throughput screening: solution- and cell-based approaches. Current Opinion in Biotechnology. 11, 47 (2000).
- Simmons, L. A. Personalized medicine is more than genomic medicine: confusion over terminology impedes progress towards personalized healthcare. PERS MED. 9, 85 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved