Method Article
Músculo liso da bexiga Faixa Contractility como um método para avaliar do trato urinário inferior Farmacologia
Neste Artigo
Resumo
Este manuscrito apresenta um simples, mas poderoso, método in vitro para a avaliação da contratilidade do músculo liso em resposta a agentes farmacológicos ou estimulação do nervo. As principais aplicações são triagem de drogas e fisiologia do tecido entendimento, farmacologia e patologia.
Resumo
Descreve-se um método in vitro para medir a contractilidade do músculo liso da bexiga, e a sua utilização para a investigação de propriedades fisiológicas e farmacológicas do músculo liso, assim como as alterações induzidas pela patologia. Este método proporciona informação crítica para compreender a função da bexiga ao superar grandes dificuldades metodológicas encontradas em experimentos in vivo, tais como as manipulações cirúrgicas e farmacológicas que afetam a estabilidade ea sobrevivência das preparações, o uso de tecidos humanos, e / ou o uso de produtos químicos caros. Também proporciona uma forma a investigar as propriedades de cada componente da bexiga (por exemplo, músculo liso, mucosa, nervos) em condições saudáveis e patológicas.
A bexiga é removida a partir de um animal anestesiado, colocada em solução de Krebs e cortada em tiras. As tiras são colocadas dentro de uma câmara cheia com solução de Krebs quente. Uma das extremidades é conectada a um tenso isométrican transdutor para medir a força de contracção, a outra extremidade está ligada a uma haste fixa. O tecido é estimulado pela adição de compostos diretamente para o banho ou por campo de eletrodos de estimulação elétrica que ativam os nervos, semelhante a provocar contrações da bexiga in vivo. Nós demonstramos a utilização deste método para avaliar a contractilidade do músculo liso espontânea durante o desenvolvimento e depois de uma lesão da medula espinal experimental, a natureza da neurotransmissão (transmissores e receptores envolvidos), os factores envolvidos na modulação da actividade do músculo liso, o papel dos componentes individuais da bexiga, e as espécies e as diferenças de órgãos em resposta a agentes farmacológicos. Além disso, poderia ser utilizada para investigar as vias intracelulares envolvidas na contracção e / ou relaxamento do músculo liso, drogas relações estrutura-actividade e da avaliação da libertação do transmissor.
O método in vitro a contractilidade do músculo liso tem sido usado extensivamente for mais de 50 anos, e forneceu dados que contribuíram significativamente para a nossa compreensão da função da bexiga, bem como para o desenvolvimento farmacêutico de compostos actualmente utilizados clinicamente para o controle da bexiga.
Introdução
O músculo liso da bexiga relaxa para permitir o armazenamento da urina, e os contratos para provocar a eliminação de urina. Relaxamento é mediada por propriedades intrínsecas do músculo liso e pela liberação tônica de norepinefrina (NE) dos nervos simpáticos, que ativa os receptores adrenérgicos beta (β 3 AR em humanos) no detrusor. Anulação é conseguido através da inibição da entrada simpático e ativando os nervos parassimpáticos que liberam acetilcolina / ATP para contrair o músculo liso da bexiga 1. Diversas condições patológicas, incluindo cérebro e / ou lesão da medula espinhal, doenças neurodegenerativas, diabetes, obstrução da saída da bexiga ou cistite intersticial, pode alterar profundamente a função da bexiga, com grave impacto na qualidade de vida do paciente 2. Estas condições de alterar a contractilidade do músculo liso por afectar um ou mais componentes da bexiga: a musculatura lisa, o aferente ou nervos eferentes e / ou omucosa.
Vários in vivo e em métodos in vitro para estudar a função da bexiga têm sido desenvolvidos. In vivo, a cistometria é a medida primária da função da bexiga. Embora isto seja uma preparação intacta que permite a recolha de informação em condições próximas das condições fisiológicas, há um número de circunstâncias, em que é preferido o uso de tiras de músculo liso. Estes incluem situações em que as manipulações cirúrgicas e / ou farmacológicos que afectam a sobrevivência e estabilidade da preparação, in vivo, ou quando os estudos requerem a utilização de tecido humano ou de produtos químicos caros. Este método também facilita o exame dos efeitos de drogas, a idade e patologia em cada componente da bexiga, do músculo liso, ou seja, a mucosa, nervos aferentes e eferentes.
Tiras de bexiga têm sido utilizados ao longo dos anos por muitos grupos para responder a uma série de questões científicas. Eles foram usados para evamudanças luate em atividade espontânea miogênica induzida pela patologia. Acredita-se que esta atividade para contribuir para a urgência e frequência sintomas de bexiga hiperativa (OAB), e é, portanto, um alvo para drogas que está sendo desenvolvido para OAB 3-9. Tiras de bexiga também foram utilizados para investigar fatores miogênicos e neuronais que modulam tônus da musculatura lisa, com o objetivo de descobrir os canais iônicos e / ou receptores e / ou vias intracelulares que poderiam ser direcionados para induzir qualquer relaxamento ou contração da musculatura lisa 3,10- 13. Outros estudos focaram-se na natureza da neurotransmissão, incluindo os transmissores e receptores envolvidos e as mudanças induzidas pela patologia 14,15. Além disso, o método tem sido usado para as comparações entre os tecidos a partir de diferentes espécies de 16 a 18, entre os órgãos de 19-21, e a avaliação das relações estrutura-actividade de drogas 22-24. Uma extensão deste método tem sido usado para MEASURÊ O efeito de drogas na liberação do transmissor de nervos eferentes 25. Além disso, uma variedade de tecidos (bexiga, uretra, tracto gastrintestinal, GI), colhidas a partir de animais ou seres humanos (a partir de cirurgias ou tecido do dador de órgãos aprovados para a pesquisa) e a partir de uma variedade de modelos animais, incluindo lesão da medula espinal (SCI), obstrução da saída da bexiga (BOO), ou cistite intersticial (IC) pode ser investigada usando esta técnica.
Neste trabalho, ilustramos o uso deste método, juntamente com protocolos experimentais necessárias, para solucionar diversas questões científicas mencionadas acima.
Protocolo
Todos os procedimentos aqui descritos são aprovados pelo comitê IACUC na Universidade de Pittsburgh.
1. Solutions
- Preparar a solução de Krebs de acordo com a receita. Composição em mM: NaCl 118, KCl 4,7, CaCl2 1,9, MgSO4 1,2, NaHCO3 24,9, KH 2 PO 4 1,2, dextrose 11,7.
- Arejar Krebs com 95% de O2, 5% de CO 2 e coloque-o em um banho de 37 ° C a água para ser usado durante todo o experimento. Coloque lado ~ 200 ml de solução de Krebs arejada à temperatura ambiente até ser utilizado para a dissecção do tecido.
- Medir pH (~ 7,4) e osmolaridade (~ 300 mOsm) de aerado Krebs.
2. Experimental Set-up (esquemático Figura 1A)
- Encha gaseificado (95% O2, 5% de CO 2) câmaras com 10 ml de Krebs.
- Ligue a bomba de circulação de água para aquecer as câmaras a 37 ° C; ligar o equipamento necessário: amplificador (s), estimulador (s) e gravação de software.
- Calibração de transdutores com um peso de 1 g.
3 Tecido (Figura 1B)
Retire a bexiga de um adulto do sexo feminino ingênuo Sprague Dawley (200-250 g; ~ 10-12 semanas de idade) seguindo estes passos:
- Prepare área de dissecção e instrumentos necessários: máquinas de barbear, pinças com dentes, lâmina de bisturi, tesouras de dissecação, microtesouras, duas pinças de dissecação (autores preferem Dumont fórceps # 3), clips de tecido (ou fio de seda), um prato dissecção Sylgard revestido com Krebs e pinos de dissecação de tecidos.
- Anestesiar os animais com a inalação de isoflurano (4% em O 2) na câmara de indução. Use pomada veterinária nos olhos para evitar a secura sob anestesia. Continuamente monitorizar o nível de anestesia mediante a observação da taxa de respiração, resposta a estímulos externos, e perda do membro posterior retirada reflexa.
- Quando o animal é anestesiado barbear a um menor abdominalrea. Expor os órgãos pélvicos através de uma incisão abdominal na linha média. Identificar a bexiga e uretra. Retirar a bexiga através do corte no colo da bexiga perto da uretra proximal. Colocar o tecido imediatamente no prato revestido Sylgard cheio com solução de Krebs arejada.
- Se for necessário, remover o tecido adicional neste momento: uretra, pedaços de gastrintestinais (GI) e / ou da próstata, etc
- Sacrificar o animal, utilizando métodos IACUC aprovados (por exemplo, por overdose do anestésico ou CO 2 asfixia seguida de um método secundário).
- Insira tecido dissecando pinos através da cúpula da bexiga, pescoço e ureteres, para estabilizar o tecido para posterior dissecação. Não estique o tecido. Remover o tecido adiposo, conjuntivo, uretra proximal e ureteres se presente.
- Abra a bexiga a partir da base de cúpula para criar uma folha plana, lado serosa baixo / lado luminal up (Figura 1B). Coloque dissecando pinos em cada canto do tecido. Remover dom bexigae tecido e pescoço.
- Se o objectivo da experiência é determinar a contribuição da mucosa (urotélio e lâmina própria - ver diagrama Figura 1C) para a contracção do músculo liso, comparar as propriedades das tiras do detrusor, com e sem a mucosa ligada. Por isso, antes de cortar o tecido em tiras, retire cuidadosamente a camada mucosa usando íris primavera tesouras e pinças finas sob um microscópio de dissecação. No final da experiência, para fixar as tiras de coloração de H & E para confirmar a remoção completa da mucosa. Note-se que este procedimento é mais fácil em rato bexiga do que em bexiga de ratos.
- Cortar o tecido longitudinalmente a partir da base de cúpula em tiras de ~ 2 x 8 mm (Figura 1B). Amarre ou anexar um clipe de tecido para ambas as extremidades de cada tira.
Observação: Uma bexiga de rato pode normalmente ser cortado em tiras de 4, mas o número de tiras pode aumentar ou diminuir de acordo com o tamanho do animal / bexiga. - Transfira as tiras para o expercâmaras imental. Anexar uma extremidade de cada tira de um transdutor de força, que mede a contracção do tecido, e a outra para uma vareta de vidro / metal fixo.
NOTA: câmaras do tecido variam em tamanho (0,2 ml a 20 ml ou maiores). Câmaras típicas para bexigas de roedores são 5-20 ml, as quais proporcionam uma altura suficiente para que as tiras ser completamente submerso na solução. Algumas câmaras vêm com alto-eletrodos de estimulação, outros não. Cuidados devem ser tomados para garantir que todas as conexões dos eletrodos estão em boas condições, caso contrário, a estimulação campo elétrico não é confiável. - Aplicar uma quantidade definida de força para cada tira de tecido que se estende suavemente até que a tensão da linha de base atinge um g (~ 10 min). Inicialmente, o tecido tende a relaxar, que é registrado como uma diminuição da tensão da linha de base. Tecido de lavagem aproximadamente a cada 15 min, utilizando a quente de Krebs gaseificado e ajustar a tensão da linha de base de 1 g após cada lavagem. Permitir que o tecido equilibrar durante ~ 1-2 horas ou até que a tensão da linha de base é estável (ou seja, não mais relaxamento do tecido).
- Teste de viabilidade do tecido pela adição de KCl (80 mM) directamente para o banho de ~ 5 minutos, ou até que uma resposta de patamar é atingido. As respostas às elevadas concentrações de KCI, também pode ser repetida durante a experiência ou no fim da experiência e utilizada para normalizar as respostas a outras drogas ou entre as tiras (ver normalização na secção de análise de dados).
- Tecidos de lavagem várias vezes (3-5x) com a quente de Krebs gaseificado para permitir que o tecido para voltar às condições de pré-tratamento.
4. Estimulação Protocolos
- Para investigar os efeitos da patologia sobre a actividade miogénica espontânea ou tom do músculo liso, usar tiras de músculo liso a partir de modelos de animais diferentes, tais como a SCI, BOO, ou recém-nascidos. Figura 2 ilustra a utilização deste método para investigar mudanças na actividade da bexiga e espontânea durante o desenvolvimento após SCI. Além disso, os agentes farmacológicos podem ser usados para modular spontaneous actividade. Figura 3 ilustra o efeito dos moduladores de canais KCNQ, a flupirtina e XE991, sobre a actividade espontânea e tonicidade do músculo liso.
- Para a estimulação do músculo construção de curvas de concentração-resposta lisas farmacológicas por adição de compostos a partir de soluções de reserva concentradas directamente para o banho em intervalos de tempo definidos. Uso de drogas e veículos em faixas paralelas para dar conta de veículos e tempo efeitos.
- Faça soluções estoque de compostos de teste desejados em 1000x a concentração de trabalho final. Para carbacol (CCh), um agonista do receptor muscarínico, preparar seguintes unidades: 10 -5 M, 3 x 10 -5 M, 10 -4 M, 3 x 10 ~ 4 M, 10 -3 M, 3 x 10 -3 M , 10 -2 M. As concentrações finais no banho é de 10 ~ 8 M a 10 -5 M (Figuras 4C, D). Para neuromedina B (NMB), um receptor bombesina subtipo 1 agonista, preparar seguintes unidades populacionais: 10 -8 M, 10 -7M, 10 -6 M, 10 -5 M, 10 -4 M, 10 -3 M e as concentrações finais no banho são 10 -11 M a 10 -6 M. Ambos CCh e NMB são esperados para aumentar a contratilidade do tecido.
- Para um banho de tecido de 10 ml, adicionar 10 ul de cada solução de estoque CCh, logo que a resposta atinge um platô (Figura 4C, D). Em tiras paralelas adicionar quantidades iguais de veículo (água). Da mesma forma, adicionar 10 ul de cada solução de estoque neuromedina B cada ~ 5 min.
NOTA: Observe o efeito excitatório do NMB e CCh no tônus da musculatura lisa em tiras de diferentes espécies na Figura 4. - Investigar as propriedades de relaxamento da musculatura lisa em tecido pré-contraído com um agente excitatório, geralmente CCh ou KCl.
- Para bloquear uma resposta agonista, o pré-tratamento de tecidos durante 10-20 minutos com o antagonista para permitir a penetração do tecido, antes da estimulação agonista.
- Para stim neuraismento do músculo liso, também chamado de estimulação campo elétrico (EFS) siga os passos de 1-3,13 e continuar como descrito abaixo. EFS destina-se a activar selectivamente nervos, contra o músculo liso. Parâmetros para a estimulação deve ser cuidadosamente escolhido para evitar a estimulação direta do músculo liso.
- Estabelecer parâmetros de estimulação: tipo de estímulo (pulsos individuais ou trens), duração (duração do pulso ea duração de trem), frequência e intensidade, conforme descrito nas etapas a seguir e ilustrado nas Figuras 5A, B.
- Para a estimulação único pulso, duração de pulso set, intervalo inter-estímulo e número de estímulos desejados. Parâmetros de duração estimulação usuais são pulsos únicos de 0,05-0,3 mseg de duração entregue em intervalos desejados (Figura 5A). Siga o passo 4.3.1.4 para a intensidade do estímulo.
- Para a estimulação trem, definir a duração do trem e inter intervalo de trem. Os valores típicos para o tecido da bexiga são 3-10 seg entregue pelo menos 1 mem separado (Figura 5B). Se ocorrer fadiga tecido (ou seja, EFS contrações diminuir durante o período de controle), aumente o intervalo entre trem.
- Estabelecer a freqüência de estímulos de trem (número de pulsos em um trem - A Figura 5B). Executar uma curva de resposta de freqüência que varia 0,5-50 Hz. Frequências típicas para bexiga são 10-20 Hz, que dão contrações reprodutíveis e estáveis mediadas pelo ATP e acetilcolina. Observe as respostas dependentes de freqüência à estimulação EFS em tiras rato bexiga na Figura 5 que demonstram como este método pode ser utilizado para avaliar a contribuição de mecanismos colinérgicos e purinérgicos a neurotransmissão.
- Estabelecer intensidade do estímulo: aumentar sistematicamente a intensidade (voltagem) do estímulo até que a amplitude da contração atinge um patamar (se estiver usando trens manter constante a freqüência).
- Definir a intensidade do estímulo, dependendo doobjetivo do experimento. Se o objectivo é o de aumentar as contracções evocadas por neuralmente, em seguida, utilizar a intensidade sub-máxima tal que a amplitude da contracção é de ~ 50% da contracção máxima. Se o objetivo é diminuir as contrações evocadas por Neurally, em seguida, definir a intensidade de ~ 80% da amplitude máxima para evitar a fadiga dos tecidos.
- Uma vez que os parâmetros de estimulação (duração, frequência e intensidade) são estabelecidos, permitir ~ 20-30 min para EFS- evocado contrações para estabilizar antes de testes de drogas.
NOTA: Para verificar a seletividade de EFS para a transmissão neural, transmissão neural bloco com o bloqueador do canal de Na +, a tetrodotoxina (TTX; 0,5-1 mM). Executar este passo, no início da experiência, enquanto TTX lava relativamente fácil. Além disso, esta realização, no final da experiência (ver o passo 4.3.5. Abaixo). - Preparar soluções estoque de 1000X as concentrações de trabalho finais para: alfa, beta-metileno ATP (ABMA; um ativador do receptor purinérgicoe dessensibilizante) 10 -2 M, atropina (um antagonista do receptor muscarínico) 10 -3 M (Figura 5C). Observar outros exemplos na Figura 6. O agonista do receptor 5HT4, cisaprida (3 x 10 -6 M, 10 -6 M, 3 x 10 -5 M, 10 -5 M, 3 x 10 ~ 4 M, 10 -4 M, 3 x 10 -3 M, 10 -3 M), aumenta a contractilidade do tecido e SB-203186 (3 x 10 -3 M), um antagonista do receptor 5HT4, inverte os efeitos de cisapride.
- Para testar os efeitos da ABMA e atropina sobre EFS (Figura 5C), realizar duas curvas de resposta de freqüência de controle. Adicionar 10 ul de 10 -2 M ABMA para o banho para uma concentração final de 10 uM. Isto irá contrair o tecido devido a estimulação directa do receptor purinérgico do músculo liso. Após a resposta retorna à linha de base, repita as curvas de resposta de freqüência. Adicionar 10 ul de 10 -3 M de atropina para um final de concentratião de 1 uM. Após cerca de 10 min (necessário para a atropina para bloquear os receptores muscarínicos), curvas de resposta de freqüência de repetição. Em tiras paralelas adicionar 10 ul de veículo, água, em cada passo.
NOTA: Para outros exemplos na Figura 6, adicionar 10 ul de cada solução de cisaprida em intervalos definidos de tempo (~ 15 min cada, ver a discussão), seguidos por 10 ml de SB-203186 solução estoque directamente para o banho e monitorizar o seu efeito em EFS contração induzida. Em tiras paralelas adicionar 10 ul de veículo, DMSO. Observar os efeitos de cisaprida, um agonista do receptor 5HT4, em contrações EFS-evocados em bexiga e íleo tecidos humanos na Figura 6. Além disso, observar o efeito do DMSO, o veículo para a cisaprida, a EFS evocados contrações na bexiga humana e tecidos íleo . - No final do protocolo de EFS verificar a selectividade de EFS, bloqueando a transmissão nervosa com o bloqueador do canal de Na +, a tetrodotoxina (TTX; 0,5-1 &# 181; M). Se contracções resistentes TTX estão ainda presentes, recomenda-se a ajustar a duração e intensidade do estímulo em experiências subsequentes.
- Estabelecer parâmetros de estimulação: tipo de estímulo (pulsos individuais ou trens), duração (duração do pulso ea duração de trem), frequência e intensidade, conforme descrito nas etapas a seguir e ilustrado nas Figuras 5A, B.
- Para determinar os efeitos das drogas em locais pré ou pós-sináptica (Figura 7A) siga os passos de 1 a 4.3.2. Estabelecer respostas reprodutíveis ao carbacol e EFS, em seguida, adicione X. droga
- No final da experiência, ou desatar desencaixe das tiras, apagá-las cuidadosamente sobre um pedaço de papel de tecido para eliminar o fluido extra e medir o peso de cada tira utilizando uma balança. Também medir o comprimento do tecido, utilizando um paquímetro para determinar a área transversal. Esta informação é usada para a normalização dos dados (ver secção 5.4).
Análise de Dados 5.
Analisar dados usando o software adequado (por exemplo, Windaq, LabChart).
- Para a atividade espontânea, selecione uma janela de pelo menos 30 segundos antes e no pico da resposta induzida por drogas e meamplitude asure e frequência de atividade miogênica (Figura 3).
- Use a análise de transformação rápida de Fourier para determinar o espectro de freqüências que contribuem para respostas contráteis e se há diferenças entre as diferentes partes da bexiga (por exemplo, a cúpula vs. pescoço) ou com o desenvolvimento, patologia e medicamentos 8.
- Para efeitos no tônus da musculatura lisa selecionar uma janela de pelo menos 10-30 segundos antes e no pico da resposta induzida por drogas e medir a amplitude de contração.
- Para efeitos sobre as contracções evocadas neuralmente medem a amplitude, a duração e a área sob a curva de contracções (pelo menos 3), antes e no pico da resposta induzida por drogas.
NOTA: É necessário medir a amplitude e área sob a curva de contracções induzidas por EFS, porque os componentes purinérgicos e colinérgicos têm diferentes cinéticas. O componente purinérgico é rápida e transiente (ATP activa purinergic canais ionotrópicos como P2X1, que permitem o influxo rápido de cálcio, em seguida, eles dessensibilizar), contribuindo, assim, mais para o pico de resposta de amplitude e menos para a área sob a curva. O componente colinérgica é mais lenta e sustentada (ACh activa receptores muscarínicos metabotrópicos, que necessitam de mais tempo para activar vias de sinalização intracelular que em última análise, activam os canais iónicos que despolarizar o músculo liso para induzir uma contracção). Assim, o componente muscarínico é capturado melhor através da medição da área sob a curva. - Normalizar os dados para poder comparar resultados entre tiras e tratamentos farmacológicos. O parâmetro escolhido para a normalização não deverá ser influenciada por os compostos de teste, estudou condição patológica ou desenho experimental. Entre estes parâmetros, a utilização de peso tira, a área de corte transversal, as respostas de KCl (Figura 4B),% da resposta máxima (Figura 7B) ou% da resposta máxima para um outro agente contráctil(Por exemplo, CCh) ou agentes relaxantes (por exemplo, papaverina).
Resultados
Espontâneo Atividade Miogênica
Atividade miogênica espontâneo é uma importante característica do músculo liso que sofre alterações com o desenvolvimento pós-natal 6-9 e patologia (por exemplo, SCI, BOO) 3-5. Porque se acredita que essa atividade contribui para os sintomas de bexiga hiperativa (OAB) 2, uma avaliação de receptores, vias intracelulares e agentes farmacológicos que modulam, é de grande interesse para o desenvolvimento de tratamentos eficazes para a OAB e outras disfunções musculares lisas. O método aqui apresentado pode facilmente investigar essas questões Figura 2 ilustra os diferentes padrões de atividade espontânea miogênica durante o desenvolvimento em neonatal (i), juvenil (ii) adulto (iii) e na medula espinhal feridos ratos. (SIC; iv). Tiras de ratos recém-nascidos apresentam grande amplitude, as contrações rítmicas baixa freqüência (Figura 2ai), enquanto tiras de rato adultos apresentam pequena amplitude, atividade de alta frequência (Figura 2Aii iii,). Depois de o padrão de SCI neonatal reemerge (Figura 2Aiv). Além da utilização de tiras de modelos animais, vários agentes farmacológicos podem ser usados para induzir contracções espontâneas em tiras a partir de animais normais, com o objectivo de compreender os mecanismos subjacentes às contracções espontâneas. Exemplos de agentes farmacológicos adequados incluem agonistas do receptor muscarínico (carbacol; CCh)., Compostos que aumentam os níveis de acetilcolina (por exemplo, inibidores de acetilcolina esterase), baixas concentrações de KCl (por exemplo, 20 mM) ou outras drogas experimentais Figuras 3A-B ilustram a modulação de actividade espontânea por agentes farmacológicos que actuam sobre os canais KCNQ localizados no músculo liso. O abridor do canal KCNQ, flupirtina, diminui a amplitude e frequência da actividade espontânea de uma forma dependente da concentração (Figura 3aa-iii), enquanto oBloqueador dos canais KCNQ, XE991, diminui a amplitude, mas aumenta a freqüência de atividade espontânea (Figura 3Bi-iii).
Tônus do músculo liso
Tônus da musculatura lisa e contratilidade propriedades são fatores importantes para o funcionamento adequado da bexiga durante o armazenamento e esvaziamento. Este método pode facilmente rastrear os efeitos dos fármacos no tono do músculo liso. Figuras 3Aiv 3Biv e mostram que a flupirtina diminui tónus basal, consistente com o relaxamento do músculo liso, enquanto que o tono do músculo liso XE991 aumenta. Figura 4 ilustra que a concentração aumenta dependentes em tono do músculo liso através da activação de receptores de bombesina com neuromedina B (NMB, Figura 4A, B) ou receptores muscarínicos com carbacol (CCh; Figuras 4C, D). Além disso, as vias intracelulares que medeiam estas respostas musculares lisas podem ser investigados ucante moduladores específicas (dados não mostrados).
Respostas e Modulação da neurotransmissão Neurally mediadas
Contracção da bexiga é conseguido através da libertação de acetilcolina / ATP a partir dos nervos eferentes parassimpático. A contribuição dos sistemas muscarínicos e purinérgicos a contracção da bexiga varia entre as espécies e as condições patológicas, com aumento da concentração de contribuição purinérgico em patologias, tais como cistite intersticial, obstrução da saída parcial, e bexiga hiperactiva 26. Figura 5C demonstra a utilização deste método para determinar o contribuição de componentes muscarínicos e purinérgicos a neurotransmissão em tiras de bexiga de rato. A contribuição do componente colinérgica foi avaliada utilizando o antagonista do receptor muscarínico, a atropina. A contribuição do sistema purinérgico foi avaliada usando o ativador do receptor purinérgico e desensitizer, alpha, beta-metileno ATP (ABMA). Além disso, a freqüência de contribuição depende de cada componente foi avaliada pela variação da freqüência de estimulação de baixa para alta freqüência (2-50 Hz).
A força de contracção da bexiga a desempenha um papel significativo na anulação da eficiência. Usando este método, os receptores e vias que modulam a transmissão neural pode ser investigado como alvos de drogas para anular disfunções. Os receptores de 5HT4 são expressos em pré-juncionalmente neurónios parassimpáticos e sua activação aumenta os níveis de acetilcolina 27. Figura 6 ilustra o efeito excitatório do agonista do receptor 5HT4, cisaprida, em tiras de bexiga e de íleo humano.
Vários protocolos experimentais podem ser utilizados para determinar o local de acção de um composto de teste. Diagrama na Figura 7A ilustra um protocolo utilizado para avaliar a pré versus sítios pós-juncionais. Se o medicamento X reduz (ou aumento) da resposta EFS mas não tem efect em resposta a CCh, o local de acção mais provável é pré-juncional. Se droga X altera tanto EFS e CCh resposta, então ele pode agir em receptores localizados pós-juncionalmente ou ambos pré e pós-juncionalmente.
Papel de cada componente: músculo liso, Mucosa e Neuronal
As diferentes condições patológicas podem afetar vários componentes da bexiga. Por exemplo cistite intersticial (IC) afeta principalmente o urotélio, enquanto OAB pode resultar em alteração da contratilidade do músculo liso. Além disso, os diferentes receptores podem ser expressos em cada componente da bexiga e poderia, assim, ser especificamente dirigida numa determinada patologia. Ao contrário de métodos in vivo, que medem um efeito líquido de todos os componentes da bexiga, este método in vitro permite a investigação de componentes específicos, usando uma combinação de procedimentos cirúrgicos e farmacológicos. Para testar a contração do músculo liso / relaxamento na ausência de natureza neuronaltransmissão, TTX (0,5-1 uM) podem ser adicionados ao banho. Na Figura 4, NMB e CCh foram testadas na presença de TTX. Para testar a contribuição da mucosa (urotélio e lâmina própria) para a contractilidade do músculo liso, em faixa, com ou sem a camada mucosa são comparados. Figura 7B mostra que as respostas a CCh são reduzidos na presença de mucosa no porco 28. Resultados semelhantes foram relatados em tiras de bexiga humanos 29. Para testar o papel de fibras nervosas, pode ser feita várias abordagens. Um deles é para ativar ou inibir fibras específicas por meio de agentes farmacológicos. Por exemplo, a capsaicina ativa uma população específica de nervos aferentes e faz com que espécies contração da musculatura lisa dependente ou relaxamento 17,18. Guanetidina inibe a liberação de noradrenalina a partir de fibras simpáticas, eliminando, assim, a contribuição dessas fibras. Outra abordagem é dessensibilizar / eliminar fibras específicas in vivoantes da experiência. Por exemplo, o tratamento sistêmico do animal com capsaicina desensitizes capsaicina nervos aferentes sensíveis. Outros componentes da bexiga que podem ser estudadas nesta preparação são as células intersticiais ou junções comunicantes ativando ou bloqueando-os com agentes específicos.
Diferenças entre as espécies
Embora a maior parte de desenvolvimento de medicamentos destina-se ao tratamento de distúrbios humanos, a pesquisa básica é realizada principalmente em tecido animal. Espécies diferenças existem num número de receptores. Por exemplo, os agonistas do receptor 5HT4 melhorar contracções neuralmente evocadas na bexiga humana, mas não na bexiga de rato 19,30, induzida por EFS contracções são quase exclusivamente atropina-sensível no detrusor de macaco do Velho Mundo e humana a partir de estáveis bexigas 31, mas tornam-se parcialmente atropina-resistentes em detrusor humano de pacientes com condições instáveis da bexiga (por exemplo, neurogênica, obstructebexigas d) 15,32,33, capsaicina provoca uma resposta excitatória no rato e humano da bexiga tiras, ausência de resposta em tiras de bexiga de porco e de resposta da inibição em tiras de bexiga de cobaia 17,18. Figura 4 mostra que os agonistas dos receptores de bombesina têm efeitos excitatórios em bexiga de ratos e sem efeitos no rato e de bexiga de porco tiras 16. Esta informação é fundamental para a escolha do modelo animal apropriado para estudar um receptor específico.
Comparação de Sensibilidade através Órgãos
Drogas destinadas ao tratamento de perturbações da bexiga podem também afectar o músculo liso a partir de outros órgãos, tais como o tracto gastrointestinal, a uretra, vesícula biliar, etc Este método permite a estimativa da selectividade de órgãos e sensibilidade a um agente farmacológico, comparando diferentes tecidos lado a lado. Tal como ilustrado na Figura 6, o agonista do receptor 5HT4, cisaprida, tem diferement eficácia e potência na bexiga humana vs tecido íleo.

Figura 1 set-up e tira bexiga preparação Experimental. A) Esquema da montagem experimental. Tiras de bexiga estão submersos em câmaras de tecido cheios de solução Krebs arejada mantida a 37 ° C por meio de uma bomba de circulação de água. Uma extremidade da tira é ligado a um transdutor de força isométrica para medir a contractilidade do tecido, o outro a uma haste fixa. O transdutor de força está ligado a um amplificador e um computador para o registo de dados. Eléctrodos de estimulação do campo eléctrico ligados a um estimulador são colocados na câmara e utilizado para evocar contracções da bexiga neuralmente mediadas. B) Preparação de tiras de tecido. A bexiga é preso em um prato e os seguintes procedimentos são realizados: # 1 º corte verticalOugh metade ventral da bexiga de uretra a cúpula para abrir a bexiga em uma folha plana. # 2 cortes horizontais remoção da cúpula e da base da bexiga / uretra proximal. . # 3 cortes verticais dividem meio a bexiga em tiras iguais (4 tiras de uma bexiga de ratos) C) Esquema de componentes de faixa: músculo liso e mucosa, ambos contendo aferentes (azul) e eferentes (verde) nervos. Mucosa consiste do urotélio e lâmina própria. A lâmina própria contém vasos sanguíneos [1], as células intersticiais [2], e muscular mucosas [3]. A linha pontilhada rotulada # 2b indica o procedimento para a remoção da camada mucosa. Clique aqui para ver uma versão maior desta figura.

Figura 2. Miogênica actividade espontânea durante o desenvolvimento e depoispatologia. A) Exemplos de actividade espontânea em neonatal (i), juvenil (ii), adulto intactos espinal (iii) e lesão medular (LM) adulto (iv) as tiras de bexiga de rato. O rato SCI foi utilizado em quatro semanas após a cirurgia. B, C) Síntese de amplitude (B) e de frequência (C) das contracções espontâneas nas quatro grupos investigados. (Reproduzido com permissão de Artim DE, Kullmann FA, Daugherty SL, Bupp E, Edwards CL, de Groat WC Neurourol Urodyn 2011 Nov; 30 (8):.. 1666-74.) Por favor, clique aqui para ver uma versão maior desta figura.
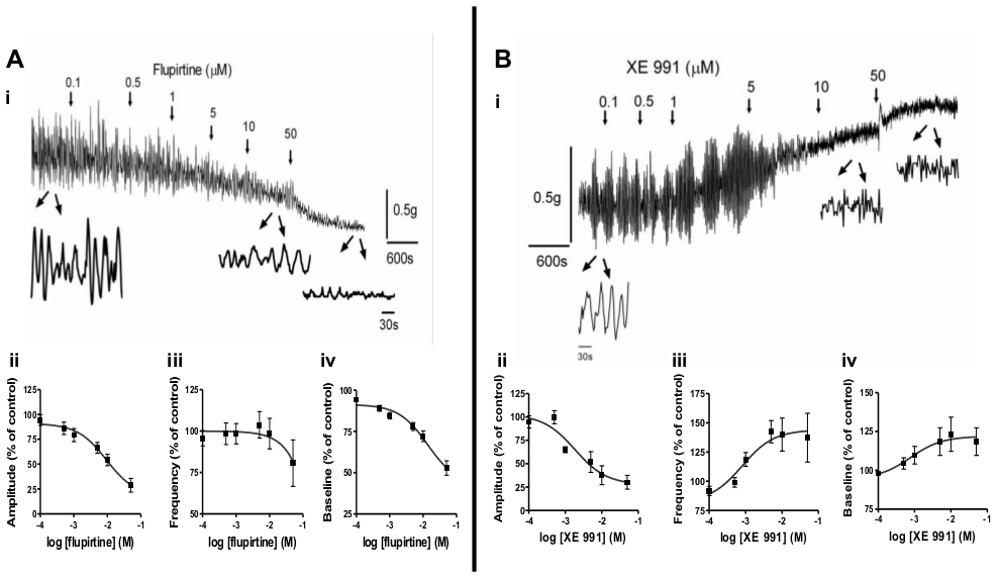
Figura 3 Modulação da actividade espontânea miogénica e tonicidade do músculo liso. A) O efeito de abertura do canal KCNQ, flupirtine, sobre a actividade espontânea e tom de linha de base em tiras de bexiga de rato adulto. (I) A flupirtina foi adicionado em concentrações crescentes (cumulativo) nos tempos indicados por setas. As ampliações sob o traço show de 4 min de atividade tira durante o controle e após a aplicação de 10 mM e 50 mM de flupirtina. (Ii-iv) Resumo dos efeitos de flupirtina (7 tiras de 4 ratos) em amplitude (ii) e de frequência (iii) de actividade espontânea e tom de linha de base (iv), expressa como% de alteração a partir dos valores de controle (pré-droga) , que foram definidas como 100%. B) O efeito do bloqueador do canal KCNQ, XE991, sobre a actividade espontânea e tom de linha de base em tiras de bexiga de rato adulto. (I) XE991 foi adicionado em concentrações crescentes (cumulativo) nos tempos indicados por setas. As ampliações sob o traço mostrar 2 min de atividade tira durante o controle e após a aplicação de 10 mM e 50 mM XE991. (Ii-iv) Resumo dos efeitos de XE991 (9 tiras a partir de 4 ratos) naamplitude (ii) e freqüência (iii) da atividade espontânea eo tom de base (iv), expressa em% em relação aos valores de controle (pré-droga), que foram fixados em 100%. Clique aqui para ver uma versão maior desta figura .

Figura diferenças 4. espécie. A) dependente da concentração as contrações do músculo liso em resposta ao agonista do receptor da bombesina, neuromedina B (NMB), em tiras de bexiga em ratos. B) Resumo dos efeitos da NMB sobre a contração do músculo liso nas tiras de bexiga em ratos. Os dados são normalizados para o KCl (80 mM) de resposta. C, D) A ausência de respostas a NMB em rato (C) e suínos (D) tiras de bexiga. Carbachol (CCh) provoca forte concentração con dependentetrações em ambas as tiras de ratinho e de suíno, indicando que as tiras podem responder a estímulos. TTX (0,5 ^ M) estava presente no banho, em todas as tiras. (Reproduzido com permissão de Kullmann FA, McKenna D, Wells GI, Thor KB Neuropeptides 2013 Oct; 47 (5):.. 305-13) Por favor, clique aqui para ver uma versão maior desta figura.
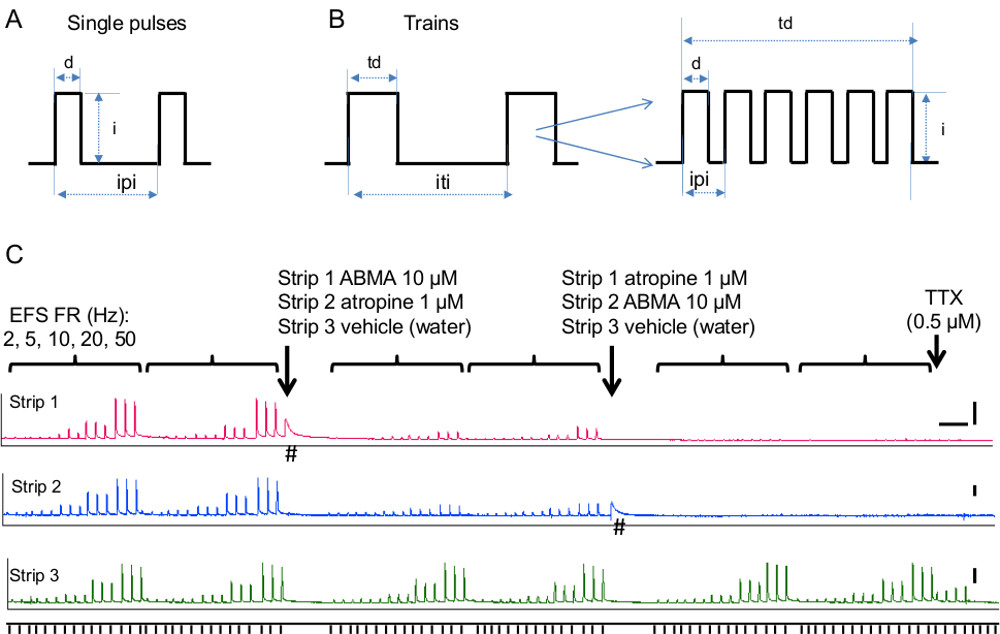
Figura 5 estimulação campo elétrico. A) Esquema de parâmetros individuais de estimulação de pulso. Abreviaturas: D = duração do pulso, i = intensidade de pulso, ipi = entre pulso intervalo B) Esquema de parâmetros de estimulação trem.. Abreviaturas: duração td = comboio, i = intensidade de pulso, iti = inter intervalo de trem. O encarte mostra o número de pulsos em um trem eo intervalo entreen-los, o que em conjunto com a duração de trem determinar a frequência de estimulação de trem. C) Contribuição dos componentes purinegic e colinérgicos para neurally evocadas contrações da bexiga. EFS-FR representam freqüências de estimulação, 2, 5, 10, 20, 50 Hz. Três estímulos entregues a cada 90 seg foram testados para cada frequência e cada série de frequência foi repetido duas vezes no controlo e duas vezes após a adição de cada composto. Alfa, beta-metileno ATP, abreviado ABMA (faixa 1), foi usado para dessensibilizar os receptores purinérgicos e atropina (faixa 2) foi utilizada para bloquear os receptores muscarínicos. Faixa 3 serviu como controlo e foi tratado com o veículo, água. As setas indicam o momento em que cada composto foi adicionada a cada tira. Note-se que as contrações EFS-evocadas são fortemente reduzida pela ABMA e atropina, embora não seja afetado pelo veículo. TTX foi adicionado no final da experiência enquanto a EFS foi entregue em 20 Hz. Note-se que as contracções restantes observados no controletira três foram abolidas por TTX, demonstrando a sua natureza neural (ou seja, iniciadas por liberação do transmissor dos nervos intramurais). # Indica respostas de músculo liso para ABMA na ausência de EFS. Barras de escala são 5 min para o eixo x e 2 g para o eixo y. Clique aqui para ver uma versão maior desta figura.

Figura 6 Modulação de contracções da bexiga neuralmente evocados. A, B) Exemplos da melhoria das contracções evocadas neuralmente pelo agonista do receptor 5HT4, cisaprida na bexiga humana (A) e as tiras de íleo (B). Cisaprida (registos pretas) ou DMSO (registos cinzento) foi adicionado de uma forma dependente da concentração nos tempos indicados por setas. As barras pretas abaixo dos registros em cada painelrepresentam EFS, que consistia de 10 trens seg entregues em 20 Hz a cada 120 segundos. Barras de escala verticais são 1 g para todos os exemplos. Concentração foi de 0,5 uM TTX CF) Resumo. Da área sob a curva (AUC) das contracções evocadas por EFS em resposta a cisaprida (barras pretas) ou DMSO (barras cinzentas) em tiras de bexiga (C, D) e as tiras de íleo (E , F). Na CF, SB representa SB-203186, que representa um resumo dos dados obtidos, depois da adição do antagonista de receptor 5HT4. As linhas pontilhadas são definidos para 100% e representam o controle. (Reproduzido com permissão de Kullmann FA, Kurihara R, Ye L, Wells GI, DG McKenna, Burgard CE, Thor KB Auton Neurosci 2013 Jun; 176 (1-2):... 70-7) Por favor, clique aqui para ver uma versão maior desta figura.
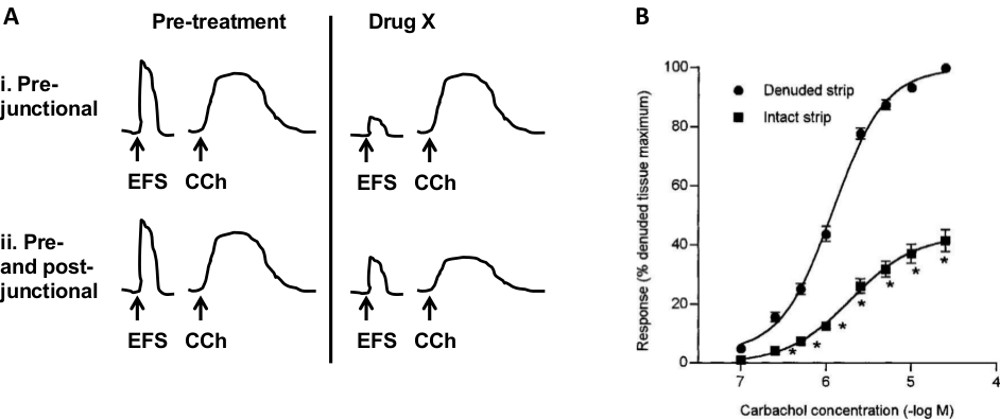
Figura 7. locais de ação das drogas e do papel dos diferentes componentes da bexiga. A) Esquema do protocolo para identificar o local de ação de uma droga. Tiras são estimuladas com ESF e carbacol (CCh). Em i droga X reduz a resposta EFS, mas não a resposta CCh, indicando um sítio pré-juncional de ação. Em ii, droga X altera ambas as respostas, indicando uma ação sobre os receptores pós-juncionais ou ambos pré e pós-juncionais. B) Influência da mucosa sobre a contração do músculo liso. Efeitos de carbacol são diminuídos em tiras com a mucosa presente (intacta) em comparação com as tiras com a mucosa removido (desnudados). (B é reproduzido com permissão de Hawthorn MH, Chapple CR, caralho M, Chess-Williams R. Br J Pharmacol 2000 fevereiro; 129 (3):. 416-9). Clique aqui para ver uma versão maior desta figura.
Discussão
Neste artigo descrevemos um simples método in vitro contratilidade do músculo liso que pode ser usada para abordar uma série de questões científicas importantes relacionados à fisiologia e patologia da bexiga, bem como auxiliando na descoberta de novos medicamentos para tratar disfunções de bexiga. Ilustramos o uso deste método para avaliar as propriedades de desenvolvimento, patológicos e farmacológicos da contractilidade do músculo liso da bexiga (Figuras 2-4), modulação da neurotransmissão (Figuras 5-7A), diferenças de espécies (Figura 4), as diferenças de órgãos (Figura 6) e relevância dos componentes da bexiga específicas (por exemplo, mucosa, Figura 7B). Aplicações adicionais não ilustrados aqui incluir a avaliação de vias intracelulares os farmacológicos 3,10,11, relacionamentos de várias drogas 22-24, ou de avaliação / quantificação de rele transmissor estrutura-atividadease após a estimulação neural 25.
Embora a função da bexiga pode vir a ser avaliada in vivo, este método in vitro supera muitas situações que são problemáticos in vivo. Estes incluem situações em que as manipulações cirúrgicas e farmacológicas que reduzem a viabilidade e / ou a sobrevivência do órgão ou do animal, a utilização de tecido humano, a necessidade de identificar e caracterizar as respostas de componentes específicos (por exemplo, músculo liso vs vs epitélio nervos ) ou a utilização de produtos químicos dispendiosos. O método permite a investigação sistemática dos efeitos de vários agentes farmacológicos, bem como na patologia actividade contráctil do músculo liso e de uma forma e ambiente bem controlado.
O método proporciona uma infinidade de informações; no entanto, o cuidado deve ser tomado ao se interpretar e extrapolar essas informações. Este é um método in vitro de uma preparação reduzida, disconectado a partir de seu ambiente normal e controle neural. As condições experimentais não são fisiológico, assim, os dados podem não reflectir inteiramente em situações fisiológicas in vivo. Por exemplo, o método não pode ser responsável por alterações no fluxo sanguíneo, hormônios, substâncias humorais, forças mecânicas externas, ou controle neural extrínseco. O tecido é agudamente descentralizada, assim respostas de lesão e isquemia relacionada precisam ser avaliadas e tomadas em consideração. As alterações patológicas que ocorrem no cérebro ou na medula espinhal não podem ser testados usando este método, a menos que já tenha alterado aferentes, do músculo liso, da mucosa ou a função do nervo intramural (isto é, a plasticidade celular). Estimulação do campo eléctrico (EFS) permite a avaliação das respostas neurally mediadas. No entanto, esta excita indiscriminadamente todas nervos na faixa (por exemplo, simpáticas, parassimpáticas, aferentes), em oposição à situação in vivo em que o reflexo de micção ativa apenas Camin especialays. Uma maneira de superar esta situação é combinar EFS com antagonistas específicos que bloqueiam seletivamente diferentes vias. Por exemplo, guanetidina poderia ser usado para bloquear a libertação de norepinefrina, quando o estudo das propriedades de contracção, ou atropina pode ser utilizada para bloquear os receptores muscarínicos para prevenir as contracções da bexiga quando se estudam as propriedades de relaxação. Finalmente, a viabilidade do tecido está limitado a um determinado número de horas. Em geral, a maioria dos componentes de tecido da bexiga é viável e estável (isto é, resposta a EFS, sem deterioração das respostas) ao longo de um período de 6-8h ou mais. No entanto, outros tecidos podem ser mais sensíveis (por exemplo, íleo de dura ~ 6 horas ou menos; experiência pessoal de autor).
Embora o método é tecnicamente viável e com boa reprodutibilidade, há várias etapas críticas necessárias para garantir o seu sucesso. Em primeiro lugar, a preparação do tecido deve ser realizada com cuidado para assegurar a viabilidade de fazer as mudanças necessáriaspara o procedimento de dissecção (evitar esticar o tecido durante a preparação das tiras) e / ou meios de comunicação, se necessário para diferentes tipos de tecido ou espécies. Outro passo fundamental é definir-se parâmetros de estimulação neuronal, de modo que os efeitos de teto são evitadas. Tal como descrito na secção do método, isto depende do tipo de experiência realizada esperado e mecanismo de acção do composto de teste. Por exemplo, para testar os efeitos de cisapride, um agonista do receptor 5HT4, em tiras de bexiga (Figura 6), que defina a amplitude da contracção evocada por EFS para ~ 50% da máxima. Isto baseou-se no mecanismo de acção conhecida dos agonistas do receptor 5HT4, nomeadamente aumentando a libertação de ACh a partir de nervos pré-juncional parassimpático 27, que por sua vez está prevista para aumentar as contracções evocadas por EFS. A estimulação do músculo contra nervos devem ser testados usando TTX, que inibe a transmissão nervosa e, portanto, deve inibir contrações EFS-evocadas. Controles adequados para veículo e time deve ser realizada durante o teste de drogas para explicar a deterioração do tecido com o tempo e para todos os efeitos possíveis do veículo. Por exemplo, muitas medicamentos são dissolvidos em DMSO ou etanol. Os nossos dados (Figura 6) mostram que o DMSO (0,1% ou mais) podem aumentar as contracções evocadas neuralmente, um efeito que deve ser subtraído o efeito do medicamento de ensaio. Da mesma forma, o etanol (até 1%) reduz as contracções espontâneas do músculo liso, mas não tem nenhum efeito sobre as contracções evocadas por neuralmente 34,35. Se o uso de animais geneticamente modificados ou modelos cirúrgicos (por exemplo, lesão medular ou ooforectomia), os controles devem incluir tecido da cepa fundo do mouse adequado ou sham operado animais, respectivamente. Além disso, alguns tecidos, como humanos, camundongos e cobaias bexigas conter gânglios intramural. Ao trabalhar com esses tecidos, a seleção de protocolo e interpretação dos dados deve levar em consideração os efeitos de drogas ou EFS sobre ne intramuralurons que estimulam ainda mais a musculatura lisa.
Projetando o protocolo experimental, escolhendo os parâmetros corretos (por EFS, para a estimulação de drogas) e as concentrações a serem testadas são fundamentais para garantir que os dados significativos. Enquanto os parâmetros devem ser ajustados para os tecidos e fármacos individuais, princípios gerais / diretrizes descritas a seguir são aplicáveis. As curvas de resposta à concentração cumulativas são desejáveis, no entanto, isto não é possível, para todos os compostos. Drogas que dessensibilizar os receptores, tais como os receptores de P2X (purineric ionotrópicos) ou fármacos que são metabolizados rapidamente no tecido (exemplo ACh) dirigidas, não pode ser testada de forma fiável por meio de curvas de resposta à concentração cumulativas no mesmo tecido. Nestes casos, as concentrações individuais são testados em diferentes grupos de tecido. Para avaliar a dessensibilização, recomenda-se a comparar a magnitude da resposta induzida por uma única concentração mais alta que a obtida no final de uma operação de concentração cumulativacurva de resposta.
Para montagem precisa dos dados obtidos a partir de curvas de resposta à concentração, é desejável testar a metade das concentrações de log (CCH exemplo na Figura 6). No entanto, as concentrações de log (exemplo NMB na Figura 4A) são aceitáveis quando a viabilidade do tecido pode ser limitada ou outras restrições podem estar no local.
Para seleccionar uma gama de concentrações para um novo composto, em experiências preliminares, é útil considerar a afinidade de ligação do composto de teste e dois potência de 10 acima e abaixo do que a concentração. Em experiências subsequentes, o protocolo é refinado para determinar um ponto de partida em que o efeito do fármaco é observado e um ponto final em que, ou a resposta é máxima ou a concentração testada não é específico para o alvo pretendido.
O intervalo de tempo para a aplicação de uma droga deve ser escolhido levando em consideração vários fatores: a) Tempo para umadrogas para ter um efeito. No caso de medicamentos gerais que visam receptores de membrana tem uma resposta relativamente rápida (segundos a minutos), enquanto que medicamentos para alvos intracelulares (por exemplo, forskolin e outros inibidores da enzima de 36, a toxina botulínica 37) requerem tempo de incubação adicional (30 min - 3 h). Além disso, a espessura do tecido pode desempenhar um papel. b) Duração e mecanismo de ação da droga. Para os casos em que o efeito do fármaco atinge um patamar, que é sustentada, tal como na Figura 4A NMB e cisaprida na Figura 6, os intervalos de tempo de 5-15 minutos no intervalo entre as aplicações de droga são adequados para a recolha de dados suficientes. Isto não é possível com os medicamentos ter uma duração muito mais curta de acção ou diferente mecanismo de acção (ATP, CCh). Por exemplo, o efeito de CCh na Figura 4C, ou 4E, atinge um patamar, mas rapidamente a tensão do tecido tende a retornar à linha de base. Neste caso, os intervalos de tempo têm de ser ajustados de acordoly, normalmente adicionando a próxima concentração quando a primeira resposta atinge um máximo.
A análise dos dados, particularmente a normalização dos dados para permitir comparações entre faixas é um passo muito importante. Diferentes estudos utilizam diferentes parâmetros para a normalização do peso, incluindo a tira 38, tira de área transversal 39, KCl resposta 12,% de resposta máxima ou 28% da resposta máxima para um outro agente contráctil (por exemplo, CCh 38). O parâmetro de normalização deve ser escolhido em função do objectivo da experiência, de modo a que o parâmetro não é influenciada pelos compostos de teste, a patologia ou o design experimental. Por exemplo, a normalização da resposta KCl elimina o peso e outras dimensões das tiras, e, assim, pode ser utilizado para comparar as respostas em tecidos onde a condição patológica pode aumentar o peso das tiras (por exemplo, diabetes aumenta a massa da bexiga). Além disso, a rerespos- ao KCl não é influenciada pela remoção da mucosa / urotélio 29, portanto, podem ser usados em experiências de avaliação diferentes componentes da bexiga (por exemplo, mucosa contra músculos lisos).
Em resumo, este método proporciona uma contratilidade abordagem rápida, fácil e muito poderosa para avaliar bexiga (e outros órgãos), fisiologia e farmacologia. Quando usado corretamente, fornece a capacidade de manipular o tecido em um ambiente reduzido e bem controlada. No estudo da função da bexiga urinária, este método foi fundamental para a descoberta e o teste de compostos correntemente utilizados para a gestão de OAB, tais como os antimuscarínicos e recentemente desenvolvido β 3 AR agonistas.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este estudo foi financiado pelo NIH R37 e R01 DK54824 DK57284 subvenções a LB.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 °C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and Surgical Instruments | |||
| Sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect, & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1 g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium chloride Potassium chloride Monobasic potassium phosphate Magnesium sulfate Dextrose Sodium bicarbonate Calcium chloride Magnesium chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
Referências
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados