Method Article
하부 요로 약리학을 평가하는 방법으로 방광 평활근 스트립 수축성
요약
이 원고는 약리학 제제 또는 신경 자극에 반응하여 평활근 수축을 평가하기위한 시험 관내 방법에있어서, 간단하지만 강력한을 제시한다. 주요 응용 프로그램은 약물 검사 및 이해 조직 생리학, 약리학, 병리학이다.
초록
우리는 체외 방광 평활근 수축을 측정하는 방법, 및 약리학 적 및 생리 평활근의 성질뿐만 아니라 병리학 적 변화에 의한 조사에 대한 사용을 설명한다. 이 방법은 수술 및 약리학 적 제제의 안정성 및 생존에 영향을 조작, 인체 조직의 사용 및 / 또는 고가의 화학 물질의 사용과 같은 생체 내 실험에서 발생 주요 방법론적인 어려움을 극복하면서, 방광 기능을 이해하는데 중요한 정보를 제공한다. 또한 건강하고 병적 조건의 각 방광 성분 (즉, 평활근, 점막, 신경)의 성질을 조사하는 방법을 제공한다.
방광은 마취 된 동물, 크렙스 용액에 넣고, 스트립으로 절단 제거한다. 스트립 따뜻한 크렙스 용액으로 채워진 챔버에 배치됩니다. 일단 아이소 장력에 부착수축력을 측정하는 n 개의 트랜스 듀서, 타단은 고정 된로드에 부착된다. 티슈 직접 목욕 또는 생체 내에서 방광 수축을 유발 유사한 신경을 활성화 전기장 자극 전극에 의해 화합물을 추가로 자극한다. 우리는이 방법의 사용은 발전 과정 및 실험 척수 손상 후 자발 평활근 수축을 평가 보여, 신경 전달 (관련된 송신기 및 수용체), 평활근 활성의 조절에 관여하는 인자의 성질, 개별 블래 성분의 역할 종 및 약리 에이전트에 응답 기관의 차이. 또한, 송신기는 릴리스 수축 및 / 또는 평활근의 이완, 약물 구조 활성 관계 및 평가에 관련된 세포 내 경로를 조사를 위해 사용될 수있다.
체외 평활근 수축 방법은 광범위하게 사용되어왔다 FO오십년 이상 R, 크게 방광 기능에 대한 우리의 이해뿐만 아니라 현재 방광 관리를 위해 임상 적으로 사용되는 화합물의 제약 발전에 기여 데이터를 제공하고 있습니다.
서문
방광 평활근 소변 제거를 유도하기 위해 소변의 저장을 허용하도록 완화하고, 계약. 휴식은 내장 평활근 속성으로하고 배뇨근 베타 아드레날린 수용체 (β 인간의 3 AR)을 활성화 교감 신경에서 노르 에피네프린 (NE)의 토닉 릴리스에 의해 매개된다. 보이드는 교감 입력을 억제하고 아세틸 콜린 / ATP는 방광 평활근 일을 계약을 해제 부교감 신경을 활성화함으로써 달성된다. 뇌 및 / 또는 척수 손상, 신경 변성 질환, 당뇨병, 방광 출구 폐색 또는 간질 성 방광염 등 다양한 병적 상태, 뿌리깊 수명이 환자의 품질에 심각한 영향을주지 않고, 방광 기능을 변경할 수있다. 평활근, 원심성 또는 구 심성 신경 및 / 또는 이러한 조건은 하나의 블래 더에 영향을 미치는 요소에 의해 평활근의 수축을 변경할점막.
생체 내 및 방광 기능을 연구하기위한 생체 외 방법에서 여러 가지가 개발되어왔다. 생체은 방광 내압 측정은 방광 기능의 기본 측정이다. 이는 생리적 조건 하에서 주변 정보의 수집을 허용 그대로 제제이더라도, 평활근 스트립의 사용이 바람직하다하는 상황들이있다. 이러한 수술 및 / 또는 약리학 적 조작이 생존과 생체 제제의 안정성, 또는 영향을 미칠 수있는 상황을 포함 연구는 인간의 조직 또는 고가의 화학 물질의 사용을 필요로 할 때. 이 방법은 또한 방광의 각 구성 요소에 대한 약물, 나이 및 병리 효과 시험을 용이하게, 평활근, 점막, 원심성 및 구 심성 신경 즉.
방광 스트립은 과학적 질문에 대답 할 수 많은 그룹으로 수년에 걸쳐 이용되어왔다. 그들은 에바에 사용되었다근원 성 자발적인 활동 luate 변경 병리에 의해 유도. 이 활동은 과민성 방광 (OAB)의 긴급 및 주파수 증상에 기여하는 것으로, 따라서 OAB 3-9 개발되고 약물의 대상이다. 방광 스트립 또한 이완 또는 평활근 수축를 유도하는 대상이 될 수있는 이온 채널 및 / 또는 수용체 및 / 또는 세포 내 경로를 발견 할 목적으로 평활근 톤을 변조 근육 조직 및 신경 세포의 요인을 조사하기 위해 사용 하였다 3,10- 13. 다른 연구는 병리 (14, 15)에 의해 유도 된 송신기와 관련된 수용체 및 변경을 포함하여 신경 전달 물질의 특성에 초점을 맞추고있다. 또한,이 방법은 장기 19-21과 약물 구조 - 활성 관계의 평가 사이 22-24, 16 종 (18)로부터의 조직 사이의 비교를 위해 사용되어왔다. 이 방법의 확장은 지표 성과 데 사용되었습니다원심성 신경 송신기 (25)로부터 방출에 약물의 효과를 전자. 또한, 조직 (방광, 요도, 위장관, GI) (연구 승인을 수술 또는 장기 기증 조직부터) 동물이나 인간에서 수확 및 척수 손상 (SCI), 방광 출구 폐색을 포함한 동물의 다양한 모델에서 다양한 (BOO), 간질 성 방광염 (IC)은이 기술을 이용하여 조사 할 수있다.
본 논문에서는 위에서 언급 한 여러 과학적인 문제를 해결하기 위해 필요한 실험 프로토콜과 함께이 방법의 사용을 예시한다.
프로토콜
여기에 설명 된 모든 절차는 피츠버그 대학에서 IACUC위원회에 의해 승인됩니다.
1 솔루션
- 법에 따라 크렙스 솔루션을 준비합니다. 염화나트륨 (118)의 KCl 4.7, 염화칼슘 1.9, 황산 1.2, 탄산 수소 나트륨 24.9, KH 2 PO 4 1.2, 포도당 11.7 : MM의 조성.
- 95 % O 2, 5 % CO 2 크렙스을 공급하십시오 및 실험을하는 동안 사용되는 37 ºC 물을 욕조에 넣습니다. 제쳐 놓고 ~ 실온에서 폭기 된 크렙스 용액 200 ㎖를 조직 절제술에 사용되는.
- 화난 크렙스의 산도 (~ 7.4)와 삼투압 (~ 300 mOsm)를 측정한다.
2 실험 장치 (회로도 그림 1A)
- (95 % O 2, 5 % CO 2) 10 ㎖의 크 레브와 챔버 화난 채 웁니다.
- 37 ° C에 챔버를 가열하는 순환 수 펌프를 시작합니다; 필요한 장비를 켜 : 앰프 (들), 자극 (들) 및 기록 소프트웨어입니다.
- 1g의 무게와 트랜스 듀서를 보정합니다.
3 조직 (그림 1B)
다음 단계 다음 (~ 10~12주 이전 200~250g) 성인 순진한 여성 스프 라그 돌리 쥐에서 방광을 제거
- 해부 영역과 필요한 장비 준비 : 전기 면도기, 치아 포셉, 메스 블레이드, 해부 가위, microscissors을,이 해부 집게, 조직 클립 (또는 실크 봉합사), 크렙스와 함께 실 가드 코팅 해부 접시 (저자는 뒤몽 집게 # 3를 선호) 조직 해부 핀입니다.
- 유도 챔버에서 흡입 이소 플루 란 (2 O 4 %)으로 동물을 마취. 마취 동안 건조 함을 방지하기 위해 눈에 수의학 연고를 사용합니다. 연속 호흡율, 외부 자극에 응답하고, 휘어진 인출 후방 사지의 손실을 관찰함으로써 마취의 레벨을 모니터링한다.
- 동물 면도 하복부 마취 할 때정말이에요. 중간 선 복부 절개를 통해 골반 장기 노출. 방광과 요도를 확인합니다. 근위부 요도에 가까운 방광 경부에서 절단하여 방광을 제거합니다. 화난 크렙스 솔루션을 가득 실 가드 코팅 접시에 즉시 조직을 놓습니다.
- 필요한 경우,이 시점에서 추가적인 조직을 제거 : 요도, 위장 (GI) 관 및 / 또는 전립선 조각 등
- IACUC 승인 된 방법 (예를 들면, 마취제 또는 과다 보조 방법이어서 질식 CO 2)를 사용하여 동물을 희생한다.
- 더 해부 조직을 안정시키기 위해, 방광 돔, 목, 및 요관을 통해 조직을 해부 핀을 삽입합니다. 조직을 늘리지 않습니다. 지방, 결합 조직, 근위부 요도, 요관하고있는 경우를 제거합니다.
- 플랫 시트를 만드는 돔 기지에서 방광을 열고 장막면이 아래 / 내강면을 위로 (그림 1B). 조직의 각 모서리에 해부 핀을 놓습니다. 방광 돔을 제거전자와 목 조직.
- 실험의 목적은 점막 (요로 상피 및 고유 층 - 다이어그램도 1C 참조)의 기여를 결정하는 경우 평활근 수축을, 함께 및 장착 점막없이 배뇨근 스트립의 특성을 비교한다. 이를 위해, 조직 스트립을 절단하기 전에 신중 홍채 해부 현미경 하에서 미세 가위 집게를 사용하여 스프링 점막층을 제거. 실험의 끝에, 점막의 완전한 제거를 확인하기 위해 H & E 염색 용 스트립을 고정한다. 이 절차는 쥐의 방광에 비해 마우스 방광에서 쉽게합니다.
- ~ 2 × 8mm (그림 1B)의 스트립으로 돔 기지에서 세로로 조직을 잘라. 넥타이 또는 각 스트립의 양단에 조직 클립을 첨부합니다.
NOTE : 한 래트 방광은 보통 4 스트립으로 절단 할 수 있지만, 스트립의 수는 증가하거나 감소 동물 / 방광 크기에 따라. - exper에 스트립 전송imental 실. 한 조직의 수축을 측정하는 힘 센서, 각 스트립의 끝과 고정 유리 / 금속 막대에 다른 연결합니다.
참고 : 조직 챔버의 크기 (20 ㎖의 이상으로 0.2 ml)에 따라 다릅니다. 쥐의 방광에 대한 일반적인 챔버 스트립이 완전히 용액에 침수 될 충분한 높이를 제공하는 5 ~ 20 ㎖의입니다. 일부 챔버 내장 자극 전극, 다른 사람 없습니다에게 제공됩니다. 케어 달리 전계 자극이없는 신뢰성, 전극의 모든 접속 상태가 양호한 것을 확인해야한다. - 베이스 라인 장력이 1g (~ 10 MN)이 도달 할 때까지 부드럽게 조직을 스트레칭하여 각 스트립에있는 힘의 정의 금액을 적용합니다. 처음에 조직은 기준선 장력의 감소로 기록되어있는 이완되는 경향이있다. 워시 조직은 약 및 따뜻한 폭기 크렙스를 사용하여 15 분마다 각 세척 후 1g 기준선 장력을 조정합니다. (기준 긴장이 안정적 조직 ~ 1-2 시간이나 때까지 평형을 허용즉, 더 이상의 조직 휴식).
- ~ 5 분간, 또는 고원 응답까지 조에 직접의 KCl (80 ㎜)에 추가하여 시험 조직 생존력이 도달된다. 고농도의 KCl에 대한 응답은 또한 실험 동안 또는 실험의 끝에서 반복 (데이터 해석 부 밑에 정규화 참조) 스트립 다른 약물에 대한 반응을 정규화 또는 사이에 사용될 수있다.
- 따뜻한 화난 크렙스 씻을 조직을 여러 번 (3-5x)는 조직 전처리 조건에 반환 할 수 있습니다.
4 자극 프로토콜
- 이러한 SCI, BOO 또는 신생아와 같은 다른 동물 모델에서 평활근 스트립을 사용, 자연, 근원 활동이나 평활근에 병리의 효과를 알아보고자 하였다.이 그림은 개발하는 동안 방광 자발적인 활동의 변화를 조사하기 위해이 방법을 사용하는 방법을 보여줍니다 및 SCI 후. 또한, 약학 제제는 SP를 변조하는데 사용될 수있다ontaneous 활동.도 3은 자발 활동 및 평활근 톤 KCNQ 채널 변조기, flupirtine 및 XE991,의 효과를 도시한다.
- 직접 정의 된 시간 간격으로 목욕 농축 원액으로부터 화합물을 첨가함으로써 약리학 평활근 자극 구조체 농도 반응 곡선. 차량 및 시간 효과를 설명하기 위해 병렬 스트립에 약물 및 차량을 사용합니다.
- 1000X 최종 작업 농도에서 원하는 시험 화합물의 원액을 확인합니다. 10-5 M, 3 × 10-5 M, 10-4 M, 3 × 10-4 M, 10-3 M, 3 × 10-3 M : 카바 콜 (CCH), 무스 카린 수용체 작용제를 들어, 다음과 같은 종목을 준비 10 -2 M. 욕실에서 최종 농도는 10 -5 M (그림 4C, D)에 10 -8 M이다. 10-8 M, 10-7 : 뉴로 메딘의 B (NMB), 봄베 신 수용체 서브 타입 1 작용제를 들어, 다음과 같은 주식을 준비M, 10-6 M, 10-5 M, 10-4 M, 10-3 M 및 욕조에 최종 농도 아르 10 -11 M에서 10 -4 M. CCH와 NMB 모두 조직의 수축력을 증가 할 것으로 예상된다.
- 응답이 고원 (그림 4C, D)에 도달로 10 ml의 조직 목욕하는 순간 각 CCH 원액의 10 μl를 추가합니다. 병렬 스트립에서 차량 (물)의 같은 양을 추가합니다. 마찬가지로, 각 뉴로 메딘의 B 원액의 10 ㎕의 모든 ~ 5 분을 추가합니다.
참고 : 그림 4 종에서 스트립의 평활근에 NMB와 CCH의 흥분성 효과를 관찰한다. - 흥분 에이전트, 일반적으로 CCH 또는 KCl을 사전 계약 조직의 평활근의 이완 특성을 조사합니다.
- 길항제 반응을 차단하는, 자극 작용제 전에 조직 침투를 허용하기 위해 길항제 10-20 분 동안 조직을 전처리.
- 신경 STIM을 위해평활근의 위험률도라는 전기장 자극 (EFS) 3.13에 단계 하나를 따라 아래에 설명 된대로 계속합니다. EFS는 선택적 평활근에 비해 신경을 활성화하기위한 것입니다. 자극 파라미터는주의 깊게 평활근에 직접 자극을 피하도록 선택되어야한다.
- 자극 매개 변수를 설정 : 아래 단계에 설명도 5A, B에 도시 된 바와 같이 자극 (단일 펄스 또는 기차), 기간 (펄스 지속 시간 및 열차 시간), 빈도와 강도의 유형을.
- 단일 펄스 자극, 세트 펄스 지속 시간, 간 자극 간격과 원하는 자극의 수하십시오. 통상, 자극 지속 기간 파라메터는 원하는 간격 (도 5a)에 전달 0.05-0.3 msec의 지속 기간의 하나의 펄스이다. 자극 강도에 대한 단계 4.3.1.4을 따르십시오.
- 기차 자극의 경우, 기차 시간 간 열차 간격을 설정합니다. 방광 조직에 대한 일반적인 값은 3-10 초는 적어도 1m를 전달떨어져에서 (그림 5B). 조직의 피로 (즉, EFS 수축 제어 기간 동안 감소)가 발생하는 경우, 간 열차 간격을 증가시킨다.
- 기차에서 펄스의 기차 자극의 주파수 (번호를 설정 - 그림 (b)). 0.5-50 Hz에서 범위의 주파수 응답 곡선을 실행. 방광의 일반적인 주파수는 ATP 및 아세틸 콜린에 의해 매개 재현하고 안정적인 수축을주고 10 ~ 20 Hz에서입니다. 이 방법은 콜린성 및 신경 전달에 퓨린 메커니즘의 기여를 평가하는 데 사용할 수있는 방법을 보여주는 그림 5에서 마우스 방광 스트립 EFS의 자극에 따라 주파수 응답을 관찰한다.
- 자극 강도를 확립 : 수축의 진폭이 정체기에 도달 할 때까지 (하여 열차의 주파수를 일정하게 유지하는 경우) 체계적 자극의 세기 (전압)을 증가시킨다.
- 에 따라 자극의 강도를 설정합니다실험의 목표로하고 있습니다. 목표 - 유발 신경을 수축을 증가시키는 경우, 수축의 진폭이 최대 수축 ~ 50 %가되도록 준 최대 강도를 사용한다. 목표 - 유발 신경을 수축을 감소시키는 경우, ~ 최대 진폭의 80 %가 조직의 피로를 방지하기 위하여 강도를 설정한다.
- 자극 매개 변수 (기간, 빈도와 강도)가 설립되면, EFS- 20 ~ 30 분 약물 검사 전에 안정 수축을 유발 ~ 수 있습니다.
참고 : (; 0.5 μM TTX) 신경 전송, 나 + 채널 차단제, 테트로도톡신와 블록 신경 전송을위한 EFS의 선택을 확인합니다. TTX 비교적 쉽게 떨어져 세척 같이, 실험의 시작에서이 단계를 수행한다. 또한, (단계 4.3.5 참조. 아래) 실험의 끝에이를 수행. - 최종 작업 농도가 1,000 배의 재고 솔루션을 준비 : 알파, 베타 - 메틸렌 ATP (ABMA, 퓨린 수용체의 활성화를및 desensitizer) 10 -2 M, 아트로핀 (무스 카린 수용체 길항제) 10 -3 M (그림 5C). 도 6에 다른 예를 관찰한다. 5HT4 수용체 작용제, 시사 프라이드 (3 × 10-6 M, 10-6 M을, 3 × 10-5 M, 10-5 M, 3 × 10-4 M을, 10-4 M, 3 × 10-3 M, 10-3 M)는, 조직 수축성 및 SB-203186 (3 × 10-3 M), 5HT4 수용체 길항제를 증가 시사 프라이드의 효과를 반전.
- EFS (그림 5C)에 ABMA의 효과와 아트로핀을 테스트하려면, 두 개의 제어 주파수 응답 곡선을 수행합니다. 10 μM의 최종 농도에 화장실에 10 -2 M ABMA의 10 μl를 추가합니다. 이는 평활근에 직접 퓨린 수용체의 자극에 조직을 수축한다. 기준에 대한 응답을 반환 한 후, 주파수 응답 곡선을 반복합니다. 최종 정광 10 -3 M의 아트로핀의 10 μl를 추가1 μM의 이온. (무스 카린 수용체를 차단하기 위해 필요한 아트로핀) ~ 10 분, 반복 주파수 응답 곡선 후. 병렬 스트립의 각 단계에서, 차량, 물 10 μl를 추가합니다.
NOTE :도 6의 다른 예를 들어, 정의 된 시간 간격들 (~ 15 분마다, 설명을 참조)에서 각 시사 프라이드 스톡 용액 10 μL를 추가 직접 조에 SB-203186 스톡 용액 10 ㎕를 다음과에 미치는 영향을 모니터링 수축을 EFS는 유도. 병렬 스트립에서 자동차, DMSO의 10 μl를 추가합니다. 시사 프라이드의 효과를 관찰,도 6 인간 방광과 회장 조직에서 EFS-유발 된 수축에 대한 5HT4 수용체 작용제는. 또한 인간 방광 및 회장 조직에서 EFS-유발 된 수축에 DMSO의 효과, 시사 프라이드 용 차량을 관찰 . - EFS 프로토콜의 끝에 나트륨 + 채널 차단제, 테트로도톡신 (TTX으로 신경 전달을 차단하여 EFS의 선택성을 확인; 0.5-1 &# 181; M). TTX에 강한 수축이 남아있을 경우, 이후의 실험에서 자극의 지속 시간과 강도를 조절하는 것이 좋습니다.
- 자극 매개 변수를 설정 : 아래 단계에 설명도 5A, B에 도시 된 바와 같이 자극 (단일 펄스 또는 기차), 기간 (펄스 지속 시간 및 열차 시간), 빈도와 강도의 유형을.
- 사전 또는 사후 시냅스 사이트 (그림 7A)를 약물의 효과를 결정하기위한 4.3.2 단계 1을 따르십시오. 카르 바콜하는 재현 응답을 설정하고 EFS는 다음 약물 X를 추가
- 실험의 끝에, 또는 클립을 풉니 스트립을 풀어, 여분의 유체를 제거하고 나머지를 사용하여 각 스트립의 중량을 측정하는 티슈 종이 위에 부드럽게 그들을시킨다. 또한 단면적을 결정하는 캘리퍼스를 사용하여 조직의 길이를 측정한다. 이 정보는 데이터의 정상화를 위해 사용된다 (5.4 절 참조).
(5) 데이터 분석
적절한 소프트웨어를 사용하여 데이터를 분석하여 (예를 들어, Windaq, LabChart).
- 자발적 활동의 경우, 이전과 약물에 의한 반응과 나의 절정에 적어도 30 초 창을 선택슈어의 진폭과 근육 조직 활동의 주파수 (그림 3).
- 방광의 다른 부분 사이의 차이가 수축 반응에 기여하고 있는지 여부의 주파수 스펙트럼을 결정하기 위해 고속 푸리에 변환 분석을 사용하여 (예를 들어, 목 대 돔) 또는 개발 병리 및 약물 8.
- 평활근 톤 효과 전에 약물 유발 반응의 피크에서, 적어도 10-30 초간의 윈도우를 선택 및 수축의 진폭을 측정한다.
- 신경을-유발 된 수축에 대한 효과를 위해 전 약물 유발 반응의 피크에서의 수축 곡선 (최소 3) 아래의 진폭, 지속 시간 및 면적을 측정한다.
주 : 퓨린 및 콜린성 다른 성분을 가지고 있기 때문에 반응 속도 EFS 유도 수축 곡선 아래의 면적 및 진폭 모두를 측정 할 필요가있다. 퓨린 성분이 빠르고 일시적인 (ATP는 purinergi를 활성화칼슘의 신속한 유입을 허용 같은 P2X1 C 등의 이온 성 채널, 그들은 이에 곡선 아래 면적에 대한 피크 진폭 응답에보다 덜 기여) 둔감. 콜린성 성분 (ACH 궁극적 수축을 유도하는 평활근 탈분극 이온 채널을 활성화 세포 내 경로를 활성화하기 위해 더 많은 시간을 필요로 대사 무스 카린 성 수용체를 활성화시킨다) 느리고 유지된다. 따라서, 무스 카린 성분 곡선 아래 면적을 측정하여 더 포착된다. - 스트립 및 약물 치료를 통해 결과를 비교할 수 있도록 데이터를 정규화한다. 정규화를 위해 선택된 파라미터는 병리학 적 조건이 연구 또는 실험 설계, 시험 화합물에 의해 좌우되어서는 안된다. 이러한 매개 변수를 사용 스트립 중량, 단면적, KCl을 응답 (도 4b), 다른 수축성 에이전트 최대 반응의 최대 반응 (도 7b) 또는 %의 % 중에서(예를 들어, CCH) 또는 편안한 에이전트 (예를 들어, 파파 베린).
결과
자발적인 근육 조직 활동
자발적인 근육 조직 활동은 출생 후의 개발 6-9 병리 (예를 들어, SCI, BOO) 3-5으로 변화를 겪는 중요한 평활근 특징입니다. 이 액티비티는 과민성 방광 (OAB) (2)의 증상에 기여하는 것으로 생각되기 때문에, 변조 수용체, 세포 내 경로 및 약리 제의 평가는 OAB 및 기타 평활근 장애에 대한 효과적인 치료법을 개발하기위한 높은 관심사이다. . 여기에 제시된 방법은 쉽게, 청소년이 질문을 조사이 신생아 (I)의 개발 과정, 근원 자연 활동의 다른 패턴을 보여줍니다 수 있습니다 그림 (II) 성인 (III)와 척수 손상 쥐 (SCI, ⅳ). 신생아 쥐에서 스트립은 큰 진폭, 낮은 주파수 리듬 수축 (그림 2AI)를 전시하면서 성인 쥐에서 스트립S는 작은 진폭 고주파 활성 (도 2Aii를, ⅲ) 나타낸다. SCI 후 신생아 패턴 (그림 2Aiv) 다시는-나온다. 동물 모델에서 스트립을 사용하는 것 외에도, 다양한 약리 제제는 자발적인 수축을 기본 메커니즘을 이해하기위한 목적으로, 동물로부터 순 스트립 자발적인 수축을 유도하는데 사용될 수있다. 적합한 약학 적 제제의 예로는 무스 카린 수용체 작용제 (카바 콜; CCH)를 포함한다. (예 : 아세틸 콜린 에스 테라 제 억제제) 아세틸 콜린의 수준을 증가 화합물의 KCl (예 : 20 mM)을하거나 다른 실험적인 약물의 낮은 농도를도 3A-B는, 변조를 도시 평활근에있는 KCNQ 채널에 작용되는 약물에 의한 자발적인 활동. KCNQ 채널 오프너가 flupirtine는, 농도 의존적으로 진폭 및 자발 활동의 빈도를 감소시킨다 (도 3Ai-III), 반면KCNQ 채널 차단제, XE991는, 진폭이 감소하지만 자발 활동의 빈도를 증가시킨다 (도 3Bi-III).
평활근
부드러운 근육 긴장과 수축 특성은 저장과 배뇨 중 방광의 적절한 기능을 위해 중요한 요소입니다. 이 방법은 평활근 톤되는 약물의 효과를 스크리닝을 쉽게 할 수있다. 피규어 3Aiv 및 3Biv가 flupirtine는 평활근 이완에 부합 기저 톤을 감소한다는 것을 보여 XE991 증가 평활근있다. 4 평활근 톤의 농도 의존성 증가를 도시 한 도표 뉴로 메딘의 B와 수용체를 활성화하여 봄베 (NMB, 그림 4A, B) 또는 무스 카린 수용체 카바 콜과 (CCH,도 4C, D). 또한, 이러한 평활근 반응을 매개하는 세포 내 경로 유를 조사 할 수 있습니다특정 노래를 변조기 (데이터는 도시하지 않음).
신경을 매개 응답 및 신경 전달 물질의 변조
방광 수축은 부교감 원심성 신경에서 아세틸 콜린 / ATP의 방출에 의해 달성된다. 방광 수축 무스 카린 및 퓨린 시스템의 기여는 간질 성 방광염, 부분 출구 폐색과 과민성 방광 (26) 등의 병리에서 퓨린 기여 주된 증가, 종 및 병리학 적 조건들에 따라 다릅니다. 그림 5c는 성을 결정하는 방법을 사용하는 방법을 보여줍니다 무스 카린 및 퓨린 성분의 기여는 마우스에서 방광 스트립에서 신경 전달한다. 콜린성 성분의 기여도는 아트로핀을 무스 카린 수용체 길항제를 사용하여 평가 하였다. 퓨린 시스템의 기여는 퓨린 성 수용체 활성화와 desensitizer 알파를 사용하여 평가하고, 베타 - 메틸엔 ATP (ABMA). 또한, 각 성분의 주파수 의존 기여 둘러부터 고주파수 (2-50 Hz에서) 자극에 주파수를 변화시킴으로써 평가되었다.
방광 수축의 강도를 효율적으로 배뇨에 중요한 역할을한다. 이 방법을 사용하여, 신경 전달을 조절하는 수용체 및 경로는 장애를 무효화에 대한 약물 표적으로 조사 할 수있다. 5HT4 수용체는 부교감 신경에 미리 junctionally 표현의 활성은 아세틸 콜린 수준 (27)을 증가시킨다. 6 인간의 방광 및 회장 스트립 5HT4 수용체 작용제, 시사 프라이드의 흥분 효과를 보여줍니다.
각종 실험 프로토콜은 시험 화합물의 작용 부위를 결정하기 위해 사용될 수있다. 도 7A의 다이어그램 대 전 후 접합부 사이트를 평가하는 데 사용되는 프로토콜을 나타낸다. 약물 X는 감소 (또는 증가) EFS 응답을하지만 effec가없는 경우CCH 응답에 t, 액션의 가능성이 가장 높은 위치는 미리 접합부이다. 약물 X 변하는 경우 모두 EFS와 CCH 응답하는 경우, 그것은 포스트 junctionally 또는 둘 모두 사전 및 사후 junctionally있는 수용체에 작용 할 수 있습니다.
각 구성 요소의 역할 : 평활근, 점막 및 신경
다른 병리학 적 조건은 방광의 다양한 구성 요소에 영향을 미칠 수있다. OAB가 변경된 평활근 수축이 발생할 수 있습니다 예를 들어 간질 성 방광염 (IC)는 주로 요로 상피에 영향을 미칩니다. 또 다른 수용체가 방광 각 구성 요소로 표현 될 수 있고, 따라서 구체적으로 특정 병리학에 타겟팅 될 수있다. 모든 블래 성분 순 효과를 측정 생체 내 방법과 반대로,이 방법은 시험 관내 및 약리학 적 수술 절차의 조합을 사용하여 특정 성분의 조사를 허용한다. 신경이없는 상태에서 부드러운 근육의 수축 / 이완을 테스트하려면변속기, TTX (0.5-1 μM)를 욕조에 첨가 될 수있다. 도 4에서, NMB 및 CCH는 TTX의 존재하에 시험 하였다. 평활근 수축에 점막 (요로 상피 및 고유 층)의 기여를 테스트하기와 점막층없이 스트립. 비하여도 7b는 CCH에 응답 돼지 28 점막의 존재 하에서 감소되는 것을 알 수있다. 비슷한 결과는 인간의 방광 스트립 (29)에보고되었다. 신경 섬유의 역할을 시험하기 위해, 여러 접근 방식이 촬영 될 수있다. 하나는 활성화 또는 약리학 적 제제를 사용하여 특정 섬유를 억제하는 것이다. 예를 들어, 캡사이신은 구 심성 신경의 특정 인구를 활성화하고 종에게 의존 평활근 수축 또는 이완 (17, 18)이 발생합니다. 구아 네티 딘 따라서 이들 섬유의 기여를 제거, 교감 신경 섬유에서 노르 에피네프린의 방출을 억제한다. 또 다른 방법은 / 둔감 생체 내에서 특정 섬유를 제거하는 것실험에 앞서. 예를 들어, 캡사이신과 동물의 전신 치료는 캡사이신 성 구 심성 신경 둔감. 이 준비를 연구 할 수있는 다른 방광 구성 요소가 활성화 또는 특정 에이전트와이를 차단하여 간질 세포 또는 갭 접합입니다.
종의 차이
대부분의 신약 개발은 인간 질병의 치료를 위해 의도되지만, 기초 연구는 주로 동물 조직에서 수행된다. 종의 차이는 수용체의 숫자에 존재한다. 예를 들어,-HT4 수용체 작용제는 인간의 방광에 신경을 - 유발 수축을 강화하지만 쥐의 방광 19,30에서 EFS에 의한 수축이 안정 방광 31에서 인간과 구대륙 원숭이 배뇨근에서 거의 독점적으로 아트로핀를 구분하지만, 부분적으로 될 수있는 것은 아닙니다 아트로핀 저항하는 인간의 배뇨근 불안정 방광 조건 (예, 신경 인성, obstructe 환자에서D 방광) 15,32,33은 캡사이신은 쥐와 인간의 방광 스트립의 흥분 반응, 돼지 방광 스트립 기니 돼지 방광 스트립 (17, 18)의 억제 반응에 어떤 반응을 이끌어 낸다. 수용체 작용제를 봄베 신에 흥분 효과를 4는 그림 쥐의 방광 및 마우스와 돼지 방광 스트립 (16)에 대한 효과없이. 이 정보는 특정 수용체를 연구에 적절한 동물 모델을 선택하기위한 중요하다.
장기에 걸쳐 감도의 비교
방광 질환의 치료를위한 약물의이 방법은면에 의해 서로 다른 조직에게 측과 비교하여 약리 에이전트 장기 선택성 및 감도의 추정을 허용 등 위장관, 요도, 담낭, 다른 장기로부터 평활근에 영향을 미칠 수있다. 시사 프라이드도 6, 5HT4 수용체 작용제에 도시 된 바와 같이 다를 수있다회장 조직 대 인간의 방광 엔트 효과와 효능.

실험 장치의 그림 1 실험 설정 및 방광 스트립 준비.) 도식. 방광 스트립은 37에서 폭기 크렙스 용액으로 채워져 조직 챔버에 보관 잠겨있다 순환 수 펌프를 통해 C를 °. 스트립의 일단에 고정 된 봉, 다른 조직의 수축을 측정하는 메트릭 힘 센서에 부착된다. 힘 센서가 데이터 기록을위한 증폭기 및 컴퓨터에 접속된다. 자극기에 연결된 전계 자극 전극을 챔버에 넣고, 신경을 매개 된 방광 수축을 불러 일으키는 사용된다. 조직 스트립 B)의 제조. 방광은 접시에 아래로 고정되어 다음과 같은 절차가 수행됩니다 # 1 수직 절단 일을요도에서 돔 방광의 ough 복부 절반 플랫 시트로 방광을 엽니 다. # 방광 / 근위부 요도의 돔과 받침대를 제거 할이 수평 잘라냅니다. . 스트립 구성 요소 # 동일한 스트립으로 중반 방광을 나누어 3 세로 인하 (쥐의 방광에서 4 스트립) C) 설계도 : 부드러운 근육과 점막 모두 포함 심성 (파란색)와 원심성 (녹색) 신경. 점막은 요로 상피와 고유 층으로 구성되어 있습니다. 고유 층 혈관 [1], [2] 간질 세포를 포함하고, 점막 하층 우세 [3]. # 1 2B 표시된 점선은 점막 층을 제거하는 절차를 의미합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

개발 과정 및 이후 2, 근원 자발적 활동을 그림병리.) 신생아 (내가 자발적 활동의 예), 부상당한 청소년 (II), 척수 손상 성인 (III)와 척수 (SCI) 성인 (IV) 쥐의 방광을 제거합니다. SCI 쥐를 조사 넷 그룹의 진폭 (B) 및 자연 수축의 빈도 (C)의 수술. B, C) 요약 한 후 사주에 사용되었다. (Artim DE, Kullmann FA, Daugherty SL, Bupp E, 에드워즈 CL, 드 거칠게 빻은 화장실의 허가를 재현 Neurourol Urodyn 십일 2011, 30 (8) :.. 1666년부터 1674년까지.) 이의 더 큰 버전을 보려면 여기를 클릭하십시오 그림.
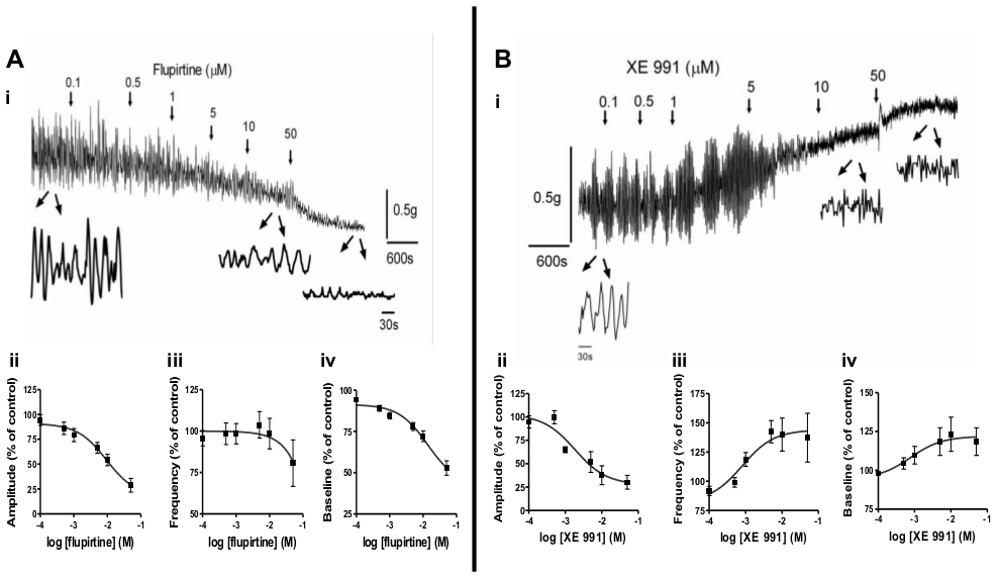
자발적인 활동 근원 성 평활근 톤의 변조도 3. A) KCNQ 채널 오프너의 효과 flupirtine, 자발적인 활동과 성인 쥐의 방광 스트립 기준 톤. (ⅰ) Flupirtine은 화살표로 나타낸 시간에 농도 (누적)을 증가 첨가 하였다. 제어시 및 10 μM과 50 μM의 flupirtine의 신청 후 스트립 활동의 추적 쇼 4 분에서 확대 한. 진폭 (II-IV) flupirtine 효과의 요약 (4 래트에서 7 스트립) (ⅱ) 및 (ⅳ), 제어 (프리 약물) 값에서 % 변화로 표현 (ⅲ) 자발적인 활동과 기준 톤의 주파수 , 이는) 100 %. B로 자발적인 활동 성인 쥐 방광 스트립 기준선 톤 KCNQ 채널 차단제, XE991,의 효과를 설정 하였다. (ⅰ) XE991은 화살표로 나타낸 시간에 농도 (누적)을 증가 첨가 하였다. 추적에서 확대 한 제어시 및 10 μM과 50 μM의 XE991의 신청 후 스트립 활동의 2 분을 보여줍니다. 에 (II-IV) XE991의 효과 요약 (4 쥐 구 스트립)진폭 (II) 및 주파수 (III) (IV), 100 %로 설정되었다 제어 (미리 약물) 값에서 변화 %로 표시 자발적인 활동과 기준 톤의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오 .

쥐의 방광 스트립 B (NMB) 뉴로 메딘 봄베 신 수용체 작용제 님의 그림 4 종의 차이.) 농도 의존적 평활근 수축,,. B) 쥐의 방광 스트립의 평활근 수축에 NMB의 효과를 요약. 데이터의 KCl에 정규화 (80 mM)을 응답. C, D) 마우스 (C)와 돼지 (D) 방광 스트립 NMB에 대한 응답의 부재. 카르 바콜 (CCH)은 강한 농도 의존적 죄수를 이끌어스트립 자극에 반응 할 수 있음을 나타내는 두 마우스와 돼지 스트립 트랙션. TTX (0.5 μM)는 모든 스트립에있는 화장실에 존재했다. (. Kullmann FA, 멕 케나 D, 웰스 GI, 토르 KB 신경 펩티드 2013 10월의 허가를 재현, 47 (5) :. 305-13) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
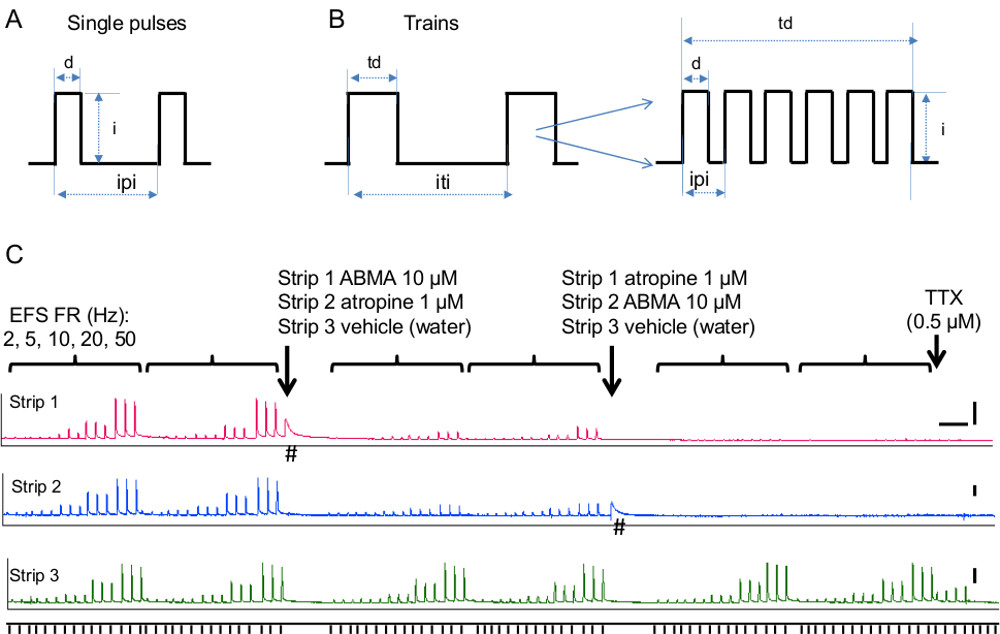
단일 펄스 자극 매개 변수의 그림 5 전기장 자극.) 도식. 약어 : D = 펄스, 난 기간 = 펄스의 강도, IPI = 간 펄스 간격 B) 도식 기차 자극 매개 변수.. 약어 : TD = 기차 시간, I = 펄스의 강도, ITI는 간 열차 간격을 =. 삽입 된 기차에서의 펄스의 수와 간격 betw을 보여줍니다함께 열차 길이와 열차 자극의 주파수를 결정하는, 그들을 EEN. C) purinegic 및 콜린성 구성 요소의 기여도는 방광 수축을 유발하는 신경을 -. EFS-FR 자극 주파수, 2, 5, 10, 20, 50 Hz에서 나타낸다. 매 90 초 세 자극 전달은 각 주파수에 대해 시험하고, 각 주파수의 일련의 제어와 번에 두 번 화합물을 첨가 한 후에 반복 하였다. 알파, 베타 - 메틸렌 ATP는 ABMA은 (스트립 (1)), 퓨린 성 수용체와 아트로핀 (스트립 2) 무스 카린 수용체를 차단하는 데 사용 된 감도를 떨어 뜨리는 데 사용 된 약칭. 스트립 (3)은 대조군으로 차량을 물로 처리 하였다. 각각의 화합물은 각각 스트립에 첨가했을 때 화살표는 시간을 나타낸다. 차량의 영향을받지 않는 반면 EFS-유발 수축이 강하게 ABMA 및 아트로핀에 의해 감소합니다. EFS는 20 Hz로 전달하면서 TTX는 실험의 끝에 첨가 하였다. 컨트롤에 관찰 나머지 수축을 참고스트립 3 (교내 신경에서 송신기 릴리스에 의해 시작된 즉) 자신의 신경 성격을 보여 TTX에 의해 폐지되었다. #은 EFS의 부재에서 ABMA에 평활근 응답을 나타냅니다. 스케일 바는 x 축에 대한 5 분 및 y 축에 대한 2g입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 - 유발 신경을 방광 수축의 변조 6. A, B) 5HT4 수용체 작용제에 의해 유발 된 신경을 수축 - 강화로서는, 인간 방광 (A) 및 회장 스트립 (B)에서 시사 프라이드. 시사 프라이드 (블랙 레코드) 또는 DMSO (회색 레코드)는 화살표로 나타내는 시간에 농도 의존적으로 첨가 하였다. 각 패널의 레코드 아래에 검정색 막대20 Hz에서 매 120 초에 전달 10 초 열차로 구성 EFS는 나타냅니다. 수직 스케일 바는 모든 예는 1g이다. TTX 농도는 0.5 μM 방광 스트립 (C, D) 및 회장 스트립에서 시사 프라이드 (검은 막대) 또는 DMSO (회색 막대)에 대한 응답 곡선 EFS-유발 수축 (AUC)에서 지역의. CF) 요약 (E이었다 , F). CF에서, SB는 5HT4 수용체 길항제의 첨가 후 얻어진 데이터의 개요를 나타내는, SB-203186 약자. 점선은 100 %로 설정하고 제어를 표현한다. (Kullmann FA 구리하라 R, 예 L, 웰스 GI, 멕 케나에 DG, Burgard EC, 토르 KB 허가를 재현 Auton Neurosci 앤젤레스 LAX 176 (1-2) :... 70-7) 을 보려면 여기를 클릭하십시오 이 그림의 큰 버전.
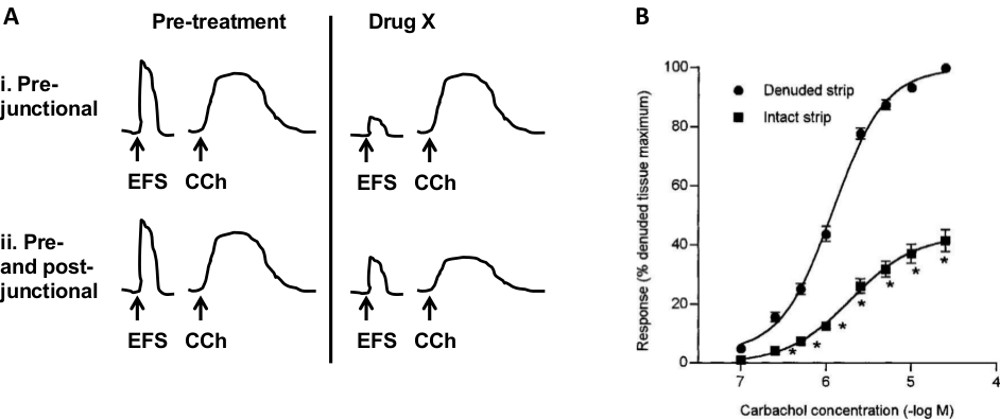
인터넷약물의 작용 부위를 식별하기위한 약물과 방광 gure.의 다른 구성 요소의 역할에 대한 행동의 7 사이트) 프로토콜의 개략도. 스트립은 ESF 및 카바 콜 (CCH)로 자극한다. 내가 마약 X에서 행동의 사전 접합부 사이트를 나타내는 EFS 응답 있지만 CCH 응답을 줄일 수 있습니다. 2에 약물 X 포스트 접합부 또는 둘 모두 사전 및 사후 접합부 수용체에 대한 작업을 나타내는 두 응답을 변경합니다. B 평활근 수축에 점막)에 영향을 미친다. 카바 콜의 효과 (무 결함) 제거 점막 스트립에 비해 점막 본 (그대로)와 스트립에 감소된다. (. B는 호손 MH, 채플 CR, 수탉 M, 체스 윌리엄 R. 브롬 J Pharmacol 2000 2월 허가를 재현, 129 (3) : 416-9). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 논문에서는 방광 생리학 및 병리학뿐만 아니라, 방광 기능 장애를 치료하기위한 새로운 약물의 발견을 돕는 관련된 중요한 과학적 문제들을 해결하는데 사용할 수있는 시험 관내 평활근 수축 방법에서 간단한 설명. 우리는 방광 평활근 수축의 발달 병리학 적 및 약리학 적 특성 (그림 2-4), 신경 전달 변조 (그림 5-7A), 종의 차이 (그림 4), 장기의 차이를 평가하는이 방법의 사용을 설명했다 (그림 6) 특정 성분의 방광 관련성 (예를 들어, 점막,도 7b). 여기에 도시되지 않은 부가 기능이 추가되는 약물 3,10,11, 다양한 약 22 ~ 24, 또는 평가 / 송신기 rele의 정량 구조 - 활성 관계를 이용하여 세포 내 경로의 평가를 포함신경 자극 25 후 ASE.
방광 기능이 궁극적으로 생체 내에서 평가 될 수 있지만,이 체외 방법은 생체 내에서 문제가 많은 상황을 극복한다. 이러한 수술 및 약리 조작이 생존 및 / 또는 기관 또는 동물, 인간 조직의 사용의 생존율을 감소시킬 수있는 상황을 포함 할 필요는 식별하고 구체적인 구성 요소 (신경 대 상피 비교 예 평활근의 응답을 특성화 ) 또는 고가의 화학 물질의 사용. 방법은 평활근 수축 활성에 및 잘 제어 된 방식과 환경의 체계적인 다양한 약리 제의 효과의 조사뿐만 아니라 병리를 허용한다.
이 방법은 정보의 과다를 제공합니다; 해석하고이 정보를 추정하는 경우에는주의를 기울여야합니다. 이 감소 된 준비 체외 방법, 창피하다정상적인 환경과 신경 제어에서 연결되어 있습니다. 실험 조건은 따라서 데이터가 완전히 생체 내 생리 학적 상황에 반영하지 않을 수 있습니다, 생리적 없습니다. 예를 들어, 상기 방법은 혈류, 호르몬, 체액 성 물질, 외부 기계적 힘 또는 외인성 신경 제어의 변화를 설명 할 수 없다. 조직 심하게 따라서 부상 및 허혈과 관련된 응답이 평가되고 고려 될 필요가 분산된다. 그들은 이미 심성, 평활근, 점막 또는 교내 신경 기능 (즉, 세포 가소성)을 변경하지 않는 한 뇌 또는 척수에서 발생하는 병적 인 변화는이 방법을 사용하여 테스트 할 수 없습니다. 전기장 자극 (EFS)는 신경을 매개 반응의 평가를 할 수 있습니다. 배뇨 반사는 단지 특정 pathw을 활성화 생체 내 상황에 반대하지만, 스트립 (예를 들면, 교감, 부교감, 구 심성)에 무차별 모든 신경 흥분AYS. 이러한 상황을 극복하는 한 가지 방법은 서로 다른 경로를 선택적으로 차단하는 특정 길항제 EFS를 결합하는 것이다. 예를 들어, 구아 네티 딘은 수축 특성을 연구 할 때 노르 에피네프린의 방출을 차단하기 위해 이용 될 수도 있고, 아트로핀이 완화 특성을 연구 할 때 방광 수축을 방지하는 무스 카린 성 수용체를 차단하기 위해 사용될 수있다. 마지막으로, 조직의 생존력은 특정 시간으로 제한된다. 일반적으로 방광 조직의 대부분의 구성 요소는 6-8h 이상에 걸쳐 (열화없이 EFS 반응에 반응, 즉) 실용적이고 안정하다. 그러나, 다른 조직이 더 민감 할 수있다 (; 필자 개인의 경험을 예를 들면, 회장이 ~ 6 시간 이하로 지속).
이 방법은 기술적으로 가능하고 재현성이지만, 그것의 성공을 보장하는 데 필요한 몇 가지 중요한 단계가 있습니다. 첫째, 조직의 준비가 필요 변경하여 생존을 보장하기 위해 신중하게 수행해야합니다박리 절차 상이한 조직 유형 또는 종 필요한 경우 및 / 또는 매체 (스트립을 준비하는 동안 조직을 피 연신). 또 다른 중요한 단계는 설정 접속되어 천정 효과가 회피되도록 신경 자극 파라미터. 방법 섹션에서 설명 된 바와 같이,이 시험 화합물의 작용의 실험 수행 예상기구의 종류에 따라 달라진다. 예를 들어, 방광 스트립에, (그림 6) 시사 프라이드, 5HT4 수용체 작용제의 효과를 테스트하기 위해, 우리는 최대의 ~ 50 % EFS-유발 수축의 진폭을 설정합니다. 이것은 즉 차례로 EFS-유발 된 수축을 증가시킬 것으로 예상된다 미리 접합부 부교감 신경 27에서 아세틸 콜린의 방출을 향상 5HT4 수용체 작용제의 작용의 공지 된 메카니즘에 기초 하였다. 신경 대 근육의 자극은 EFS-유발 수축을 억제한다 따라서 신경 전달을 억제하고 TTX를 사용하여 테스트해야합니다. 차량과 팀을 위해 적절한 제어E는 시간과 조직의 열화를 고려하여 약물 검사시 차량의 어떤 가능한 효과에 대해 수행되어야한다. 예를 들어, 많은 약물은 DMSO 또는 에탄올에 용해된다. 우리의 데이타 (도 6)을 DMSO (0.1 % 이상)은, 시험 약물의 영향으로부터 감산해야 효과 - 유발 신경을 수축을 증가시킬 수 있음을 보여준다. 마찬가지로, 에탄올 (최대 1 %) 자연 평활근 수축을 감소 시키지만, 신경을 - 유발 수축 (34, 35)에 영향을주지 않습니다. 유전자 조작 동물이나 수술 모델 (예를 들면, 척수 손상 또는 난소)을 사용하는 경우, 컨트롤은 각각 적절한 배경 마우스 변형 또는 허위 조작 동물에서 조직을 포함해야한다. 또한, 같은 인간, 마우스 및 기니 돼지 방광과 같은 일부 조직, 교내 신경절이 포함되어 있습니다. 이러한 조직과 작업 할 때, 프로토콜 선택 및 데이터 해석은 교내 북동에 약 또는 EFS의 계정 효과를 고려해야합니다상기 평활근을 자극 urons.
, 실험 프로토콜 설계 테스트 할 (약물 자극에 대해 EFS에 대한) 적절한 매개 변수를 선택하고 농도는 의미있는 데이터를 확인하는 것이 중요하다. 매개 변수는 개별 조직과 마약, 일반 원칙에 따라 조정해야하지만 / 아래에 설명 된 지침을 적용 할 수 있습니다. 누적 농도 반응 곡선 그러나이 모든 화합물 불가능 바람직하다. 이러한 조직 (예 ACH)에서 빠르게 대사된다 purineric 이온 성 수용체 (P2X) 또는 의약품 등의 둔감 수용체를 표적 약물 확실 동일 조직에서 누적 농도 반응 곡선을 사용하여 테스트 할 수 없다. 이 경우, 하나의 농도는 조직의 다른 그룹에서 테스트됩니다. 탈감작을 평가하기 위해서는 누적 농도의 말에 달성 한 것에 높은 농도에 의해 유도 된 반응의 크기를 비교하기 위해 권장응답 곡선.
농도 반응 곡선으로부터 얻어진 데이터의 정확한 맞춤의 경우, 반 로그 농도 (도 6의 예 CCH)을 테스트하는 것이 바람직하다. 조직의 생존 능력이 제한 될 수 있습니다 또는 다른 제약이 제자리에있을 수 있습니다 그러나, 로그 농도 (그림 4A 예 NMB)는 허용됩니다.
신규 한 화합물의 농도 범위를 선택하기 위해, 예비 실험에서, 이는 두 개의 전원 (10)의 농도가 그 상하 및 시험 화합물의 결합 친화도를 고려하는 것이 유용하다. 후속 실험에서, 프로토콜은 약물의 효과가 관찰되지 시작점과 응답이 최대 없거나 시험 농도가 더 이상 의도 된 표적에 특이 어느 종점을 결정하기 위해 정제된다.
a) 시간에 대해 : 약물을인가하기위한 시간 간격을 고려하여 여러 가지 요인을 고려하여 선택되어야한다약은 효과가 있습니다. (- 3 시간 30 분) 막 수용체를 표적 일반적인 의약품 세포 내 표적에 대한 약물 반면 (예를 들면, 포스 콜린 및 기타 효소 저해제 (36), 보툴리눔 독소 37)이 추가로 배양 시간을 필요로, 상대적으로 빠른 응답 (분, 초)를 가지고있다. 또한, 조직 두께는 역할을 할. 나) 기간 및 약물의 작용 메커니즘입니다. 예를 들어 약물의 효과는도 6과 같은도 4a에 NMB로지지되어 고원 및 시사 프라이드에 도달 할 때, 약물 애플리케이션 간의 5-15 분의 시간 간격은 충분한 데이터를 수집하기 위해 적합하다. 이 약물은 행동이나 행동의 다른 메커니즘 (ATP, CCH)의 더 짧은 지속 시간을 갖는 것은 불가능하다. 예를 들어도 4c 또는 4d에 CCH의 효과가 급격 고원 도달하지만 조직 장력은 기준선으로 복귀하는 경향이있다. 이 경우, 시간 간격이 따라 조정해야제 1 응답이 최대에 도달 할 때 LY는, 일반적으로 다음의 농도를 첨가.
데이터 분석 스트립 사이의 비교를 허용하는 데이터의 정규화는 특히 매우 중요한 단계이다. 다른 연구는 다른 수축 에이전트 (예를 들어, CCH 38)에 대한 최대 응답의 최대 반응 또는 28 %의 스트립 무게 38, 스트립 단면적 39, KCl을 응답 12 %를 포함하여 정상화 다른 매개 변수를 사용합니다. 정규화 파라미터는 실험의 목적에 따라 선택되어야한다, 매개 변수가 시험 화합물, 또는 병리학 실험 디자인에 의해 좌우되지 않도록. 예를 들어, KCl을 응답으로 정규화 중량과 스트립의 다른 차원을 제거하고, 이에 병적 상태가 스트립 (예, 당뇨병 방광 질량 증가)의 중량을 증가시킬 수있다 여기서 조직에서의 응답과 비교하는데 사용될 수있다. 또한, 재KCl을 행 sponse가 점막 / 요로 상피 (29)의 제거에 의해 영향을받지 않는다, 따라서 방광 (예를 들면, 점막 대 평활근)의 다른 구성 요소를 평가의 실험에 이용 될 수있다.
요약하면,이 수축 방법은 방광 (및 기타 기관)의 생리 및 약리학을 평가하는 빠르고, 쉽고 매우 강력한 접근 방식을 제공합니다. 적절하게 사용하면 감소하고 잘 제어 된 환경에서 조직을 조작하는 능력을 제공한다. 방광 기능의 연구에서,이 방법은 항 무스 카린 등 현재 OAB 관리에 사용되는 화합물의 발견 및 테스트 수단이 새로 3 AR 작용 물질 β 개발되었다.
공개
저자는 그들이 더 경쟁 금전적 이해 관계가 없다고 선언합니다.
감사의 말
이 연구는 (LB)에 NIH R37 DK54824 및 R01 DK57284 보조금에 의해 지원되었다
자료
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and surgical instruments | |||
| sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium Chloride Potassium Chloride Monobasic Potassium Phosphate Magnesium Sulfate Dextrose Sodium Bicarbonate Calcium Chloride Magnesium Chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
참고문헌
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유