Method Article
下部尿路薬理学を評価するための方法として膀胱平滑筋収縮ストリップ
要約
この原稿は、薬理学的薬剤または神経刺激に応答して平滑筋収縮性を評価するためのインビトロの方法で 、シンプルでありながらパワフルなを提示します。主な用途は、薬物スクリーニングと理解組織生理学、薬理学、病理学である。
要約
私たちは、 インビトロ膀胱平滑筋の収縮性を測定する方法、及び生理学的および薬理学的な平滑筋の特性ならびに病理学によって誘導された変化を調査するためのその使用を記載している。この方法は、外科的および薬理学的調製物の安定性および生存に影響を与える操作が、ヒト組織の使用、および/ または高価な化学物質の使用のようなin vivo実験において遭遇する主要な方法論的な困難を克服しながら膀胱機能を理解するための重要な情報を提供する。また、健康的で病的状態で各袋コンポーネント( すなわち 、平滑筋、粘膜、神経)の特性を調べるための方法を提供します。
膀胱は、麻酔した動物から取り出しクレブス溶液中に入れ、ストリップに切断される。ストリップは温かいKrebs溶液で満たされたチャンバ内に配置されている。一端はアイソメトリックtensioに取り付けられている収縮力を測定するためのn個のトランスデューサ、他端が固定されたロッドに取り付けられている。組織を直接浴にまたはインビボで膀胱収縮をトリガーに似神経を活性化する電場刺激電極によって化合物を添加することによって刺激される。個々の膀胱の成分の役割は、平滑筋活性の調節に関与する因子、発達中および実験的脊髄損傷後の神経伝達(関連する送信機および受容体)の性質を自発的平滑筋収縮性を評価するために、この方法の使用を実証する、と種との薬理学的薬剤に応答して、臓器の違い。さらに、それは伝達物質の放出の収縮および/または平滑筋の弛緩、薬物の構造活性相関評価に関与する細胞内経路を調査するために使用することができる。
in vitroでの平滑筋収縮法がfoは広く使用されている50歳以上のR、および大幅に膀胱機能の理解にも同様に、現在膀胱管理のために臨床的に使用される化合物の医薬開発に貢献したデータを提供してきました。
概要
膀胱平滑筋は、尿貯蔵及び契約は、尿排泄を誘発することができるように緩和する。リラクゼーションには、固有の平滑筋の特性によっておよび排尿筋におけるβアドレナリン受容体(ヒトにおけるβ3 AR)を活性化する交感神経からのノルエピネフリンの持続放出(NE)によって媒介される。排尿は、交感神経入力を抑制し、膀胱平滑筋1を収縮させるアセチルコリン/ ATPを放出する副交感神経を活性化することによって達成される。脳および/ または脊髄損傷、神経変性疾患、糖尿病、膀胱出口閉塞または間質性膀胱炎を含む多くの病理学的状態は 、重度の生命2の患者の質に深刻な影響を与え、膀胱機能を変化させることができる。平滑筋、求心性または遠心性神経および/またはこれらの条件は、膀胱の1つ以上の構成要素に影響を与えることにより、平滑筋の収縮性を変化させる粘膜。
膀胱機能を研究するin vivoおよびin vitroの方法にはいくつか開発されている。 インビボでは 、膀胱内圧測定は、膀胱機能の主要な測定である。これは生理的条件に近い条件下での情報の収集を可能にする無傷製剤であるが、平滑筋ストリップの使用が優先される状況が多数ある。これらは、外科的および/ または薬理学的操作は生存およびインビボでの製剤の安定性、または影響を与える状況を含む研究は、ヒト組織または高価な化学薬品の使用を必要とする場合。この方法はまた、膀胱の各コンポーネントに対する薬剤、年齢や病状の効果の検討を容易にする平滑筋、粘膜、求心性及び遠心性神経、すなわち 。
膀胱ストリップは、科学的な質問の数に答えるために、多くのグループによって長年にわたって使用されてきた。彼らは、エヴァに使用された病理学によって誘導された筋原自発活動のluate変化。この活動は、過活動膀胱(OAB)の緊急性と周波数の症状に寄与すると考えられ、したがって、OAB 3-9のために開発されて薬物のための標的である。膀胱ストリップはまた、イオンチャネルおよび/ または平滑筋の弛緩または収縮のいずれかを誘導するために標的化され得る受容体および/ または細胞内経路を発見する目的で、平滑筋緊張を調節する筋原性および神経因子を調査するために使用された3,10- 13。他の研究では、送信機及び受容体関与しており、病理14,15によって誘導された変更を含む、神経伝達の性質に焦点を当てている。さらに、この方法は、器官19-21、および薬物の構造活性相関の評価の22〜24の間、異なる種からの組織の16〜18間の比較のために使用されてきた。この方法の拡張は、MEASURするために使用されている遠心性神経25から伝達物質の放出に対する薬物の効果を電子。さらに、組織(膀胱、尿道、消化管、GI)(研究のために承認手術または臓器ドナー組織からの)動物またはヒトから採取し、脊髄損傷(SCI)、膀胱出口閉塞などの動物モデルの多様から多様な(BOO)、または間質性膀胱炎(IC)は、この技術を使用して調べることができる。
本論文では、上記のいくつかの科学的問題に対処するために、必要な実験プロトコルと一緒に、このメソッドの使用例を示します。
プロトコル
ここで説明するすべての手順は、ピッツバーグ大学のIACUC委員会により承認されています。
1。ソリューション
- レシピに従ってKrebs溶液を調製します。 mM単位組成:NaClの118、塩化カリウム4.7、 塩化カルシウム1.9、 硫酸マグネシウム1.2、 炭酸水素ナトリウム24.9、KH 2 PO 4 1.2、ブドウ糖11.7。
- 95%O 2、5%CO 2で曝気クレブスを、実験全体にわたって使用される37ºC水浴中に置き。脇に置く〜室温で曝気クレブス溶液200mlを組織切開に使用する。
- 曝気クレブスのpH(〜7.4)と、浸透圧(〜300 mOsmで)を測定します。
2。実験セットアップ(回路図図1A)
- (95%O 2、5%CO 2)を10mlのクレブスとチャンバー曝気埋める。
- 37℃にチャンバを加熱する循環水ポンプを始動;アンプ(S)、刺激剤(:必要な機器の電源を入れるs)とレコーディングソフトウェア。
- 1グラムの重量を有する変換器を校正します。
3組織(図1B)
:以下の手順に従って、大人のナイーブな女性のSprague Dawleyラット(〜10〜12週齢200〜250グラム)から膀胱を削除する
- 解剖エリアと必要な器具の準備:電気カミソリ、歯鉗子、メスの刃、解剖ハサミ、microscissorsを、2解剖鉗子は、組織·クリップ(または絹縫合糸)、クレブスとしたシルガードコーティングされた解剖皿(著者は、デュモン鉗子#3を好む)組織切開端子です。
- 誘導チャンバー内のイソフルラン吸入(O 2中4%)で動物を麻酔。麻酔下ながら乾燥を防ぐために、目に獣医軟膏を使用してください。継続的に反射を撤回呼吸数、外部刺激に応答して、リア四肢の喪失を観察することによって、麻酔のレベルを監視します。
- 動物は、ひげをそる下腹部A麻酔をされた場合レア。腹部正中切開により骨盤臓器を公開します。膀胱と尿道を特定します。近位尿道の近くに膀胱頸部で切断することにより、膀胱を削除します。曝気クレブス溶液で満たされたシルガードコーティングされた皿に、すぐに組織を置きます。
- 必要であれば、この時点で追加の組織を除去する:尿道、胃腸(GI)管および/ または前立腺の断片など
- IACUC承認された方法( 例えば 、麻酔薬の過剰投与または二次の方法に続いてCO 2窒息)を用いて動物を生け贄に捧げる。
- さらに解剖のための組織を安定させるために、膀胱ドーム、首、尿管を通って組織切開のピンを挿入します。組織を伸ばさない。存在する場合、脂肪、結合組織、近位尿道および尿管を取り外します。
- 平坦なシートを作成するためにドームにベースから膀胱を開き、漿膜側を下/腔側アップ( 図1B)。組織の各コーナーに解剖のピンを配置します。膀胱DOMを削除するeと首組織。
- 実験の目的は粘膜(尿路上皮と固有層-ダイアグラム図1Cを参照)の寄与を決定することである場合には、平滑筋収縮をして、添付粘膜ずに排尿筋ストリップの特性を比較。このために、帯状に組織を切断する前に、慎重にアイリスを用いて粘膜層を除去し、ハサミ、解剖顕微鏡下で、微細鉗子を春。実験の最後に、粘膜の完全な除去を確認するために、H&E染色のためにストリップを固定します。この手順は、ラットの膀胱に比べて、マウスの膀胱内に簡単であることに注意してください。
- 〜2×8ミリメートル( 図1B)の短冊状にドームにベースから縦に組織を切断する。接続するか、各ストリップの両端に、組織のクリップを取り付けます。
注:ワンラットの膀胱は、通常は4ストリップに切断することができますが、ストリップの数は、動物/膀胱サイズに応じて増減することができます。 - EXPERにストリップを転送imental室。固定されたガラス/金属棒に組織収縮を測定する力変換器に各ストリップの一端を取り付け、その他。
注:組織チャンバーのサイズは(20ミリリットル以上0.2 ml)を変化させる。げっ歯類ブラダーのための典型的なチャンバーは完全に溶液中に浸漬するストリップのために十分な高さを提供する5〜20ミリリットルである。一部のチャンバーは、内蔵の刺激電極と他人をしない来る。ケアは、特に電場刺激が信頼できない、電極のすべての接続が良好な状態であることを保証するために注意すべきである。 - ベースライン張力が1g(〜を10mN)に達するまで穏やかに組織を延伸することによって、各ストリップに力が規定量を適用する。当初は組織は、ベースラインの張力の減少として記録されているリラックスする傾向がある。ウォッシュ暖かい曝気クレブスを用いて組織ごとに約15分であり、各洗浄後に1グラムのベースライン張力を調整すること。 (ベースラインテンションが安定している組織は〜のために1〜2時間まで、または平衡化することを許可するすなわち 、それ以上の組織弛緩)。
- 直接〜5分間浴、またはプラトー応答が到達するまでのKCl(80ミリモル)を添加することにより、試験組織の生存率。 KClを高濃度に応答も実験中または実験の最後に反復し(データ解析部の下に正規化を参照)、他の薬物またはストリップ間の応答を正規化するために使用することができる。
- 組織が前処理条件に戻れるようにする温かい曝気クレブスで洗う組織を複数回(3-5x)。
4。刺激プロトコル
- 自発的な筋原性活動や平滑筋緊張に対する病理学の影響を調査するために、平滑筋などのSCI、BOOなどの異なる動物モデルからのストリップ、または新生児を使用します。 図2に、開発中に膀胱の自発活動の変化を調査するためにこの方法を使用することを示し、 SCI後。さらに、薬理学的薬剤は、種を調節するために使用され得るontaneous活動。 図3に、自発的な活動と平滑筋の緊 張に、KCNQチャネル調節、フルピルチンとXE991の効果を示す。
- 定義された時間間隔で浴に直接濃縮ストック溶液から化合物を添加することにより薬理平滑筋刺激コンストラクト濃度応答曲線である。車両や時間の影響を考慮するために平行なストリップに薬物および車両を使用してください。
- 1000倍の最終使用濃度において所望の試験化合物のストック溶液を作る。 10 -5 M、3×10 -5 M、10 -4 M、3×10 -4 M、10 -3 M、3×10 -3 M:カルバコール(CCH)、ムスカリン性受容体作動薬は、以下のストックを調製、10 -2 M.浴中の最終濃度は10 -5 M( 図4C、D)を10 -8 Mである。 10 -8 M、10 -7:ニューロメジンB(NMB)、ボンベシン受容体サブタイプ1アゴニストは、以下の株式を準備M、10 -6 M、10 -5 M、10 -4 M、10 -3 Mと浴中の最終濃度である10 -11 M〜10 -6 MのCChとNMB両方は、組織の収縮性を増加することが予想される。
- 10ミリリットル組織槽の場合は、できるだけ早く応答がプラトー( 図4C、D)に到達するように、各制御CHのストック溶液10μlを加える。平行なストリップでは車両の等量(水)を追加します。同様に、各ニューロメジンBストック溶液10μl毎〜5分を追加します。
注: 図4の異なる種からのストリップにおける平滑筋緊張に対するNMBとのCChの興奮効果を観察します。 - 興奮剤は、通常のCChまたはKClで予め収縮組織中の平滑筋の弛緩特性を調査します。
- アゴニスト応答をブロックするには、事前のアゴニスト刺激に対する組織の浸透を、可能にするためにアンタゴニストで10〜20分間、組織を前処理。
- 神経stimのためにまた、電場刺激(EFS)と呼ばれる平滑筋のulationは、3.13〜ステップ1に従い、以下に説明するように継続する。 EFSを選択的に平滑筋に対する神経を活性化することを意図している。刺激のパラメータは、慎重に直接平滑筋の刺激を避けるように選択すべきである。
- 刺激パラメータを確立します。刺激のタイプ(単一パルスまたは電車)、持続時間(パルス持続時間と列持続時間)、頻度と強度は、以下の手順で説明し、 図5A、Bに示すように。
- 単一パルス刺激は、パルス持続時間、刺激間間隔および所望の刺激の数を設定する。通常の刺激持続時間パラメータは、所望の間隔( 図5A)で供給0.05〜0.3ミリ秒の持続時間の単一のパルスである。刺激強度に対するステップ4.3.1.4に従ってください。
- 列車の刺激のために、列持続時間およびインタートレイン間隔を設定します。膀胱組織の典型的な値は3〜10秒には、少なくとも1メートルを配信されます離れにある( 図5B)。組織疲労が( つまり、EFS収縮が制御期間中に減少)が発生した場合は、インタートレイン間隔を増やします。
- 電車の中で列車の刺激の周波数(パルスの数を確立 - 図5B)。 0.5〜50 Hzの範囲の周波数応答曲線を実行します。膀胱のための典型的な周波数は、ATPとのAChによって仲介再現性のある安定した収縮を与える10-20 Hzである。この方法は、コリン作動性神経伝達にプリンのメカニズムの寄与を評価するために使用できる方法を示す図5のマウスの膀胱ストリップにおけるEFS刺激に対する周波数依存応答を観察します。
- 刺激の強度を確立する:(使用して列車は周波数を一定に保つ場合)収縮の振幅がプラトーに達するまで体系的に刺激の強度(電圧)を増大させる。
- に応じて刺激の強さを設定実験の目的。目的は、神経誘発収縮を増加させることである場合には、収縮の振幅が最大収縮の約50%であるような準最大強度を使用する。目的は、神経誘発収縮を減少させることである場合は、組織の疲労を回避するために、最大振幅の〜80%に強度を設定する。
- 刺激パラメータ(期間、頻度と強度)が確立されると、EFS-のため20〜30分は、薬物検査の前に安定させるために収縮を誘発〜許す。
注:Na +チャネル遮断薬で、神経伝達を遮断、神経伝達のためにEFSの選択性を確認するには、テトロドトキシン(TTX; 0.5〜1μM)。 TTXは、比較的簡単に洗い流すように、実験開始時にこの手順を実行します。また、(ステップ4.3.5を参照してください。下の)実験の最後に、これを実行します。 - のために1,000倍の最終作業濃度でストック溶液を準備します。アルファ、ベータメチレンATP(ABMA;プリン受容体活性化剤と減感)10 -2 M、アトロピン(ムスカリン受容体拮抗薬)10 -3 M( 図5C)。図6の他の例を観察する。5HT4受容体アゴニスト、シサプリド(3×10 -6 M、10 -6 Mを、3×10 -5 M、10 -5 M、3×10 -4 Mを、10 -4 M、 3×10 -3 M、10 -3 M)は、組織の収縮およびSB-203186(3×10 -3 M)、5HT4受容体拮抗薬が増加しシサプリドの効果を逆転させる。
- EFS( 図5C)にABMAおよびアトロピンの効果を試験するために、2つの制御周波数応答曲線を実行する。 10μMの最終濃度浴に10 -2 M ABMA10μlのを追加します。これは、平滑筋におけるプリン受容体の直接刺激に組織を収縮する。ベースラインへの応答が戻った後、周波数応答曲線を繰り返す。最後のconcentrat 10 -3 Mのアトロピン10μlのを追加1μMのイオン。 (ムスカリン受容体を遮断するアトロピンのために必要)〜10分後、周波数応答曲線を繰り返す。平行なストリップでは、各ステップにおいて、車両、水10μlを加える。
注: 図6の他の例については、定義された時間間隔で、各シサプリドストック溶液10μlを加える(〜15分毎に、説明を参照)、お風呂に直接SB-203186のストック溶液10μlが続き、に対するそれらの効果を監視するEFS誘発収縮。平行なストリップでは車両のDMSO 10μlを加える。シサプリドの効果を観察し、 図6のヒト膀胱と回腸組織におけるEFS誘発収縮に対する5HT4受容体作動薬は、。さらに、ヒト膀胱および回腸組織におけるEFS誘発収縮に対するDMSOの影響、シサプリドのための車両を観察。 - EFSプロトコルの終わりに、Na +チャネル遮断薬、テトロドトキシン(TTXで神経伝達を遮断することにより、EFSの選択性を検証する。0.5-1µ M)。 TTX抵抗性の収縮がまだ存在している場合は、その後の実験では、刺激の持続時間と強度を調整することをお勧めします。
- 刺激パラメータを確立します。刺激のタイプ(単一パルスまたは電車)、持続時間(パルス持続時間と列持続時間)、頻度と強度は、以下の手順で説明し、 図5A、Bに示すように。
- 前または後シナプス部位( 図7A)に対する薬物の効果を測定するために4.3.2ステップ1に従ってください。カルバコールとEFSに再現性のある反応を確立し、その後、薬物Xを追加
- 実験の最後に、クリップを取り除くまたはストリップをほどく、余分な液を除去し、天秤を使用して各ストリップの重量を測定するためにティッシュ紙の上にそっとブロット。また、断面積を決定するために、キャリパーを用いて組織の長さを測定する。この情報は、データの正規化のために使用されます(セクション5.4を参照)。
5。データ解析
適切なソフトウェア( 例えば 、Windaq、LabChartの)を使用してデータを分析します。
- 自発的活動のために、薬剤誘発性応答のピークの前とで少なくとも30秒のウィンドウを選択してくれASURE振幅と筋原性活動の頻度( 図3)。
- 膀胱の異なる部分の間に相違がある応答の収縮性かどうかに寄与する周波数のスペクトルを決定するために、高速フーリエ変換解析を使用して( 例えば 、首対ドーム)または開発、病理学、および薬8である。
- 平滑筋の緊張への影響については前と薬剤誘発性応答のピークで少なくとも10〜30秒のウィンドウを選択し、収縮の振幅を測定。
- 神経誘発収縮に対する効果について(少なくとも3)の前に、薬剤誘発性応答のピーク時に収縮の曲線下振幅、持続時間と面積を測定します。
NOTE:プリン作動性およびコリン作動性の成分が異なる速度を持っているので、EFS誘導性収縮の振幅曲線下面積の両方を測定する必要がある。プリンコンポーネントは迅速かつ一過性である(ATPはpurinergiを活性化させるカルシウムの迅速な流入を可能にするようなP2X1などのCイオンチャネル型チャンネルは、それらは、このように曲線下面積に対するピーク振幅応答に対してより少ない貢献、)脱感作。コリン作動性成分(アセチルコリンが最終的に収縮を誘導するために、平滑筋を脱分極イオンチャネルを活性化する細胞内経路を活性化するために多くの時間を必要とする代謝型ムスカリン受容体を活性化する)遅く、持続的である。このように、ムスカリン性成分は曲線下面積を測定することによって、より良いキャプチャされます。 - ストリップ及び薬理学的治療を横切っ結果を比較することができるようにデータを正規化する。正規化のために選択されたパラメータは、病理学的状態を研究や実験計画、試験化合物によって影響されるべきではありません。これらのパラメータのうち、利用ストリップの重量、断面積、塩化カリウム応答( 図4B)、最大応答( 図7B)の%または別の収縮剤に対する最大応答の%( 例えば 、のCCh)やリラックス剤( 例えば 、パパベリン)。
結果
自発筋原アクティビティ
自発筋原活性は生後発達6-9および病理学的変化( 例えば 、SCI、BOO)3-5を受ける重要な平滑筋の特徴である。この活性は、過活動膀胱(OAB)2の症状に寄与すると考えられるので、それを調節する受容体、細胞内経路及び薬理学的薬剤の評価は、OABおよびその他の平滑筋機能障害のための有効な治療を開発するための重要度が高いものである。ここで紹介する方法は、簡単にこれらの質問を調査することができます。図2は、新生児(ⅰ)、若年性(ⅱ)成人(iii)および脊髄損傷ラット(SCI;ⅳ)での開発中に筋原性の自発的活動の異なるパターンを示している。新生児ラットからストリップは、成体ラットからストリップしながら、大振幅、低周波リズミカルな収縮( 図2AI)を示すsは小振幅、高周波活性( 図2Aiiこと、iii)を示す。 SCI後新生児パターン( 図2Aiv)再出現する。動物モデルからストリップを使用することに加えて、さまざまな薬理学的薬剤は、自発収縮の根底にあるメカニズムを理解する目的で、ナイーブ動物からのストリップでの自発収縮を誘導するために使用することができる。適切な薬理学的薬剤の例としては、ムスカリン性受容体アゴニスト(カルバコール;のCCh)が挙げられる。(例えば、アセチルコリンエステラーゼ阻害剤として)のAChレベルを上昇させる化合物のKCl( 例えば 、20mM)を、または他の実験薬剤の低濃度を図3A-B、変調を示す平滑筋に位置してKCNQチャネルに作用する薬理学的物質による自発的な活動の。一方KCNQチャネル開口薬、フルピルチンは、濃度依存的( 図3AI-iii)の中で自発的活動の振幅および周波数を減少させるKCNQチャネルブロッカー、XE991は、振幅が減少するが自発的活動の頻度を増加させます( 図3BI-III)。
平滑筋の緊 張
平滑筋の緊張や収縮特性は、ストレージや排尿時の膀胱の適切な機能のために重要な要素である。この方法は簡単に平滑筋緊張に対する薬理学的作用物質の効果をスクリーニングすることができる。3Aivと3Bivは XE991が増加平滑筋緊張しながら、平滑筋の弛緩と一致し、フルピルチンは基礎音を減少させることを示している。 図4は、平滑筋の緊 張における濃度依存性の増加を示しているニューロメジンBとのボンベシン受容体を活性化することによって(NMB; 図4A、B)またはムスカリン受容体カルバコールと(CCH; 図4C、D)。さらに、これらの平滑筋の応答を媒介する細胞内経路は、uで調べることができる特異的なモジュレーターを歌う(データは示さず)。
神経媒介応答と神経伝達の調節
膀胱収縮は、副交感神経遠心性神経からのアセチルコリン/ ATPの放出によって達成される。膀胱収縮にムスカリンおよびプリン作動システムの寄与は、間質性膀胱炎、部分的な出口閉塞、および過活動膀胱26などの病態におけるプリン作動寄与が支配的な増加に伴い、種および病的状態によって異なります。 図5Cは、決定するために、このメソッドの使用方法を示しマウスの膀胱ストリップにおける神経伝達にムスカリンおよびプリン成分の寄与。コリン作動性成分の寄与は、ムスカリン受容体アンタゴニスト、アトロピンを用いて評価した。プリン作動性システムの寄与は、プリン作動性受容体活性化剤及び減感剤、α、β-メチルを使用して評価したエンATP(ABMA)。また、各成分の周波数依存性寄与が低いから高い周波数(2-50 Hz)での刺激周波数を変化させることによって評価した。
膀胱収縮の強度を効率的に排泄に重要な役割を果たしている。この方法を使用して、神経伝達を調節する受容体および経路は、機能障害排尿するための薬物標的として調べることができる。 5HT4受容体は、副交感神経ニューロンにおけるプリjunctionally発現させ、それらの活性化は、アセチルコリンレベル27が増加している。 図6は、ヒト膀胱および回腸短冊における5HT4受容体アゴニスト、シサプリド、興奮性の効果を示す。
さまざまな実験プロトコールは、試験化合物の作用部位を決定するために使用することができる。 図7(a)の図は、前対後の接合部位を評価するために使用するプロトコルを示す。薬物Xが減少(または増加)するEFS応答が、何effecがない場合tはCChの応答に、アクションの最も可能性の高い部位は、接合部前である。薬剤Xの改変の両方EFSとのCCh応答場合、それは、ポストjunctionallyまたは両方前後junctionally位置する受容体に作用することができる。
各コンポーネントの役割:平滑筋、粘膜、および神経
さまざまな病理学的状態は、膀胱のさまざまなコンポーネントに影響することがあります。 OABが変更された平滑筋収縮を引き起こすかもしれない例えば、間質性膀胱炎(IC)は、主に尿路上皮に影響を与えます。また、別の受容体はそれぞれ、膀胱成分において発現させることができるため、特に、特定の病理に標的化され得る。すべての膀胱成分の正味の効果を測定するインビボ法とは対照的に、このインビトロ法は、外科的および薬理学的手順の組み合わせを使用して、特定の構成要素の調査を可能にする。神経細胞の非存在下で平滑筋の収縮/弛緩を試験するためにトランスミッション、TTX(0.5μM)を浴に添加することができる。 図4では、NMBとのCChは、TTXの存在下で試験した。平滑筋収縮への粘膜(尿路上皮と固有層)の寄与をテストするには、粘膜層とないストリップが比較されます。 図7Bは、のCChに対する応答が豚28で粘膜の存在下で還元されることを示している。同様の結果がヒト膀胱条片29で報告された。神経線維の役割を試験するために、いくつかのアプローチをとることができる。一つは、薬理学的物質を使用して特定の繊維を活性化または阻害することである。例えば、カプサイシンは、求心性神経の特定の集団を活性化し、種の依存平滑筋収縮や弛緩17,18の原因となる。グアネチジン、従ってこれらの繊維の寄与を排除し、交感神経繊維からのノルエピネフリンの放出を阻害する。別のアプローチは、/脱感作、インビボで特定の繊維を除去することである実験に先立っ。例えば、カプサイシンによる動物の全身治療は、カプサイシンに敏感な求心性神経を脱感作する。この準備で研究することができる他の膀胱のコンポーネントは特定の薬剤とそれらを活性化または遮断することにより、間質細胞またはギャップ結合である。
種差
ほとんどの薬物開発はヒトの疾患の治療のために意図されているが、基礎研究は、主に動物の組織で行われる。種差は受容体の数が存在します。例えば、5HT4受容体作動薬は、ヒト膀胱における神経誘発収縮を強化するが、ラットの膀胱19,30に、EFS誘発性収縮は、ヒトおよび安定した空気袋31からの旧世界のサル排尿筋でほぼ独占的にアトロピンと小文字が区別されますが、部分的にならないアトロピン耐性ヒト排尿筋では不安定膀胱条件( 例えば 、神経性、obstructeの患者からDブラダ)15,32,33、カプサイシンはラットおよびヒト膀胱条片における興奮性応答、豚の膀胱ストリップ及びモルモット膀胱ストリップ17,18における阻害応答でno応答を誘発する。受容体アゴニストは上の興奮性作用を有するボンベシン4に示す。図ラットの膀胱とマウスとブタの膀胱ストリップ16への影響。この情報は、特定の受容体を研究するための適切な動物モデルを選択するために重要である。
臓器全体の感度の比較
膀胱障害の治療のために意図された薬物はまた、胃腸管、尿道、胆嚢などのような他の器官からの平滑筋に影響を与える可能性があり、この方法は、並んで、異なる組織面を比較することにより薬剤に臓器選択性と感度を推定することができる。 図6に示すように、5HT4受容体アゴニスト、シサプリドは、異なっている回腸組織対ヒト膀胱におけるENTの有効性および効力。

図1。実験のセットアップおよび膀胱ストリップの準備実験設備の。A)の模式図。膀胱ストリップは曝気クレブス液を充填した組織チャンバ内に浸漬され37℃に維持 循環水ポンプを介して、℃。ストリップの一端が固定されたロッドに、他の組織の収縮性を測定するための等尺性力変換器に取り付けられている。力変換器は、データ記録用のアンプやコンピュータに接続されている。刺激装置に接続された電界の刺激電極は、チャンバ内に配置され、神経媒介性の膀胱収縮を惹起するために使用される。組織片のB)の調製。膀胱を皿に釘付けにされ、次の手順が実行されます。#1の垂直カット目を尿道からドームまで膀胱のウワーッ腹側半分はフラットシートに膀胱を開きます。膀胱/近位尿道のドームとベースを取り外す#2水平カット。 。ストリップコンポーネントの#等しいストリップに半ば膀胱を分割する3垂直カット(ラットの膀胱から4ストリップ)C)回路図:平滑筋および粘膜の両方を含む求心性(青)と遠心性(緑色)の神経。粘膜は尿路上皮と固有層で構成されています。固有層は、血管[1]、[2]間質細胞を含み、粘膜筋板[3]。 #2bとラベルされた点線は、粘膜層を除去するための手順を示します。 この図の拡大版をご覧になるにはこちらをクリックしてください。

開発中および後の2筋原自発的活動図病理新生児における自発的活動の。A)の例は、(i)、若年性(ⅱ)、脊髄無傷の成人(iii)および損傷した脊髄(SCI)、成人(iv)のラットの膀胱ストリップ。 SCIラットは、手術後4週目に使用した。調べた四つのグループの自発収縮のB、C)は、振幅の概要(B)と周波数(C)。 (アルティムDE、カルマンFA·ドアティSL、Bupp E、エドワーズCL、デ·グロートトイレから許可を得て複製Neurourol Urodyn 2011/11/20; 30(8):1666年から1674年。) これの拡大版をご覧になるにはこちらをクリックしてください。フィギュア。
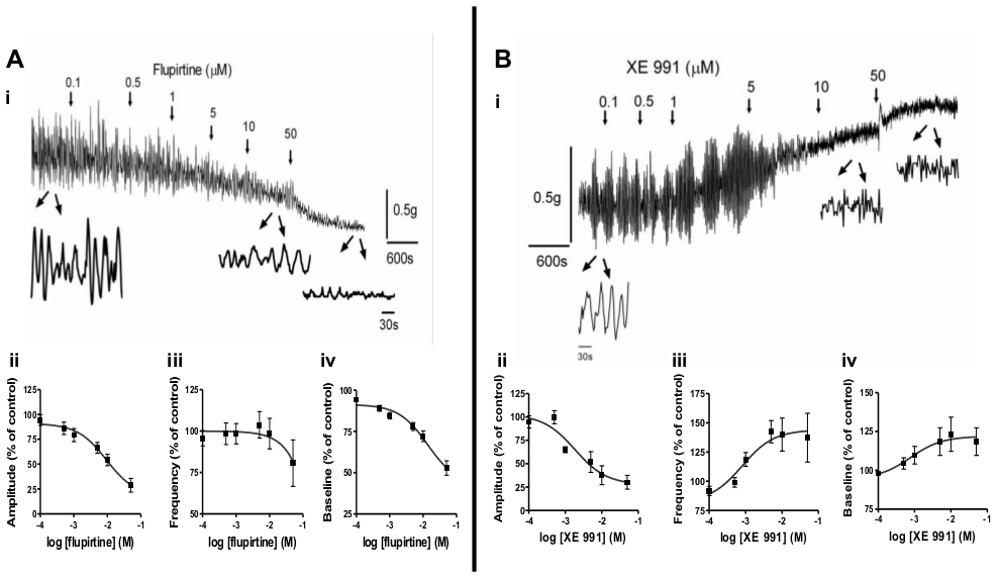
筋原自発活動の図3。変調と平滑筋の緊 張。A)KCNQチャネル開口薬の効果は、FLUPIrtine、自発的活動及び成体ラットの膀胱ストリップのベースライントーン上。 (i)のフルピルチンを矢印で示すタイミングで濃度(累積)を大きくして加えた。制御時および10μMおよび50μMのフルピルチンを適用した後のストリップ活動の痕跡を示して4分の下に引き伸ばし。振幅に(II〜IV)フルピルチンの効果のまとめ(4匹のラットからのストリップ7)(ii)および(iv)は、対照(薬物前)値からの%変化として表さ(iii)の自発的活動とベースライントーンの周波数、これを100%に設定した。B)、自発的活動及び成体ラットの膀胱ストリップにおけるベースラインのトーン上のKCNQチャネル遮断薬、XE991の影響。 (i)のXE991は矢印で示された時間における濃度(累積)を大きくして加えた。トレースの下の引き伸ばしは、制御時および10μMおよび50μMのXE991を適用した後のストリップ活動の2分を示している。上の(II〜IV)XE991の効果のまとめ(4匹から9ストリップ)自発的活動とベースライントーンの振幅(ii)および周波数(III)が(iv)は、コントロールを100%に設定された(薬物前)の値から%変化として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。 。

ラットの膀胱ストリップ中のB(NMB)ニューロメジンボンベシン受容体アゴニストに応答して、 図4種の違い。A)濃度依存平滑筋の収縮、、。B)ラットの膀胱ストリップにおける平滑筋収縮に対するNMBの影響のまとめ。データは、マウスにおけるNMBに対する応答(C)およびブタ(D)膀胱ストリップのKCl(80 mM)の応答。C、D)不在に正規化される。カルバコール(CCH)が強い濃度依存詐欺を誘発ストリップは刺激に応答可能であることを示すマウスとブタのストリップの両方でトラクション、。 TTX(0.5μM)は、すべてのストリップでの入浴中に存在していた。 (カルマンFA·マッケナD、ウェルズ、GI、トールKB神経ペプチド2013 10月から許可を得て複製; 47(5):305から13) 、この図の拡大版をご覧になるにはこちらをクリックしてください。
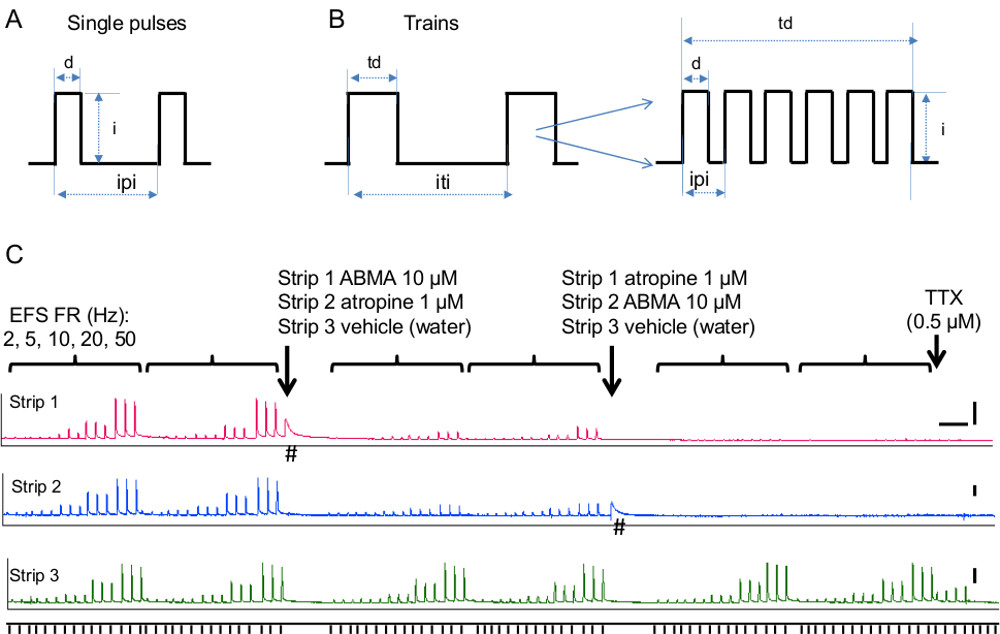
単一パルス刺激パラメータの図5。電場刺激。A)の回路図。略語:D =パルスの持続時間、私のパルス=強度、IPI =インターパルス間隔B)列車の刺激パラメータの概略。略語:TD =列持続時間、I =パルスの強度、ITIは、インタートレイン間隔を=。挿入図は、列中のパルスの数と間隔betwを示している一緒に列持続時間と列車の刺激の頻度を決定した、それらをEEN。C) 神経誘発膀胱収縮にpurinegicとコリン作動性成分の寄与。 EFS-FRは、刺激周波数、2、5、10、20、50ヘルツを表す。毎90秒配信三刺激は、各周波数について試験した各周波数シリーズはコントロールで二回、各化合物を添加した後、二回繰り返した。 α、β-メチレンATPは、ABMA(ストリップ1)と略す、プリン受容体を脱感作するために使用され、アトロピン(ストリップ2)は、ムスカリン受容体を遮断するために使用された。ストリップ3は、対照として機能し、車両、水で処理した。矢印は、各化合物は、各ストリップに追加された時刻を示す。車両の影響を受けずに、EFS誘発収縮が強く、ABMAとアトロピンにより減少していることに注意してください。 EFSは20Hzで送達された一方TTXは、実験の終わりに添加した。残りの収縮がコントロールで観察されたことに注意してくださいストリップ3( すなわち壁内神経からの伝達物質の放出によって開始された)彼らの神経の性質を証明する、TTXにより廃止された。 #は、EFSがない場合のABMAに平滑筋の応答を示している。スケールバーは、x軸とy軸の2グラムを5分である。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図神経誘発膀胱収縮の調節6。A、B)5HT4受容体アゴニストによる神経誘発収縮の増強の例には、ヒト膀胱(A)および回腸ストリップ(B)におけるシサプリド。シサプリド(黒レコード)またはDMSO(灰色のレコード)が矢印で示された時間に濃度依存的に添加した。各パネル内のレコード下の黒いバーすべての120秒20Hzで配信10秒列車で構成され、EFSを表す。垂直スケールバーは、すべての例については、1グラムである。 TTX濃度は0.5であった。シサプリドに応じて、EFS誘発収縮の曲線下面積(AUC)のCF)まとめ膀胱細片(C、D)および回腸ストリップ中(黒棒)またはDMSO(灰色のバー)、(E 、F)。 CFにおいては、SBは、5HT4受容体アンタゴニストの添加後に得られたデータの要約を表す、SB-203186を表す。点線は、100%に設定し、制御を表している。 (カルマンFA、栗原R、イェL、ウェルズ、GI、マッケナDG、Burgard EC、トールKBから許可を得て複製Auton Neurosci 2013 6月、176(1-2):。70-7) 見るにはこちらをクリックしてください。この図の拡大版。
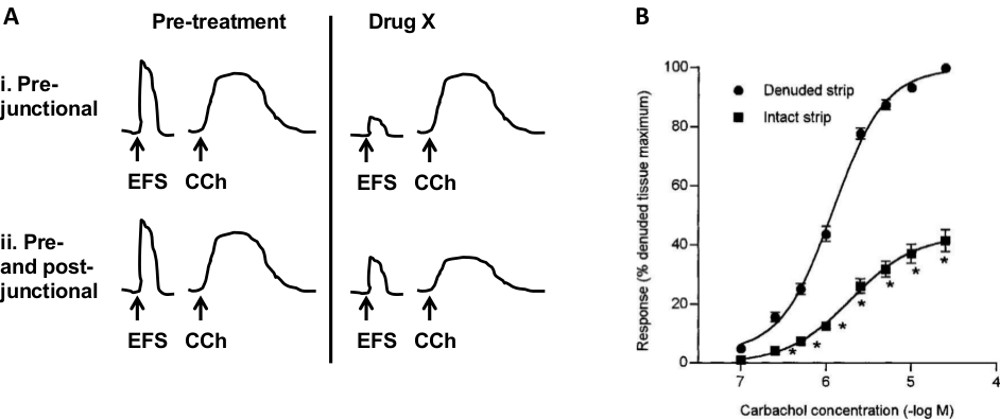
Fiの薬や膀胱のさまざまなコンポーネントの役割の作用のグレ7サイト。薬の作用部位を同定するためのプロトコルのA)の模式図。ストリップは、ESFとカルバコール(CChは)で刺激する。私の薬剤では、Xは、アクションの接合部前のサイトを示す、EFS応答ではなく、制御CH応答を低減します。 IIにおいて、薬剤Xは結合後、またはその両方前後の接合部の受容体への作用を示す、両方の応答を変更します。、B、平滑筋収縮に対する粘膜の)影響。 カルバコールの効果(無欠陥)が除去粘膜とストリップに比べて粘膜に存在(無傷)でストライプ状に減少している。 (BはホーソンMH、チャップルCR、巨根、M、チェス·ウィリアムズR. BrのJ薬理学からの許可を得て複製されている2000年2月、129(3):416から9)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
本論文では、膀胱生理学および病理学に関連する重要な科学的問題の数だけでなく、膀胱機能不全を治療する新薬の発見を助けるに対処するために使用することができ、簡単なin vitroでの平滑筋収縮方法を説明した。私たちは、膀胱平滑筋の収縮( 図2-4)、神経伝達変調( 図5-7A)、種差( 図4)、臓器差( 図6)、発達病理学的および薬理学的特性を評価するためのこの方法の使用を例示している特定の膀胱のコンポーネントの関連性( 例えば 、粘膜、 図7B)。ここでは図示していない付加的なアプリケーションには、薬理学的物質3,10,11、各種薬物22-24、または評価/送信機RELEの定量化の構造活性相関を用いた細胞内経路の評価を含める神経刺激25の後アーゼ。
膀胱機能が最終的にインビボで評価することができるが、このインビトロ法は、 インビボで問題となる多くの状況を克服する。これらは、外科的および薬理学的操作は生存率および/ または臓器もしくは動物の生存を減少させるであろう状況で、ヒト組織の使用、特定のコンポーネントからの応答を同定し、特徴付けるための必要性(神経上皮対対例えば 、平滑筋が含まれる)や高価な化学物質の使用。この方法は、平滑筋の収縮活性に対する、よく制御された方法と環境内のさまざまな薬理学的物質だけでなく、病状の影響を系統的に調査することができます。
この方法は、情報の過多を提供します。この情報を解釈し、外挿するときただし、注意が必要です。これは、減少準備のin vitro方法、投あるその通常の環境と神経のコントロールから接続されています。実験条件は、このように、データが完全に生体内の生理的状況では反映されない場合があり、生理的ではありません。例えば、本方法は、血流の変化、ホルモン、体液性物質、外部の機械的な力、または外因性の神経制御を説明できない。組織は、このように損傷および虚血に関連する応答を考慮に評価し、取られる必要がある、急性分散型である。彼らはすでに求心性、平滑筋、粘膜または壁内神経機能( すなわちセルラー可塑性)を変更した場合を除き、脳や脊髄に生じる病理学的変化は、この方法を使用してテストすることができません。電場刺激(EFS)神経調節性応答を評価することができます。排尿反射は、特定pathwを活性化するin vivoでの状況とは対照的に、しかし、それは、ストリップ( 例えば 、交感神経、副交感神経、求心性神経)に無差別にすべての神経を励起し、AYS。この状況を克服する1つの方法は、選択的に異なる経路を遮断する特異的アンタゴニストでEFSを組み合わせることである。例えば、収縮特性を研究するグアネチジンはノルエピネフリン放出をブロックするために使用することができ、又はアトロピンの緩和特性を研究する際に膀胱収縮を防止するために、ムスカリン受容体を遮断するために使用することができる。最後に、組織の生存率は、時間の特定の数に限定される。一般的に、膀胱組織のほとんどのコンポーネントは、6〜8時間、またはそれ以上の期間にわたって( すなわちレスポンスを劣化させることなく、EFSへの対応)生存可能であり、安定している。しかし、他の組織はより敏感である(;著者の個人的な経験などは 、回腸〜6時間以下続く)。
この方法は技術的に可能と再現性よくあるが、その成功を確実にするために必要ないくつかの重要なステップがあります。まず、組織標本は、必要な変更を加えることで、生存率を確実にするために慎重に行うべきである解剖プロシージャに異なる組織タイプまたは種のため、必要に応じておよび/またはメディア(ストリップを準備しながら、組織を伸ばす避ける)。もう一つの重要なステップは、設定アップされている天井効果が回避されるように、神経刺激パラメータを、。方法の項で説明したように、これは、試験化合物の作用の実験を行い、予想されるメカニズムのタイプに依存する。例えば、膀胱細片に、( 図6)シサプリド、5HT4受容体アゴニストの効果を試験するために、私たちは最大のの〜50%、EFS誘発収縮の振幅を設定。これは、すなわち、次にEFS-誘発収縮を増加すると予想される接合部前副交感神経27からのACh放出を増強する、5HT4受容体アゴニストの作用の公知の機構に基づいていた。神経対筋肉の刺激は、神経伝達を阻害し、したがって、EFS誘発収縮を阻害するはずであるTTXを使用してテストする必要があります。車両とティムのための適切なコントロールeは、時間と組織の劣化や車両のいずれかの可能性のある影響を考慮するために薬物検査中に実行されなければならない。例えば、多くの薬物はDMSOまたはエタノールに溶解する。本発明者らのデータ( 図6)は、DMSO(0.1%以上)は、試験薬物の効果から減算される必要がある効果を神経的に誘発収縮を増加させることができることを示している。同様に、(1%まで)エタノールが自発的な平滑筋の収縮を低減するが、神経誘発収縮34,35には影響しません。遺伝子操作された動物または外科的モデル( 例えば 、脊髄損傷または卵巣摘出)を使用している場合、コントロールはそれぞれ、適切なバックグラウンドマウス株または偽手術動物由来の組織を含める必要があります。また、例えば、ヒト、マウスおよびモルモットの膀胱のようないくつかの組織は、壁内神経節を含んでいる。これらの組織で作業する場合、プロトコル選択とデータ解釈は、学内NEの薬物やEFSのアカウントの影響を考慮する必要がありますさらに平滑筋を刺激urons。
、実験プロトコルの設計、試験される(薬物刺激のため、EFSのために)正しいパラメータを選択し、濃度が意味のあるデータを確実にするために重要である。パラメータは、個別の組織や麻薬のために調整されるべきであるが、以下に概説する一般的な原則/ガイドラインが適用されます。累積濃度応答曲線が望ましいが、これは全ての化合物は不可能である。このような組織(例ACH)で迅速に代謝されるpurinericイオンチャネル型受容体(P2X)、または薬物のような脱感作受容体を標的とする薬剤は、確実に同じ組織に累積濃度応答曲線を使用してテストすることができません。これらのケースでは、単一の濃度は、組織の異なるグループで試験する。脱感作を評価するためには、累積濃度の終わりに達成されるものと単一の最高濃度によって誘発される応答の大きさを比較することが推奨される応答曲線。
濃度応答曲線から得られたデータの正確なフィッティングのためには、半対数濃度( 図6の例のCCh)をテストすることが望ましい。組織の生存率が制限される場合があり、または他の制約が生じていてもよいしかし、ログ濃度( 図4Aの例NMB)が許容される。
新規化合物のための濃度範囲を選択するには、予備実験において、その濃度の上下10の化合物と試験つの電力の結合親和性を考慮することが有用である。その後の実験では、プロトコルは、薬物の影響は観察されない出発点と応答が最大でないか、試験した濃度は、もはや意図された標的に特異的であるいずれかのエンドポイントを決定するために精製される。
a)は時間のために:薬剤を適用するための時間間隔を考慮し、いくつかの要因を考慮して選択すべきである薬は効果があります。 ( - 3時間30分)細胞内標的( 例えば 、フォルスコリンおよび他の酵素阻害剤36、ボツリヌス毒素37)のための薬剤は、追加のインキュベーション時間を必要とするのに対し、膜受容体を標的とする一般的な薬剤には、比較的速い応答(数秒から数分)を有している。さらに、組織の厚さが役割を果たし得る。 b)の期間、薬剤の作用機序。 図6において、図4Aおよびシサプリド、このようなNMBような薬物の効果が維持されるプラトーに達した場合は、、薬物アプリケーション間で5〜15分の時間間隔が十分なデータを収集するために適切である。これは薬が作用または異なる作用機序(ATP、のCCh)のはるかに短い期間を有するでは不可能である。例えば図4Cまたは4D内のCChの効果は、急速にプラトーに達したが、組織の緊張は、ベースラインに戻ろう。この場合、時間間隔は応じて調整する必要がある最初の応答が最大に達したときLYは、通常、次の濃度を添加する。
ストリップ間の比較を可能にするデータ分析、データの正規化は、特に非常に重要なステップである。別の研究では、別の収縮剤( 例えば 、のCCh 38)への最大応答の最大応答28または%のストリップ体重38、ストリップ断面積39、塩化カリウム応答12%を含む、正規化のための異なるパラメータを使用しています。正規化パラメータは、パラメータは、試験化合物、病状または実験設計によって影響されないように、実験の目的に応じて選択すべきである。例えば、KClの応答に正規化は、重みとストリップの他の寸法がなくなり、したがって、病理学的状態は、ストリップの重量( 例えば 、糖尿病、膀胱質量を増加させる)を増加させることができる組織における応答を比較するために使用することができる。また、再KClに対するsponseが粘膜/尿路上皮29の除去によって影響されない、したがって膀胱(平滑筋対、例えば 、粘膜)の異なる成分を評価する実験に使用することができる。
要約すると、この収縮法は、膀胱(および他の器官)生理学および薬理学を評価するための迅速、簡単かつ非常に強力なアプローチを提供します。適切に使用されるとき、それは減少し、よく制御された環境で組織を操作する能力を提供する。膀胱機能の研究では、この方法は、抗ムスカリン、現在、OABの管理のために使用される化合物の発見とテストに尽力し、新たに3 ARアゴニストβ開発しました。
開示事項
著者は、彼らが競合する金融利害がないことを宣言します。
謝辞
この研究は、LBにNIH R37 DK54824およびR01 DK57284助成金によってサポートされていました
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 °C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and Surgical Instruments | |||
| Sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect, & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1 g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium chloride Potassium chloride Monobasic potassium phosphate Magnesium sulfate Dextrose Sodium bicarbonate Calcium chloride Magnesium chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
参考文献
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved