Method Article
Vescica muscolo liscio Striscia contrattilità come un metodo per valutare Lower Urinary Tract Farmacologia
In questo articolo
Riepilogo
Questo manoscritto presenta una semplice, ma potente, metodo in vitro per valutare la contrattilità della muscolatura liscia in risposta ad agenti farmacologici o la stimolazione del nervo. Le applicazioni principali sono lo screening di stupefacenti e la fisiologia dei tessuti comprensione, farmacologia e patologia.
Abstract
Descriviamo un metodo in vitro per misurare vescica contrattilità della muscolatura liscia, e il suo uso per indagare le proprietà fisiologiche e farmacologiche della muscolatura liscia così come i cambiamenti indotti dalla patologia. Questo metodo fornisce informazioni fondamentali per comprendere la funzione della vescica, mentre superando notevoli difficoltà metodologiche incontrate in vivo, come ad esempio le manipolazioni chirurgiche e farmacologiche che influenzano la stabilità e la sopravvivenza dei preparativi, l'uso di tessuti umani, e / o l'uso di prodotti chimici costosi. Esso fornisce anche un modo per indagare le proprietà di ogni componente della vescica (cioè muscolatura liscia, mucosa, nervi) in condizioni sane e patologiche.
La vescica urinaria è rimosso da un animale anestetizzato, posto in soluzione di Krebs e tagliato a listarelle. Le strisce sono posti in una camera riempita con soluzione calda di Krebs. Una estremità è collegata ad un tensioattivo isometrican trasduttore per misurare la forza di contrazione, l'altra estremità è collegata ad una canna fissa. Tissue è stimolata da aggiungere direttamente composti al bagno o da elettrodi di stimolazione di campo elettrico che attivano i nervi, simile a innescare le contrazioni della vescica in vivo. Dimostriamo l'uso di questo metodo per valutare la contrattilità della muscolatura liscia spontanea durante lo sviluppo e dopo una lesione del midollo spinale sperimentale, la natura della neurotrasmissione (trasmettitori e recettori coinvolti), fattori coinvolti nella modulazione dell'attività della muscolatura liscia, il ruolo dei componenti della vescica individuali, e le specie e le differenze di organi in risposta ad agenti farmacologici. Inoltre, potrebbe essere utilizzata per indagare meccanismi intracellulari coinvolti nella contrazione e / o rilassamento della muscolatura liscia, droga relazioni struttura-attività e la valutazione di rilascio del trasmettitore.
Il metodo di contrattilità della muscolatura liscia in vitro è stato ampiamente utilizzato for più di 50 anni, e ha fornito dati che hanno contribuito in modo significativo alla nostra comprensione della funzione della vescica, nonché allo sviluppo farmaceutico di composti attualmente utilizzati clinicamente per la gestione della vescica.
Introduzione
La muscolatura liscia della vescica si rilassa per permettere il riempimento di urina, e contratti di suscitare l'eliminazione delle urine. Il relax è mediata da proprietà intrinseche della muscolatura liscia e tonica rilascio di noradrenalina (NE) dai nervi simpatici, che attiva i recettori adrenergici beta (β 3 AR in umana) nel detrusore. Svuotamento si ottiene inibendo l'ingresso simpatico e l'attivazione dei nervi parasimpatici che rilasciano ACh / ATP di contrarre la vescica muscolo liscio 1. Numerose condizioni patologiche, tra cui il cervello e / o lesioni del midollo spinale, malattie neurodegenerative, diabete, ostruzione dello sbocco vescicale o cistite interstiziale, possono alterare profondamente la funzione della vescica, con grave impatto sulla qualità di vita del paziente 2. Queste condizioni alterano la contrattilità del muscolo liscio influendo uno o più componenti della vescica: il muscolo liscio, afferenti o nervi efferenti e / o lamucosa.
Diversi in vivo e metodi in vitro per studiare la funzione della vescica sono stati sviluppati. In vivo, cistometria è la misura primaria di funzione della vescica. Anche se questo è un preparato intatto che permette la raccolta di informazioni in condizioni prossime a quelle fisiologiche, ci sono una serie di circostanze in cui è preferibile l'utilizzo di strisce muscolari lisce. Questi includono situazioni quando chirurgica e / o manipolazioni farmacologiche possano pregiudicare la sopravvivenza e la stabilità della preparazione in vivo, o quando gli studi richiedono l'uso del tessuto umano o chimici costosi. Questo metodo facilita anche un esame degli effetti dei farmaci, età e patologia su ogni componente della vescica, cioè la muscolatura liscia, mucosa, afferenti ed efferenti nervi.
Strisce della vescica sono stati impiegati nel corso degli anni da molti gruppi per rispondere a una serie di questioni scientifiche. Essi sono stati usati per evacambiamenti luate in attività spontanea miogenico indotto dalla patologia. Questa attività è creduto di contribuire ai frequenza ed urgenza i sintomi della vescica iperattiva (OAB), ed è quindi un bersaglio per i farmaci in fase di sviluppo per OAB 3-9. Strisce della vescica sono stati utilizzati anche per studiare i fattori miogenici e neuronali che modulano il tono della muscolatura liscia con l'obiettivo di scoprire canali ionici e / o recettori e / o le vie intracellulari che potrebbero essere mirati per indurre il rilassamento sia o contrazione della muscolatura liscia 3,10- 13. Altri studi si sono concentrati sulla natura della neurotrasmissione, compresi trasmettitori e recettori coinvolti e variazioni indotte dalla patologia 14,15. Inoltre, il metodo è stato utilizzato per il confronto di tessuti da 18 a 16 specie diverse, tra organi 19-21, e la valutazione delle relazioni struttura-attività farmaco 22-24. Un'estensione di questo metodo è stato utilizzato per MEASURvia e l'effetto dei farmaci sul rilascio del trasmettitore da nervi efferenti 25. Inoltre, una varietà di tessuti (vescica, uretra, tratto gastrointestinale, GI) raccolti da animali o esseri umani (da interventi chirurgici o tessuti donatore di organi riconosciuti per la ricerca) e da una varietà di modelli animali tra cui lesioni del midollo spinale (SCI), della vescica presa di ostruzione (BOO), o cistite interstiziale (IC) possono essere studiate usando questa tecnica.
In questo articolo illustriamo l'uso di questo metodo insieme a necessari protocolli sperimentali, per risolvere diverse questioni scientifiche di cui sopra.
Protocollo
Tutte le procedure descritte qui sono approvati dal comitato IACUC presso l'Università di Pittsburgh.
1. Solutions
- Preparare la soluzione Krebs secondo la ricetta. Composizione in mM: NaCl 118, 4.7 KCl, CaCl 2 1.9, MgSO4 1.2, NaHCO3 24.9, KH 2 PO 4 1.2, destrosio 11.7.
- Aerare Krebs con il 95% O 2, 5% di CO 2 e collocarlo in un bagno di 37 ° C acqua da utilizzare tutto l'esperimento. Inserire parte ~ 200 ml di soluzione di Krebs aerato a temperatura ambiente da utilizzare per dissezione tissutale.
- Misurare il pH (~ 7.4) e osmolarità (~ 300 mOsm) del aerato Krebs.
2 set-up sperimentale (Schema Figura 1A)
- Riempire aerato (95% O 2, 5% di CO 2) camere con 10 ml di Krebs.
- Avviare la pompa di circolazione per riscaldare le camere a 37 ° C; accendere l'attrezzatura necessaria: amplificatore (s), stimolatore (s) e la registrazione del software.
- Calibrare trasduttori con un peso di 1 g.
3 Tissue (Figura 1B)
Rimuovere la vescica da un adulto di sesso femminile ingenuo Sprague Dawley di ratto (200-250 g; ~ 10-12 settimane di età) seguendo questi passi:
- Preparare zona dissezione e strumenti necessari: rasoi elettrici, pinze con denti, lama di bisturi, forbici dissezione, microscissors, due dissettore (autori preferiscono Dumont pinza 3 #), clip di tessuto (o sutura di seta), un piatto dissezione Sylgard rivestita di Krebs e perni dissezione dei tessuti.
- Anestetizzare l'animale con inalazione isoflurano (4% in O 2) nella camera di induzione. Usare pomata veterinaria sugli occhi per prevenire la secchezza mentre sotto anestesia. Monitorare costantemente il livello di anestesia osservando il tasso di respirazione, risposta a stimoli esterni, e la perdita di un arto posteriore ritirare reflex.
- Quando l'animale è anestetizzato rasatura minore un addominalerea. Esporre gli organi pelvici attraverso una incisione addominale mediana. Identificare la vescica e l'uretra. Rimuovere la vescica tagliando a livello del collo vescicale vicino alla uretra prossimale. Mettere immediatamente il tessuto nel piatto rivestito Sylgard riempito con soluzione di Krebs aerato.
- Se necessario, rimuovere il tessuto supplementare in questo momento: uretra, pezzi di gastrointestinale (GI) e / o della prostata, ecc
- Sacrifica l'animale con metodi approvati IACUC (ad esempio, overdose di anestetico o di CO 2 asfissia seguita da un metodo secondario).
- Inserire i perni dissezione dei tessuti attraverso la cupola della vescica, collo e ureteri, per stabilizzare il tessuto per un'ulteriore dissezione. Non tendere il tessuto. Togliere il grasso, tessuto connettivo, uretra prossimale, e ureteri se presenti.
- Aprire la vescica dalla base alla cupola per creare un foglio piatto, sierosa lato lungo / lato luminale (Figura 1B). Posizionare i perni dissezione su ogni angolo del tessuto. Rimuovere vescica domposta e dei tessuti del collo.
- Se lo scopo di questo esperimento è quello di determinare il contributo della mucosa (urotelio e lamina propria - vedi figura Figura 1C) per la contrazione della muscolatura liscia, confrontare le proprietà di strisce detrusore con e senza la mucosa aderente. Per questo, prima di tagliare il tessuto in strisce, rimuovere con attenzione lo strato mucoso con iris primavera forbici e una pinza sottile sotto un microscopio da dissezione. Alla fine dell'esperimento, fissare le strisce di colorazione H & E per confermare la rimozione completa della mucosa. Si noti che questa procedura è più facile nel topo che nel ratto vescica vescica.
- Tagliare il tessuto della lunghezza dalla base alla cupola in strisce di ~ 2 x 8 mm (Figura 1B). Legare o allegare un clip di tessuto a entrambe le estremità di ogni striscia.
NOTA: Un ratto vescica di solito può essere tagliato in 4 strisce, ma il numero di strisce può aumentare o diminuire a seconda delle dimensioni degli animali / vescica. - Trasferire le strisce al espericamere imental. Attaccare un'estremità di ogni striscia di un trasduttore di forza, che misura la contrazione del tessuto, e l'altra di una bacchetta di vetro / metallo fisso.
NOTA: camere di tessuto di dimensioni variabili (da 0,2 ml a 20 ml o più). Camere tipiche per vesciche roditori sono 5-20 ml, che forniscono l'altezza sufficiente per le strisce siano completamente sommersi in soluzione. Alcune camere sono con built-in elettrodi di stimolazione, altri no. Si deve prestare attenzione per assicurare che tutti i collegamenti degli elettrodi sono in buone condizioni, altrimenti la stimolazione di campo elettrico non è affidabile. - Applicare una quantità definita di forza per ogni striscia di stretching delicatamente il tessuto fino a quando la tensione della linea di base raggiunge 1 g (~ 10 mN). Inizialmente il tessuto tende a rilassarsi che viene registrata come una diminuzione della tensione di riferimento. Tessuto Wash circa ogni 15 minuti con il caldo aerato Krebs e regolare la tensione della linea di base di 1 g dopo ogni lavaggio. Lasciare che il tessuto si stabilizzi per ~ 1-2 ore o fino a quando la tensione della linea di base è stabile (cioè nessuna ulteriore rilassamento dei tessuti).
- Test di vitalità del tessuto con l'aggiunta di KCl (80 mM) direttamente al bagno per ~ 5 minuti, o fino a quando la risposta plateau viene raggiunto. Risposte ad alte concentrazioni di KCl possono essere ripetute durante l'esperimento o alla fine dell'esperimento e utilizzati per normalizzare le risposte ad altri farmaci o tra le strisce (vedi normalizzazione nella sezione di analisi dei dati).
- Tessuto Lavare più volte (3-5x) con il caldo aerato Krebs per consentire al tessuto per tornare alle condizioni pre-trattamento.
4. Stimolazione Protocolli
- Per studiare gli effetti della patologia sull'attività miogena spontanea o il tono della muscolatura liscia, utilizzare le strisce muscolari lisce di diversi modelli animali, quali SIC, BOO, o neonati. Figura 2 illustra l'uso di questo metodo per studiare i cambiamenti nella vescica attività spontanea durante lo sviluppo e dopo SCI. Inoltre, gli agenti farmacologici possono essere utilizzati per modulare spontaneous attività. figura 3 illustra l'effetto dei modulatori di canale KCNQ, flupirtine e XE991, sulle attività spontanea e il tono della muscolatura liscia.
- Per farmacologiche lisce stimolazione muscolare costruire curve concentrazione-risposta con l'aggiunta di composti di soluzioni madre concentrate direttamente al bagno ad intervalli di tempo definiti. Il consumo di droga e dei veicoli in strisce parallele per tenere conto di veicoli e di tempo gli effetti.
- Fate soluzioni stock di composti di prova desiderati al 1000x la concentrazione di lavoro finale. Per carbachol (CCh), un agonista del recettore muscarinico, preparare seguenti stock: 10 -5 M, 3 x 10 -5 M, 10 -4 M, 3 x 10 -4 M, 10 -3 M, 3 x 10 -3 M , 10 -2 M. Le concentrazioni finali nella vasca è di 10 -8 M a 10 -5 M (Figure 4C, D). Per neuromedin B (NMB), un recettore bombesin sottotipo 1 agonista, preparare seguenti stock: 10 -8 M, 10 -7M, 10 -6 M, 10 -5 M, 10 -4 M, 10 -3 M e concentrazioni finali in bagno sono 10 -11 M a 10 -6 M. Sia CCh e NMB dovrebbero aumentare la contrattilità del tessuto.
- Per un bagno tessuto 10 ml, aggiungere 10 ml di ciascuna soluzione madre CCh appena la risposta raggiunge un plateau (Figura 4C, D). Nel strisce parallele aggiungere pari quantità di veicolo (acqua). Allo stesso modo, aggiungere 10 ml di ciascuna soluzione neuromedin B ~ azione ogni 5 min.
NOTA: Osservare l'effetto eccitatorio della NMB e CCh sul tono della muscolatura liscia in strisce da diverse specie in Figura 4. - Indagare le proprietà di rilassamento dei muscoli lisci nel tessuto pre-contratto con un agente eccitatorio, di solito CCh o KCl.
- Per bloccare una risposta agonista, pretrattare il tessuto per 10-20 min con l'antagonista per consentire la penetrazione del tessuto, prima di agonista stimolazione.
- Per stim neuralilamento della muscolatura liscia, chiamata anche la stimolazione del campo elettrico (EFS) Seguire i punti 1-3,13 e continuare come descritto di seguito. EFS è destinato ad attivare selettivamente i nervi contro muscolatura liscia. I parametri per la stimolazione devono essere scelti con attenzione per evitare la stimolazione della muscolatura liscia diretta.
- Stabilire parametri di stimolazione: tipo di stimolo (impulsi singoli o treni), la durata (durata dell'impulso e durata treno), frequenza e intensità, come descritto nella procedura riportata di seguito e illustrato nelle figure 5A, B.
- Per singolo impulso di stimolazione, durata dell'impulso set, intervallo inter-stimolo e il numero di stimoli desiderati. Parametri di durata stimolazione usuali sono singoli impulsi di 0,05-0,3 durata msec consegnati a intervalli desiderati (Figura 5A). Seguire passo 4.3.1.4 per l'intensità dello stimolo.
- Per la stimolazione treno, impostare la durata treno e l'intervallo treno interregionale. Valori tipici per i tessuti della vescica sono 3-10 sec consegnati almeno 1 mnella parte (Figura 5B). In caso di affaticamento del tessuto (cioè EFS contrazioni diminuiscono durante il periodo di controllo), aumentare l'intervallo treno interregionale.
- Stabilire la frequenza degli stimoli del treno (numero di impulsi in un treno - Figura 5B). Eseguire una curva di risposta in frequenza che vanno 0,5-50 Hz. Frequenze tipiche della vescica sono 10-20 Hz, che danno contrazioni riproducibili e stabili mediati da ATP e ACh. Osservare le risposte in frequenza dipendenti alla stimolazione EFS in nastri topo vescica in Figura 5 che dimostrano come questo metodo può essere utilizzato per valutare il contributo di colinergica e meccanismi purinergici di neurotrasmissione.
- Stabilire intensità dello stimolo: aumentare sistematicamente l'intensità (tensione) dello stimolo finché l'ampiezza della contrazione raggiunge un plateau (se utilizzando treni mantengono costante la frequenza).
- Impostare l'intensità dello stimolo seconda delscopo dell'esperimento. Se l'obiettivo è quello di aumentare le contrazioni neuromediata evocata, quindi utilizzare intensità submassimale tale che l'ampiezza della contrazione è ~ 50% della contrazione massima. Se l'obiettivo è quello di diminuire le contrazioni neuro-evocato, quindi impostare l'intensità al ~ 80% di ampiezza massima per evitare l'affaticamento del tessuto.
- Una volta che i parametri di stimolazione (durata, frequenza e intensità) sono stabilite, consentire ~ 20-30 min per EFS- evocato contrazioni di stabilizzazione prima di test anti-droga.
NOTA: Per verificare la selettività di EFS per la trasmissione neurale, blocco di trasmissione neurale con il bloccante dei canali del Na +, tetrodotossina (TTX; 0.5-1 mM). Eseguire questo passaggio all'inizio dell'esperimento, come TTX lava via relativamente facile. Inoltre, eseguire questo alla fine dell'esperimento (vedere fase 4.3.5. Sotto). - Preparare le soluzioni madre a 1,000x le concentrazioni di lavoro finali per: alfa, beta-metilene ATP (ABMA, un attivatore del recettore purinergicoe desensibilizzante) 10 -2 M, atropina (un antagonista del recettore muscarinico) 10 -3 M (Figura 5C). Osservare altri esempi in Figura 6. L'agonista del recettore 5HT4, cisapride (3 x 10 -6 M, 10 -6 M, 3 x 10 -5 M, 10 -5 M, 3 x 10 -4 M, 10 -4 M, 3 x 10 -3 M, 10 -3 M), aumenta la contrattilità dei tessuti e SB-203186 (3 x 10 -3 M), un antagonista del recettore 5HT4, inverte gli effetti di cisapride.
- Per testare gli effetti di ABMA e atropina su EFS (Figura 5C), effettuare due curve di risposta in frequenza di controllo. Aggiungere 10 ml di 10 -2 M ABMA al bagno per una concentrazione finale di 10 mM. Questo si contrarrà il tessuto dovuto alla stimolazione diretta dei recettori purinergici nel muscolo liscio. Dopo la risposta ritorna al basale, ripetere le curve di risposta in frequenza. Aggiungere 10 ml di 10 -3 M atropina per un Concentrat finaleione di 1 micron. Dopo circa 10 minuti (necessario per la atropina per bloccare i recettori muscarinici), ripetere le curve di risposta in frequenza. Nel strisce parallele aggiungere 10 ml di veicolo, acqua, ad ogni passo.
NOTA: Per altri esempi in Figura 6, aggiungere 10 ml di ciascuna soluzione cisapride magazzino ad intervalli di tempo definiti (~ ogni 15 min; vedi discussione), seguita da 10 ml di SB-203186 soluzione madre direttamente al bagno e monitorare il loro effetto sulla contrazione EFS-indotta. Nel strisce parallele aggiungere 10 ml di veicolo, DMSO. Osservare gli effetti di cisapride, un agonista del recettore 5HT4, su contrazioni EFS evocati in vescica e ileo tessuti umani in Figura 6. Inoltre, osservare l'effetto del DMSO, il veicolo per cisapride, su EFS-evocate contrazioni della vescica e tessuti umani ileo . - Alla fine del protocollo EFS verificare la selettività di EFS bloccando la trasmissione neurale con il bloccante dei canali Na +, tetrodotossina (TTX; 0,5-1 &# 181, M). Se le contrazioni TTX resistenti sono ancora presenti, si raccomanda di regolare la durata e l'intensità dello stimolo in esperimenti successivi.
- Stabilire parametri di stimolazione: tipo di stimolo (impulsi singoli o treni), la durata (durata dell'impulso e durata treno), frequenza e intensità, come descritto nella procedura riportata di seguito e illustrato nelle figure 5A, B.
- Per determinare gli effetti dei farmaci su siti pre o post-sinaptica (Figura 7A) seguire i passi da 1 a 4.3.2. Stabilire risposte riproducibili a carbacolo e EFS, quindi aggiungere X. droga
- Alla fine dell'esperimento, sganciare o sciogliere le strisce, asciugare delicatamente su un pezzo di carta velina per eliminare liquidi in eccesso e misurare il peso di ogni striscia utilizzando una bilancia. Anche misurare la lunghezza del tessuto utilizzando un calibro per determinare area della sezione trasversale. Queste informazioni vengono utilizzate per la normalizzazione dei dati (vedere la sezione 5.4).
Analisi dei dati 5.
Analizzare i dati utilizzando un software adeguato (ad esempio, Windaq, LabChart).
- Per attività spontanea, selezionare una finestra di almeno 30 secondi prima e al picco della risposta indotta dal farmaco e miasure ampiezza e frequenza dell'attività miogenico (Figura 3).
- Utilizzare veloce analisi di trasformazione di Fourier per determinare lo spettro di frequenze che contribuiscono alla contrattili risposte e se ci sono differenze tra le diverse parti della vescica (ad esempio, la cupola vs collo) o con lo sviluppo, la patologia e la droga 8.
- Per gli effetti sul tono della muscolatura liscia selezionare una finestra di almeno 10-30 secondi prima e al picco della risposta indotta dal farmaco e misurare l'ampiezza di contrazione.
- Per gli effetti sulle contrazioni neuro-evocati misurare l'ampiezza, la durata e l'area sotto la curva delle contrazioni (almeno 3) prima e al picco della risposta farmaco-indotta.
NOTA: E 'necessario misurare sia l'ampiezza e l'area sotto la curva delle contrazioni EFS-indotte perché i componenti purinergici e colinergici hanno diverse cinetiche. La componente purinergico è veloce e transitoria (ATP attiva purinergic canali ionotropici come P2X1 che permettono rapido afflusso di calcio, poi desensibilizzare), contribuendo così più della risposta di picco di ampiezza e meno per l'area sotto la curva. La componente colinergica è più lenta e sostenuta (ACh attiva i recettori muscarinici metabotropici, che richiedono più tempo per attivare meccanismi intracellulari che alla fine attivano i canali ionici che depolarizzano la muscolatura liscia di indurre una contrazione). Pertanto, il componente muscarinico viene catturata meglio misurando l'area sotto la curva. - Normalizzare i dati per poter confrontare i risultati tra strisce e trattamenti farmacologici. Il parametro scelto per la normalizzazione non dovrebbe essere influenzata dai composti in esame, condizione patologica studiato o disegno sperimentale. Tra questi parametri, peso uso strip, sezione trasversale, risposte KCl (Figura 4B),% della risposta massima (Figura 7B) o% della massima risposta ad un altro agente contrattile(Ad esempio, CCH) o agenti rilassanti (ad esempio, papaverina).
Risultati
Spontanea Attività Miogenica
Attività miogena spontanea è una caratteristica importante della muscolatura liscia che subisce cambiamenti con lo sviluppo postnatale 6-9 e patologia (ad esempio, SCI, BOO) 3-5. Poiché questa attività è creduto di contribuire ai sintomi della vescica iperattiva (OAB) 2, una valutazione di recettori, vie intracellulari e agenti farmacologici che modulano essa, è di grande interesse per lo sviluppo di trattamenti efficaci per OAB e di altre disfunzioni muscolari lisce. Il metodo qui presentato può facilmente esaminare tali questioni figura 2 illustra diversi modelli di attività spontanea miogena durante lo sviluppo in neonatale (i), giovanile (ii) adulti (iii) e del midollo spinale feriti ratti. (SIC, iv). Strisce da ratti neonati mostrano grande ampiezza, contrazioni ritmiche a bassa frequenza (Figura 2AI), mentre strisce da ratto adultos esibiscono piccola ampiezza, attività ad alta frequenza (Figura 2Aii iii,). Dopo SCI il modello neonatale riemerge (Figura 2Aiv). Oltre a utilizzare strisce da modelli animali, vari agenti farmacologici possono essere usati per indurre contrazioni spontanee in strisce da animali nati, al fine di comprendere i meccanismi sottostanti le contrazioni spontanee. Esempi di agenti farmacologici adatti includono agonisti dei recettori muscarinici (carbacol; CCh)., Composti che aumentano i livelli di ACh (come gli inibitori acetilcolina esterasi), basse concentrazioni di KCl (ad esempio, 20 mm) o altri farmaci sperimentali Figure 3A-B, illustrare modulazione di attività spontanea da agenti farmacologici che agiscono sui canali KCNQ situati sulla muscolatura liscia. L'opener canale KCNQ, flupirtine, diminuisce l'ampiezza e la frequenza delle attività spontanea in modo concentrazione-dipendente (Figura 3Ai-iii), mentre ilKCNQ antagonista, XE991, diminuisce l'ampiezza, ma aumenta la frequenza di attività spontanea (Figura 3Bi-iii).
Tono della muscolatura liscia
Proprietà tono della muscolatura liscia e la contrattilità sono fattori importanti per il corretto funzionamento della vescica durante lo stoccaggio e svuotamento. Questo metodo può facilmente schermare gli effetti di agenti farmacologici sul tono della muscolatura liscia. Figure 3Aiv e 3Biv mostrano che flupirtine diminuisce tono basale, coerente con il rilassamento della muscolatura liscia, mentre l'aumento XE991 tono della muscolatura liscia. Figura 4 illustra concentrazione aumenti dipendenti di tono della muscolatura liscia attivando i recettori bombesin con neuromedin B (NMB, 4A, B) o recettori muscarinici con carbachol (CCh, figure 4C, D). Inoltre, vie intracellulari che mediano queste risposte muscolari lisce possono essere indagati ucantare modulatori specifici (dati non riportati).
Risposte neuromediata e modulazione della neurotrasmissione
Vescica contrazione si ottiene il rilascio di ACh / ATP dai nervi efferenti parasimpatiche. Il contributo dei sistemi muscarinici e purinergici di contrazione della vescica varia da specie a specie e le condizioni patologiche, con predominante aumento del contributo purinergico in patologie quali cistite interstiziale, ostruzione parziale, e la vescica iperattiva 26. Figura 5C illustra l'utilizzo di questo metodo per determinare il contributo delle componenti muscarinici e purinergici di neurotrasmissione in strisce vescica del mouse. Il contributo della componente colinergica è stata valutata utilizzando l'antagonista dei recettori muscarinici, atropina. Il contributo del sistema purinergica è stata valutata utilizzando l'attivatore del recettore purinergico e desensibilizzante, alfa, beta-metilene ATP (ABMA). Inoltre, il contributo dipendente dalla frequenza di ciascun componente è stato valutato variando la frequenza di stimolazione a bassa sia ad alte frequenze (2-50 Hz).
La forza della contrazione della vescica gioca un ruolo significativo nella svuotamento in modo efficiente. Utilizzando questo metodo, recettori e vie che modulano la trasmissione neurale possono essere studiati come bersagli farmacologici per invalidare disfunzioni. I recettori 5HT4 sono espressi pre-junctionally nei neuroni parasimpatici e la loro attivazione aumenta i livelli di ACh 27. La Figura 6 illustra l'effetto eccitatorio del agonista del recettore 5HT4, cisapride, in strisce vescica e ileo umani.
Vari protocolli sperimentali possono essere utilizzati per determinare il sito di azione di un composto in esame. Diagramma in Figura 7A illustra un protocollo utilizzato per valutare pre vs siti post-giunzionali. Se il farmaco X riduce (o aumenta) la risposta EFS ma non ha effit sulla risposta CCh, il sito più probabile di azione è pre-giunzionale. Se il farmaco X altera sia la risposta EFS e CCh, allora può agire sui recettori situati post-junctionally o entrambi-junctionally pre e post.
Ruolo di ogni componente: muscolo liscio, mucosa, e neuronale
Condizioni patologiche diverse possono incidere vari componenti della vescica. Per esempio cistite interstiziale (IC) colpisce principalmente dell'urotelio, mentre OAB può provocare alterazioni della contrattilità della muscolatura liscia. Inoltre, i recettori diversi possono essere espressi in ogni componente della vescica e quindi potrebbero essere specificamente mirati in una certa patologia. A differenza dei metodi in vivo, che misurano un effetto netto di tutti i componenti della vescica, questo metodo in vitro permette lo studio di particolari componenti utilizzando una combinazione di procedure chirurgiche e farmacologiche. Per testare muscolo liscio contrazione / rilassamento in assenza di neuronaletrasmissione, TTX (0.5-1 mM) possono essere aggiunti al bagno. Nella Figura 4, NMB e CCh stati testati in presenza di TTX. Per testare il contributo della mucosa (urotelio e lamina propria) alla contrattilità del muscolo liscio, strisce con e senza lo strato mucoso vengono confrontati. Figura 7B mostra che le risposte a CCh sono ridotti in presenza di mucosa nel maiale 28. Risultati simili sono stati riportati in strisce vescica umani 29. Per testare il ruolo delle fibre nervose, diversi approcci possono essere prese. Uno è quello di attivare o inibire fibre specifiche mediante agenti farmacologici. Ad esempio, la capsaicina attiva una specifica popolazione di nervi afferenti e provoca specie dipendenti contrazione della muscolatura liscia o rilassamento 17,18. Guanetidina inibisce il rilascio di noradrenalina da fibre simpatiche, eliminando così il contributo di tali fibre. Un altro approccio è quello di desensibilizzare / eliminare le fibre specifiche in vivoprima dell'esperimento. Ad esempio, il trattamento sistemico dell'animale con capsaicina capsaicina desensibilizza nervi afferenti sensibili. Altri componenti della vescica che possono essere studiati in questa preparazione sono cellule interstiziali o giunzioni attivando o bloccarli con agenti specifici.
Differenze di specie
Mentre la maggior parte lo sviluppo di farmaci è destinato per il trattamento di patologie umane, la ricerca di base viene eseguita principalmente nei tessuti animali. Esistono differenze Specie in un certo numero di recettori. Ad esempio, agonisti del recettore 5HT4 migliorare contrazioni neuro-evocati nella vescica umana, ma non nel ratto vescica 19,30, EFS-indotta contrazioni sono quasi esclusivamente atropina-sensibile in detrusore scimmia umana e vecchio mondo da vesciche stabili 31 ma diventano parzialmente atropina-resistente in detrusore umano di pazienti con condizioni di vescica instabile (ad esempio, neurogena, obstructevesciche d) 15,32,33, la capsaicina suscita una risposta eccitatoria in strisce di ratto e della vescica umana, nessuna risposta in strisce vescica del maiale e la risposta inibitoria in strisce vescica cavia 17,18. figura 4 mostra che bombesin agonisti del recettore avere effetti eccitatori su rat vescica e nessun effetto sul mouse e vescica di maiale strisce 16. Questa informazione è fondamentale per la selezione del modello animale appropriato per studiare un recettore specifico.
Confronto di sensibilità attraverso organi
I farmaci destinati al trattamento di disturbi della vescica possono influire muscolo liscio da altri organi, come il tratto gastrointestinale, uretra, cistifellea, ecc Questo metodo permette di stimare selettività organo e la sensibilità di un agente farmacologico confrontando diversi tessuti fianco a fianco. Come illustrato in figura 6, agonista del recettore 5HT4, cisapride, ha differireent efficacia e potenza in vescica umana contro il tessuto ileo.

Figura 1 Set-up sperimentale e nastri vescica preparazione. A) Schema del set-up sperimentale. Strisce vescica sono immerso in alloggiamenti del tessuto riempite con soluzione di Krebs aerato mantenuta a 37 ° C tramite una pompa di acqua circolante. Una estremità della striscia è collegata a un trasduttore di forza isometrica per misurare la contrattilità del tessuto, l'altro ad una canna fissa. Il trasduttore di forza è collegato ad un amplificatore e di computer per la registrazione dei dati. Elettrodi di stimolazione di campo elettrico collegato ad uno stimolatore vengono inseriti nella camera e utilizzati per evocare contrazioni vescicali neuromediata. B) Preparazione di strisce di tessuto. La vescica è immobilizzato in un piatto e vengono eseguite le seguenti procedure: # 1 taglio verticali though metà ventrale della vescica da dell'uretra a cupola per aprire la vescica in un foglio piatto. # 2 tagli orizzontali rimuovere la cupola e la base della vescica / uretra prossimale. . # 3 tagli verticali che dividono la metà vescica in strisce uguali (4 strisce da una vescica di ratto) C) Schema dei componenti della striscia: muscolatura liscia e la mucosa, entrambi contenenti afferente (blu) ed efferenti (verde) nervi. Mucosa consiste dell'urotelio e lamina propria. Lamina propria contiene vasi sanguigni [1], cellule interstiziali [2], e muscolaris mucosae [3]. La linea tratteggiata etichettata # 2b indica la procedura per la rimozione di strati mucosa. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2 Miogenica attività spontanea durante lo sviluppo e dopopatologia. A) Esempi di attività spontanea in neonatale (i), giovanile (ii), midollo adulto intatto (iii) e midollo spinale danneggiato (SCI) adulti (iv) le strisce di ratto vescica. Il ratto SCI è stato usato a 4 settimane dopo l'intervento. B, C) Sintesi di ampiezza (B) e frequenza (C) di contrazioni spontanee nei quattro gruppi studiati. (Riprodotto con il permesso di Artim DE, Kullmann FA, Daugherty SL, Bupp E, Edwards CL, de Grano WC Neurourol Urodyn 2011 Nov; 30 (8):.. 1666-1674.) Cliccate qui per vedere una versione più grande di questo figura.
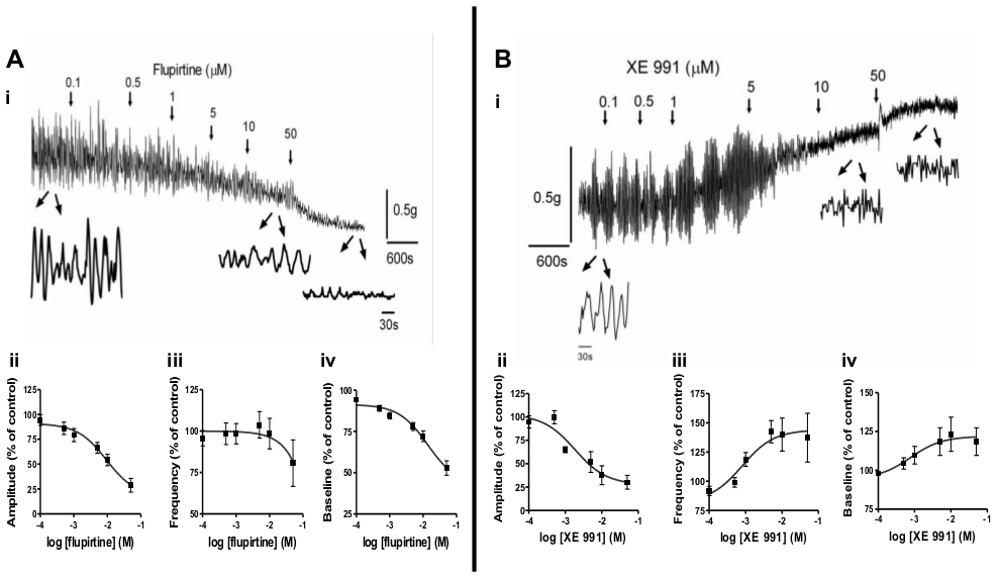
Figura 3 Modulazione di attività spontanea miogenico e tono della muscolatura liscia. A) L'effetto della opener canale KCNQ, flupirtine, sull'attività spontanea e il tono basale in strisce vescica di ratto adulto. (I) Flupirtine è stato aggiunto in concentrazioni crescenti (cumulativo) ai tempi indicati dalle frecce. Gli ingrandimenti sotto la traccia mostra 4 minuti di attività striscia di controllo durante e dopo l'applicazione di 10 micron e 50 micron flupirtine. (Ii-iv) Sintesi degli effetti del flupirtine (7 strisce da 4 ratti) in ampiezza (ii) e frequenza (iii) di attività spontanea e il tono basale (iv), espresso come variazione% rispetto ai valori di controllo (pre-droga) , che sono stati fissati al 100%. B) L'effetto del bloccante dei canali KCNQ, XE991, sull'attività spontanea e il tono basale in strisce vescica di ratto adulto. (I) XE991 è stato aggiunto in concentrazioni crescenti (cumulativo) ai tempi indicati dalle frecce. Gli ingrandimenti sotto traccia mostrano 2 min di attività striscia di controllo durante e dopo l'applicazione di 10 micron e 50 micron XE991. (Ii-iv) Sintesi degli effetti del XE991 (9 strisce da 4 ratti) sulampiezza (ii) e frequenza (iii) di attività spontanea e il tono basale (iv), espresso come variazione% rispetto ai valori di controllo (pre-droga), che sono stati impostati al 100%. Cliccate qui per vedere una versione più grande di questa figura .

Figura differenze 4. specie. A) dipendente dalla concentrazione le contrazioni della muscolatura liscia in risposta alla agonista del recettore bombesin, neuromedin B (NMB), in strisce di ratto vescica. B) Sintesi degli effetti di NMB sulla contrazione della muscolatura liscia delle strisce ratto vescica. I dati sono normalizzati al KCl (80 mm) di risposta. C, D) Assenza di risposte alla NMB in mouse (C) e di maiale (D) strisce vescica. Carbachol (CCh) suscita forte concentrazione con dipendentitrazioni in entrambe le strisce mouse e suini, a indicare che le strisce possono rispondere agli stimoli. TTX (0,5 mM) era presente nel bagno in tutte le strisce. (Riprodotto con il permesso di Kullmann FA, McKenna D, Wells GI, Thor KB neuropeptidi 2013 Ottobre; 47 (5):.. 305-13) , cliccate qui per vedere una versione più grande di questa figura.
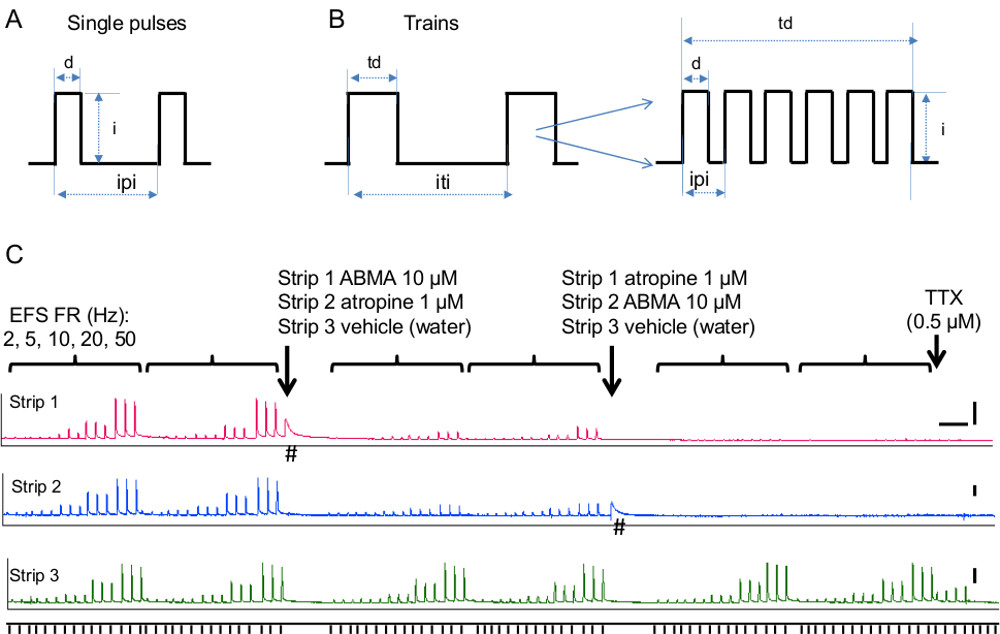
Figura 5 stimolazione di campo elettrico. A) Schema di singoli parametri di stimolazione degli impulsi. Abbreviazioni: D = durata di impulso, i = intensità di impulso, IPI = intervallo tra impulsi B) Schema di parametri di stimolazione treno.. Abbreviazioni: durata td = treno, i = intensità di impulso, iti = intervallo treno interregionale. Inserto mostra il numero di impulsi in un treno e l'intervallo betwli een, che insieme con la durata treno determinare la frequenza di stimolazione treno. C) Contributo di componenti purinegic e colinergici di neuro-evocato contrazioni vescicali. EFS-FR rappresentano frequenze di stimolazione, 2, 5, 10, 20, 50 Hz. Tre stimoli consegnati ogni 90 secondi sono stati testati per ogni frequenza e ogni serie di frequenza è stata ripetuta due volte nel controllo e due volte dopo l'aggiunta di ogni composto. Alfa, beta-metilene ATP, abbreviato ABMA (striscia 1), è stato utilizzato per desensibilizzare i recettori purinergici e atropina (striscia 2) è stato utilizzato per bloccare i recettori muscarinici. Striscia 3 servito come controllo ed è stato trattato con il veicolo, acqua. Le frecce indicano il momento in cui ciascun composto è stato aggiunto ad ogni striscia. Si noti che le contrazioni EFS-evocate sono fortemente ridotti ABMA e atropina, pur non interessata dal veicolo. TTX stato aggiunto alla fine dell'esperimento mentre l'EFS è stato consegnato a 20 Hz. Si noti che i restanti contrazioni osservate nel controllostriscia 3 sono stati aboliti da TTX, dimostrando la loro natura neurale (cioè iniziato da rilascio di neurotrasmettitore dai nervi intramurali). # Indica le risposte muscolari lisce a ABMA in assenza di EFS. Barre di scala sono 5 minuti per asse x e 2 g per asse y. Cliccate qui per vedere una versione più grande di questa figura.

Figura 6 Modulazione delle contrazioni della vescica neuro-evocate. A, B) Esempi di valorizzazione delle contrazioni neuro-evocate dal agonista del recettore 5HT4, cisapride in vescica umana (A) e strisce di ileo (B). Cisapride (record neri) o DMSO (record di grigio) è stato aggiunto in un modo dipendente dalla concentrazione ai tempi indicati dalle frecce. Barre nere sotto i record di ciascun pannellorappresentano EFS, che consisteva di 10 sec treni consegnati a 20 Hz ogni 120 sec. Barre verticali sono in scala 1 g per tutti gli esempi. Concentrazione TTX era di 0,5 micron. CF) Sintesi dell'area sotto la curva (AUC) di contrazioni EFS-evocati in risposta alla cisapride (barre nere) o DMSO (barre grigie) in strisce vescica (C, D) e strisce ileo (E , F). In CF, SB sta per SB-203186, che rappresenta una sintesi dei dati ottenuti dopo l'aggiunta del antagonista del recettore 5HT4. Le linee tratteggiate sono impostati al 100% e rappresentano il controllo. (Riprodotto con il permesso di Kullmann FA, Kurihara R, Ye L, Wells GI, DG McKenna, Burgard CE, Thor KB Auton Neurosci 2013 Giugno; 176 (1-2):... 70-7) Fare clic qui per visualizzare un grande versione di questa figura.
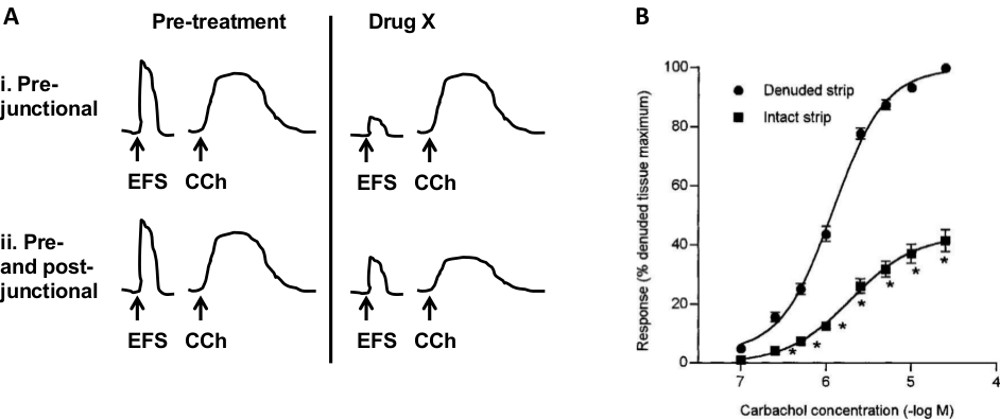
Figura 7. siti di azione dei farmaci e il ruolo dei diversi componenti della vescica. A) Schema di protocollo per identificare il sito d'azione di un farmaco. Le strisce vengono stimolati con FSE e carbacolo (CCh). In i farmaci X riduce la risposta EFS ma non la risposta CCh, indicando un pre-giunzionale di azione. In II, farmaco X altera entrambe le risposte, indicando un'azione sui recettori post-giunzionali o entrambi pre-e post-giunzionali. B) Influenza della mucosa sulla contrazione della muscolatura liscia. Effetti di carbachol sono diminuiti in strisce con la mucosa presente (intatto) rispetto a strisce con la mucosa rimosso (denudato). (B è riprodotta con il permesso di Hawthorn MH, Chapple CR, Cazzo M, Chess-Williams R. Br J Pharmacol 2000 Febbraio; 129 (3):. 416-9). Cliccate qui per vedere una versione più grande di questa figura.
Discussione
In questo lavoro abbiamo descritto un semplice metodo in vitro liscio contrattilità muscolare che può essere utilizzato per affrontare una serie di importanti questioni scientifiche relative alla fisiologia della vescica e della patologia, oltre a favorire la scoperta di nuovi farmaci per il trattamento di disfunzioni della vescica. Abbiamo illustrato l'utilizzo di questo metodo per valutare le proprietà di sviluppo, patologiche e farmacologiche di contrattilità della vescica muscolo liscio (figure 2-4), modulazione neurotrasmissione (Figure 5-7A), differenze di specie (Figura 4), differenze di organi (Figura 6) e la rilevanza dei componenti della vescica specifici (ad esempio, mucosa, Figura 7B). Ulteriori applicazioni non illustrati qui includono la valutazione dei meccanismi intracellulari che utilizzano agenti farmacologici 3,10,11, relazioni struttura-attività delle varie droghe 22-24, o la valutazione / quantificazione dei rele trasmettitorease dopo stimolazione neurale 25.
Mentre la funzione della vescica può in definitiva essere valutata in vivo, questo metodo in vitro supera molte situazioni che sono problematici in vivo. Questi includono situazioni in cui le manipolazioni chirurgiche e farmacologiche sarebbe ridurre la vitalità e / o la sopravvivenza dell'organo o l'animale, l'uso di tessuti umani, la necessità di identificare e caratterizzare le risposte da componenti specifici (ad esempio, muscolo liscio vs epitelio vs nervi ) o l'uso di prodotti chimici costosi. Il metodo permette di indagine sistematica degli effetti di vari agenti farmacologici nonché patologia sull'attività contrattile della muscolatura liscia e in modo e ambiente ben controllata.
Il metodo fornisce una pletora di informazioni; Tuttavia, occorre prestare attenzione quando si interpretano e estrapolando queste informazioni. Questo è un metodo in vitro di una preparazione ridotta, discollegato dal suo ambiente normale e controllo neurale. Le condizioni sperimentali non sono fisiologica, quindi i dati potrebbero non riflettere interamente in situazioni fisiologiche vivo. Ad esempio, il metodo non può tenere conto di cambiamenti nel flusso sanguigno, ormoni, sostanze umorali, forze meccaniche esterne, o il controllo neurale estrinseca. Tissue è acutamente decentrata, così le risposte di pregiudizio e di ischemia correlata devono essere valutati e presi in considerazione. Le alterazioni patologiche che si verificano nel cervello o nel midollo spinale non possono essere testati con questo metodo a meno che non siano già modificato afferente, muscolo liscio, mucosa o la funzione del nervo intramurale (cioè plasticità cellulare). Stimolazione di campo elettrico (EFS) permette la valutazione di risposte neuro-mediata. Tuttavia, si eccita indiscriminatamente tutti i nervi nella striscia (ad esempio, simpatico, parasimpatico, afferenze), a differenza di situazione in vivo in cui il riflesso della minzione attiva solo particolare pathways. Un modo per superare questa situazione è quello di combinare EFS con antagonisti specifici che bloccano selettivamente diversi percorsi. Ad esempio, guanetidina potrebbe essere utilizzato per bloccare il rilascio di noradrenalina quando si studia le proprietà di contrazione, o atropina potrebbe essere utilizzato per bloccare i recettori muscarinici per evitare contrazioni della vescica quando si studia le proprietà di rilassamento. Infine, la vitalità del tessuto è limitata ad un certo numero di ore. In generale, la maggior parte dei componenti del tessuto della vescica sono vitali e stabili (cioè rispondere alle EFS senza risposte deterioramento) per un periodo di 6-8h o più. Tuttavia, altri tessuti possono essere più sensibili (ad esempio, ileo dura ~ 6 ore o meno, l'esperienza personale dell'autore).
Anche se il metodo è tecnicamente fattibile e con buona riproducibilità, ci sono diversi passaggi critici necessari per garantire il suo successo. In primo luogo, preparazione dei tessuti deve essere eseguita con attenzione per garantire la redditività apportando modifiche necessariela procedura di dissezione (evitare l'allungamento dei tessuti durante la preparazione delle strisce) e / o supporto se necessario per diversi tipi di tessuto o specie. Un altro passo fondamentale è la creazione-up parametri di stimolazione neuronali, in modo tale che gli effetti siano evitati soffitto. Come descritto nella sezione metodo, questo dipende dal tipo di esperimento condotto e atteso meccanismo di azione del composto in esame. Ad esempio, per testare gli effetti di cisapride, un agonista del recettore 5HT4, su strisce di vescica (Figura 6), abbiamo impostato l'ampiezza della contrazione EFS evocata a ~ 50% del massimo. Questo è stato basato sul noto meccanismo di azione di agonisti dei recettori 5HT4, cioè migliorando il rilascio di ACh dai nervi pre-giunzionale parasimpatico 27, che a sua volta dovrebbe aumentare le contrazioni EFS-evocati. La stimolazione del muscolo vs nervi deve essere testato con TTX, che inibisce la trasmissione neurale e quindi dovrebbe inibire le contrazioni EFS-evocati. Controlli adeguati per veicoli e time deve essere eseguita durante la prova della droga per spiegare il deterioramento del tessuto con il tempo e per eventuali effetti del veicolo. Ad esempio, molti farmaci vengono disciolte in DMSO o etanolo. I nostri dati (Figura 6) mostrano che DMSO (0,1% e superiore) può aumentare le contrazioni neuro-evocati, un effetto che deve essere sottratto l'effetto della droga prova. Allo stesso modo, l'etanolo (fino all'1%) riduce le contrazioni della muscolatura liscia spontanee ma non ha alcun effetto sulla neuro-evocato contrazioni 34,35. Se si utilizza animali geneticamente modificati o modelli chirurgici (ad esempio, lesioni del midollo spinale o ovariectomia), i controlli dovrebbero includere tessuto dalla appropriato ceppo sfondo del mouse o sham operati animali, rispettivamente. Inoltre, alcuni tessuti, come umani, topo e cavia vesciche contengono gangli intramurale. Quando si lavora con questi tessuti, la selezione del protocollo e l'interpretazione dei dati deve tener conto degli effetti di farmaci o EFS su ne intramuraleurons che stimolano ulteriormente la muscolatura liscia.
Progettare il protocollo sperimentale, scegliendo i giusti parametri (per EFS, per la stimolazione di droga) e le concentrazioni da testare sono fondamentali per garantire che i dati significativi. Mentre parametri devono essere regolati per i singoli tessuti e farmaci, principi generali / linee guida riportate qui di seguito sono applicabili. Cumulativi curve concentrazione-risposta sono auspicabili, ma questo non è possibile per tutti i composti. Farmaci mirati recettori che desensibilizzare, come ad esempio i recettori ionotropici purineric (P2X), o farmaci che vengono metabolizzati rapidamente nel tessuto (esempio ACh), non possono essere testati in modo affidabile utilizzando le curve concentrazione-risposta cumulative nello stesso tessuto. In questi casi, singole concentrazioni sono testati in diversi gruppi di tessuto. Per valutare desensibilizzazione, si consiglia di confrontare la grandezza della risposta ottenuta da una singola concentrazione più alta di quella raggiunta al termine di una concentrazione cumulativacurva di risposta.
Per il montaggio preciso dei dati ottenuti dalle curve concentrazione-risposta, è opportuno testare mezzo concentrazioni di registro (ad esempio CCh in Figura 6). Tuttavia, le concentrazioni di registro (NMB esempio in Figura 4A) sono accettabili quando vitalità del tessuto può essere limitata o altri vincoli può essere a posto.
Per selezionare un intervallo di concentrazione di un nuovo composto, in esperimenti preliminari, è utile considerare l'affinità di legame del composto di prova e due potenza di 10 sopra e sotto tale concentrazione. In esperimenti successivi, il protocollo è raffinato per stabilire un punto di partenza in cui si osserva alcun effetto del farmaco e un punto finale in cui sia la risposta è massima o la concentrazione testata non è più specifica per il target previsto.
L'intervallo di tempo per l'applicazione di un farmaco deve essere scelto tenendo in considerazione diversi fattori: a) Tempo per unfarmaco abbia effetto. In generale i farmaci mirati recettori di membrana avere una risposta relativamente veloce (secondi o minuti), mentre i farmaci per bersagli intracellulari (ad esempio, forskolina e altri inibitori dell'enzima 36, la tossina botulinica 37) richiede il tempo di incubazione supplementare (30 min - 3 ore). Inoltre, lo spessore dei tessuti può svolgere un ruolo. b) Durata e meccanismo d'azione del farmaco. Per i casi in cui l'effetto farmaco raggiunge un plateau che è sostenuta, come NMB in Figura 4A e cisapride in figura 6, intervalli di tempo di 5-15 minuti tra le applicazioni farmacologiche sono adeguati per la raccolta di dati sufficienti. Questo non è possibile con i farmaci di durata molto più breve di azione o diverso meccanismo d'azione (ATP, CCH). Ad esempio l'effetto di CCh nella Figura 4C e 4D, raggiunge un plateau rapidamente ma la tensione tessuto tende a ritornare al basale. In questo caso, gli intervalli di tempo devono essere regolati secondoly, di solito aggiungendo la successiva concentrazione quando la prima risposta raggiunge un massimo.
L'analisi dei dati, in particolare per la normalizzazione dei dati per consentire il confronto tra le strisce è un passo molto importante. Diversi studi utilizzano parametri diversi per la normalizzazione, tra cui il peso della striscia 38, striscia trasversale area della sezione 39, la risposta KCl 12% della risposta massima 28 o% della risposta massima a un altro agente contrattile (ad esempio, CCH 38). Il parametro normalizzazione dovrebbe essere scelto a seconda dello scopo dell'esperimento, tale che il parametro non è influenzato dalla composti in esame, patologia o disegno sperimentale. Ad esempio, la normalizzazione di risposta KCl elimina il peso e altre dimensioni delle strisce, e quindi potrebbe essere utilizzata per confrontare le risposte in tessuti dove condizione patologica può aumentare il peso delle strisce (ad esempio, il diabete aumenta massa vescica). Inoltre, la ririsposta al KCl non è influenzata dalla rimozione della mucosa / urotelio 29, quindi potrebbe essere utilizzato in esperimenti che valutano diverse componenti della vescica (ad esempio, mucosa vs muscoli lisci).
In sintesi, questo metodo contrattilità fornisce un approccio veloce, facile e molto potente per valutare vescica (e altri organi), fisiologia e farmacologia. Se usato correttamente, fornisce la capacità di manipolare il tessuto in un ambiente ridotta e ben controllato. Nello studio della funzione della vescica urinaria, questo metodo è stato fondamentale per la scoperta e la sperimentazione di composti attualmente utilizzati per la gestione della Rubrica fuori rete, come ad esempio gli antimuscarinici e di nuova concezione β 3 AR agonisti.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo studio è stato sostenuto da NIH R37 e R01 DK54824 DK57284 sovvenzioni a LB.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 °C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and Surgical Instruments | |||
| Sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect, & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1 g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium chloride Potassium chloride Monobasic potassium phosphate Magnesium sulfate Dextrose Sodium bicarbonate Calcium chloride Magnesium chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
Riferimenti
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon