Method Article
Vessie muscle lisse bande de contractilité comme une méthode pour évaluer urinaires inférieures Pharmacologie
Dans cet article
Résumé
Ce manuscrit présente un simple, mais puissant, méthode in vitro pour l'évaluation de contractilité du muscle lisse en réponse à des agents pharmacologiques ou la stimulation du nerf. Les principales applications sont le dépistage des drogues et de la physiologie des tissus compréhension, la pharmacologie et la pathologie.
Résumé
Nous décrivons une méthode in vitro pour mesurer la vessie contractilité du muscle lisse, et son utilisation pour l'étude des propriétés physiologiques et pharmacologiques des muscles lisses ainsi que les changements induits par la pathologie. Cette méthode fournit des informations essentielles pour comprendre le fonctionnement de la vessie tout en surmontant les grandes difficultés méthodologiques rencontrées dans des expériences in vivo, comme les manipulations chirurgicales et pharmacologiques qui affectent la stabilité et la survie de la préparation, l'utilisation de tissus humains, et / ou l'utilisation de produits chimiques coûteux. Il fournit également un moyen d'étudier les propriétés de chaque composant de la vessie (c.-à-muscle lisse, les muqueuses, les nerfs) dans des conditions saines et pathologiques.
La vessie est enlevée d'un animal anesthésié, placé dans une solution de Krebs et couper en lanières. Les bandes sont placées dans une chambre remplie avec une solution tiède de Krebs. Une extrémité est fixée à un tensio isométriquen transducteur pour mesurer la force de contraction, l'autre extrémité est fixée à une barre fixe. Le tissu est stimulée par addition de composés directement dans le bain ou par des électrodes de stimulation de champs électriques qui activent les nerfs, similaire au déclenchement des contractions de la vessie in vivo. Nous démontrons l'utilisation de cette méthode d'évaluation de contractilité des muscles lisses spontanée au cours du développement et après une lésion de la moelle épinière expérimental, la nature de la neurotransmission (émetteurs et récepteurs impliqués), les facteurs impliqués dans la modulation de l'activité du muscle lisse, le rôle des différents composants de la vessie, et les espèces et les différences d'organes en réponse aux agents pharmacologiques. De plus, il pourrait être utilisé pour l'étude des voies intracellulaires impliqués dans la contraction et / ou de relaxation des muscles lisses, les relations structure-activité et l'évaluation de médicaments libération du transmetteur.
La méthode de la lisse de la contractilité du muscle in vitro a été largement utilisée for plus de 50 ans, et a fourni des données qui ont contribué de manière significative à notre compréhension de la fonction de la vessie ainsi que pour le développement pharmaceutique de composés actuellement utilisés en clinique pour la gestion de la vessie.
Introduction
La lisse de la vessie muscle se détend pour permettre le stockage de l'urine, et les contrats de susciter l'urine élimination. Relaxation est médiée par des propriétés musculaires lisses intrinsèques et par la libération tonique de la noradrénaline (NA) des nerfs sympathiques, qui active les récepteurs bêta-adrénergiques (β de 3 AR chez l'homme) dans le détrusor. Annulation est réalisé par l'inhibition de l'entrée sympathique et l'activation des nerfs parasympathiques qui libèrent l'acétylcholine / ATP de contracter le muscle lisse de la vessie 1. De nombreux états pathologiques, y compris le cerveau et / ou une blessure de la moelle épinière, les maladies neurodégénératives, le diabète, l'obstruction de la sortie de la vessie, ou de la cystite interstitielle peuvent modifier profondément la fonction de la vessie, avec de graves répercussions sur la qualité de vie du patient 2. Ces conditions altèrent la contractilité du muscle lisse en affectant un ou plusieurs composants de la vessie: le muscle lisse, les nerfs afférents ou efférents et / ou lemuqueuse.
Plusieurs in vivo et des méthodes in vitro pour étudier la fonction de la vessie ont été développés. In vivo, cystometry est la principale mesure de la fonction de la vessie. Bien que ce soit une préparation intacte qui permet la collecte d'informations dans des conditions proches physiologiques, il ya un certain nombre de circonstances dans lesquelles l'utilisation de bandes de muscle lisse est préférable. Il s'agit notamment des situations où chirurgical et / ou des manipulations pharmacologiques pourraient affecter la survie et la stabilité de la préparation in vivo, ou lorsque les études nécessitent l'utilisation de tissu humain ou des produits chimiques coûteux. Cette méthode facilite également l'examen des effets de la drogue, de l'âge et de la pathologie de chaque composante de la vessie, c'est à dire le muscle lisse, les muqueuses, les nerfs afférents et efférents.
bandes de la vessie ont été utilisés au cours des années par de nombreux groupes de répondre à un certain nombre de questions scientifiques. Ils ont été utilisés pour evachangements de luer l'activité spontanée myogénique induits par la pathologie. Cette activité est censé contribuer à l'urgence et la fréquence des symptômes de la vessie hyperactive (OAB), et est donc une cible pour les médicaments en cours de développement pour la vessie hyperactive 3-9. bandes de la vessie ont également été utilisés pour étudier les facteurs myogéniques et neuronaux qui modulent le tonus musculaire lisse dans le but de découvrir les canaux ioniques et / ou des récepteurs et / ou des voies intracellulaires qui pourraient être ciblées pour induire soit la relaxation ou la contraction du muscle lisse 3,10- 13. D'autres études se sont concentrées sur la nature de la neurotransmission, notamment des émetteurs et des récepteurs impliqués et les changements induits par la pathologie 14,15. En outre, la méthode a été utilisée pour les comparaisons entre les tissus de différentes espèces de 16 18, entre les organes 19-21, et l'évaluation des médicaments relations structure-activité 22-24. Une extension de cette méthode a été utilisée pour MEASURe l'effet des médicaments sur la libération du transmetteur de nerfs efférents 25. En outre, une variété de tissus (vessie, l'urètre, le tube digestif, GI) récoltées à partir d'animaux ou d'humains (de chirurgies ou de tissus de donneurs d'organes approuvés pour la recherche) et d'une variété de modèles animaux, y compris des blessures de la moelle épinière (SCI), l'obstruction de sortie de vessie (BOO), ou la cystite interstitielle (IC) peuvent être étudiés en utilisant cette technique.
Dans cet article, nous illustrons l'utilisation de cette méthode ainsi que des protocoles expérimentaux nécessaires, à répondre à plusieurs questions scientifiques mentionnées ci-dessus.
Protocole
Toutes les procédures décrites ici sont approuvés par le comité IACUC à l'Université de Pittsburgh.
1. Solutions
- Préparer une solution de Krebs selon la recette. Composition en mM: NaCl 118, KCl 4,7, CaCl2 1,9, MgSO4 1,2, NaHCO 3 24.9, KH 2 PO 4 1,2, dextrose 11,7.
- Aérer Krebs avec 95% de O 2, 5% de CO 2 et le placer dans un bain à 37 ° C de l'eau pour être utilisé tout au long de l'expérience. Placer côté ~ 200 ml de solution de Krebs aérée à la température ambiante pour être utilisés pour la dissection de tissus.
- Mesurer le pH (~ 7.4) et l'osmolarité (~ 300 mOsm) aérée de Krebs.
2. expérimental (Schéma Figure 1A)
- Remplir aérée (95% O 2, 5% CO 2) chambres avec 10 ml de Krebs.
- Démarrer la pompe à circulation d'eau pour chauffer les chambres à 37 ° C; allumer l'équipement nécessaire: amplificateur (s), stimulateur (s) et le logiciel d'enregistrement.
- Calibrer les capteurs avec un poids de 1 g.
3. tissus (Figure 1B)
Retirer la vessie d'une femme adulte naïf Sprague Dawley (200-250 g; ~ 10-12 semaines) en suivant ces étapes:
- Préparer la zone de dissection et instruments nécessaires: les rasoirs électriques, des pinces à dents, lame de scalpel, ciseaux de dissection, microciseaux, deux pinces à disséquer (auteurs préfèrent Dumont forceps 3 #), les clips de tissus (ou suture de soie), un plat de dissection enduit Sylgard avec Krebs et repères de la dissection du tissu.
- Anesthésier l'animal avec l'inhalation d'isoflurane (4% de O 2) dans la chambre d'induction. Utilisez pommade vétérinaire sur les yeux pour prévenir la sécheresse alors que sous anesthésie. Surveiller en permanence le niveau de l'anesthésie en observant le taux de respiration, réponse à des stimuli externes, et perte d'un membre arrière retirer réflexe.
- Lorsque l'animal est anesthésié rasage du bas de l'abdomen unerea. Exposer les organes pelviens par une incision abdominale médiane. Identifier la vessie et de l'urètre. Retirer la vessie en coupant au niveau du col de la vessie près de l'urètre proximal. Placez le tissu immédiatement dans le plat recouvert Sylgard rempli de solution aérée Krebs.
- Si nécessaire, enlever le tissu supplémentaire à cette époque: l'urètre, des morceaux de gastro-intestinal (GI) et / ou de la prostate, etc
- Sacrifier l'animal en utilisant des méthodes IACUC approuvés (par exemple surdose d'anesthésique ou CO 2 asphyxie suivie par une méthode secondaire).
- Insérer les broches de tissus disséquer à travers les dômes vessie, le cou et les uretères, pour stabiliser le tissu pour plus de dissection. Ne pas étirer le tissu. Enlever la graisse, le tissu conjonctif, de l'urètre proximal, et les uretères s'il est présent.
- Ouvrez la vessie de la base au dôme de créer une feuille plate, côté séreuse descente côté / luminale (Figure 1B). Placer les repères de dissection à chaque coin du tissu. Retirer la vessie dome et le tissu du col.
- Si le but de l'expérience est de déterminer la contribution de la muqueuse (urothélium et de la lamina propria - voir schéma figure 1C) de la contraction du muscle lisse, comparer les propriétés des bandes du détrusor avec et sans la muqueuse attachée. Pour cela, avant de couper le tissu en bandes, retirez soigneusement la couche muqueuse en utilisant l'iris printemps ciseaux et des pinces fines sous un microscope à dissection. A la fin de l'expérience, fixer les bandes de coloration H & E pour confirmer la suppression complète de la muqueuse. A noter que cette procédure est plus facile dans la vessie de la souris dans la vessie de rat.
- Couper le tissu de la longueur de la base au dôme en bandes de ~ 2 x 8 mm (figure 1B). Attachez ou fixez un clip de tissus aux deux extrémités de chaque bande.
REMARQUE: Une vessie de rat peut généralement être découpé en 4 bandes, mais le nombre de bandes peut augmenter ou diminuer en fonction de la taille des animaux / vessie. - Transférer les bandes à la experchambres imental. Attacher une extrémité de chaque bande à un transducteur de force, qui mesure la contraction des tissus, et l'autre à une tige fixe verre / métal.
REMARQUE: chambres de tissus varient en taille (0,2 ml à 20 ml ou plus). Chambres typiques de vessies de rongeurs sont 5-20 ml, qui offrent une hauteur suffisante pour les bandes d'être complètement immergés dans une solution. Certaines chambres sont équipées de haut-électrodes de stimulation, d'autres non. Il faut prendre soin de s'assurer que toutes les connexions des électrodes sont en bon état, sinon, une stimulation de champ électrique n'est pas fiable. - Appliquer une quantité définie de la force pour chaque bande par étirement en douceur le tissu jusqu'à ce que la tension de référence atteint 1 g (~ 10 mN). Initialement, le tissu a tendance à se détendre qui est enregistré comme une diminution de la tension de référence. Laver le tissu environ toutes les 15 minutes en utilisant la chaleur aérée Krebs et ajuster la tension de référence à 1 g après chaque lavage. Laisser le tissu à s'équilibrer pendant ~ 1-2 heures ou jusqu'à ce que la tension de référence est stable (c'est à dire pas plus de relâchement des tissus).
- Test de viabilité du tissu par l'addition de KCl (80 mM) directement au bain de ~ 5 min, ou jusqu'à ce qu'une réponse de plateau est atteinte. Les réponses à de fortes concentrations de KCl peuvent aussi être répétées au cours de l'expérience ou à la fin de l'expérience et utilisés pour normaliser les réponses à d'autres médicaments ou entre les bandes (voir normalisation vertu de l'article d'analyse de données).
- Plusieurs fois de tissu de lavage (3-5x) avec la chaleur de Krebs aérée pour permettre au tissu de revenir à des conditions de pré-traitement.
4 Protocoles de stimulation
- Pour étudier les effets de la pathologie sur l'activité myogène spontanée ou tonus des muscles lisses, utiliser des bandes de muscles lisses de différents modèles animaux, comme le PCA, BOO, ou le nouveau-né. Figure 2 illustre l'utilisation de cette méthode pour étudier les changements dans la vessie activité spontanée au cours du développement et après la SCI. En outre, des agents pharmacologiques peuvent être utilisés pour moduler spactivité ontaneous. Figure 3 illustre l'effet des modulateurs des canaux KCNQ, flupirtine et XE991, sur l'activité spontanée et tonus des muscles lisses.
- Pour les courbes lisses pharmacologiques stimulation musculaire construct de réponse à la concentration par addition de composés à partir de solutions mères concentrées directement dans le bain à des intervalles de temps définis. Utilisez la drogue et le véhicule en bandes parallèles à tenir compte des effets de véhicules et de temps.
- Faire des solutions mères de composés de test souhaités à 1000x la concentration de travail finale. Pour carbachol (CCh), un agoniste des récepteurs muscariniques, de préparer des stocks suivants: 10 -5 M, 3 x 10 -5 M, 10 -4 M, 3 x 10 -4 M, 10 -3 M, 3 x 10 -3 M , 10 -2 M. Les concentrations finales dans le bain est de 10 -8 M à 10 -5 M (figures 4C et D). Pour neuromédine B (NMB), un sous-type de récepteurs de la bombésine une agoniste, préparer des stocks suivants: 10 -8 M, 10 -7M, 10 -6 M, 10 -5 M, 10 -4 M, 10 -3 M et des concentrations finales dans la salle de bain sont 10 -11 M à 10 -6 M. Les deux CCh et NMB devraient augmenter la contractilité des tissus.
- Pour un bain de tissu de 10 ml, ajouter 10 ul de chaque solution mère CCh dès que la réponse atteint un plateau (figure 4C, D). En bandes parallèles ajouter des quantités égales de véhicule (eau). De même, ajouter 10 ul de chaque solution neuromédine B du stock chaque ~ 5 min.
REMARQUE: Observez l'effet excitateur du NMB et CCh sur le tonus musculaire lisse en bandes de différentes espèces dans la figure 4. - Étudier les propriétés de relaxation des muscles lisses dans les tissus pré-traitées avec un agent excitateur, généralement CCh ou KCl.
- Pour bloquer une réponse agoniste, prétraiter les tissus pour 10-20 min avec l'antagoniste pour permettre la pénétration de tissu, avant agoniste stimulation.
- Pour stim neuronesulation du muscle lisse, aussi appelée stimulation de champ électrique (EFS) suivre les étapes 1 à 3.13 et continuer comme décrit ci-dessous. EFS est destiné à activer sélectivement les nerfs contre le muscle lisse. Paramètres de stimulation doivent être choisis avec soin pour éviter la stimulation des muscles lisses direct.
- Établir des paramètres de stimulation: type de stimulus (des impulsions uniques ou des trains), la durée (durée de l'impulsion et de la durée de train), la fréquence et l'intensité, comme décrit dans les étapes ci-dessous et illustré sur les figures 5A, B.
- Pour la stimulation unique d'impulsion, définissez la durée d'impulsion, intervalle inter-stimulus et le nombre de stimuli souhaités. Paramètres de durée de stimulation habituels sont des impulsions uniques de 0,05-0,3 msec livré à des intervalles souhaités (figure 5A). Suivez l'étape 4.3.1.4 pour l'intensité du stimulus.
- Pour la stimulation de train, régler la durée de train et l'intervalle de train inter. Des valeurs typiques pour les tissus de la vessie sont livrés 10.03 sec au moins 1 mdans l'autre (Figure 5B). Si la fatigue des tissus se produit (c.-à-EFS contractions diminuent pendant la période de contrôle), augmenter l'intervalle de train inter.
- Établir la fréquence des stimuli de train (nombre d'impulsions dans un train - La figure 5B). Exécution d'une courbe de réponse en fréquence allant de 0,5 à 50 Hz. Fréquences typiques de la vessie sont 10-20 Hz, ce qui donne des contractions reproductibles et stables médiation par l'ATP et l'acétylcholine. Respecter les réponses dépendant de la fréquence à EFS stimulation en bandes de la vessie de la souris dans la figure 5 montrant comment cette méthode peut être utilisée pour évaluer la contribution des cholinergique et mécanismes purinergiques à la neurotransmission.
- Établir l'intensité de la stimulation: systématiquement augmenter l'intensité (tension) du stimulus jusqu'à ce que l'amplitude de la contraction atteint un plateau (si l'on utilise des trains de maintenir constante la fréquence).
- Régler l'intensité de la stimulation en fonction de l'but de l'expérience. Si l'objectif est d'augmenter les contractions neuronale évoquée, puis utilisez intensité sous-maximale telle que l'amplitude de la contraction est d'environ 50% de la contraction maximale. Si l'objectif est de diminuer les contractions neuronale évoquée, puis réglez l'intensité de ~ 80% de l'amplitude maximale pour éviter la fatigue des tissus.
- Une fois les paramètres de stimulation (durée, fréquence et intensité) sont établies, permettra ~ 20-30 min pour EFS- évoqué contractions se stabiliser avant de dépistage des drogues.
REMARQUE: Pour vérifier la sélectivité de l'EFS pour la transmission neuronale, transmission nerveuse bloc avec le bloqueur des canaux Na +, la tétrodotoxine (TTX; 0,5-1 M). Effectuer cette étape au début de l'expérience, comme TTX s'enlève relativement facilement. De plus, réaliser cela à la fin de l'expérience (voir l'étape 4.3.5. Ci-dessous). - Préparer des solutions de 1,000x à des concentrations finales de travail pour: alpha, bêta-méthylène ATP (ABMA, un activateur de récepteurs purinergiqueset désensibilisant) 10 -2 M, l'atropine (un antagoniste des récepteurs muscariniques) 10 -3 M (Figure 5C). Observer les autres exemples dans la figure 6. L'agoniste des récepteurs de 5HT4, le cisapride (3 x 10 -6 M, 10 -6 M, 3 x 10 -5 M, 10 -5 M, 3 x 10 -4 M, 10 -4 M, 3 x 10 -3 M, 10 -3 M), augmente la contractilité du tissu et le SB-203186 (3 x 10 -3 M), un antagoniste du récepteur 5HT4, inverse les effets de cisapride.
- Pour tester les effets de l'atropine et ABMA sur EFS (figure 5C), effectuer deux courbes de réponse en fréquence de contrôle. Ajouter 10 ul de 10 -2 M dans le bain ABMA pour une concentration finale de 10 uM. Ce tissu se contracte en raison de la stimulation directe des récepteurs purinergiques dans les muscles lisses. Après le retour de réponse à la ligne de base, répéter courbes de réponse en fréquence. Ajouter 10 ul de 10 -3 M atropine pour un concentrat finaleion de 1 uM. Après ~ 10 min (nécessaire pour l'atropine pour bloquer les récepteurs muscariniques), les courbes de réponse en fréquence de répétition. Dans bandes parallèles ajouter 10 ul du véhicule, de l'eau, à chaque étape.
REMARQUE: Pour d'autres exemples de la figure 6, ajouter 10 ul de chaque solution cisapride des stocks à des intervalles définis de temps (~ toutes les 15 min; voir la discussion), suivis par 10 pi de SB-203186 solution stock directement dans le bain et de surveiller leur effet sur contraction EFS-induite. Dans bandes parallèles ajouter 10 ul du véhicule, le DMSO. Observer les effets du cisapride, un agoniste des récepteurs 5HT4, sur les contractions EFS évoquées dans les tissus de la vessie et l'iléon des droits de la figure 6. Outre, observer l'effet de DMSO, le véhicule pour le cisapride, sur EFS évoqués contractions de la vessie et des tissus humains de l'iléon . - A la fin du protocole EFS vérifier la sélectivité de EFS en bloquant la transmission nerveuse de l'agent de blocage des canaux Na +, la tétrodotoxine (TTX; 0,5-1 et# 181; M). Si les contractions résistants TTX sont toujours présents, il est recommandé d'ajuster la durée et de l'intensité du stimulus dans les expériences suivantes.
- Établir des paramètres de stimulation: type de stimulus (des impulsions uniques ou des trains), la durée (durée de l'impulsion et de la durée de train), la fréquence et l'intensité, comme décrit dans les étapes ci-dessous et illustré sur les figures 5A, B.
- Pour déterminer les effets des médicaments sur des sites pré ou post-synaptiques (figure 7A) suivez les étapes 1 à 4.3.2. Établir des réponses reproductibles au carbachol et EFS, puis ajouter médicament X.
- A la fin de l'expérience, déclipser ou défaire les bandes, éponger délicatement sur un morceau de papier de soie pour éliminer davantage de liquides et de mesurer le poids de chaque bande en utilisant une balance. Mesurer également la longueur de tissu en utilisant un pied à coulisse à déterminer surface de section transversale. Cette information est utilisée pour la normalisation des données (voir section 5.4).
Analyse 5. données
Analyser les données en utilisant un logiciel adéquat (par exemple, Windaq, LabChart).
- Pour l'activité spontanée, sélectionner une fenêtre d'au moins 30 secondes avant et à l'apogée de la réponse induite par les médicaments et moiasure amplitude et la fréquence de l'activité myogène (figure 3).
- Utilisez rapide analyse de la transformation de Fourier pour déterminer le spectre de fréquences qui contribuent à la contraction des réponses et s'il existe des différences entre les différentes parties de la vessie (par exemple, le dôme vs cou) ou avec le développement, la pathologie et la drogue 8.
- Pour les effets sur le tonus musculaire lisse sélectionner une fenêtre d'au moins 10-30 secondes avant et à l'apogée de la réponse induite par les médicaments et de mesurer l'amplitude de la contraction.
- Pour les effets sur les contractions syncope évoqués mesurer l'amplitude, la durée et l'aire sous la courbe des contractions (au moins 3) avant et pendant le pic de la réponse induite par le médicament.
NOTE: Il est nécessaire de mesurer à la fois l'amplitude et l'aire sous la courbe des contractions EFS-induites parce que les composants purinergiques et cholinergiques ont une cinétique différente. La composante purinergiques est rapide et transitoire (ATP active purinergic canaux ionotropiques tels que P2X1 afflux rapide qui permettent de calcium, puis ils désensibiliser), ce qui contribue davantage à la réponse d'amplitude de crête inférieure et de la surface sous la courbe. La composante cholinergique est plus lente et soutenue (ACh active les récepteurs muscariniques métabotropiques, qui nécessitent plus de temps pour activer les voies intracellulaires qui activent finalement canaux ioniques qui dépolariser le muscle lisse pour induire une contraction). Ainsi, le composant muscarinique est capturée par une meilleure mesure de l'aire sous la courbe. - Normaliser les données pour être en mesure de comparer les résultats entre les bandes et les traitements pharmacologiques. Le paramètre choisi pour la normalisation ne doit pas être influencé par les composés d'essai, l'état pathologique ou de la conception expérimentale étudiée. Parmi ces paramètres, le poids utilisation de la bande, surface de section transversale, les réponses au KCl (Figure 4B),% de la réponse maximale (Figure 7B) ou% de la réponse maximale à un autre agent contractile(Par exemple, CCH) ou des agents de détente (par exemple, la papavérine).
Résultats
Activité spontanée Myogenic
L'activité myogène spontanée est une caractéristique importante du muscle lisse qui subit des variations avec le développement postnatal 6-9 et pathologie (par exemple, SCI, BOO) 3-5. Parce que cette activité est estimé à contribuer aux symptômes de la vessie hyperactive (OAB) 2, une évaluation des récepteurs, des voies intracellulaires et des agents pharmacologiques qui modulent il, est d'un grand intérêt pour le développement de traitements efficaces pour la vessie hyperactive et autres dysfonctionnements musculaires lisses. La méthode présentée ici peut facilement étudier ces questions figure 2 illustre les différentes tendances de l'activité spontanée myogénique au cours du développement dans néonatale (i), juvénile (ii) adulte (iii) et la moelle épinière des rats blessés. (SCI; iv). Bandes de rats nouveau-nés présentent une grande amplitude, faible fréquence des contractions rythmiques (Figure 2AI), tandis que des bandes de rat adultes présentent une faible amplitude, l'activité de haute fréquence (figure 2aii iii). Après le modèle SCI néonatale ré-émerge (Figure 2Aiv). En plus d'utiliser des bandes de modèles animaux, les divers agents pharmacologiques peuvent être utilisés pour induire des contractions spontanées chez les animaux naïfs de bandes, dans le but de comprendre les mécanismes qui sous-tendent les contractions spontanées. Des exemples d'agents pharmacologiques appropriés comprennent des agonistes muscariniques du récepteur (de carbachol; CCH)., Des composés qui augmentent les niveaux d'ACh (tels que les inhibiteurs de l'acétylcholinestérase), de faibles concentrations de KCl (par exemple, 20 mM) ou d'autres médicaments expérimentaux figures 3A-B, illustrent modulation de l'activité spontanée par des agents pharmacologiques qui agissent sur les canaux KCNQ situés sur le muscle lisse. Le canal ouvre KCNQ, flupirtine, diminue l'amplitude et la fréquence de l'activité spontanée d'une manière dépendante de la concentration (Figure 3ai-iii), tandis que l'Bloqueur des canaux KCNQ, XE991, mais diminue l'amplitude augmente la fréquence de l'activité spontanée (Figure 3BI-iii).
Bon tonus musculaire
Propriétés lisse de tonus musculaire et la contractilité sont des facteurs importants pour le bon fonctionnement de la vessie pendant le stockage et la miction. Cette méthode peut facilement dépister les effets des agents pharmacologiques sur le tonus musculaire lisse. Figures 3Aiv et 3Biv montrent que Flupirtine diminue basale ton, conformément à la relaxation des muscles lisses, tandis que le XE991 augmentation du tonus musculaire lisse. Figure 4 illustre augmentations proportionnelles à la concentration dans le tonus musculaire lisse par l'activation de récepteurs de la bombésine de neuromédine B (NMB; la figure 4A, B) ou les récepteurs muscariniques de carbachol (CCH; Figures 4C, D). En outre, des voies intracellulaires de médiation ces réponses musculaires lisses peuvent être étudiés uchanter modulateurs spécifiques (données non présentées).
Réponses neurocardiogénique et modulation de la neurotransmission
Contraction de la vessie est obtenue par la libération d'acétylcholine / ATP des nerfs efférents parasympathique. La contribution des systèmes muscariniques et purinergiques de contraction de la vessie varie selon les espèces et les conditions pathologiques, avec augmentation prédominante dans contribution purinergiques dans des pathologies telles que la cystite interstitielle, l'obstruction de la vidange partielle et de la vessie hyperactive 26. Figure 5C illustre l'utilisation de cette méthode pour déterminer l' contribution des composantes muscariniques et purinergiques de la neurotransmission dans les bandes de la vessie de la souris. La contribution de la composante cholinergique a été évaluée en utilisant l'antagoniste des récepteurs muscariniques, l'atropine. La contribution du système purinergiques a été évaluée à l'aide de l'activateur de récepteurs purinergiques et désensibilisant, alpha, bêta-méthylène ATP (ABMA). En outre, la contribution dépend de chaque composante de fréquence a été évaluée en faisant varier la fréquence de stimulation de faible à hautes fréquences (2-50 Hz).
La force de la contraction de la vessie joue un rôle important dans la miction efficacement. En utilisant cette méthode, les récepteurs et les voies qui modulent la transmission nerveuse peuvent être examinés comme cibles médicamenteuses pour annuler dysfonctionnements. Les récepteurs 5HT4 sont exprimés en pré-jonctionnellement neurones parasympathiques et leur activation augmente les niveaux d'ACh 27. Figure 6 illustre l'effet excitateur de l'agoniste du récepteur 5HT4, du cisapride, de la vessie et de l'iléon bandes humains.
Divers protocoles expérimentaux peuvent être utilisés pour déterminer le site d'action d'un composé de test. Diagramme de la figure 7A illustre un protocole utilisé pour évaluer les sites pré-vs post-jonctionnels. Si le médicament X réduit (ou augmente) la réponse EFS, mais n'a pas effect sur la réponse CCH, le site le plus probable de l'action est pré-jonction. Si le médicament X modifie à la fois de réponse EFS et CCH, alors il peut agir sur des récepteurs situés post-jonctionnellement ou les deux avant et après jonctionnellement.
Rôle de chaque composante: muscle lisse, la muqueuse, et neuronale
Les différents états pathologiques peuvent affecter diverses composantes de la vessie. Par exemple la cystite interstitielle (IC) affecte principalement l'urothélium, alors que la vessie hyperactive peut résulter en une altération de la contractilité du muscle lisse. En outre, différents récepteurs peuvent être exprimés dans chaque composant de la vessie, et donc peuvent être spécifiquement ciblés dans une certaine pathologie. Contrairement aux procédés in vivo, qui mesurent un effet net de tous les composants de la vessie, cette méthode in vitro permet l'étude des composants particuliers en utilisant une combinaison de procédures chirurgicales et pharmacologiques. Pour tester le muscle lisse contraction / relaxation en l'absence de neuronestransmission, TTX (0,5 à 1 uM) peuvent être ajoutés au bain. Sur la figure 4, NMB et CCh ont été testés en présence de TTX. Pour tester la contribution de la muqueuse (urothélium et la lamina propria) de la contractilité du muscle lisse, les bandes avec et sans la couche muqueuse sont comparées. Figure 7B montre que les réponses à CCh sont réduits en présence de la muqueuse chez le porc 28. Des résultats similaires ont été signalés dans les bandes de la vessie humaines 29. Pour tester le rôle des fibres nerveuses, plusieurs approches peuvent être prises. La première consiste à activer ou inhiber fibres spécifiques en utilisant des agents pharmacologiques. Par exemple, la capsaïcine active une population spécifique de nerfs afférents et provoque espèce dépendant de la contraction ou la relaxation des muscles lisses 17,18. Guanethidine inhibe la libération de noradrénaline à partir de fibres sympathiques, éliminant ainsi la contribution de ces fibres. Une autre approche consiste à désensibiliser / éliminer les fibres spécifiques in vivoavant l'expérience. Par exemple, le traitement systémique de l'animal avec la capsaïcine désensibilise nerfs afférents sensibles à la capsaïcine. D'autres composants de la vessie qui peuvent être étudiés dans cette préparation sont des cellules interstitielles ou jonctions lacunaires en activant ou en les bloquant avec des agents spécifiques.
différences entre les espèces
Bien que la plupart du développement de médicaments est destinée au traitement de troubles humains, la recherche fondamentale est essentiellement effectuée dans le tissu animal. Les différences entre espèces existent dans un certain nombre de récepteurs. Par exemple, les agonistes des récepteurs 5HT4 améliorer contractions syncope évoqués dans la vessie humaine, mais pas dans la vessie de rat 19,30, EFS-contractions induites sont presque exclusivement atropine sensible dans détrusor de singe humain et du vieux monde de vessies stables 31 mais deviennent partiellement atropine résistant à détrusor humain de patients atteints de conditions instables de la vessie (par exemple, neurogène, obstructed) les vessies 15,32,33, la capsaïcine provoque une réponse d'excitation dans des bandes de vessie de rat et humain, en l'absence de réponse des bandes de vessie de porc et d'inhibition de la réponse en Guinée porc vésicaux bandes 17,18. figure 4 montre que les agonistes des récepteurs de la bombésine avoir des effets excitateurs sur vessie de rat et aucun effet sur la souris et de la vessie de porc bandes 16. Cette information est essentielle pour la sélection du modèle animal approprié pour l'étude d'un récepteur spécifique.
Comparaison de la sensibilité dans les organes
Les médicaments destinés au traitement de troubles de la vessie peuvent aussi influer sur le muscle lisse des autres organes, tels que le tractus gastro-intestinal, de l'urètre, de la vésicule biliaire, etc Cette méthode permet une estimation de la sélectivité d'organe et de la sensibilité à un agent pharmacologique, en comparant les différents tissus côte à côte. Comme illustré sur la figure 6, l'agoniste du récepteur 5HT4, le cisapride, a différerent efficacité et de la puissance dans la vessie humaine contre les tissus de l'iléon.

Figure 1: Dispositif expérimental et la bande de la vessie préparation. A) Schéma du dispositif expérimental. bandes de la vessie sont immergés dans des chambres de tissus remplis de solution aérée Krebs maintenue à 37 ° C par l'intermédiaire d'une pompe de circulation d'eau. Une extrémité de la bande est fixée à un transducteur de force isométrique pour mesurer la contractilité du tissu, l'autre à une tige fixe. Le capteur de force est relié à un amplificateur et à l'ordinateur pour l'enregistrement de données. Des électrodes de stimulation de champ électrique reliés à un stimulateur sont placés dans la chambre et utilisé pour évoquer des contractions de la vessie à médiation neuronale. B) Préparation de bandes de tissu. La vessie est cloué dans un plat et les procédures suivantes sont effectuées: # 1 e verticales coupéesough moitié ventrale de l'urètre à la vessie de dôme d'ouvrir la vessie en une feuille plate. # 2 coupes horizontales enlever le dôme et la base de la vessie / urètre proximal. . # 3 coupes verticales divisant la mi vessie en bandes égales (4 bandes d'une vessie de rat) C) Schéma de composants de bande: le muscle lisse et de la muqueuse, à la fois contenant afférente (bleu) et efférentes (vert) nerfs. Muqueuse se compose de l'urothélium et de la lamina propria. Lamina propria contient les vaisseaux sanguins [1], les cellules interstitielles [2], et musculaire muqueuse [3]. La ligne en pointillé étiqueté # 2b indique la procédure pour enlever la couche de muqueuse. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2 Myogenic activité spontanée au cours du développement et aprèspathologie. A) Exemples d'activité spontanée dans néonatale (i), juvénile (ii), adulte intact moelle (iii) et de la moelle épinière (SCI) adulte (iv) les bandes de la vessie de rat. Le rat a été utilisé SCI à 4 semaines après la chirurgie. B, C) Synthèse de l'amplitude (B) et la fréquence (C) de contractions spontanées dans les quatre groupes étudiés. (Reproduit avec la permission de Artim DE, FA Kullmann, Daugherty SL, Bupp E, CL Edwards, de Groat WC Neurourol Urodyn nov 2011; 30 (8):.. 1666-1674.) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
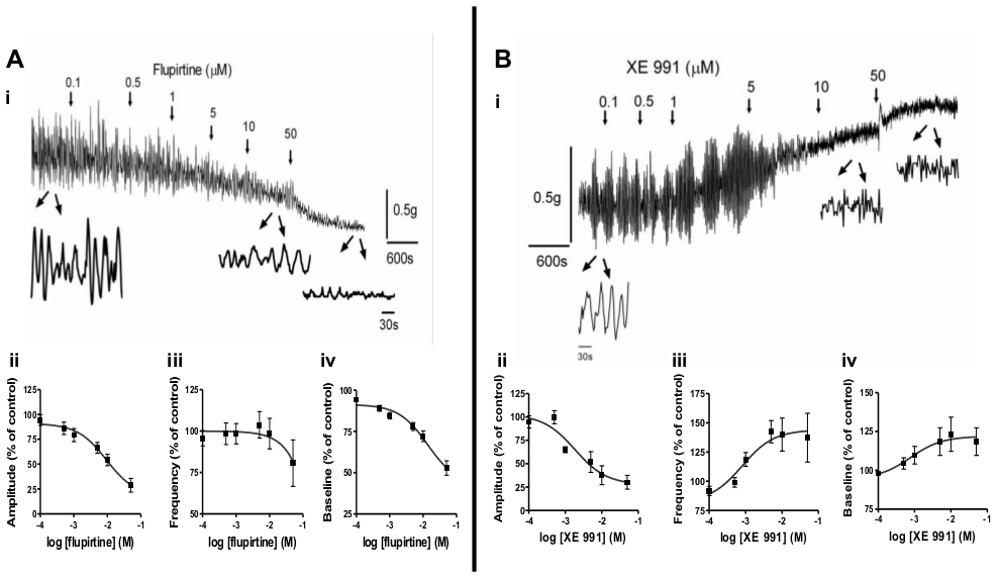
Figure 3 Modulation de l'activité spontanée myogénique et tonus des muscles lisses. A) L'effet du canal ouvre KCNQ, flupirtine, sur l'activité spontanée et le ton de base dans adultes bandes de la vessie de rat. (I) La flupirtine a été ajouté à des concentrations (cumulatif) aux moments indiqués par les flèches de plus en plus. Les élargissements dans le cadre du spectacle trace 4 min de l'activité de la bande lors du contrôle et après l'application de 10 pM et 50 pM Flupirtine. (Ii-iv) Résumé des effets de flupirtine (7 bandes de 4 rats) sur l'amplitude (ii) et la fréquence (iii) de l'activité spontanée et le ton de base (iv), exprimée en% de variation de contrôle des valeurs (pré-drogue) , qui ont été mis à 100%. B) L'effet de l'inhibiteur de canal KCNQ, XE991, sur l'activité spontanée et le ton de base dans adultes bandes de la vessie de rat. (I) XE991 a été ajouté à des concentrations (cumulatif) dans les délais indiqués par des flèches de plus en plus. Les élargissements en vertu de la trace montrent 2 min de l'activité de la bande lors de la commande et après l'application de 10 pM et 50 pM XE991. (Ii-iv) Résumé des effets de XE991 (9 bandes de 4 rats) sur laamplitude (ii) et la fréquence (iii) de l'activité spontanée et le ton de base (iv), exprimée en% de variation de contrôle des valeurs (pré-drogue), qui ont été mis à 100%. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure .

Figure 4: différences entre les espèces. Dépendantes contractions des muscles lisses A) de concentration en réponse à l'agoniste du récepteur de la bombésine, neuromédine B (NMB), en bandes de la vessie de rat. B) Résumé des effets de NMB sur contraction des muscles lisses dans les bandes de la vessie de rat. Les données sont normalisées au KCl (80 mM) réponse. C, D) Absence de réponses aux NMB chez la souris (C) et le porc (D) des bandes de la vessie. Carbachol (CCh) suscite une forte concentration con dépendtractions dans les deux bandes de souris et de porcs, ce qui indique que les bandes peuvent réagir à des stimuli. TTX (0,5 uM) était présent dans le bain dans toutes les bandes. (Reproduit avec la permission de Kullmann FA, McKenna D, Wells GI, Thor KB neuropeptides 2013 PTOM; 47 (5):.. 305-13) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
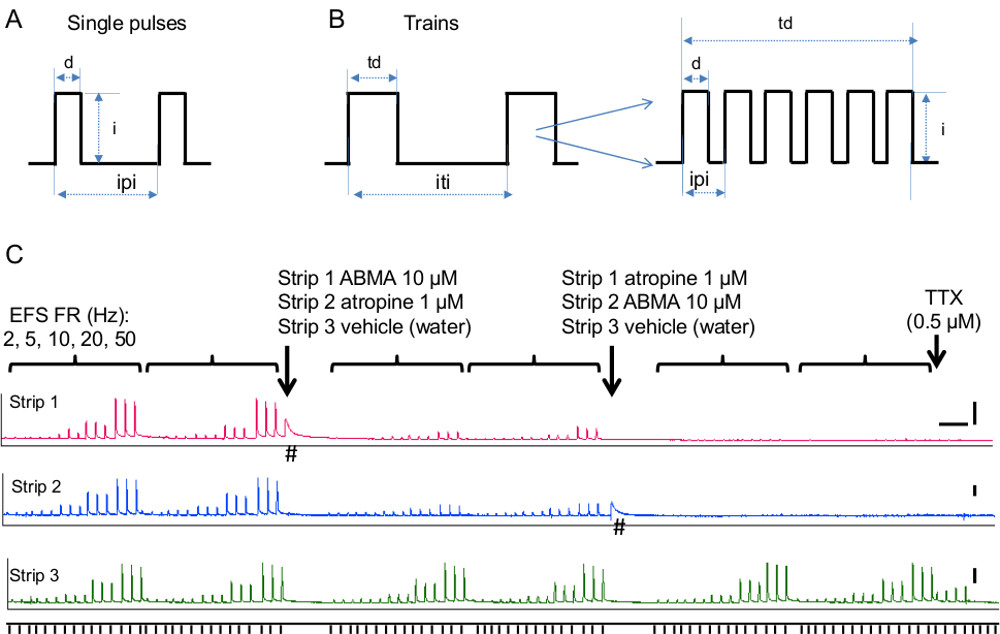
Figure 5 une stimulation de champ électrique. A) Représentation schématique de paramètres de stimulation d'impulsion unique. Abréviations: D = durée de l'impulsion, i = intensité de l'impulsion, ipi = inter impulsion intervalle B) Schéma de paramètres de stimulation de train.. Abréviations: durée td = de train, i = intensité de l'impulsion, iti = intervalle de train inter. En médaillon, le nombre d'impulsions dans un train et l'intervalle entreen eux, qui, conjointement avec la durée du train de déterminer la fréquence de stimulation du train. C) Contribution de purinegic et cholinergiques composants de syncope évoqué contractions de la vessie. EFS-FR représentent les fréquences de stimulation, 2, 5, 10, 20, 50 Hz. Trois stimuli délivrés chaque 90 s ont été testés pour chaque fréquence et chaque série de fréquences a été répétée deux fois et deux fois dans le contrôle après l'ajout de chaque composé. Alpha, bêta-méthylène ATP, en abrégé ABMA (bande 1), a été utilisé pour désensibiliser les récepteurs purinergiques et l'atropine (bande 2) a été utilisé pour bloquer les récepteurs muscariniques. Bande 3 a servi de témoin et a été traité avec le véhicule, de l'eau. Les flèches indiquent le moment où chaque composé a été ajouté à chaque bande. Notez que les contractions EFS évoquées sont fortement réduits par ABMA et de l'atropine, tout en n'étant pas affecté par le véhicule. TTX a été ajouté à la fin de l'expérience tandis que l'EFS a été livré à 20 Hz. Notez que les contractions restent observées dans le contrôlebande 3 ont été supprimés par la TTX, démontrant leur nature nerveuse (c.-à-initié par la libération du transmetteur de nerfs intra-muros). # Indique réponses musculaires lisses selon ABMA en l'absence de système de fichiers EFS. Les barres d'échelle sont à 5 mn de l'axe des x et 2 g pour l'axe y. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6 La modulation des contractions de la vessie provoquées neurocardiogénique. A, B) des exemples de la mise en valeur des contractions provoquées par neurocardiogénique l'agoniste du récepteur 5HT4, du cisapride dans la vessie humain (A) et des bandes d'iléon (B). Le cisapride (documents noirs) ou du DMSO (documents de gris) ont été ajoutés d'une manière dépendante de la concentration aux moments indiqués par des flèches. Des barres noires au-dessous des enregistrements de chaque panneaureprésentent EFS, qui se composait de 10 trains sec livrées à 20 Hz tous les 120 sec. Des barres verticales à grande échelle sont de 1 g pour tous les exemples. Concentration TTX était de 0,5 uM. FC) Résumé de l'aire sous la courbe (ASC) des contractions EFS évoquées en réponse à cisapride (barres noires) ou du DMSO (barres grises) en bandes de la vessie (C, D) et les bandes d'iléon (E , F). En CF, SB signifie SB-203186, soit un résumé des données obtenues après l'addition de l'antagoniste des récepteurs 5HT4. Les lignes en pointillé sont définis à 100% et représentent contrôle. (Reproduit avec la permission de Kullmann FA, Kurihara R, L Ye, Wells GI, McKenna DG, Burgard CE, Thor KB Auton Neurosci 2013 juin; 176 (1-2):... 70-7) S'il vous plaît cliquer ici pour voir une plus grande version de ce chiffre.
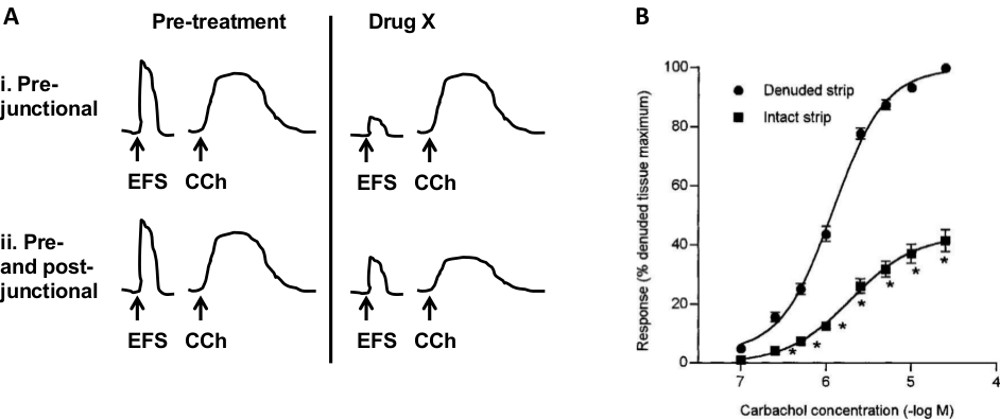
Figure 7. Sites d'action des médicaments et le rôle des différentes composantes de la vessie. A) Schéma de protocole pour identifier le site d'action d'un médicament. Les bandes sont stimulées par le FSE et le carbachol (CCh). Dans i médicament X réduit la réponse EFS mais pas la réponse CCH, indiquant un site pré-jonction de l'action. Dans ii, le médicament X modifie les deux réponses, indiquant une action sur les récepteurs post-jonctionnels ou les deux pré-et post-jonctionnels. B) Influence de la muqueuse sur contraction du muscle lisse. Effets de carbachol sont diminués en bandes avec la muqueuse présente (intact) par rapport à des bandes avec la muqueuse enlevée (dénudé). (B est reproduit avec la permission de Hawthorn MH, Chapple CR, Cock M, Chess-Williams R. Br J Pharmacol 2000 février; 129 (3):. 416-9). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dans cet article, nous avons décrit une in vitro simple lisse méthode de la contractilité du muscle qui peut être utilisé pour répondre à un certain nombre de questions scientifiques importantes liées à la vessie physiologie et la pathologie, ainsi que la complicité de la découverte de nouveaux médicaments pour traiter les dysfonctionnements de la vessie. Nous avons illustré l'utilisation de cette méthode pour évaluer les propriétés de développement, pathologiques et pharmacologiques de contractilité du muscle lisse de la vessie (figures 2-4), la neurotransmission modulation (figures 5-7a), différences entre les espèces (Figure 4), les différences d'organes (Figure 6) et la pertinence des composantes de la vessie spécifiques (par exemple, la muqueuse, figure 7B). D'autres applications non illustrés ici comprennent l'évaluation des voies intracellulaires des agents pharmacologiques 3,10,11, relations structure-activité de divers médicaments 22-24, ou l'évaluation / quantification de perti de l'émetteurase 25 après stimulation neurale.
Bien que la fonction de la vessie peut finalement être évaluée in vivo, cette méthode in vitro surmonte de nombreuses situations problématiques in vivo. Il s'agit notamment des situations où les manipulations chirurgicales et pharmacologiques réduiraient la viabilité et / ou la survie de l'organe ou de l'animal, l'utilisation de tissus humains, la nécessité d'identifier et de caractériser les réponses des composants spécifiques (par exemple, le muscle lisse vs vs épithélium nerfs ) ou l'utilisation de produits chimiques coûteux. La méthode permet l'étude systématique des effets de divers agents pharmacologiques ainsi que la pathologie sur l'activité contractile du muscle lisse et d'une façon bien contrôlée et de l'environnement.
La méthode fournit une multitude d'informations; Cependant, des précautions doivent être prises lors de l'interprétation et l'extrapolation de ces informations. Il s'agit d'une méthode in vitro d'une préparation réduite, disconnecté à son environnement normal et contrôle neural. Les conditions expérimentales sont pas physiologique, donc les données peuvent ne pas refléter entièrement dans des situations physiologiques in vivo. Par exemple, la méthode ne peut pas tenir compte des changements dans la circulation sanguine, les hormones, les substances humorales, les forces mécaniques extérieures, ou contrôle neural extrinsèque. Le tissu est profondément décentralisée, donc les réponses de blessures et de l'ischémie liée doivent être évaluées et prises en compte. Les modifications pathologiques qui se produisent dans le cerveau ou la moelle épinière ne peuvent pas être testés à l'aide de cette méthode, sauf s'ils ont déjà modifié afférente, le muscle lisse, les muqueuses ou la fonction des nerfs intra-muros (c.-à-plasticité cellulaire). Stimulation de champ électrique (EFS) permet l'évaluation des réponses à médiation neuronale. Cependant, il excite indistinctement tous les nerfs dans la bande (par exemple, sympathiques, parasympathiques, afférences), par opposition à la situation in vivo où le réflexe de miction active que pathw particulierays. Une façon de surmonter cette situation est de combiner EFS avec des antagonistes spécifiques qui bloquent sélectivement différentes voies. Par exemple, la guanéthidine peut être utilisé pour bloquer la libération de norépinéphrine dans l'étude des propriétés de contraction ou l'atropine peut être utilisée pour bloquer les récepteurs muscariniques à empêcher les contractions de la vessie lorsque l'on étudie les propriétés de relaxation. Enfin, la viabilité du tissu est limité à un certain nombre d'heures. En général, la plupart des composants des tissus de la vessie sont viable et stable (à savoir la réponse à l'EFS sans détérioration des réponses) sur une période de 6-8h ou plus. Cependant, d'autres tissus peuvent être plus sensibles (par exemple, l'iléon dure ~ 6 h ou moins; expérience personnelle de l'auteur).
Bien que la méthode est techniquement possible et avec une bonne reproductibilité, il ya plusieurs étapes essentielles nécessaires pour assurer son succès. Tout d'abord, la préparation des tissus doit être effectuée avec soin pour assurer la viabilité en faisant les changements nécessairespour la procédure de dissection (éviter l'étirement du tissu lors de la préparation des bandes) et / ou le support en cas de besoin pour différents types de tissus ou d'espèces. Une autre étape importante est la mise en place des paramètres de stimulation neuronale, tels que les effets de plafond sont évitées. Comme décrit dans la section Procédé d', cela dépend du type de mécanisme d'expérience réalisée et prévue de l'action du composé de test. Par exemple, pour tester les effets du cisapride, un agoniste des récepteurs de 5HT4, sur des bandes de la vessie (figure 6), nous avons mis l'amplitude de la contraction provoquée par EFS à environ 50% du maximum. Cette décision était fondée sur le mécanisme d'action connu du agonistes des récepteurs 5HT4, à savoir améliorant la libération d'ACh par les nerfs pré-jonction parasympathique 27, qui à son tour devrait augmenter les contractions EFS évoquées. Stimulation des muscles contre nerfs devrait être testé à l'aide TTX, qui inhibe la transmission nerveuse et devrait donc inhiber les contractions EFS évoquées. Des contrôles adéquats pour véhicule et time doit être effectuée pendant l'essai de la drogue pour tenir compte de la dégradation du tissu avec le temps et pour des effets possibles du véhicule. Par exemple, de nombreux médicaments sont dissous dans du DMSO ou de l'éthanol. Nos données (Figure 6) montrent que le DMSO (0,1% et plus) peut augmenter les contractions syncope évoqués, un effet qui doit être soustrait de l'effet du médicament d'essai. De même, l'éthanol (jusqu'à 1%) réduit les contractions spontanées du muscle lisse, mais n'a pas d'effet sur les contractions neuronale évoquée 34,35. Si l'utilisation d'animaux génétiquement modifiés ou des modèles de chirurgie (par exemple, des blessures de la moelle épinière ou ovariectomie), les contrôles devraient comprendre des tissus de la souche fond de souris approprié ou subi une opération fictive animaux, respectivement. En outre, certains tissus, tels que les droits, la souris et le cochon Guinée vessies contiennent ganglions intra-muros. Lorsque vous travaillez avec ces tissus, la sélection du protocole et l'interprétation des données doivent tenir compte des effets de la drogue ou de l'EFS sur ne intra-murosurons qui stimulent davantage le muscle lisse.
Concevoir le protocole expérimental, choisir les bons paramètres (pour EFS, pour la stimulation de la drogue) et les concentrations à tester sont essentielles pour s'assurer que les données significatives. Bien que les paramètres doivent être ajustés pour les tissus et les médicaments individuels, les principes généraux / les lignes directrices énoncées ci-dessous s'appliquent. Courbes cumulatives concentration-réponse sont souhaitables, mais ce n'est pas possible pour tous les composés. Médicaments ciblant les récepteurs qui se désensibiliser tels que les récepteurs purineric ionotropiques (P2X), ou des médicaments qui sont métabolisés rapidement dans le tissu (exemple ACh), ne peuvent pas être testés de manière fiable en utilisant des courbes cumulatives concentration-réponse dans le même tissu. Dans ces cas, les concentrations individuelles sont testés dans différents groupes de tissus. Pour évaluer la désensibilisation, il est recommandé de comparer l'amplitude de la réponse induite par une seule concentration la plus élevée à celle obtenue à la fin d'une concentration cumulativecourbe de réponse.
Pour le montage de précision des données obtenues à partir des courbes concentration-réponse, il est souhaitable de tester des concentrations moitié de log (CCh exemple sur la figure 6). Cependant, les concentrations de journaux (exemple NMB figure 4A) sont acceptables lorsque la viabilité des tissus peut être limitée ou d'autres contraintes peuvent être mis en place.
Pour sélectionner une plage de concentration d'un composé nouveau, dans des expériences préliminaires, il est utile de prendre en considération l'affinité de liaison du composé test à deux et de puissance 10 au-dessus et au-dessous de cette concentration. Dans des expériences ultérieures, on affine le protocole pour déterminer un point où aucun effet du médicament est observée de départ et un point final où soit la réponse est maximale ou la concentration testée est plus spécifique à la cible visée.
L'intervalle de temps pour appliquer un médicament doit être choisi en tenant compte de plusieurs facteurs: a) Le temps d'unemédicament ait un effet. Dans médicaments généraux ciblant les récepteurs membranaires avoir une réponse relativement rapide (secondes à quelques minutes), alors que les médicaments pour cibles intracellulaires (par exemple, la forskoline et d'autres inhibiteurs de l'enzyme 36, la toxine botulique 37) ont besoin de temps d'incubation supplémentaire (30 min - 3 h). En outre, l'épaisseur du tissu peut jouer un rôle. b) Durée et mécanisme d'action du médicament. Pour les cas où l'effet du médicament atteint un plateau qui est maintenu, comme sur la figure 4A NMB cisapride et sur la figure 6, les intervalles de temps de 5 à 15 minutes entre les applications de médicaments sont appropriés pour la collecte de données suffisantes. Ceci n'est pas possible avec les médicaments ayant une durée beaucoup plus courte d'action ou un mécanisme d'action différent (ATP, CCH). Par exemple l'effet de CCh sur la figure 4C ou 4D, atteint rapidement un plateau mais la tension du tissu tend à revenir à la valeur initiale. Dans ce cas, les intervalles de temps doivent être ajustés en fonctionly, généralement en ajoutant la concentration suivante lorsque la première réaction atteint un maximum.
L'analyse des données, en particulier la normalisation des données pour permettre des comparaisons entre des bandes est une étape très importante. Différentes études utilisent des paramètres de normalisation de bande, y compris les poids 38, la bande 39 surface en coupe transversale, la réponse KCl 12% de la réponse maximale ou 28% de la réponse maximale à un autre agent contractile (par exemple, 38 CCh). Le paramètre de normalisation doivent être choisis en fonction du but de l'expérience, de telle sorte que le paramètre n'est pas influencé par des composés d'essai, de la pathologie ou de la conception expérimentale. Par exemple, la normalisation de la réponse KCl élimine le poids et d'autres dimensions des bandes, et pourrait donc être utilisé pour comparer les réponses dans les tissus où pathologie peut augmenter le poids des bandes (par exemple, le diabète augmente la masse de la vessie). En outre, le reréponse au KCl n'est pas influencée par la suppression de la muqueuse / 29 urothélium, donc susceptibles d'être utilisés dans des expériences évaluant différents composants de la vessie (par exemple, les muqueuses contre les muscles lisses).
En résumé, cette méthode de la contractilité fournit une approche rapide, facile et très puissant pour évaluer la vessie (et d'autres organes) la physiologie et de la pharmacologie. Lorsqu'il est utilisé correctement, il offre la possibilité de manipuler le tissu dans un environnement réduite et bien maîtrisée. Dans l'étude de la fonction de la vessie, cette méthode a joué un rôle dans la découverte et l'essai des composés actuellement utilisés pour la gestion de l'hyperactivité vésicale, tels que les antimuscariniques et nouvellement développé β agonistes de A3AR.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Cette étude a été soutenue par le NIH R37 DK54824 et R01 DK57284 subventions à LB
matériels
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and surgical instruments | |||
| sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium Chloride Potassium Chloride Monobasic Potassium Phosphate Magnesium Sulfate Dextrose Sodium Bicarbonate Calcium Chloride Magnesium Chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
Références
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon