Method Article
膀胱平滑肌收缩带作为一种方法来评估下尿路药理学
摘要
此稿件提出了一个简单但功能强大, 体外方法应对药物制剂或神经刺激评估平滑肌收缩。主要应用于药物筛选和理解组织生理学,药理学,病理检查。
摘要
我们描述了一种体外方法来测量膀胱平滑肌收缩,而将其用于调查平滑肌的生理和药理性质以及诱导病理变化。这个方法提供了对于理解膀胱功能,同时克服体内实验中遇到的主要方法困难,如手术和药理操纵影响稳定性的制剂和生存,利用人体组织,和/或使用昂贵的化学品的重要信息。它也提供了一种方法来调查在健康和病理条件下的每个膀胱组分( 即平滑肌,粘膜神经)的属性。
膀胱是从麻醉动物,放在Krebs溶液和切成条除去。带被置于填充有温暖的Krebs溶液的腔室。一端被连接到一个等角tensioÑ传感器来测量收缩力,其另一端被连接到一个固定的杆。组织被直接添加化合物的浴或由电场激励电极的激活神经,类似于触发膀胱收缩的体内刺激。我们证明了使用该方法的过程中发展和实验性脊髓损伤后,评估自发平滑肌收缩,神经传递(发送器和受体参与),参与平滑肌的活性调节因子的性质,个体膀胱部件的作用,和物种,并且响应于药剂器官的差异。此外,它可以被用于研究参与的收缩和/或平滑肌的松弛,药物的构效关系和评价递质释放的胞内途径。
在体外平滑肌收缩力的方法已被广泛用于FOr动用超过50年,提供了数据显著促成了我们的膀胱功能的理解以及对目前临床上用于膀胱管理化合物的药物开发。
引言
膀胱平滑肌松弛,使储尿和合同引出尿液排除。松弛是由固有平滑肌性质,并通过从交感神经补药释放的去甲肾上腺素(NE),其中激活在逼尿肌β肾上腺素受体(β3 AR人类)介导的。排尿是通过抑制交感神经的输入和激活会释放乙酰胆碱/ ATP的收缩膀胱平滑肌1副交感神经实现。许多病理状况,包括脑和/或脊髓损伤,神经变性疾病,糖尿病,膀胱出口梗阻或间质性膀胱炎,可以极大地改变膀胱功能,对生命2的患者的质量造成严重影响。的平滑肌中,传入或传出的神经和/或所述:这些条件通过影响一种或膀胱的多种组分改变平滑肌的收缩性粘膜。
几种体内和体外方法来研究膀胱功能已被开发出来。 在体内 ,膀胱是膀胱功能的主要测量。虽然这是一个完整的准备,允许收集在接近生理条件的信息,有若干在其中使用的平滑肌条是优选的情况。这些包括当外科手术和/或药理学的操作会影响生存和体内制剂的稳定性,或情况下,当研究需要使用的人体组织或昂贵的化学品。该方法还有助于药物,年龄和病理膀胱的各成分的作用的检查, 即平滑肌,粘膜,传入和传出神经。
膀胱条已受聘多年来受到许多团体来回答一些科学问题。他们用EVA在肌自发性活动luate变化引起的病变。这项活动被认为是导致膀胱过度活动症(OAB)的紧迫性和频率的症状,因此对OAB 3-9正在开发的药物的目标。膀胱条带也被用于研究该调节平滑肌张力与发现的离子通道和/或受体和/或可能被靶向诱导或者松弛或平滑肌的收缩,细胞内途径的目的肌和神经因子3,10- 13。其它的研究集中在神经传递的性质,包括诱导病理14,15发射机和参与受体和变化。此外,该方法已被用于组织之间的比较,从不同物种16-18,器官19-21,和药物的构效关系22-24评价之间。这种方法的一个扩展已被用来测量电电子药物对递质释放的传出神经25的效果。此外,各种组织(膀胱,尿道,胃肠道,胃肠道),从动物或人体(从批准用于研究的手术或器官供体组织)收集并从多种动物模型,包括脊髓损伤(SCI),膀胱出口梗阻(BOO),或间质性膀胱炎(IC),可以使用该技术进行研究。
在本文中,我们演示了如何使用这种方法,连同必要的实验方案,来解决上面提到的几个科学问题。
研究方案
这里描述的所有程序是由美国匹兹堡大学IACUC委员会批准。
1,解决方案
- 根据配方制备的Krebs溶液。组成MM:氯化钠118,氯化钾4.7, 氯化钙 1.9, 硫酸镁 1.2, 碳酸氢钠 24.9,KH 2 PO 4 1.2,葡萄糖11.7。
- 充气的Krebs用95%O 2,5%CO 2,并将其放置在37℃水浴中在整个实验过程中使用。放置一旁〜要用于组织解剖将200ml在室温下充气的Krebs溶液。
- 测量充气的Krebs的pH值(〜7.4)和渗透压摩尔浓度(约300毫渗透摩尔浓度)。
2,实验装置(原理图1A)
- 填充气(95%O 2,5%CO 2)用10毫升的Krebs腔室。
- 启动循环水泵,加热腔室至37℃;打开必要的设备:放大器(S),刺激(S)和录音软件。
- 校准传感器以1克重的。
3,组织(图1B)
从一个天真的成年人雌性SD大鼠取出膀胱(200-250克;〜10-12周龄)执行以下步骤:
- 准备清扫面积和必要的工具:电动剃须刀,镊子与牙齿,手术刀,解剖剪刀,microscissors两个解剖钳(作者喜欢杜蒙钳#3),组织夹(或丝线缝合),A的Sylgard涂层剥离菜和克雷布斯组织解剖针。
- 麻醉用异氟烷吸入(在O 2 4%)在感应腔室中的动物。使用对眼睛的兽医药膏,以防止干燥时在麻醉下。连续地观察呼吸速率,响应于外部刺激,和后肢撤回反射丧失监测麻醉的水平。
- 当动物被麻醉,剃毛的下腹部Ä意图。通过中线腹部切口暴露盆腔器官。确定膀胱和尿道。通过切割在膀胱颈附近的近端尿道取出膀胱。在的Sylgard涂层菜充满了加气Krebs溶液立即将组织。
- 如果需要的话,除去额外的组织,此时:尿道,胃肠道(GI)和/或前列腺件等
- 祭祀用IACUC批准的方法( 例如 ,麻醉过量或CO 2窒息后的第二法)的动物。
- 将组织解剖针穿过膀胱顶部,颈部,输尿管,稳定的组织作进一步解剖。不要伸展组织。去除脂肪,结缔组织,近端尿道,输尿管和如果存在的话。
- 从基部打开膀胱圆顶创建的平片,浆膜侧向下/腔侧上( 图1B)。放置夹层引脚上的组织的各个角落。删除膀胱DOMe和颈部组织。
- 如果该实验的目的是确定在粘膜(上皮和粘膜固有层-参见图图1C)的贡献,平滑肌收缩,有和没有附着在粘膜比较逼尿肌的属性。对于这一点,前切削成条的组织,使用光圈弹簧在解剖显微镜下剪刀和细镊子小心去除粘膜层。在实验结束时,固定片与H&E染色,以确认完整切除粘膜。注意,此过程是容易在小鼠膀胱比在大鼠的膀胱。
- 从基部纵向切割组织到圆顶成〜2×8毫米( 图1B)的条。领带或附上组织夹到每个条带的两端。
注意:一鼠膀胱通常可切成4片,但带条的数目可以增加或减少取决于动物/膀胱大小。 - 转移带的EXPERimental室。将每个条带的力传感器,其测量组织收缩的一端,另一对固定的玻璃/金属杆。
注:组织室大小不等(0.2毫升〜20毫升或更大)。对啮齿动物的囊典型腔是5-20毫升,这提供足够的高度的条带,以在溶液被完全浸没。有些室配备了内置的刺激电极,别人没有。应注意,以确保电极的所有连接都在良好的状态,否则电场刺激是不可靠的。 - 轻轻拉伸的组织,直到基本张力达100克(约10 MN)施涂的力量,每个条。最初的组织趋向于放松被记录为基线张力的降低。洗净组织大约用温水加气克雷布斯和每15分钟调整基线张力各1g后洗净。让组织中平衡约1-2小时,或直至基本张力稳定(即没有进一步的组织松弛)。
- 加入氯化钾(80毫米)直接连接到该浴〜5分钟,或直至高原反应试验组织活力被达到。也可在实验过程中,或在实验结束时重复和用于归一化的反应的其它药物或间条带(参见下的数据分析部分正常化)响应于高浓度的KCl。
- 与温暖充气的Krebs洗涤组织多次(3-5x),以允许所述组织返回到前处理的条件。
4,刺激方案
- 调查病理学上自发肌活动或平滑肌张力的影响,使用来自不同的动物模型,如脊髓损伤,BOO或新生儿平滑肌条, 图2示出了使用该方法的研究开发过程中的变化在膀胱自发活动和脊髓损伤后。此外,药物制剂可被用来调制藻ontaneous活性。 图3示出的KCNQ通道调节剂,氟吡汀和XE991,对自发活性和平滑肌紧张的效果。
- 通过添加来自浓缩的储备溶液的化合物直接向浴中在定义的时间间隔的药理平滑肌刺激构建体的浓度响应曲线。使用平行条带药和车辆占车辆和时间的影响。
- 使母液所需的测试化合物在1000倍的最终工作浓度。对于卡巴(CCH),毒蕈碱受体激动剂,请准备以下个股:10 -5米,3×10 -5男,10 -4米,3×10 -4男,10 -3米,3×10 -3 M ,10 -2 M。最终浓度在浴为10 -8 M〜10 -5 M( 图4C,D)。对于神经介素B(NMB)中,蛙皮素受体 亚型1激动剂,请准备以下个股:10-8男,10 -7男,10 -6男,10 -5 M,10 -4男,10 -3 M和终浓度在洗澡都是10 -11 m到10 -6 M。 CCh引起双方和仲裁委员会预计将增加组织的收缩。
- 为10ml的组织浴中,立即加入10微升每CCh引起原液作为响应达到平台( 图4C,D)。在平行条增加车辆(水)的等量。同样,加入10微升的每个神经介素B货解决方案的各个〜5分钟。
注意:观察图4 NMB和CCH对平滑肌张力在来自不同物种的条带的兴奋作用。 - 与兴奋性剂,通常CCh引起或氯化钾调查平滑肌预收缩组织的松弛性能。
- 要阻止激动剂的反应,预处理组织10-20分钟的拮抗剂,使组织穿透性,以激动剂刺激之前。
- 对于神经STIM平滑肌的ulation,也称为电场刺激(EFS)按照步骤1至3.13,继续如下所述。 EFS是为了有选择地激活的神经与平滑肌。为刺激参数应慎重选择,以避免直接平滑肌的刺激。
- 建立的刺激参数:刺激(单脉冲或火车),持续时间(脉冲持续时间和列车的持续时间),频率和强度,如在下面的步骤中所描述和在图5A,B所示的类型。
- 对于单脉冲刺激,置位脉冲的持续时间,刺激间间隔和期望的刺激的数量。通常的刺激持续时间的参数是单个的脉冲以期望的间隔( 图5A)递送0.05-0.3毫秒的持续时间。遵循刺激强度的步骤4.3.1.4。
- 对于火车的刺激,将列车时间和列车间的间隔。膀胱组织的典型值3-10秒交付至少1m在分开( 图5B)。如果发生组织疲劳(在控制周期即 EFS的收缩降低),提高了列车间的间隔。
- 建立在火车列车刺激脉冲的频率(数 - 图5B)。运行频率响应曲线,从0.5〜50赫兹。典型频率为膀胱是10-20赫兹,这给了ATP和乙酰胆碱介导的可重复性和稳定的收缩。观察到的EFS刺激的频率依赖性反应在小鼠膀胱条带在图5演示了如何此方法可用于评估胆碱和嘌呤机制的神经传递相关的贡献。
- 建立激励强度:系统增加刺激的强度(电压),直到收缩的幅度达到了高原(如果使用的列车保持频率不变)。
- 将刺激取决于强度瞄准实验。如果目的是增加neurally诱发的收缩,然后用次最大强度,使得收缩的幅度〜最大收缩的50%。如果目的是要减少neurally诱发的收缩,然后将强度到〜80%的最大振幅的,以避免组织的疲劳。
- 一旦刺激参数(时间,频率和强度)建立,允许〜20-30分钟的EFS-诱发宫缩前的药物测试稳定。
注意:要验证EFS的选择性神经传输,神经区块传输与钠离子通道阻断剂河豚毒素(TTX; 0.5-1微米)。执行此步骤在实验开始时,作为TTX洗掉相对容易。此外,在实验结束时执行此(见步骤4.3.5。下文)。 - 准备原液在1000倍的最终工作浓度为:α,β-亚甲基三磷酸腺苷(ABMA;有嘌呤受体激活剂和脱敏剂)10 -2男,阿托品(毒蕈碱受体拮抗剂)10 -3米( 图5C)。观察其它实施例在图6中的5HT4受体激动剂,西沙必利(3×10 -6 M,10 -6 M,3×10 -5 M,10 -5 M,3×10 -4 M,10 -4 M, 3×10 -3 M,10 -3 M),增加组织收缩和SB-203186(3×10 -3 M)中,5HT4受体拮抗剂,反向的西沙必利的影响。
- 为了测试ABMA对EFS( 图5C)的影响,以及阿托品,执行两个控制频率响应曲线。加入10微升10 -2 M ABMA到该浴中的10μM的终浓度。这将收缩的组织由于嘌呤能受体的平滑肌的直接刺激。响应返回到基线后,重复频率响应曲线。加入10微升10 -3 M阿托品作最后concentrat离子为1μM。后〜10分钟(以方框毒蕈碱受体所需要的阿托品),重复频率响应曲线。在平行条带加10微升的车辆,水,在每一个步骤。
注意:对于图6中的其它实施例中,加10微升每西沙比利原液在定义的时间间隔(〜每隔15分钟;见讨论)中,随后加入10μl的SB-203186原液直接向浴和监测其效果EFS引起的收缩。在平行条带加10微升的车辆,二甲基亚砜。观察西沙必利的效果,5HT4受体激动剂对人膀胱和回肠组织中的图6的EFS诱发的收缩,另外,观察DMSO的作用,该车辆为西沙必利,对EFS诱发的人膀胱和回肠组织中的收缩。 - 在EFS协议的端部通过阻断神经传输用的Na +通道阻断剂,河豚毒素(TTX验证EFS的选择性; 0.5-1及#181,M)。如果TTX抗性的收缩仍然存在,建议调整刺激在随后的实验的持续时间和强度。
- 建立的刺激参数:刺激(单脉冲或火车),持续时间(脉冲持续时间和列车的持续时间),频率和强度,如在下面的步骤中所描述和在图5A,B所示的类型。
- 为了确定预或突触后部位药物的影响( 图7A)按照步骤1至4.3.2。建立可重复的反应,卡巴和EFS,再加入药物十
- 在实验结束时,中松开或解开的条带,轻轻吸干它们放在一张薄纸,消除多余的流体,并用天平测量每个条的重量。使用卡尺以确定横截面面积还测量组织的长度。此信息用于数据标准化(参见5.4节)。
5,数据分析
分析使用适当的软件数据( 例如 ,Windaq,LabChart)。
- 对于自发活动,之前和药物引起的反应和我的高峰期至少选择30秒的窗口ASURE振幅和肌活动的频率( 图3)。
- 使用快速傅立叶变换分析,以确定频率有助于收缩反应和是否频谱有气囊的不同部分之间的差异( 例如 ,圆顶与颈部)或具有发展,病理学和药物8。
- 对平滑肌张力作用之前和在药物诱导的响应的峰值选择至少10-30秒的窗口,并测量收缩的幅度。
- 对neurally诱发的收缩效应测量收缩之前和在药物诱导的响应的峰值的曲线(至少3个)下的幅度,持续时间和面积。
注:这是必要的EFS引起的收缩曲线下测量幅度和面积,因为嘌呤和胆碱成分具有不同的动力学。的嘌呤成分是速度快,瞬态(ATP激活purinergiÇ离子型渠道,如P2X1,使钙的快速涌入,然后他们慢慢适应),从而曲线下促成更多的峰值响应和更少的区域。胆碱能元件是较慢的和持续的胆碱(ACh激活代谢型毒蕈碱受体,它需要更多的时间来激活胞内途径,最终激活离子通道去极化的平滑肌诱导的收缩)。因此,毒蕈碱成分被捕获由曲线下测量面积更好。 - 归一化数据,以便能够比较不同条带和药物治疗的结果。选择用于归一化的参数不应当由试验化合物的影响,病理状况的研究或实验设计。在这些参数中,使用带材的重量,剖面积,氯化钾的反应( 图4B),%至另一个收缩剂的最大反应的最大反应( 图7B)或%的( 例如 ,CCH3)或放松剂( 如罂粟碱)。
结果
自发性肌活动
肌自发性的活动是经过与出生后发育6-9和病理( 如脊髓损伤,BOO)3-5变革的重要平滑肌的特性。因为此活性被认为是造成膀胱过度活动症(OAB)2的症状,受体,细胞内途径和药理学试剂的评价能调节它,是开发有效的治疗OAB和其它平滑肌功能障碍高的兴趣。这里介绍的方法,可以很容易地调查这些问题, 图2示出发展中的新生儿(i)在不同的肌自发性活动模式,少年(ⅱ)成人(iii)和脊髓损伤大鼠(SCI;ⅳ)。从新生大鼠条呈现大振幅,低频率节律性收缩( 图2AI),而从成年大鼠条š表现出小振幅,高频率的活动( 图2Aii,ⅲ)。脊髓损伤后的新生儿格局再度出现( 图2Aiv)。除了使用动物模型带,各种药剂,可以用于诱导在从幼稚动物条自发性收缩,以理解的自发收缩底层机制的目的。合适的药理学试剂的例子包括毒蕈碱受体激动剂(乙酰胆碱; CCh引起)。,即提高乙酰胆碱的水平(如乙酰胆碱酯酶抑制剂)的化合物中,低浓度的KCl( 例如 20毫米)或其他实验药物的图3A-B,示出了调制通过药理学药剂在位于平滑肌KCNQ通道起作用的自发活动。该KCNQ通道开放剂,氟吡汀,降低的幅度和自发活动的频率呈浓度依赖性( 图3 Al-III),而KCNQ通道阻滞剂,XE991,减少幅度,但会增加自发活动的频率( 图3Bi-III)。
平滑肌张力
平滑肌张力和收缩性是膀胱的储尿及排尿时功能正常的重要因素。这个方法可以很容易地筛选对平滑肌张力药剂的影响。 图3Aiv和3Biv表明,氟吡汀降低基底色调,具有平滑肌松弛一致,而XE991增加平滑肌张力, 图4示出浓度依赖性增加平滑肌张力通过活化的铃蟾肽受体与神经介肽B(NMB; 图4A,B)或毒蕈碱受体与氯化氨甲酰胆碱(CCH; 图4C,D)。此外,细胞内途径介导这些平滑肌反应可以进行调查ü唱特定调制器(数据未示出)。
Neurally介导的反应和神经传递的调制
膀胱收缩是由乙酰胆碱/ ATP的副交感神经传出神经释放来实现的。毒蕈碱和嘌呤能系统对膀胱收缩的贡献物种和病理条件而异,以在疾病,如间质性膀胱炎,局部出口梗阻,和膀胱活动过度26嘌呤贡献占主导地位的增加。 图5C说明了如何使用该方法来确定毒蕈碱和嘌呤成分贡献的神经传递从小鼠膀胱条。使用毒蕈碱受体拮抗剂,阿托品胆碱成分的贡献进行了评估。使用嘌呤受体活化剂和脱敏剂,阿尔法嘌呤系统的贡献进行评估,β-甲基烯三磷酸腺苷(ABMA)。此外,每个分量的频率依赖性的贡献,通过改变刺激频率从低到高的频率(2-50赫兹)中的评估。
膀胱收缩的强度起着排尿高效地显著作用。使用这种方法,该调制神经传递受体和途径可以调查作为药物靶点的排尿功能障碍。对5HT4受体表达的预junctionally在副交感神经的神经元和它们的激活增加乙酰胆碱的水平27, 图6示出了5HT4受体激动剂,西沙必利,在膀胱和回肠条的兴奋作用。
不同的实验方案,可以用来确定测试化合物的作用位点。图图7A说明用于评估前与后的交界部位的协议。如果X药物减少(或增加)的EFS响应,但没有短跑运动员t关于卫生协调响应,动作的最可能的位点是预先交界。如果X药物变造既EFS和CCH响应,那么它可以作用于位于后junctionally或两者前后junctionally受体。
各部件的作用:平滑肌,黏膜和神经元
不同病理状况可能影响膀胱的各种组件。例如间质性膀胱炎(IC)的主要影响尿路上皮,而OAB可能导致改变的平滑肌收缩。此外,不同的受体可以表达在每个囊组件,从而可以在一定的病理具体目标。相对于体内的方法,其中测量所有气囊组件的净效果,该体外方法允许特定的组件使用的手术和药理方法的组合进行调查。为了测试平滑肌收缩/放松在没有神经元的传输,TTX(0.5-1微米)可以被添加到该浴中。在图4中,NMB和CCH在TTX的存在下进行了测试。为了测试粘膜(上皮和粘膜固有层)的平滑肌收缩性的贡献,条带和不带粘膜层进行了比较。 图7B示出应对CCh引起减少在粘膜中的猪28的存在。类似的结果报告在膀胱条29。要测试的神经纤维的作用,几种方法可以采取。一个是激活或使用药剂抑制特定的纤维。例如,辣椒素激活传入神经 的特定人群,造成物种依赖平滑肌的收缩或放松17,18。胍乙啶抑制去甲肾上腺素从交感神经纤维的释放,从而消除了这些纤维的贡献。另一种方法是脱敏/消除体内特定纤维之前的实验。例如,与辣椒素的动物的全身治疗脱敏辣椒素敏感传入神经。可以在本制剂进行研究其他膀胱组件是间质细胞或间隙连接通过激活或阻断它们与特定的试剂。
种属差异
虽然大多数药物开发是用于人类疾病的治疗中,基础研究主要是在动物组织中进行。在一些受体的存在种属差异。例如,5HT4受体激动剂提高neurally诱发的收缩在人类膀胱,但尚未在大鼠膀胱19,30,EFS诱发的收缩是在从稳定气囊31的人力和旧世界猴逼尿肌几乎完全阿托品敏感而变得部分阿托品性在人类逼尿肌从患者的膀胱不稳定的条件( 例如 ,神经性,obstructeð囊)15,32,33,辣椒素引发在大鼠和人的膀胱条兴奋性反应,在猪膀胱条带和在豚鼠膀胱条带17,18抑制反应没有反应。 图4表明,铃蟾肽受体激动剂有兴奋作用大鼠膀胱和鼠标和猪膀胱条16没有影响。此信息可用于选择合适的动物模型用于研究特定受体的关键。
整个器官敏感性的比较
药物用于膀胱疾病的治疗也有可能影响平滑肌从其他器官,如胃肠道,尿道,胆囊等这种方法允许估计器官的选择性和灵敏度的一种药理活性剂由一侧比较不同组织侧。 如图6所示 ,5HT4受体激动剂,西沙必利,已不同耳鼻喉科有效性和效力在膀胱与回肠组织。

的实验装置图1实验装置和膀胱条的准备。一)示意图。膀胱条被浸没在组织室弥漫着加气Krebs溶液保持在37 °Ç通过循环水泵。条带的一端附连到的等距力传感器以测量组织的收缩,另外,以一个固定的活塞杆。力换能器被连接到放大器和计算机进行数据记录。连接到刺激器的电场激励电极被放置在所述腔室和用于唤起neurally介导的膀胱收缩。 乙)制备的组织条。膀胱被牵制在培养皿中,并以下步骤执行:1#竖切日ough腹侧膀胱的一半从尿道到圆顶打开膀胱成扁平片。 #2横切口取出膀胱/尿道近端的穹顶和基地。 #3垂直切口分割中期膀胱成等于条(4条从大鼠膀胱)C)示意图条组件:平滑肌和粘膜,既包含传入(蓝色)和传出(绿色)的神经。粘膜由上皮和固有层。固有层含有血管[1],细胞间质[2]和粘膜肌层[3]。标记#2B虚线表示去除粘膜层的过程。 请点击这里查看该图的放大版本。

在开发过程中和之后,图2肌的自发活动病理A)自发活动的新生儿(一例子),青少年(II),脊柱完好的成人(iii)及脊髓损伤(SCI)成年(四)大鼠膀胱条。脊髓损伤大鼠使用4周后手术。B,C)中的四组调查振幅(B)和自发收缩的频率(C)的摘要。 (转载自Artim酒店德,Kullmann足总杯,多尔蒂SL,Bupp E,爱德华兹CL,面包类去厕所权限Neurourol Urodyn 2011年11月,30(8):1666年至1674年)。 请点击这里查看这个放大版图。
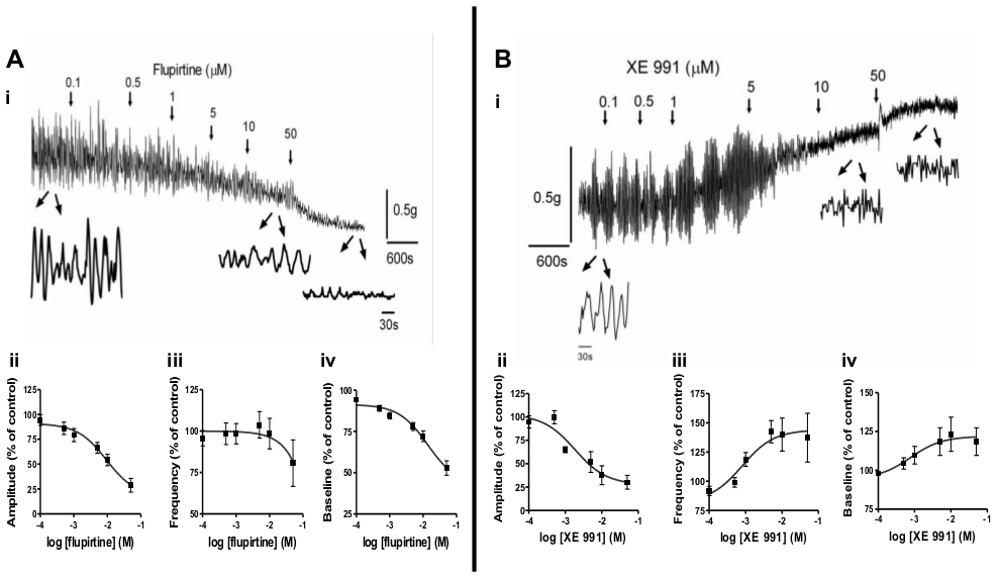
图3调制成肌自发活动和平滑肌张力的。一)KCNQ通道开放剂的效果,flupirtine,自发活动,并在成年大鼠膀胱条基线音。 (ⅰ)氟吡汀的加入增加浓度的(累积)在由箭头指示的时间。过程控制和应用为10μM和50μM的氟吡汀后下条活动的踪迹显示为4分钟的放大效果。上的振幅(II-IV)的氟吡汀的作用概要(7条从4只大鼠)(ii)和频率(ⅲ)的自发活动和基准音的(iv)中,表示为从控制(前药)的值变化率% ,它被设置为100%。 二)KCNQ通道阻滞剂,XE991,对自发活性和在成年大鼠膀胱条基线音的效果。 (ⅰ)XE991的加入增加浓度的(累积)在由箭头指示的时间。跟踪下的放大显示条活动的2分钟期间,控制和应用为10μM和50μM的XE991之后。在(II-IV)的XE991的效果总结(4只9条)振幅(ii)和频率(III)自发活动和基线音(IV),表示为控制(前药)值,分别设置为100%变化。 请点击这里查看该图的放大版本。 。

图4种差异。A)的浓度依赖性平滑肌收缩响应于所述铃蟾肽受体激动剂,神经介素B(NMB),在大鼠的膀胱条。B)的肌松对大鼠膀胱条平滑肌收缩效果综述。数据进行归一化的氯化钾(80毫摩尔)反应。C,D)在小鼠(C)和猪(D)的膀胱条至NMB响应缺失。卡巴(CCH)引发强烈的浓度依赖性CON牵引力在小鼠和猪带,表明该带可以对刺激作出反应。 TTX(0.5μM)的存在在所有条带的浴。 (转载自Kullmann足总杯,麦肯纳研发,井胃肠道,雷神KB的神经肽2013十月许可; 47(5):305-13), 请点击这里查看该图的放大版本。
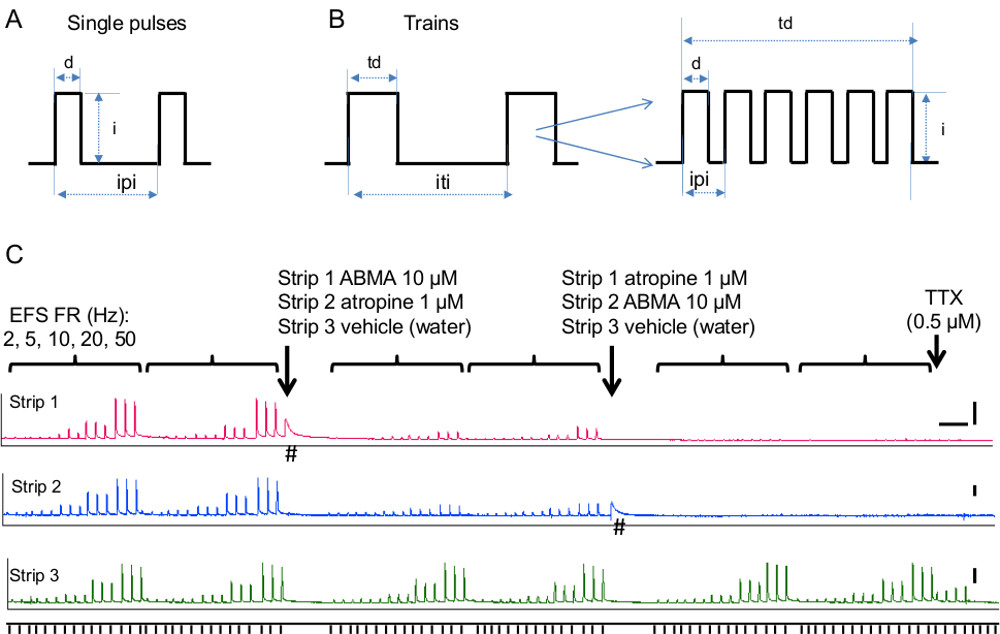
图5电场刺激。一)单脉冲刺激参数示意图。简称:列车刺激参数的示意图D =脉冲,我的时间=脉冲的强度,IPI =脉冲间的间隔B)。缩写:TD =火车时间,I =脉冲的强度,ITI =列车间的间隔。插图显示的脉冲在一列火车的数量和比较(%)区间EEN它们,这与列车的持续时间一起确定列车刺激的频率。℃) purinegic和胆碱成分的贡献neurally诱发膀胱收缩。 EFS-FR代表刺激频率,2,5,10,20,50赫兹。三刺激递送,每90秒进行测试的每个频率和各频率系列重复对照两次并加入各化合物经过两次。 α,β-亚甲基三磷酸腺苷,简称ABMA(带1),用于脱敏嘌呤能受体和阿托品(带2)中的用于阻断毒蕈碱受体。条带3为对照,并与所述车辆,用水处理。箭头指示的时间时,每一种化合物加入到各条。注意,EFS诱发的收缩是由ABMA和阿托品强烈降低,而不会影响车辆。 TTX是在实验结束时加入,而EFS交付在20赫兹。注意在控制观察到剩余的收缩带3由河豚毒素被取消,显示了其神经性( 即由发射器释放的肌壁间神经开始)。 #表示平滑肌的反应,根据ABMA在没有EFS的。比例尺是5分钟的X轴和2克的Y轴。 请点击这里查看该图的放大版本。

图6调制的neurally诱发膀胱收缩。A,B)的neurally诱发收缩的5HT4受体激动剂增强的例子,西沙必利对人膀胱(A)和回肠片(B)。西沙必利(黑色记录)或DMSO(灰色记录)在由箭头指示的时间添加以浓度依赖性的方式。在每个面板下方的记录。黑条代表EFS,其中包括在20赫兹每120秒交付10秒列车。垂直比例尺为1克的例子。 TTX浓度为0.5μM的区域的曲线EFS诱发的收缩的面积(AUC)下的响应于西沙必利(黑色柱)或DMSO(灰色柱)的膀胱条带(C,D)和回肠条。CF)摘要(E ,F)。在CF,SB代表SB-203186,表示相加的5HT4受体拮抗剂之后获得的数据的总结。虚线被设置为100%,表示控制。 (转载自Kullmann足总杯,栗原R,叶升,井胃肠道,麦肯纳DG,Burgard乳油,雷神上传权限王文浩神经科学2013军; 176(1-2):。70-7) 请点击这里查看更大的版本这个数字。
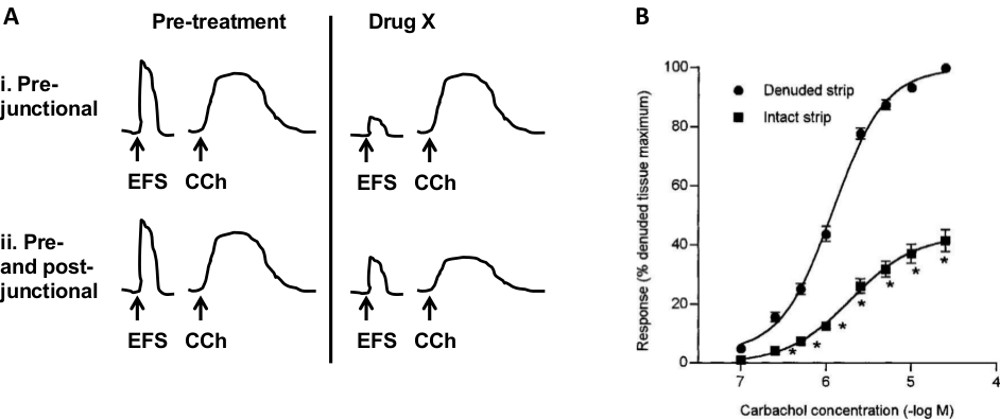
网络连接gure 7站点的药物和膀胱。A的不同组成部分的作用行动)协议的原理确定药物的作用部位。带受到刺激与ESF和氨甲酰胆碱(CCH)。 IN I X药物降低了EFS响应,但没有卫生协调响应,表示动作的预交界部位。在二,X药物改变了两种反应,表明在节后或前和节后受体的作用。 乙粘膜上的平滑肌收缩)的影响。 卡巴胆碱的效果减弱成条与粘膜本(完整)相比,条带与粘膜去除(裸露)。 (B从山楂氢,查普尔华润,屌男,国际象棋-威廉姆斯河溴Ĵ药理学2000二月经授权转载; 129(3):416-9)。 请点击这里查看该图的放大版本。
讨论
在本文中,我们在这可以用来解决一些涉及到膀胱的生理和病理,以及协助新药的发现治疗膀胱功能障碍的重要科学问题, 体外平滑肌收缩的方法描述了一个简单。我们已经示出了使用这种方法来评估的膀胱平滑肌收缩的发育,病理和药理学特性( 图2-4),神经传递的调制( 图5-7A),种间差异( 图4),器官的差异( 图6)和特定膀胱组件的相关( 例如 ,粘膜, 图7B)。这里未示出的其它应用包括使用药剂3,10,11,各种药物22-24,或评估/发射机RELE的定量结构-活性关系的细胞内途径的评价神经刺激25后ASE。
而膀胱功能可能最终在体内评估,该体外方法克服了许多情况下这是有问题的体内 。这些措施包括在手术和药理学的操作会降低活力和/或器官或动物,使用人体组织的生存状况,需要识别和描述的特定组件( 例如 ,平滑肌与上皮与神经反应)或使用昂贵的化学品。该方法允许对各种药剂的效果的平滑肌的收缩活性和良好控制的方式和环境系统的调查以及病理。
该方法提供了大量的信息;不过,应注意解释和推断此信息时,要采取。这是一个降低制剂的体外方法,DIS从正常的环境和神经控制连接。实验条件没有生理,从而该数据可以完全反映体内的生理状况。例如,该方法可以不考虑血流变化,激素,体液的物质,外部的机械力,或外在的神经控制。组织敏锐地分散,从而损伤及缺血相关的应对措施都需要进行评估和考虑。在脑或脊髓发生病理改变,不能使用该方法进行测试,除非它们已经改变传入,平滑肌,粘膜或壁间神经功能( 即蜂窝可塑性)。电场刺激(EFS)允许的神经介导的反应的评估。然而,它激发胡乱所有神经中的带材( 例如 ,交感神经,副交感神经,传入神经 ),而不是在体内情况的排尿反射仅激活特定pathwAYS。克服这种情况的一种方式是EFS结合特异性拮抗剂,其选择性地阻止不同的途径。例如,胍乙啶可用于学习的收缩特性时阻止去甲肾上腺素的释放,或阿托品可用于阻断毒蕈碱受体,以防止学习松弛性能时膀胱收缩。最后,该组织的生存力被限制为若干小时。在一般情况下,膀胱组织的大多数组件是可行的和稳定的( 即响应EFS而不恶化的响应)在一段6-8H或更长的时间。然而,其他组织可能更敏感( 如回肠持续〜6小时或更少;笔者的个人经验)。
虽然该方法在技术上是可行的,并具有良好的重现性,有必要的几个关键步骤,以确保其成功。首先,组织编制应认真执行,以确保生存能力通过必要的修改到清扫过程(避免拉伸该组织而制备的条带),如果需要,对于不同的组织类型或物种和/或媒体。另一个关键步骤是设定式神经刺激参数,使得可避免天花板效应。如在方法部分中所述,这取决于所测试化合物的作用的执行和预期实验机构的类型。例如,用于测试的西沙必利中,5HT4受体激动剂的作用,对膀胱条带( 图6)中,我们设置EFS诱发的收缩的幅度,以最大的〜50%。这是基于对5HT4受体激动剂,即提高从预交界副交感神经27,进而预期将增加EFS诱发的收缩的乙酰胆碱释放作用的已知机制。肌肉的刺激与神经应该使用河豚毒素,从而抑制神经传递,从而抑制应该EFS诱发宫缩进行测试。车辆和Tim足够的控制必须在药物测试,以计算与时间的组织的恶化及对车辆的任何可能的影响来进行ë。例如,许多药物被溶解在DMSO或乙醇。我们的数据( 图6)表明,DMSO(0.1%或更高)可以增加neurally诱发的收缩,这需要从测试药物的作用减的效果。同样,乙醇(最高可达1%)降低了自发平滑肌的收缩,但对neurally诱发收缩34,35没有影响。如果使用基因工程化的动物或外科模型( 例如 ,脊髓损伤或卵巢 切除术),对照应包括来自相应背景的小鼠品系或假手术的动物中,分别组织。此外,一些组织,如人,小鼠和豚鼠膀胱壁内含有神经节。当与这些组织合作,协议选择和数据解释必须考虑到药物或EFS在校内的NE账户的影响urons进一步刺激平滑肌。
设计实验方案,选择合适的参数(EFS,药物刺激)和浓度进行测试,才能确保有意义的数据。虽然参数应该调整个别组织和药物,一般原则/概述如下指导原则是适用的。累积浓度反应曲线是所希望的,然而,这是不可能的所有化合物。靶向受体的脱敏,如purineric离子型受体(P2X),或药物在组织(例如乙酰胆碱)快速代谢的药物,不能可靠地使用累积浓度响应曲线在相同的组织进行试验。在这些情况下,单个的浓度在不同的组组织的测试。来评价脱敏,建议以比较反应的由单个最高浓度引发对所取得的累积浓度的末端的幅度响应曲线。
从浓度响应曲线获得的数据的精确装配,期望以测试半对数浓度(例如CCh引起图6)。然而,记录浓度(例如NMB 图4A)是可接受的,当组织生存力可以被限制或其它限制可能在的地方。
以选择的浓度范围为一种新颖的化合物,在初步实验中,考虑两个功率为10以上和以下的浓度的化合物,并测试的结合亲和力是有用的。在随后的实验中,该协议被细化,以确定一个起点,其中观察到的药物没有效果和结束点,其中任一该响应是最大的或所测试的浓度不再是具体的预定目标。
申请药物的时间间隔应选择考虑到以下几个因素:a)时间为药物有效果。在靶向细胞膜受体一般药物具有相对快的响应(数秒至数分钟),而药物的细胞内靶( 例如 ,毛喉素和其他酶抑制剂36,A型肉毒毒素37)需要额外的温育时间(30分钟- 3小时)。此外,组织厚度可以发挥作用。 B)持续时间和药物的作用机制。对于情况下,当药物效果达到所持续的高原,如NMB在图4A和西沙必利在图6中 ,对药物的应用程序之间的5-15分钟时间间隔内是足够的,收集足够的数据。这是不可能的,具有动作或动作(ATP,CCh)则不同机制的更短的持续时间的药物。例如CCh对图4C或4D的作用,迅速 达到稳定,但在组织张力趋向于恢复到基线。在这种情况下,时间间隔需要根据被调整LY,一般添加浓度旁边时,第一反应达到最大。
数据分析,特别是归一化的数据,以允许条带之间的比较是非常重要的一步。不同的研究中使用不同的参数进行归一化,其中包括带材重38,带材的横截面面积39,氯化钾反应12%至另一个收缩剂( 例如 ,CCH3 38)的最大反应的最大反应28%或的。的归一化参数应根据实验的目的来选择,使得该参数不通过试验化合物,病理或实验设计的影响。例如,归一化对KCl应答消除了重量和条带的其他方面,并且因此可以用于在组织中进行比较的响应,其中病理状态可以增加带( 例如 ,糖尿病增加膀胱的质量)的重量。此外,再sponse对KCl不被切除粘膜/尿路上皮29的影响,因而可以在实验评估膀胱( 例如 ,粘膜与平滑肌)的不同部件使用。
综上所述,本收缩方法提供了一种快速,简便,功能非常强大的方法来评估膀胱(和其他器官)生理学和药理学。如果使用得当,它提供了操纵组织的减少,并很好的控制环境的能力。在膀胱功能的研究中,这个方法是有助的在目前用于OAB管理的化合物,如抗毒蕈碱药的发现和测试,并新开发的β3 AR激动剂。
披露声明
作者宣称,他们没有竞争的经济利益。
致谢
这项研究是由美国国立卫生研究院R37 DK54824和R01 DK57284补助磅。支持
材料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tissue Bath System with Reservoir | Radnoti, LLC | 159920 | isolated tissue baths |
| Warm water recirculator pump | Kent Scientific Corporation | TPZ-749 | to keep tissue baths to 37 °C |
| Computer | |||
| Data Acquisiton System | DataQ Instruments | DI-710-UH | To view, record and analyze data |
| Transbridge Transducer Amplifier | World Precision Instruments | SYS-TBM4M | Transducer amplifier |
| Grass stimulator | Grass Technologies | Model S88 | Stimulator |
| Anesthesia System | Kent Scientific Corporation | ACV-1205S | To anesthetesize the animal |
| Anesthetizing Box | Harvard Apparatus | 500116 | To anesthetesize the animal |
| Anesthesia Masks | Kent Scientific Corporation | AC-09508 | To anesthetesize the animal |
| Materials and Surgical Instruments | |||
| Sylgard | Dow Corning Corp | 184 SIL ELAST KIT | To pin, dissect, & cut tissue |
| Petri Dish | Corning | 3160-152 | To dissect/cut tissue |
| Insect Pins | ENTOMORAVIA Austerlitz Insect Pins | Size 5 | To pin tissue |
| Bench Pad | VWR International | 56617-014 | Absorbent bench underpads |
| Rat surgical Kit | Kent Scientific Corporation | INSRATKIT | To remove and dissect tissue |
| 2 Dumont #3 Forceps | Kent Scientific Corporation | INS500064 | To remove and dissect tissue |
| Tissue Forceps | Kent Scientific Corporation | INS500092 | To remove and dissect tissue |
| Scalpel | Kent Scientific Corporation | INS500236 | To remove and dissect tissue |
| Scalpel blade | Kent Scientific Corporation | INS500239 | To remove and dissect tissue |
| Professional Clipper | Braintree Scientific, Inc. | CLP-223 45 | To remove fur |
| Suture Thread | Fine Science Tools | 18020-50 | Tie tissue |
| Tissue Clips | Radnoti, LLC | 158802 | Attach tissue to rod/transducer |
| 1 g weight | Mettler Toledo | 11119525 | For transducer calibration |
| Chemicals | |||
| Krebs Solution: Sodium chloride Potassium chloride Monobasic potassium phosphate Magnesium sulfate Dextrose Sodium bicarbonate Calcium chloride Magnesium chloride | Sigma Fisher Fisher Fisher Fisher Sigma EMD Baker | S7653 P217-500 P285-3 M65-500 D16-500 S5761 CX0130-2 2444 | To prepare Krebs solution |
| Isoflurane | Henry Schein | 029405 | To anesthetesize the animal |
| Oxygen tank | Matheson Tri Gas | ox251 | To use with anesthesia system |
| Carbogen Tank (95% Oxygen; 5% Carbon Dioxide) | Matheson Tri Gas | Moxn00hn36D | To aerate Krebs solutions |
参考文献
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nat Rev Neurosci. 9, 453-466 (2008).
- Andersson, K. E. Detrusor myocyte activity and afferent signaling. Neurourol Urodyn. 29, 97-106 (2010).
- Artim, D. E., et al. Developmental and spinal cord injury-induced changes in nitric oxide-mediated inhibition in rat urinary bladder. Neurourology and urodynamics. 30, 1666-1674 (2011).
- Kita, M., et al. Effects of bladder outlet obstruction on properties of Ca2+-activated K+ channels in rat bladder. Am J Physiol Regul Integr Comp Physiol. 298, 1310-1319 (2010).
- Barendrecht, M. M., et al. The effect of bladder outlet obstruction on alpha1- and beta-adrenoceptor expression and function. Neurourol Urodyn. 28, 349-355 (2009).
- Maggi, C. A., Santicioli, P., Meli, A. Postnatal development of myogenic contractile activity and excitatory innervation of rat urinary bladder. The American journal of physiology. 247, 972-978 (1984).
- Ng, Y. K., de Groat, W. C., Wu, H. Y. Smooth muscle and neural mechanisms contributing to the downregulation of neonatal rat spontaneous bladder contractions during postnatal development. American journal of physiology. Regulatory, integrative and comparative physiology. 292, 2100-2112 (2007).
- Szell, E. A., Somogyi, G. T., de Groat, W. C., Szigeti, G. P. Developmental changes in spontaneous smooth muscle activity in the neonatal rat urinary bladder. Am J Physiol Regul Integr Comp Physiol. 285, 809-816 (2003).
- Szigeti, G. P., Somogyi, G. T., Csernoch, L., Szell, E. A. Age-dependence of the spontaneous activity of the rat urinary bladder. J Muscle Res Cell Motil. 26, 23-29 (2005).
- Frazier, E. P., Braverman, A. S., Peters, S. L., Michel, M. C., Ruggieri, M. R. Does phospholipase C mediate muscarinic receptor-induced rat urinary bladder contraction. The Journal of pharmacology and experimental therapeutics. 322, 998-1002 (2007).
- Xin, W., Soder, R. P., Cheng, Q., Rovner, E. S., Petkov, G. V. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation. American journal of physiology. Cell physiology. 303, 1079-1089 (2012).
- Frazier, E. P., Peters, S. L., Braverman, A. S., Ruggieri, M. R., Michel, M. C. Signal transduction underlying the control of urinary bladder smooth muscle tone by muscarinic receptors and beta-adrenoceptors. Naunyn-Schmiedeberg's archives of pharmacology. 377, 449-462 (2008).
- Svalo, J., et al. The novel beta3-adrenoceptor agonist mirabegron reduces carbachol-induced contractile activity in detrusor tissue from patients with bladder outflow obstruction with or without detrusor overactivity. European journal of pharmacology. 699, 101-105 (2013).
- Yokota, T., Yamaguchi, O. Changes in cholinergic and purinergic neurotransmission in pathologic bladder of chronic spinal rabbit. J Urol. 156, 1862-1866 (1996).
- Bayliss, M., Wu, C., Newgreen, D., Mundy, A. R., Fry, C. H. A quantitative study of atropine-resistant contractile responses in human detrusor smooth muscle, from stable, unstable and obstructed bladders. J Urol. 162, 1833-1839 (1999).
- Kullmann, F. A., McKenna, D., Wells, G. I., Thor, K. B. Functional bombesin receptors in urinary tract of rats and human but not of pigs and mice, an in vitro study. Neuropeptides. 47, 305-313 (2013).
- Sadananda, P., Kao, F. C., Liu, L., Mansfield, K. J., Burcher, E. Acid and stretch, but not capsaicin, are effective stimuli for ATP release in the porcine bladder mucosa: Are ASIC and TRPV1 receptors involved. European journal of pharmacology. 683, 252-259 (2012).
- Maggi, C. A., et al. Species-related variations in the effects of capsaicin on urinary bladder functions: relation to bladder content of substance P-like immunoreactivity. Naunyn-Schmiedeberg's archives of pharmacology. 336, 546-555 (1987).
- Kullmann, F. A., et al. Effects of the 5-HT4 receptor agonist, cisapride, on neuronally evoked responses in human bladder, urethra, and ileum. Autonomic neuroscience : basic & clinical. 176, 70-77 (2013).
- Warner, F. J., Miller, R. C., Burcher, E. Human tachykinin NK2 receptor: a comparative study of the colon and urinary bladder. Clin Exp Pharmacol Physiol. 30, 632-639 (2003).
- Zoubek, J., Somogyi, G. T., De Groat, W. C. A comparison of inhibitory effects of neuropeptide Y on rat urinary bladder, urethra, and vas deferens. The American journal of physiology. 265, 537-543 (1993).
- Warner, F. J., Miller, R. C., Burcher, E. Structure-activity relationship of neurokinin A(4-10) at the human tachykinin NK(2) receptor: the effect of amino acid substitutions on receptor affinity and function. Biochem Pharmacol. 63, 2181-2186 (2002).
- Warner, F. J., Mack, P., Comis, A., Miller, R. C., Burcher, E. Structure-activity relationships of neurokinin A (4-10) at the human tachykinin NK(2) receptor: the role of natural residues and their chirality. Biochem Pharmacol. 61, 55-60 (2001).
- Dion, S., et al. Structure-activity study of neurokinins: antagonists for the neurokinin-2 receptor. Pharmacology. 41, 184-194 (1990).
- Somogyi, G. T., Zernova, G. V., Yoshiyama, M., Yamamoto, T., de Groat, W. C. Frequency dependence of muscarinic facilitation of transmitter release in urinary bladder strips from neurally intact or chronic spinal cord transected rats. British journal of pharmacology. 125, 241-246 (1998).
- Andersson, K. E., Wein, A. J. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological reviews. 56, 581-631 (2004).
- D’Agostino, G., Condino, A. M., Gallinari, P., Franceschetti, G. P., Tonini, M. Characterization of prejunctional serotonin receptors modulating [3H]acetylcholine release in the human detrusor. The Journal of pharmacology and experimental therapeutics. 316, 129-135 (2006).
- Hawthorn, M. H., Chapple, C. R., Cock, M., Chess-Williams, R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. British journal of pharmacology. 129, 416-419 (2000).
- Chaiyaprasithi, B., Mang, C. F., Kilbinger, H., Hohenfellner, M. Inhibition of human detrusor contraction by a urothelium derived factor. J Urol. 170, 1897-1900 (2003).
- Testa, R., et al. Effect of different 5-hydroxytryptamine receptor subtype antagonists on the micturition reflex in rats. BJU international. 87, 256-264 (2001).
- Craggs, M. D., Rushton, D. N., Stephenson, J. D. A putative non-cholinergic mechanism in urinary bladders of New but not Old World primates. J Urol. 136, 1348-1350 (1986).
- Fry, C. H., Bayliss, M., Young, J. S., Hussain, M. Influence of age and bladder dysfunction on the contractile properties of isolated human detrusor smooth muscle. BJU international. 108, 91-96 (2011).
- Kennedy, C., Tasker, P. N., Gallacher, G., Westfall, T. D. Identification of atropine- and P2X1 receptor antagonist-resistant, neurogenic contractions of the urinary bladder. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 845-851 (2007).
- Levin, R. M., Danek, M., Whitbeck, C., Haugaard, N. Effect of ethanol on the response of the rat urinary bladder to in vitro ischemia: protective effect of alpha-lipoic acid. Molecular and cellular biochemistry. 271, 133-138 (2005).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: Involvement of BK and L-type Ca2+ channels. American journal of physiology. Cell physiology. 306, 45-58 (2013).
- Longhurst, P. A., Briscoe, J. A., Rosenberg, D. J., Leggett, R. E. The role of cyclic nucleotides in guinea-pig bladder contractility. British journal of pharmacology. 121, 1665-1672 (1997).
- Takahashi, R., Yunoki, T., Naito, S., Yoshimura, N. Differential effects of botulinum neurotoxin A on bladder contractile responses to activation of efferent nerves, smooth muscles and afferent nerves in rats. J Urol. 188, 1993-1999 (2012).
- Sadananda, P., Chess-Williams, R., Burcher, E. Contractile properties of the pig bladder mucosa in response to neurokinin A: a role for myofibroblasts. British journal of pharmacology. 153, 1465-1473 (2008).
- Liu, G., Daneshgari, F. Alterations in neurogenically mediated contractile responses of urinary bladder in rats with diabetes. American journal of physiology. Renal physiology. 288, 1220-1226 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。