Method Article
Um Ensaio de microplacas para avaliar os efeitos químicos de RBL-2H3 degranulação dos mastócitos: Efeitos do Triclosan, sem utilização de solventes orgânicos
Neste Artigo
Resumo
Degranulação dos mastócitos, a liberação de mediadores alérgicos, é importante para alergia, asma e defesa do parasita. Aqui demonstramos uma técnicas para a avaliação dos efeitos de drogas e de substâncias tóxicas em desgranulação, a metodologia utilizada recentemente para expor o efeito inibidor potente do agente antibacteriano triclosano 2.
Resumo
Os mastócitos desempenham um papel importante na doença alérgica e de defesa imunológica contra parasitas. Uma vez activado (por exemplo, por um alérgeno), eles desgranulam, um processo que resulta na exocitose de mediadores alérgicos. Modulação da desgranulação dos mastócitos por drogas e substâncias tóxicas podem ter efeitos positivos ou negativos sobre a saúde humana. Função de mastócitos foi dissecada em pormenor com a utilização de mastócitos de leucemia basófilas de rato (RBL-2H3), um modelo amplamente aceito de mastócitos das mucosas humanas 3-5. Componente de mastro de células granulares e o mediador alérgica β-hexosaminidase, que é libertado de forma linear em conjunto com a histamina dos mastócitos 6, pode ser facilmente e confiantemente ser medido por meio de reacção com um substrato f luorogénico, obtendo-se a intensidade de fluorescência mensurável num ensaio de microplacas que é passível de estudos de alto rendimento 1. Originalmente publicado por Naal et al. 1, que se adaptaram este ensaio degranulação para a triagem of drogas e substâncias tóxicas e demonstrar seu uso aqui.
Triclosan é um agente antibacteriano de largo espectro, que está presente em muitos produtos de consumo e foi encontrado ser uma ajuda terapêutica na doença alérgica da pele humana 7-11, embora o mecanismo deste efeito é desconhecido. Aqui demonstramos um ensaio para o efeito do triclosan sobre a desgranulação de mastócitos. Mostramos recentemente que triclosan afeta fortemente a função dos mastócitos 2. Em um esforço para evitar a utilização de um solvente orgânico, o triclosan é dissolvida directamente em tampão aquoso com calor e agitação, e a concentração resultante é confirmado por espectrofotometria de UV-Vis (usando ε 280 = 4,200 L / M / cm) 12. Este protocolo tem o potencial para ser usado com uma variedade de produtos químicos para determinar os seus efeitos sobre a desgranulação de mastócitos e, mais genericamente, o seu potencial alérgico.
Introdução
Os mastócitos são altamente granulado células imunes efetoras que servem como mediadores importantes na asma, alergias, parasitas defesa e carcinogênese 13-16. Eles residem em quase todos os tecidos vascularizados 15, onde armazenar com segurança os mediadores inflamatórios e alérgicos em grânulos citoplasmáticos até ser ativado para desgranulam. Degranulação é a exocitose de grânulos à membrana, o que resulta na liberação de mediadores farmacologicamente ativos, tais como a histamina, triptase, leucotrienos e 15. Este processo resulta na iniciação de reacções de hipersensibilidade do tipo I, que são críticas para a montagem de defesa contra parasitas bem como o início de reacções alérgicas, asma, e 15 cancerígenas.
Os mastócitos e basófilos, FceRI expressam receptores, os receptores de alta afinidade para a imunoglobulina E (IgE) 17. A exposição a um alergénio ou antigénio provoca a agregação de múltiplos receptores de IgE FceRI ligados 17, e é este so-chamada "reticulação" de receptores Fc de IgE ligadas, que inicia o processo de desgranulação: uma cascata de acontecimentos de fosforilação de tirosina, a activação de fosfolipase C, o efluxo de cálcio das reservas internas, e influxo de cálcio para dentro da célula 18. Este influxo de cálcio é necessária para a desgranulação e, ainda, sinaliza a fusão com a membrana dos grânulos antes de causar a exocitose de grânulos 15. Experimentalmente, um ionóforo de cálcio pode ser utilizada para transporte de cálcio directamente através da membrana da célula 19, o que evita essencialmente todas as etapas de transdução de sinal, antes da etapa 20 do influxo de cálcio, permitindo a identificação de um alvo por via de um tóxico como estando a montante ou a jusante de cálcio de sinalização 20.
Degranulação pode ser medido de forma rápida e eficaz, o controlo da libertação de β-hexosaminidase no sobrenadante de células, que é libertada a partir dos grânulos de forma linear juntamente com a histamina 6, mas ié muito mais fácil de detectar utilizando uma reacção enzima-substrato simples e um leitor de microplacas para análise do produto fluorescente. Este ensaio de microplacas, como descrito na secção do protocolo, baseia-se num método robusto originalmente desenvolvida por Naal et ai. 1, que quantifica a clivagem do substrato fluorogénico 4-metilumbeliferil-N-acetil--D-β glucosaminide por β- hexosaminidase. Nós modificamos o ensaio para efeitos de teste de drogas e substâncias tóxicas, com triclosan destaque aqui. Este método quantifica fiável desgranulação, é uma alternativa de baixo custo para, por exemplo, o fluxo de métodos de detecção baseados em citometria de 21, e tem o potencial de se prestar bem para rastreio de alto rendimento de uma grande variedade de fármacos anti-alérgicos, assim como imunotóxicas ou substâncias químicas alergênicas. Este último ponto é particularmente importante, tendo em conta o relatório do Conselho Nacional de Pesquisa 2007 "Ensaios de Toxicidade no Século 21: Uma visão e uma StratEGY "( http://www.nap.edu/openbook.php?record_id=11970 ), que preconiza para o desenvolvimento de testes de toxicologia de alto rendimento que utilizam a cultura de células para reduzir a utilização dispendiosa de animais tradicionais, tais como ratinhos de laboratório. O protocolo desenvolvido pela desgranulação Naal et ai. 1, e modificada por nós 2, utiliza a linha de células RBL-2H3, que é um modelo bem aceite homóloga aos mastócitos das mucosas humanas ou basófilos 3-5. (Métodos para a cultura de células RBL-2H3 estão detalhados em Hutchinson et al. 22). Este ensaio poderia provavelmente ser adaptado a qualquer tipo de célula mastro em anexo.
Triclosan (TCS) é um antimicrobiano de amplo espectro que tem sido utilizado por mais de 30 anos em hospitais, produtos de cuidados pessoais e de bens de consumo 23,24. O modo de ação para a característica antimicrobiana da TCS é a inibição da biossíntese de ácidos graxos, provavelmente inibindo enoil-acilproteína transportadora reductase 25,26. É encontrado em todo o mundo em uma ampla gama de produtos de consumo, tais como gel de banho, loção para as mãos, creme dental, enxaguatório bucal, e na mão sabonetes em concentrações de até 0,3% ou 10 mM 24. O uso generalizado de TCS resultou em níveis detectáveis em humanos 27-29 e em rios e córregos 30. Um estudo feito pela Allmyr et al. 27 demonstraram que a TCS e seus metabólitos estão presentes tanto no plasma e no leite de mães que amamentam. Importante, a TCS é facilmente absorvido pela pele 31-37. Queckenberg et ai. Encontrado 37 ~ 10% a absorção de um ~ 70 mM TCS creme na pele humana, dentro de 12 horas, resultando em uma concentração significativa na pele, onde residem os mastócitos.
SCT foi demonstrado clinicamente para controlar a doença alérgica da pele humana 7-11, mas o mecanismo pelo qual a TCS alivia as doenças alérgicas de pele tem sido desconhecido 38. Usando o ensaio de fluorescência de microplacas detailed neste vídeo, demonstramos recentemente que a TCS, a concentrações tão baixas quanto 2 uM, atenua significativamente a função de mastócitos e desgranulação, proporcionando uma potencial explicação para estes dados clínicos 2. Além de proporcionar uma explicação para estes dados clínicos, os nossos resultados em Palmer et al. 2 sugerem que a TCS de sinalização tem como alvo a jusante das moléculas do influxo de cálcio. Devido à importância da sinalização de cálcio em muitos outros processos imunológicos e biológicos, a TCS poderia ter efeitos adversos sobre uma ampla variedade de processos biológicos necessários. Na verdade, Udoji et al. 39 mostrou que TCS suprime a atividade das células natural killer humano lítico, outra função imune inato importante.
Para além do seu potencial como uma ajuda terapêutica na doença alérgica da pele (ou, inversamente, como um immunotoxicant), TCS também pode ser um disruptor endócrino 40-49. Assim, um procedimento claro de como preparar este produto químico em solução is de interesse para os toxicologistas. Porque SCT é uma pequena molécula hidrófoba, os veículos orgânicos são muitas vezes utilizados para torná-lo mais solúvel em água. Na maioria dos estudos de toxicidade em que a TCS foi testado, a preparação envolveu a dissolução em água com o auxílio de um solvente orgânico tal como etanol, acetona, ou óleo 2,50,51. No entanto, muitas vezes esses solventes são biologicamente ativa-se, complicando assim a interpretação da substância em estudo de dados 51. Na verdade, de acordo com Rufli et al. 52 e outros 53, recomenda-se que as soluções de ensaio para ensaios de toxicidade aquática são preparadas utilizando métodos físicos sobre os métodos químicos, devido ao potencial de solventes químicos para criar artefactos de toxicidade. Nós mostramos anteriormente que a TCS dissolvido em 0,24% de etanol / água (v / v) e sonicado por 30 min amortece RBL degranulação dos mastócitos 2. O etanol em concentrações mais elevadas do que 0,24% foi mostrado para amortecer degradação mastócitoscanulação 54,55, exemplos dos efeitos potencialmente de confusão de solventes orgânicos em estudos de toxicidade.
Não só é importante ter em conta o efeito de solventes no organismo ou células utilizadas para o estudo, mas também é importante para monitorizar o efeito de um solvente sobre o próprio produto químico de teste. Por exemplo, Skaare et ai. Dissolvendo 51 descobriram que a TCS em polietileno-glicol (normalmente encontrados nos dentífricos e bochechos) atenuou os efeitos anti-bacterianos e anti-placa em mulheres saudáveis do sexo feminino durante a dissolução em óleos provocou uma perda completa de função. Portanto, a capacidade de diferentes solventes para modular tóxico e de drogas, incluindo TCS, efeitos devem ser considerados no desenho do ensaio. A utilização de óleos ou aditivos de sabor pode interferir com os efeitos de TCS em vários produtos 50,51.
Num esforço para eliminar a necessidade de utilizar solventes orgânicos, que melhorado para o nosso método de dissolução TCS 2, eliminando o uso de um sol orgânicadesabafar. No presente protocolo, dissolver TCS grânulos diretamente em tampão aquoso com o calor (≤ 50 ° C) e, em seguida, verificar a concentração desse estoque TCS por espectrofotometria de UV-Vis. Estas melhorias são possíveis porque SCT é solúvel em água até 40 uM ( http://www.epa.gov/oppsrrd1/REDs/2340red.pdf ) e tem sido demonstrado que resistem à degradação quando aquecido a 50 ° C ( http:// / oehha.ca.gov/prop65/public_meetings/052909coms/triclosan/ciba3.pdf ) 56,57. Também tem a vantagem de espectrofotometria de UV-Vis, como TCS também é conhecido por absorvem fortemente a 280 nm, com um 58 coeficiente de extinção molar de 4,200 L / mol / cm 12.
Este protocolo oferece uma maneira simples, mas eficaz para dissolver TCS grânulos para um tampão, sem o auxílio de um solvente orgânico, incluindo o baixo custo e rápida verificaçãode concentração e descreve um ensaio de microplaca fluorescente poderoso para monitorar os efeitos químicos sobre a degranulação dos mastócitos.
Protocolo
Note-se que todas as receitas tampão são incluídas numa tabela no final do texto do protocolo.
DIA 1:
1. Preparação de Células
- Planeje 96 poços esquema de configuração da placa, centrando-se amostras no layout, a fim de evitar efeitos de borda. Atribuir três repetições para cada concentração testada TCS (± desgranulação estimulante de antigénio ou ionóforo), bem como triplicados para a libertação espontânea (sem estimulante degranulação), a libertação máxima (0,2% de Triton X-100 [TX] detergente de lise), bem como poços reservado para amostras de fundo (que não contêm células). Para cada dia experimental replicar, escolher um novo layout aleatório das concentrações das amostras TCS.
- Quente mídia RBL (Receita fornecida na tabela) e tripsina em 37 ° C banho-maria.
- Confira as células RBL em T-25 frasco (2-4 dias desde a última passagem e menos de 3-4 meses desde que foram descongelados) para os sinais gerais de boa curath: pH adequado indicado pela cor dos meios de comunicação e falta de nebulosidade. Colocar o balão sob um microscópio de luz para confirmar que o balão esteja livre de contaminação e que as células parecem saudáveis, adequadamente confluentes, e principalmente em anexo. Note-se que as células devem ser verificados para a contaminação por micoplasma, aproximadamente a cada seis semanas 22.
| Tratamento | Triplicatas |
| Estimulado, 0 mM TCS | A7, B7, C7, F4, G4, H4 |
| Estimulada, 0,001 fiM TCS | F6, G6, H6 |
| Estimulada, 0,1 uM TCS | A4, B4, C4 |
| Estimulada, 1 uM TCS | A6, B6, C6 |
| Estimulado, 5 mM TCS | F5, G5, H5 |
| Estimulada, 10 uM TCS | A3, B3, C3 |
| Estimulada, 15 uM TCS | A5, B5, C5 |
| Estimulada, 20 uM TCS | F7, G7, H7 |
| Estimulado, além de maior [TCS] | F3, G3, H3 |
| Espontânea, sem TCS (inclui zomba) | A10, A11, A12, B10, B11, B12 A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, No TCS | D10, D11, D12, E10, E11, E12 |
| Nenhuma célula, fundo, além de maior [TCS] | G10, G11, G12, H10, H11, H12 |
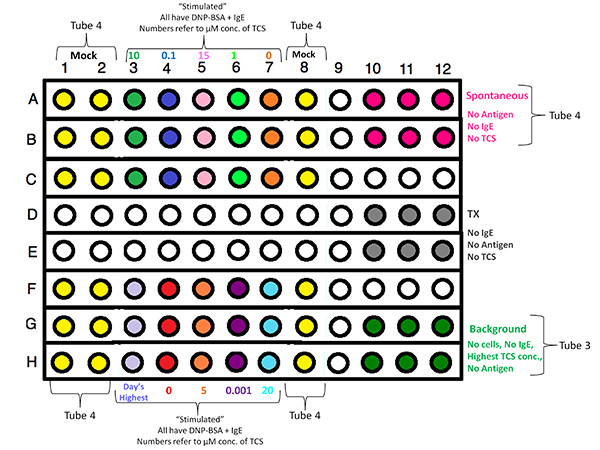
Clique aqui para ver a imagem ampliada .
- Pegue o frasco de células RBL na cultura de tecido estéril (TC) capô. As células são ligadas para o bottom do balão. Trabalhando sob o capô CT e utilizando uma técnica estéril padrão, remover todos os meios de frasco com uma pipeta estéril, as células permanecem ligados ao fundo do frasco. Em seguida, enxaguar frasco com 2 ml de tripsina, em seguida, descartar esta lavagem.
- Adicionar exactamente 2 ml de tripsina a cobrir a parte inferior do frasco. Colocar em 37 ° C incubadora durante 5 min para permitir que as células a separar a partir do fundo do balão.
- Após 5 min, atingiu o lado do frasco com uma mão aberta para soltar as células. Imediatamente, adicione 18 ml de mídia RBL para lavar as células fora do frasco e para saciar a tripsina. Tomar imediatamente a mistura de células-media-tripsina fora do frasco e transferir para um novo tubo de 50 ml estéril (o volume total neste tubo é agora 20 ml).
- Após misturar suavemente, mas completamente, retirar 50 mL de suspensão de células a partir deste tubo, e transferir para um tubo de microcentrífuga de 1,5 ml esterilizado, o que é um exemplo a ser contado. Tomar esta amostra, assim como os 50 ml0; tubo contendo a mistura de células-media-tripsina fora do capô TC para a bancada.
- Gire o tubo de 50 ml em centrífuga (com equilíbrio) por 8 min a 500 xg; esta força células pelotas de forma eficaz.
- Durante o tempo de centrifugação, a contagem das células na amostra que foram isoladas antes de girar. Para fazer isso, em primeiro lugar adicionar 50 ul de corante azul de tripano a 50 ul de células em 1,5 ml de tubo, e suave mas completamente pipetar para cima e para baixo para misturar 5x. Imediatamente, transferir 10 ul desta mistura para a hematocytometer vidro, e contar as células na área da grelha de acordo com as instruções do fabricante. Contar, no mínimo, 100 células por resultados estatísticos razoáveis.
- Back in the hood TC, remover o sobrenadante de células que foram girados para baixo.
- Tapar o tubo celular, e agite sedimento no fundo do tubo para soltar as células.
- Adicionar meio de células tratadas com tripsina para se obter uma densidade de 0,5 x 10 6 células / ml, com base na contagem das células.
- Misture bem, mas com cuidado para manter as células em suspensão durante o processo de revestimento. Usando um Pipetman, colocar as células a 100 ul / cavidade em uma placa de 96 poços (plana, de fundo preto), seguindo o modelo de placa de folha. Randomizar como as células são adicionados aos poços para evitar o erro sistemático, e misturar depois de cada conjunto de três poços foi adicionado. Não se esqueça de colocar as células nos poços rotulados para as amostras de fundo.
- Uma vez que todas as células foram transferidas, colocar a tampa de placa sobre a placa, e transferir para a incubadora (37 ° C / 5% de CO 2) durante a noite. Limpe seguindo técnica asséptica padrão.
DIA 2:
2. Preparação de Triclosan
- Usando um cilindro, medida 250 ml Tyrodes tampão graduado (Receita fornecida na tabela) em um frasco de 500 ml Erlenmeyer rotulado como "TCS-buffer." Adicionar bar mexa. Utilizar material de vidro, misture bar, termômetro designado para uso com TCS só.
- Também nesta altura, medida a 250ml Tyrodes em um Erlenmeyer de 500 mL separado, identificado como "tampão de controle." utilizar material de vidro, agitar bar, termômetro que não são designados para a TCS. Adicionar bar mexa.
- Pesar 0,0022 g de TCS grânulos e transferir para o balão "TCS-tampão" (que contém 250 ml Tampão Tyrodes). Para transferir eficientemente grânulos de Erlenmeyer, use 10 ml das medidos 250 ml Tyrodes para lavar pesar barco, certificando-se de tudo TCS foi transferido.
- Place "TCS-tampão" frascos em uma combinação de placa / placa de agitação magnética, e configurá-lo para mexer em um manageably alta velocidade. Uma vez bem misturados, este estoque TCS será nominalmente de 30 mM (concentração real será calculado após o aquecimento). (Faça tudo de mistura em um exaustor química.)
- Também nessa época, coloque o "tampão controle" frascos (contendo nenhuma TCS) para uma segunda combinação placa / placa de agitação magnética, e configurá-lo para agitar a uma velocidade similar.
- Ligue lâmpada UV / Vis para aquecer a lâmpada para uso posterior.
- Aquece-se a solução de "SCT-tampão", a 50 ° C, sob agitação constante. Após atingir a temperatura, o tempo, durante 90 minutos. Durante os 90 minutos, continuar a monitorizar a temperatura de 50 ° C ea velocidade de agitação adequada frequência.
- Ao mesmo tempo, aquecer a solução de "tampão de controlo" (que é cerca de 250 ml de tampão de Tyrode normal) a 50 ° C com agitação contínua. Após atingir 50 ° C, tempo durante 90 minutos, tempo durante o qual a temperatura (mantendo a 50 ° C) e sob agitação são ambas monitorizadas.
- No final da década de 90 min, tomar dois frascos Erlenmeyer fora dos pratos quentes e transferência para a bancada.
- Usando a função de verificação de comprimento de onda num espectrofotómetro UV / Vis, placa da máquina em 1 ml da solução aquecida "controlo de tampão" antes de digitalizar 1 ml da solução aquecida "SCT-tampão". Verifique a forma do espectro, umad valor recorde de absorção a 280 nm. Para determinar a concentração de, utilizar a equação de Beer-Lambert (A 280 = 280 ε ℓ c) utilizando uma ε 280 de 4200 L / mol / cm e 12 ℓ de 1 cm.
- Após a determinação da concentração de TCS, adicionar 0,249 g de albumina sérica bovina (BSA) a 249 mL restantes da solução "SCT-tampão", e misturar bem.
- Simultaneamente, adicionar 0,249 g de BSA para 249 ml o restante da solução de "tampão de controlo", e misturar bem.
DIA 2:
3. Antígeno-estimuladas Ensaio Degranulação Usando células RBL-2H3
- Antes de iniciar, verifique o pH de todos os buffers sendo usados, e garantir que eles são claros e não turva: isto inclui Tyrodes tampão, tampão de acetato de sódio e tampão de carbonato de glicina (receitas fornecidas na tabela).
- Mídia RBL quentes e tripsina em 37 ° C banho-maria.
- Adicione BT (1 mg / ml0; BSA em tampão de Tyrode): 0,05 g de BSA + 50 ml de tampão de Tyrode (X2). Coloque em banho-maria a 37 ° C.
- Adicione 0,2% de Triton X-100: 3,136 ml de BT + 64 ul de 10% de Triton X-100 (concentração final de Triton X-100 é de 0,2%). Misture bem por inversão, mas não vórtice. Coloque em banho-maria a 37 ° C.
- Iniciar a preparação da TCS e tampão Tyrodes aquecida (passos "2", acima) Nota:. Não comece o próximo passo (exposição IgE) até a "TCS-tampão" e soluções "tampão" de controle de chegar a 50 ° C e agitar para os primeiros 70 min de tempo de 90 min aquecimento / agitação.
- Uma vez que ambas as soluções têm sido agitada a 50 ° C durante 70 minutos, composição de 0,1 ug / mL de anti-DNP IgE rato (Sigma) em meio de RBL para poços de amostras a ser sensibilizados (100 ul / poço). IgE estoque não deve ter mais de 30 dias, quando armazenado a 4 ° C; gravar quantos anos o estoque é. Agite para misturar, mas não vórtice IgE.
- Dentro de uma câmara TC,adicionar 0,6 ul estoque IgE (Stock é de 1 mg / ml) a 6 ml de meio de RBL em um tubo de 50 ml. Em um segundo tubo de 50 ml, adicionar 6 ml de apenas media RBL simples (que se destina a amostras nonsensitized).
- Despeje todos os meios de placa de 96 poços (que foi preparado no dia 1) em pia, e trazer a placa sob o capô TC.
- Aleatoriamente adicionar 100 ul / media mistura IgE aos poços que devem ser estimuladas (48 total de poços). Esta mistura não se destina a "espontânea", "TX" e amostras de "fundo".
- Aleatoriamente, adicionar 100 mL de mídia RBL simples apenas para "TX", "espontânea" e "fundo" poços.
- Coloque a tampa da placa na placa e mova placa em 5% CO 2/37 ° C incubadora por 1 hora.
- Durante 1 hora de incubação, siga os passos de 3,13-3,24.
- Na bancada, preparar as diluições do antigénio. Adicionar 0,53 ml de 1,6 mg / ml de caldo de DNP-BSA + 850 ul & #160; BT para obter uma concentração de antigénio de 1 mg / ml. Vortex e inverter este estoque para misturar.
- Uma vez que "SCT-tampão" e "solução tampão de contraprova" ter sido aquecido e, em seguida, agitada durante 90 min a 50 ° C, continua-se com o resto da preparação para o protocolo de SCT (ir para passos 2.6 - 2.8.1). Após a BSA estar dissolvida em ambas as soluções, continuar a seguir.
- Começar a preparar os buffers de exposição, com ± Ag, ± TCS. Em primeiro lugar, a partir da amostra ml de solução de "SCT-tampão" (que já foi aquecida e agitada durante 90 min), a transferência de 50 mL para um novo tubo de 50 ml 249. Remover 20 ul desta aliquota de 50 ml e substituí-la por 20 ul da 1 ug / ml de antigénio preparada anteriormente para uma concentração de 0,0004 ng / ml de DNP-BSA antigénio final. Vortex e inverter.
- Etiqueta este "tubo 1, de alta TCS / Ag + / + BT." É utilizado para diluições e maior exposição à concentração TCS.
- A partir da amostra ml de solução de "tampão de controlo" 249, transferir 50 mL para um novo tubo de 50 ml. Remover 20 ul desta nova aliquota de 50 mL e substituir por 20 ul da 1 ug / ml de antigénio preparada anteriormente para uma concentração de 0,0004 ng / ml de DNP-BSA antigénio final. Vortex e inverter.
- Etiqueta este "tubo 2, No TCS / Ag + / + BT". Usado para diluições TCS e 0 mM de exposição concentração TCS.
- Agora tirar 50 ml de solução "TCS-tampão" e colocar em outro tubo de 50 ml. Retire 20 mL desta nova alíquota de 50 ml e substituí-lo com 20 l de simples BT. Vortex e inverter. Não é adicionado antigénio.
- Rotular este "tubo 3, de alta TCS / Não Ag / + BT." Isto é usado para o fundo.
- Transferir 50 ml de solução de "controlo de tampão" para outro tubo de 50 ml. Retire 20 mL dessa ne w 50 ml alíquota e substituí-lo com 20 l de simples BT. Vortex e inverter. (Sem Ag é adicionado.)
- Rotular este "tubo 4, No TCS / Não Ag / + BT." Isto é usado para o fundo e as amostras espontâneas.
| BSA | TCS | Antígeno | |
| Tubo 1 |  | Alto [] |  |
| Tubo 2 |  | NO |  |
| Tubo 3 | / "Width =" files/ftp_upload/50671/check.jpg 15px "/> | Alto [] | NO |
| Tubo 4 |  | NO | NO |
- Calcular e gravar volumes para diluições após a determinação da concentração do "SCT-tampão de" estoque. O volume total para cada concentração de diluição deve ser de 1 ml, e deve ser preparada em um tubo de microcentrífuga estéril. Use P2 calibrado e P1000 Pipetman.
| Concentração | Alta Triclosan Tyrodes + + BSA a 0,0004 ng / ml de Ag (Tubo 1 a partir de cima) | Aquecida BT 0,0004 ug / ml de Ag (Tubo 2 a partir de cima) |
| 20 uM | ||
| 15 uM | ||
| 10 uM | ||
| 5 fiM | ||
| 1 uM | ||
| 0,1 fiM | ||
| 0,001 mM | ||
| 0 mM (topo da placa) | ----------------------- | 500 mL além de outros 500 mL |
| 0 mM (parte inferior da placa) | ----------------------- | 500 mL além de outros 500 mL |
- Depois de 1 hr IgE incubação, tomar placa de incubadora e atirar em todos os meios de pia. (Nota: se os produtos químicos de teste são conhecidas por serem mais tóxica do que a TCS de produtos de consumo, a eliminação de resíduos perigosos podem ser necessárias.)
- Usando um Combitip, lavar aleatoriamente células na placa de 96 poços com tampão de Tyrode-BSA (200ul / poço). Soltar o tampão de lavagem para os lados das cavidades, em vez de directamente sobre as células ligadas, de modo a evitar perturbar as células anexadas. Repita o processo uma segunda vez.
- Para se preparar para a aplicação de tratamentos, vórtice e inverter diluições direita antes além da chapa.
- Começando com a secção superior da placa: Aleatoriamente adicionar triplicados de 200 ul cada uma das soluções de antigénio (com as concentrações correctas de SCT) às cavidades correspondentes. Continue a parte inferior da placa. Adicionar solução de "controlo de tampão" plus Ag (de "Tubo 2" acima) para todos os "simulações" sobre a placa.
- Adicionar 200 mL de soluções adequadas para os poços correspondentes:
- Adicionar 200 ul de 0,2% de Triton X-100 poços de "TX"-designados.
- Em seguida, adiciona-se 200 ul de tubo 3 para os três poços marcados "Antecedentes (Bkgd)-Maior TCS" sobre a placa.
- Finalmente, adicione 200 mLTubo de 4-6 poços rotulado "espontânea".
- Incubar a placa durante 1 hora, em 37 ° C / 5% de CO 2.
- Durante 1 hora de incubação: Obter dois baldes de gelo (um para a placa "antiga" em incubadora e um para nova placa). Descongelar 4-metilumbeliferil-N-acetil-beta-D-glucosaminide (4-MU), à temperatura ambiente durante até 40 minutos, mantendo-se em tiras, pois é sensível à luz.
- Uma vez 4-MU estoque é descongelado, compõem solução de 4-MU de trabalho: estoque de 150 mL + 14,85 mL de tampão acetato de frio (receita dada na tabela); vórtice e inverter. Manter no tubo de centrífuga de 50 ml, envolvido em folha, e em gelo até à utilização.
- Usando Combitip, adicione aleatoriamente 100 l frio solução de trabalho 4-MU na parte inferior de cada poço de uma nova Grenier preto placa de 96 poços (em balde de gelo # 2). Iniciar primeiro por adição da solução de trabalho de forma aleatória no interior da parte superior da placa, de forma aleatória no interior da parte inferior da placa, de forma aleatória dentro de Triton X-100 poços,e, finalmente, aleatoriamente dentro dos poços de fundo.
- Saia nova caixa de P200 dicas para o próximo passo.
- No final do 1 hr de incubação, colocar placa de células de incubadora para balde de gelo # 1, pipeta sobrenadante cima e para baixo 4-5x (suavemente, não a introdução de bolhas), indo ao redor do bem para uma boa mistura, mas não tocar as células ao misturar . Sistematicamente, tirar amostra de 25 mL de cada poço e local para a nova placa com o substrato (a mesma ordenação de amostras, como originalmente planejado). Pipeta cima e para baixo para misturar amostra completamente quando em novo poço, sem a introdução de bolhas.
- Incubar durante 30 min a 37 ° C / 5% de CO 2.
- Após 30 minutos de incubação, adiciona aleatoriamente 200 ul de tampão glicina-carbonato de frio por poço (usando Combitip) para encher os poços até 325 ul totais. (Faça isso além dos X-100 amostras Triton último, para evitar Triton X-100 spillover). Verifique se há bolhas antes chapa leitura (picar com limpo P10 pipetate ponta a aparecer as bolhas).
- Execute o prato no leitor de placas de fluorescência (vá para a seção 4).
DIA 2:
4. Fluorescentes Placa Instruções leitor e Análise de Dados
- Abra o programa Gen5 e seção experiência aberta.
- Ligue o leitor de placa e placa de inserção (canto superior esquerdo é A1).
- Protocolo
 Procedimento
Procedimento  Leia para definir leituras personalizadas. Não acrescentam nada sobre amostras, réplicas, etc, a fim de recolher dados de fluorescência matérias de cada poço.
Leia para definir leituras personalizadas. Não acrescentam nada sobre amostras, réplicas, etc, a fim de recolher dados de fluorescência matérias de cada poço. - Em "Leia" escolha "fluorescência", "Endpoint", "velocidade normal", "Gain 40", "Excitação 360/40", "Emissão 460/40", posição Optics: Top 50%. Top óptico offset: 7mm. No shake, sem atraso, não cinética, nenhum monitor bem, a temperatura: incubadora fora.
- Escolha fundo preto liso, placa de 96 poços (Grenier 96 poços, parte inferior lisa).
- Lidar com o layout da placa: Protocolo
 layout da placa. Configure amostras sem indicar se repete, diluições, etc
layout da placa. Configure amostras sem indicar se repete, diluições, etc - Prato
 ler.
ler. - Salvar o arquivo: Clique no botão "Excel", que irá exportar arquivos de dados para o Excel. Faça isso para o layout da placa e para a matriz. Salve o arquivo no computador e em um drive USB.
- No Excel, subtrair o fundo leitura média de cada amostra, incluindo Triton X-100 poços.
- Calcule% degranulação relativa dividindo cada valor (tendo já havia subtraído fundo) pelo valor médio de Triton X-100, e depois multiplique por 100 para torná-lo uma porcentagem.
- Média de todas as triplicatas, e calcular o desvio padrão. Dados do gráfico no Excel como valores médios ± desvio padrão. Para os testes estatísticos, passar agora a software GraphPad Prism por.
DIA 2:
5. Ionóforo Estimulada Ensaio Degranulação Usando células RBL-2H3
- Siga o protocolo de "Preparação de células" (Seção 1, dia 1) e "Preparação de triclosan" (Seção 2, Dia 2), conforme as instruções acima. O exemplo layout da placa para a estimulação ionóforo é mostrado abaixo.
| Tratamento | Triplicatas |
| Estimulado, 0 mM TCS | A7, B7, C7, F4, G4, H4 |
| Estimulada, 0,001 fiM TCS | F6, G6, H6 |
| Estimulada, 0,01 fiM TCS | F3, G3, H3 |
| Estimulada, 0,1 uM TCS | A4, B4, C4 |
| Estimulada, 1 uM TCS | A6, B6, C6 |
| Estimulado, 5 uM [TCS | F5, G5, H5 |
| Estimulada, 10 uM TCS | A3, B3, C3 |
| Estimulada, 15 uM TCS | A5, B5, C5 |
| Estimulada, 20 uM TCS | F7, G7, H7 |
| Espontânea, com DMSO, sem TCS (inclui zomba) | A10, A11, A12, B10, B11, B12 A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, com o DMSO, n TCS | D10, D11, D12, E10, E11, E12 |
| No fundo células, com DMSO, além de maior [TCS] | G10, G11, G12, H10, H11, H12 |

Clique aqui para ver a imagem ampliada .
- Antes de iniciar, verifique o pH de todos os buffers sendo usados, e garantir que eles são claros e não turva. Tyrodes, tampão de acetato de sódio, e tampão de carbonato de glicina (receitas indicadas na tabela).
- Preparar um tubo de 50 ml de BT, adicionando 0,05 g de BSA a 50 ml de tampão Tyrodes e em vortex para misturar bem. Incubar em banho-maria a 37 ° C.
- Adicione 0,2% de Triton X-100 com 0,0032% de DMSO (a concentração de cálcio ionóforo veículo final) por adição de 96 ul de 10% de Triton X-100-4,704 ml BT. Misturar bem. Em seguida, pegue a 0,155 mL desta solução e descarte. Agora adicione de volta em 0.155 ml de DMSO 100%.
- Preparar um estoque de 5 mM (2,5 mg / ml) de ionóforo A23187 a partir de pó através da adição de 400 ul de DMSO a 100% fresco para dentro do frasco e ionóforo de vórtex para misturar. Uma vez em solução,transferir para um tubo de 1,5 ml, o conteúdo da ficha e data de validade e de hoje (3 meses após a preparação quando armazenadas adequadamente a -20 ° C).
- Alternativamente, se estiver usando um estoque congelado hoje, degelo no gelo, e verifique se a mM ionóforo A23187 5 é bem misturado e clara. Vortex, súbito, e inverter esse estoque antes de usar. Data-base de preparação e Lot # deste A23187.
- Uma vez que "SCT-tampão" e "solução tampão de contraprova" ter sido aquecida e agitada durante 90 min, continuar o resto da preparação para o protocolo TCS (ir para 2.6-2.8.1 passos). Após a BSA é bem misturado em ambas as soluções, continue com as etapas do protocolo restantes.
- A partir da amostra ml de solução de "SCT-tampão de" 249, transferir 50 mL para um novo tubo de 50 ml. Remover 1,8 mL da alíquota de 50 mL e adicionar 1,8 mL de 5 mM de ionóforo de estoque. Vortex 3x por 8 segundos e inverter 3x. A concentração final é de um ionóforo80 nm. Note-se que esta concentração de A23187 variará dependendo estoque potência, e uma resposta dose de ionóforo A23187 é recomendado para identificar uma concentração de A23187 que provoca um nível desgranulação de aproximadamente 20% de libertação máxima, o qual foi identificado como sendo não citotóxico para uma RBL-2H3 células por ensaio de citotoxicidade (ver 2).
- Etiqueta este "tubo 1, de alta TCS / + ionóforo / + BT." Usado para diluições e maior exposição à concentração TCS.
- A partir da amostra ml de solução de "tampão de controlo" 249, transferir 50 mL para um novo tubo de 50 ml. Retire 1,8 mL da alíquota de 50 ml e adicionar novamente em 1,8 mL de 5 estoque ionóforo mM. Vortex 3x por 8 segundos e inverter 3x. Ionóforo concentração final é de 180 nm.
- Etiqueta este "tubo 2, No TCS / + ionóforo / + BT." Isto é usado para diluições e concentrações 0 TCS fiM.
- Do ml da amostra de R 249 20; solução TCS-tampão ", a transferência de 50 ml para um novo tubo de 50 ml. Retire 1,8 ml da nova alíquota de 50 ml e adicionar 1,8 mL de DMSO 100%. Vortex 3x por 8 segundos e inverter 3x, nenhum ionóforo é adicionado.
- Etiqueta este "tubo 3, de alta TCS / No ionóforo / + BT / + DMSO", usado para o fundo.
- A partir da amostra ml de solução de "tampão de controlo" 249, transferir 50 mL para um novo tubo de 50 ml. Retire 1,8 mL da nova alíquota de 50 ml e adicionar 1,8 mL de DMSO 100%. Vortex 3x por 8 segundos e inverter 3x. No ionóforo é adicionado.
- Etiqueta este "tubo 4, No TCS / No ionóforo / + BT / + DMSO", usado para amostras liberação espontânea.
| BSA | TCS | Ionóforo | Adicionou-se 100% de DMSO | |
| Tubo 1 | "Src =" / files/ftp_upload/50671/check.jpg "width =" 15px "/> | Alto [] |  | NO |
| Tubo 2 |  | NO |  | NO |
| Tubo 3 |  | Alto [] | NO |  |
| Tubo 4 |  | NO | NO | eck marca "fo: content-width =" 0,1 em "src =" / "width =" files/ftp_upload/50671/check.jpg 15px "/> |
- Calcular e gravar volumes para diluições após a determinação da concentração do "SCT-tampão de" estoque. Use P2 calibrado e P1000 Pipetman. O volume total para cada concentração de diluição deve ser de 1 ml, e deve ser preparada em um tubo de microcentrífuga estéril:
| Concentração | Alta Triclosan + Tyrodes + BSA 180 nM A23187 (tubo 1 de cima) | Aquecido BT 180 nM A23187 (tubo 2 de cima) |
| 20 uM | ||
| 15 uM | ||
| 10 uM | ||
| 5 fiM | ||
| 1 uM | ||
| 0,1 fiM | ||
| 0,001 mM | ||
| 0 mM (topo da placa) | ---------------------------------- | 500 mL além de outros 500 mL |
| 0 mM (parte inferior da placa) | ---------------------------------- | 500 mL além de outros 500 mL |
- Tome as células semeadas ontem fora da incubadora, e vazias na mídia na pia. Usando um Combitip, lavar aleatoriamente células na placa de 96 poços com a BT (200 ul / poço). Repetir a lavagem mais uma vez.
- Para se preparar para a aplicação de tratamentos, vórtice e inverter diluições direita antes além da chapa. Começando com a secção superior da placa: Aleatoriamente adicionar triplicados de 200 ul cada da concentração correcta de SCT a corresponding bem. Continue a parte inferior da placa. Adicionar solução de "controlo de tampão" plus A23187 (a partir de "Tubo 2" acima) para todos os "simulações" sobre a placa.
- Adicionar 200 mL de soluções adequadas para os poços correspondentes:
- Adicionar 200 ul de 0,2% de Triton X-100 poços de "TX"-designados.
- Em seguida, adiciona-se 200 ul de tubo 3 para os três poços marcados "Antecedentes (Bkgd)-Maior TCS" sobre a placa.
- Por último, acrescente 200 ml de tubo quatro a seis poços rotulados como "espontânea".
- Incubar a placa durante 1 hora, em 37 ° C / 5% de CO 2.
- Durante a 1 hora de incubação: Obter dois baldes de gelo (um para a placa "antiga" em incubadora e um para nova placa). Descongelar 4-metilumbeliferil-N-acetil-beta-D-glucosaminide (4-MU), à temperatura ambiente durante até 40 minutos, mantendo-se em tiras, pois é sensível à luz.
- Uma vez 4-MU estoque é descongelado, maquiagem 4-MU de trabalho solução queem: 150 estoque mL + 14,85 mL de tampão acetato de frio (receita dada na tabela); vórtice e inverter. Manter no tubo de centrífuga de 50 ml, envolvido em folha, e em gelo até à utilização.
- Usando Combitip, adicionar 100 ul aleatoriamente frio solução de trabalho de 4-MU no próprio fundo de cada poço de uma nova placa de Grenier preto de 96 poços (em balde de gelo # 2): começar por adição da solução de trabalho de forma aleatória no interior da parte superior da prato, de forma aleatória no interior da parte inferior da placa, de forma aleatória dentro de Triton X-100 poços, e, finalmente, aleatoriamente dentro dos poços de fundo.
- Saia nova caixa de P200 dicas para o próximo passo.
- No final do 1 hr de incubação, colocar placa de células da incubadora em balde de gelo # 1, pipeta sobrenadante cima e para baixo 4-5x (suavemente, não a introdução de bolhas), indo ao redor do bem para uma boa mistura, mas não tocar as células ao misturar . Sistematicamente, tirar amostra de 25 mL de cada poço e local para a nova placa com o substrato (a mesma ordem de SAmples, como originalmente planejado). Pipeta cima e para baixo para misturar amostra completamente quando em novo poço, sem a introdução de bolhas.
- Incubar durante 30 min a 37 ° C / 5% de CO 2.
- Após 30 minutos de incubação, adiciona aleatoriamente 200 ul de tampão glicina-carbonato de frio por poço (usando Combitip) para encher os poços até 325 ul total de (fazer esta adição aos Triton X-100 amostras últimos, a fim de evitar o Triton X-100 de transbordamento). Verifique se há bolhas antes da placa de leitura (picar com limpo P10 ponteira para estourar as bolhas).
- Execute o prato no leitor de placas de fluorescência (Siga todos os passos na secção 4).
Resultados
Quando aquecida a 50 ° C durante 90 min, o espectro de absorção de UV-Vis de SCT produz uma curva forte, suave entre ~ 260 e 300 nm, com pico a 280 nm, como mostrado na Figura 1. Espectrofotometria de UV-Vis, portanto, é uma importante ferramenta que pode ser utilizada para calcular a concentração, uma vez que o coeficiente de absorção molar publicada a 280 nm é de 4.200 L / mol / cm 12. Nós descobrimos que a TCS não cai para fora da solução durante o período de tempo de todo o experimento desgranulação, após aquecimento a 50 ° C (dados não mostrados).
Depois de utilizar este método de aquecimento para dissolver TCS directamente em tampão aquoso, examinámos o efeito de TCS em desgranulação de mastócitos utilizando um ensaio baseado em fluorescência que foi optimizado de Naal et ai. Uma Este ensaio regista o nível de β-hexosaminidase libertada mastro células após uma hora de incubação, através da detecção de um produto de substrato f luorogénico. Quer seja estimulada a desgranulam por DNP-BSUm antígeno (Figura 2) ou ionóforo de cálcio A23187 (Figura 3), pode-se ver claramente que a TCS provoca uma significativa inibição dose-resposta da liberação de β-hexosaminidase (ie degranulação).
A Figura 2 é representativo dos resultados obtidos para as células RBL sensibilizados pela IgE, que foram incubadas durante 1 hora em "SCT-tampão" ou "tampão de controlo", e exposto a uma dose de antigénio de DNP-BSA de 0,0004 ug / mL. Esta concentração de DNP-BSA, induziu uma resposta média em desgranulação absoluta de 22,5% ± 0,1 (média ± desvio padrão), na ausência de TCS. Inibição estatisticamente significativa da desgranulação começou a 5 uM, onde os níveis de degranulação foram de 0,79 ± 0,05 vezes (média ± DP) dos níveis de controlo 0 uM TCS. Como o aumento da concentração de TCS, há um maior efeito de amortecimento do TCS, mostrando uma forte relação dose-resposta. TCS, a 20 fiM, almost anula completamente a resposta de desgranulação, a níveis aproximadamente iguais a desgranulação espontânea (sem antigénio, onde estiver presente). No geral, esta figura mostra uma forte inibição da desgranulação de mastócitos estimulada antigénio multivalente, devido à concentração TCS verificado, sem o uso de solventes orgânicos.
Na Figura 3, o ionóforo de cálcio A23187 foi usada como uma maneira para investigar o mecanismo de SCT induzida amortecimento da desgranulação de mastócitos RBL. A23187 é utilizado como um estimulante alternativa porque evita a reticulação FceRI e outros eventos de sinalização a montante de influxo de cálcio, mas provoca ainda a desgranulação. Mastócitos RBL foram incubadas durante 1 hora em "SCT-tampão" ou "tampão de controlo", que contém uma dose de ionóforo de cálcio de 180 nm. Na ausência de SCT, esta concentração de A23187 induziu uma resposta média em desgranulação absoluta de 25,1% ± 4,7 (média ± desvio padrão). A inibição da desgranulação foiencontrado com tão pouco como 1 mM TCS (0,63 ± 0,11 [média ± DP]). Dado que a concentração da TCS aumenta, o mesmo acontece com a gravidade da inibição: a 5 uM, 0,21 ± 0,04 vezes dos níveis de controlo 0 uM TCS, a 10 uM, 0,09 ± 0,05, a 15 mM, 0,077 ± 0,006, e de 20 fiM , 0,09 ± 0,02 (média ± DP). De facto, a partir de 5 uM e concentrações mais elevadas de SCT, os níveis de desgranulação induzida por A23187 foram encontrados estar perto do nível de controlo espontânea (em que nenhum de A23187 está presente em todos). Em geral, a Figura 3, em combinação com a Figura 2, indica que os eventos moleculares orientadas pela TCS são susceptíveis a jusante do fluxo de cálcio.

Figura 1:. Representante TCS espectro de absorção UV-Vis TCS tem uma ervilha robustok a 280 nm, permitindo a fácil determinação do A 280, bem como proporcionar a capacidade de utilizar o coeficiente de extinção molar de 4,200 L / mol / cm 12, para determinar a concentração real de SCT dissolvido em tampão de Tyrode. A linha amarela indica o pico a 280 nm. Neste exemplo, o valor de absorbância a 280 nm é 0,11876, o que indica uma concentração TCS de 28,28 mM. Clique aqui para ver a imagem ampliada .

Figura 2:. Uma resposta representativa desgranulação de mastócitos RBL sensibilizados com IgE expostos a 0,0004 mg / ml de antigénio de DNP-BSA e TCS (0-20 uM) o valor de libertação espontânea (sem antigénio presente) é descrito por referência. Os valores representam a média7; desvio padrão de amostras em triplicado. Conforme apresentado, os dados foram normalizados para o controlo (0 uM TCS), e as diferenças significativas foram determinados no software Prism com um ANOVA de uma via seguido por teste post-hoc de Tukey (comparações feitas para 0,001 uM TCS resposta média). Significado é representada por *** p <0,001. Clique aqui para ver a imagem ampliada .
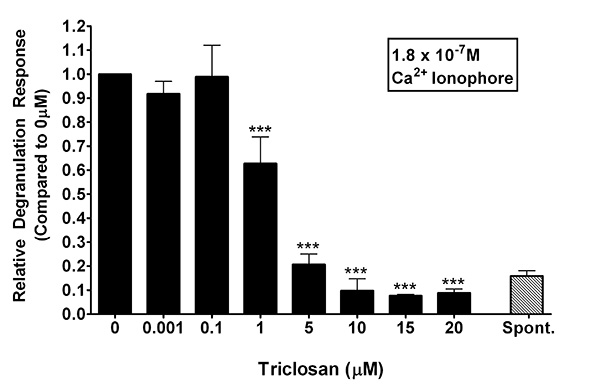
Figura 3:. Uma resposta representativa desgranulação de mastócitos RBL estimuladas com 180 nM do ionóforo de cálcio A23187 na presença de SCT (0-20 uM) Uma amostra libertação espontânea (sem ionóforo presente) é descrito por referência. Os valores representam a média ± desvio padrão de amostras em triplicado. Como Presented, os dados são normalizados para o controlo (0 uM TCS), e as diferenças significativas foram determinados no software Prism com um ANOVA de uma via seguido por teste post-hoc de Tukey (comparações feitas para 0,001 uM TCS resposta média). Significado é representada por *** p <0,001; ** p <0,01. Clique aqui para ver a imagem ampliada .
Discussão
Em 2004, Naal et ai. Uma desenvolveu um biossensor de mastócitos para o ensaio de elevado rendimento de degranulação. É um ensaio robusto que nós adaptamos para os nossos estudos TCS e detalhado neste vídeo. Antes da Naal et ai. Ensaio 1, a desgranulação dos mastócitos foi avaliada rotineiramente através β-hexosaminidase 59-61, mas estes métodos iniciais utilizados fluorímetros no qual uma amostra foi lido ao mesmo tempo. Importante, Naal et al. concordância directa estabelecido entre o seu método de mais alto rendimento, utilizando um leitor de microplacas e o método anterior em que as amostras foram lidas um-em-um-tempo num f luorómetro. Em suma, Naal et al. 1 melhorou muito a velocidade, força, simplicidade e confiabilidade do teste, adaptando-a a uma plataforma de microplacas de alto rendimento, bem como pela incorporação de diversas mudanças para o fluxo de trabalho. Aqui, temos ainda adaptado deste ensaio para um estudo de vários produtos químicos de teste, em particular, aqui, O onipresente droga TCS. Os detalhes do vídeo os passos deste ensaio muito útil. Além disso, temos também desenvolvido um método orgânico solvente livre de aplicar TCS em tampão aquoso, e vamos mostrar um procedimento simples e de baixo custo para a verificação concentração TCS. Esses métodos devem ser úteis para o campo aparentemente crescente do triclosan toxicologia. Nesta discussão, detalhamos várias considerações para com este ensaio degranulação para testar outros produtos químicos também.
TCS foi preparado directamente em tampão aquoso sem a ajuda de solventes orgânicos, a concentração foi verificada por espectrofotometria de UV-Vis (Figura 1), e então o efeito de SCT (<30 mM) foi examinada com a desgranulação dos mastócitos (Figuras 2 e 3) , utilizando um ensaio de microplaca de fluorescência para detectar a presença de β-hexosaminidase, um marcador substituto para a desgranulação. Nós descobrimos que a TCS é capaz de atenuar significativamente a libertação de β-hexosaminidase de mastócitos RBL quando dissolvido numa baixa concentração de etanol (0,24% vol / vol) de 2, ou, como ilustrado aqui, directamente em tampão aquoso. Por renunciando solvente orgânico, que se vê mais pronunciada amortecimento em desgranulação induzida por antigénio, em comparação nossos estudos em que a TCS foi dissolvido em etanol a 0,24% (vol / vol). Por exemplo, aqui demonstraram uma redução> 50% na desgranulação induzida por antigénio (0,46 ± 0,07 vezes), o que é muito maior do que a redução de ~ 25%, relata-se 10 uM TCS dissolvidos em etanol a 0,24% (0,76 vezes ± 0,02) 2. No mesmo sentido, determinou-se para as células A23187-estimulados que, por 5 mM, TCS inibe a degranulação de níveis de liberação espontânea, este efeito não foi demonstrado até 10 mM TCS em nosso anteriormente, etanol utilizando, estudo 2. Há duas possíveis razões para essa discrepância: ou um veículo de etanol 0,24% 2 atenua a capacidade da TCS para inibir cel mastro ativol degranulação, ou a TCS estávamos usando era menos concentrado do que o previsto (desde que as concentrações não foram verificados por espectrofotometria de UV-Vis no estudo anterior 2). Quanto o alvo molecular para a inibição da desgranulação de mastócitos da TCS, é provável que ocorre algures na cascata de transdução de sinal a jusante do fluxo de cálcio 2. Utilizou-ionóforo de cálcio A23187, como um estimulante para a desgranulação ignorar os eventos sinalizadores precoces e efeito inibidor da TCS persistiu, indicando que o alvo de SCT inibição na desgranulação via não é provável localizado a montante da entrada de cálcio. Nós mostramos anteriormente que ruffling membrana destas células também é suprimido, devido ao tratamento a TCS, sugerindo a possibilidade de um alvo via comum 2.
Estudos anteriores mostraram o espectro de absorção de SCT tendo um pico máximo a 280 nm e um coeficiente de absorção molar foi avaliada para ser 4200 L / mol / cm neste wavelenGTH (a valores de pH abaixo do pKa) 12. Tem sido mostrado que o aquecimento da TCS não levar à degradação térmica 57, e um outro estudo demonstrou o sucesso na dissolução TCS em água enquanto é aquecida até 50 ° C, sem a ajuda de um solvente orgânico 56. Quando qualquer novo produto químico de teste é utilizado, a sua solubilidade no tampão aquoso, é claro, deve ser cuidadosamente considerada. Também descobrimos que, quando se aquece o TCS, a forma da leitura espectral não é afectada se ela é aquecida durante 40-90 minutos (dados não apresentados): isto sugere uma falta de degradação do ASR quando aquecido durante um período mais longo de tempo. Note-se, contudo, que a TCS de dissolução for superior a 90 min a 40 min. Também se confirmou que a TCS não cair da solução para a duração da experiência desgranulação (dados não mostrados).
O antigénio de DNP-BSA e as concentrações de ionóforo de cálcio utilizado no presente estudo foram escolhidos com base em ensaios de antigénio-e de resposta de dose de ionóforo, umd foram seleccionados para provocar níveis moderados desgranulação das Figuras 2 e 3 representativos. Um exemplo de um ensaio de resposta à dose de antigénio pode ser visto na Figura 1A do nosso trabalho anterior 2. Ao determinar a concentração de antígeno ou ionóforo para ser usado em seu experimento, é importante estar ciente de que os experimentos dose-resposta estimulante precisa ser feito periodicamente, normalmente, pelo menos a cada dois meses, uma vez que as células RBL-2H3, por vezes funcionar variável. A concentração que origina a percentagem desgranulação desejado pode variar, dependendo da idade das células e na preparação de antigénio / ionóforo. Além disso, como vimos com arsenito inorgânico 22, os percentuais de degranulação absolutos (níveis de antígeno usado) pode afetar os níveis de efeitos tóxicos em degranulação RBL, então tóxico dose-resposta deve ser feito em várias concentrações de antígeno / ionóforo diferentes. Também é importante considerar o conce definitivontration de veículo DMSO ao estimular a degranulação com ionóforo, desde degranulação é afetado por DMSO 62. Foram encontradas concentrações de DMSO utilizadas neste protocolo não afetam degranulação, leituras de fundo, ou 0,2%, valores Triton X-100 2.
Além do antigénio multivalente de DNP-BSA e o ionóforo de cálcio A23187, existem vários outros métodos de estimulação de RBL-2H3. Um desses métodos é a estimulação através de exposição ao composto 48/80, juntamente com 63 de quercetina. Outro é o crosslinking de receptores IgE ligados com uma IgG anti-IgE, como previamente testado juntamente com a exposição TCS 2. Existem muitos outros métodos de estimulação, e cada um destes métodos aborda um aspecto diferente mecanicista da desgranulação de mastócitos. Este leitor de placas de ensaio podem ser adaptados para uso com muitas destas estimuladores alternativos, expandindo a sua utilidade.
Este protocolo desgranulação tem o potencial para ser usado com uma grande variedade de chedutos químicos. Em um estudo de qualquer produto químico teste com este ensaio, os controles devem ser executados para o seguinte: (1) o efeito da substância em estudo no fundo (sem pilhas) leituras, (2) o efeito do produto químico em degranulação espontânea (células sem IgE , nenhum antigénio, nenhuma ionóforo), (3) Efeito do produto químico em-100 Triton-X valores das células lisadas (sem antigénio, nenhuma ionóforo). Esses testes podem ser facilmente trabalhado no layout da placa. Anteriormente, encontramos a TCS afeta nenhum desses três parâmetros 2. Além disso, os testes devem ser executados para determinar se a substância de ensaio não interfere com a reacção de enzima / substrato de hexosaminidase β-se em uma preparação isenta de células, como descrito na Figura S1 de uma secção de Palmer et ai dados complementar apêndice 2. Descobrimos que a TCS não interfere com a capacidade de β-hexosaminidase para clivar o substrato fluorogénico 4-MU 2. Efeitos de quaisquer solventes utilizados também devem ser consideradosEm todas estas experiências de controlo. Por exemplo, constatou-se que o DMSO, o solvente para o ionóforo, não tem nenhum efeito sobre-X-100 Triton níveis de fluorescência de amostras (dados não mostrados). Observamos também que nós selecionamos todos os plásticos utilizados neste estudo para que não contém o disruptor endócrino bisfenol A, mas, infelizmente, porém, todos os plásticos atualmente no mercado, provavelmente contêm alguns efeitos endócrinos nocivos, o que poderia confundir os dados 64.
No caso de solução de problemas é necessária, vários aspectos potenciais deste protocolo deve ser revisto. Por exemplo, pode ser que (1) os níveis de libertação espontâneos são muito elevada (superior a ~ 7% dos valores de lise), (2), uma dose-resposta com qualquer estimulante e / ou químicas de teste não é observado, ou (3) a concentração de TCS em solução é muito baixo (inferior a 20 fiM). No primeiro caso, um nível espontâneo elevado pode ser uma indicação de que as células estarem em cultura por muito tempo ou estar contaminada com micoplasma; conseguinte, Experimente estes experimentos com células RBL-2H3 que estiveram na cultura entre 2-20 semanas, e testar regularmente por micoplasma. Se uma dose-resposta estimulante não for observado, a concentração de estimulante dissolvido pode ser muito baixa, e as ações devem ser refeitos. Como um exemplo, ionóforo de cálcio é normalmente fornecido como um filme fino, para ser reconstituído com DMSO, que requer atenção cuidadosa e muito vórtex. Além disso, um novo estoque ionóforo com um número de lote diferente poderia ter uma potência diferente, simplesmente devido à variação de lote para lote e, portanto, recomenda-se uma dose-resposta degranulação com cada ação ionóforo recém-adquirido. É também interessante notar que a aparente falta de efeito com um determinado produto químico de teste pode ser uma indicação de que esta substância pode requerer um período de incubação mais longo, a fim de causar um efeito. Se você não está conseguindo um alto rendimento TCS em solução, verifique se a temperatura permaneceu constante (50 ° C ± 5), enquanto os grânulos estão se dissolvendo em buffer. Ttermómetro ele nunca devem tocar no fundo do frasco, uma posição que poderia levar a uma sobreavaliação da temperatura da solução. Além disso, certifique-se que é vigorosa agitação constante e que a contagem regressiva de 90 min não é iniciado até que a temperatura chegou a primeira 50 ° C.
Tabela para Resolução de Problemas.
Problema | Razão potencial | Solução |
TCS estoque está determinado a ser <20 mM | Não uniforme de aquecimento da solução de | Assegurar que o termómetro é posicionada de modo que ela é suspenso na solução e não tocar no fundo do frasco. |
A agitação não é suficientemente vigorosa | Aumente agitação magnética em agitar-placa para atingir um nível de mexer que é vigorosa sem causar a solução para saltar para fora do balão. Certifique-se que uma barra de agitação magnética de tamanho adequado é usado. | |
Problemas com espectrofotômetro | Permitir adequada de aquecimento de lâmpada UV (tipicamente 10 min), ou substitua a lâmpada, se necessário. | |
Desgranulação níveis espontâneos são muito alta (> ~ 7%) | Células adquiriram mutações genéticas anormais devido a muito tempo em cultura | Realizar experimentos com um novo degelo celular. |
As células estão morrendo por causa do corte mecânico | Ao adicionar tampão ou tratamentos de células aderentes, tome cuidado para não perturbar as células, adicionando esses volumes cuidadosamente para os lados das cavidades. Pratique usando o Combitip. | |
IgE / DNP-BSA não causar a liberação de beta-hexosaminidase sobre os níveis de liberação espontânea | A IgE é mais de 30 dias ou que tenha sido sujeito a congelamento descongelamento | Use uma nova alíquota devidamente armazenados de IgE. |
DNP-BSA não foi devidamente misturado | Não se esqueça de adicionar cuidadosamente o pequeno volume de DNP-BSA para o tubo cônico e to vórtice completamente. | |
Ionóforo A23187 não causar a liberação de beta-hexosaminidase sobre os níveis de liberação espontânea | A23187 estoque não foi devidamente reconstituído | Produto chega como um "filme fino", e deve ser reconstituído com cuidado e muito vórtex. Transferência reconstituído estoque para um novo tubo de 1,5 ml para armazenamento. |
A23187 estoque não foi devidamente armazenados | Os estoques são sensíveis à luz. Uma vez reconstituídos, Parafilm o topo, e armazenar envolvido em folha, a -20 ° C. Se houver uma pergunta sobre o armazenamento de um estoque, descartar e começar os testes com um novo estoque. | |
180 nM de ionóforo A23187 não provocamo mesmo nível de resposta em relação a desgranulação, como a encontrada num ensaio cedo | Variação de lote para lote de ionóforo A23187 | Realizar um experimento de dose-resposta para cada novo lote de ionóforo. Recomenda-se também que os estoques do mesmo lote ser testada, devido ao potencial de variabilidade no processo de reconstituição. |
Como em qualquer toxicologia / farmacologia experimento, a substância de ensaio não deve ser abertamente tóxico nas concentrações testadas. Recomendamos utilizando métodos de ensaio para que tanto a apoptose e necrose, quer individualmente ou combinado (por exemplo, com ensaios clonogénicos), bem como os testes de danos gerais para a membrana do plasma (tais como vazamento de lactato desidrogenase). TCS, em concentrações mostradas no presente estudo, não é citotóxica para as células RBL-2H3 2. Uma nota particular de preocupação com os estudos ionóforo é que ionóforo mais ionóforo veículo(Provavelmente DMSO), além de produtos químicos de teste, além de quaisquer solventes orgânicos utilizados, pode ser uma mistura potencialmente citotóxico, que deve ser cuidadosamente controlada, como foi feito em Palmer et al 2.
O protocolo para a preparação de soluções de TCS, sem a utilização de um solvente orgânico que seja útil para testes toxicológicos deste produto químico ubíquo, sem a interferência de artefactos de solvente, uma consideração especialmente importante em toxicologia aquática. Estes métodos permitem também a verificação da concentração de SCT em solução e a quantificação dos efeitos dos produtos químicos, tais como a ASR, têm sobre a desgranulação de mastócitos. Este protocolo pode ser utilizado para avaliar os efeitos de uma grande variedade de produtos químicos sobre a desgranulação de mastócitos, tais como os produtos químicos 55 interrompendo suspeita endócrino, e, potencialmente, podem ser ampliados para triagem de alto rendimento. Além disso, outros tipos de mastócitos podem ser utilizados neste ensaio em trabalho futuro.
Divulgações
Não temos nada a divulgar.
Agradecimentos
LMW e RHK são suportados pela Escola de Pós-Graduação da UMaine de Ciências Biomédicas e Engenharia (GSBSE); RHK também foi apoiado pelo Fundo Maine & Estação Experimental Forest. Financiamento adicional foi fornecido pelo Instituto Nacional de Ciências Médicas Gerais (NIH P20-GM103423), o Agricultural Maine & Estação Experimental Florestal (Grant Número ME08004-10, JAG), a Universidade de Maine ADVANCE Rising Tide Center (NSF Grant # 1008498) e um Research Grant Iniciado em Farmacologia / Toxicologia da PhRMA fundação (JAG). Agradecemos drs. David Holowka e Barbara Baird para o antigénio e células. Somos gratos a Hina Hashmi, Alejandro Velez e Andrew Abovian ajuda com equipamentos e ordens. Este é Maine Agricultural & Estação Experimental Floresta número de publicação 3311.
Materiais
| Name | Company | Catalog Number | Comments |
| RBL-2H3 Cells | ATCC | CRL-2256 | The cells we used were a gift, but they are also available from ATCC |
| Triclosan/Irgasan | Sigma | 72779 CAS# 3380-34-5 | Should be stored in a low humidity environment |
| Trypsin | Gibco | 25300-054 CAS# 3380-34-5 | |
| EMEM | Lonza | 12-611F | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Gentamycin Sulfate | Lonza Biological Sciences | 17-518 | |
| Albumin, Bovine Serum | Calbiochem | 12659 CAS# 9048-46-8 | |
| Surfact-Amps X-100 (Triton X-100; 10% solution) | Pierce | 28314 CAS# 9002-93-1 | |
| HEPES | J.T Baker | 4153-01 CAS# 75277-39-3 | |
| Magnesium Chloride | VWR | BDH0244-500G CAS# 7791-18-6 | |
| D-(+)-Glucose | Biomedicals | 152527 CAS# 50-99-7 | |
| Potassium Chloride Crystal | J.T Baker | 3046-01 CAS# 7447-40-7 | |
| Calcium chloride dihyrdate | Acros Organics | 207780010 CAS# 10035-04-8 | |
| Glycine | Sigma | G8898 CAS# 56-40-6 | |
| 4-Methylumbelliferyl-N-acetyl-β-D-glucosaminide (4-MU) | EMD Biosciences | 474502-250MG CAS # 37067-30-4 | Wrap in foil – is light-sensitive |
| Anti-DNP Mouse IgE | Sigma | D8406 | Reagent has concentration of 1 mg/ml. Aliquot 25 µl of reagent into separate microcentrifuge tubes and Parafilm. Store aliquots at -20 °C that are not being used and store aliquot that is being used at 2-8 °C for no longer than 1 month. |
| DNP-BSA | Gift from Dr. David Holowka and Dr. Barbara Baird, Cornell University | Suggest: life technologies DNP-BSA catalog# A23018 | |
| Calcium Ionophore A23187 | Sigma | C75-22-1mg | Ionophore was made from a powder by adding 400 µl of fresh 100% DMSO into the ionophore vial and is kept at -20 °C Note: we have used the ionophore past its 3 month expiration date successfully |
| DMSO | Sigma | D2650 CAS# 67-68-5 | |
| Acetic Acid | VWR | BDH3094-2 CAS# 64-19-7 | |
| Anhydrous Sodium Carbonate | Sigma | 222321 CAS# 497-19-8 | |
| Sodium Chloride | Sigma | 71376 CAS# 7647-14-5 | |
| Hydrochloric Acid | VWR | BDH3026 CAS# 7647-01-0 | |
| Reference Buffer, pH 7 | VWR | BDH5046 | |
| Reference Buffer, pH 10 | VWR | BDH5072 | |
| Reference Buffer, pH 4 | VWR | BDH5018 | |
| pH electrode storage solution | VWR | 14002-828 | |
| Equipment: | |||
| DU 7500 Spectrophotometer | Beckmann | No longer sold | |
| Synergy 2 plate reader Uses Gen5 Microplate Data Collection and Analysis Software | BioTek | Module S | |
| Hematocytometer | Hausser Scientific | 3110 | |
| 7 x 7 CER HOT/STIR 120 V Combination hot plate/magnetic stir plate | VWR | 97042-634 | |
| Centrifuge | Eppendorf | 5430 | |
| Tissue culture water bath | VWR | Model# 89032-206 | |
| Tissue Culture biological safety cabinet SafeGARD (TC hood) | The Baker Company | Model# SG403A-HE | |
| Tissue culture incubator | ThermoScientific | Model# 3598 | |
| Pipetman | VWR | Range: P2-P1000 | |
| Balance | Mettler Toledo | Model# AG204 | |
| pH meter | Symphony/VWR | Model# SB70P | |
| Pipet-Aid | Drummond Scientific | 4-000-100 | |
| Combitip dispenser | Eppendorf | 4981 000.019 | |
| Recipes: | |||
| Acetate Buffer, pH 4.4 | Make 0.12 M acetic acid and titrate to pH 4.4 with 10 N NaOH. This is 5.3 ml glacial acetic acid into 1 L of MilliQ water: (1 L)*(0.12 mol/L)*(60 g/mol)*(ml/1.37 g) = 5.3 ml because density of glacial is 1.37 g/ml | Sterile Filter into autoclaved glass bottle | |
| Substrate (4-MU) | Sigma M-2133, 250 mg, C18H21NO8, FW 379.4 CAS (37067-30-4) Store in -20°C Stock: 0.12 M in DMSO (46 mg in 1 ml DMSO), warm to 37 °C, vortex, sonicate 10 min. in water-bath sonicator with warm water, vortex again | For each experiment, make fresh solution of substrate in acetate buffer (100x dilution), for final concentration of 1.2 mM in acetate buffer | |
| Glycine Carbonate Buffer, pH 10 | 26.7 g glycine 47.1 g anhydrous sodium carbonate Add deionized water for 1 L, and adjust pH to 10 | Sterile filter into autoclaved glass bottle | |
| Tyrodes (2 L), pH 7.4 | 135 mM NaCl: 15.78 g (or 270 ml of 1 M) 5 mM KCl: 10 ml of 1 M stock 1.8 mM CaCl2: 7.20 ml of 0.5 M stock 1 mM MgCl2: 4.00 ml of 0.5 M stock 5.6 mM glucose: 2.02 g (11.2 ml of 1 M) 20 mM HEPES: 40 ml of 1 M stock Using concentrated HCl pH from ~9.7-7.4 | Sterile filter into autoclaved glass bottle | |
| RBL Cell Media | Thaw fetal bovine serum (FBS, stored at -20 °C) for about 4 hours in 37 °C water bath Follow standard sterile technique Get out 1 L minimum essential medium (MEM) with L-glutamine (with Earle’s salts) Pour off some MEM to have 800 ml MEM, add 200 mL warm FBS Add 1 ml gentamicin sulfate antibiotic to 1 L of media with sterile pipette Only use media bottles that have been autoclaved and marked for cell culture use only. | Sterile filter (0.2 mm) into autoclaved glass bottle | |
| Plastic material used: | |||
| 200 µl Disposable sterile pipet tips with graduations in 96 rack | VWR | 53509-009 | polypropylene |
| 1,000 µl Sterile aerosol pipet tips with HighRecovery | VWR | 89003-420 | polyethylene |
| 10 µl micro tip low binding sterile | VWR | 14217-704 | polypropylene |
| Disposable/conical Microcentrifuge tubes for high G-force | VWR | 20170-038 | polypropylene |
| Disposable/graduated/conical/sterile 50 ml centrifuge tubes with screw caps | VWR | 21008-178 | polypropylene |
| Disposable/graduated/conical/sterile 15 ml centrifuge tubes with screw caps | VWR | 21008-103 | polypropylene |
| CELLSTAR Tissue Culture Treated T-25 Flask w/ Filter Cap | Greiner Bio One | 690175 | polystyrene |
| CELLSTAR Tissue Culture Treated T-75 Flask w/ Filter Cap | Greiner Bio One | 658175 | polystyrene |
| CELLSTAR 10 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 607180 | polystyrene |
| CELLSTAR 2 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 710180 | polystyrene |
| CELLSTAR 5 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 606180 | polystyrene |
| CELLSTAR 25 ml Paper /Plastic Wrapped Serological Pipette | Greiner Bio One | 760180 | polystyrene |
| 1 cm cuvettes | N/A | N/A | polystyrene |
| CELLSTAR, 96W Microplate, Tissue-Culture Treated, Black, with Lid 96-well Plate | Greiner Bio One | 655086 | polystyrene |
| Combitips | Eppendorf | 022266501 | Polypropylene/ polyethylene |
Referências
- Naal, R., Tabb, J., Holowka, D., Baird, B. In situ measurement of degranulation as a biosensor based on RBL-2H3 mast cells. Biosens. Bioelectron. 20, 791-796 (2004).
- Palmer, R. K., et al. Antibacterial agent triclosan suppresses RBL-2H3 mast cell function. Toxicol. Appl. Pharmacol. 258, 99-108 (2012).
- Fewtrell, C., Kessler, A., Metzger, H. Comparative aspects of secretion from tumor and normal mast cells. Adv. Inflam. Res. 1, 205-221 (1979).
- Metzger, H., et al. The receptor with high-affinity for immunoglobulin-E. Annu. Rev. Immunol. 4, 419-470 (1986).
- Seldin, D. C., et al. Homology of the rat basophilic leukemia-cell and the rat mucosal mast-cell. Proc. Natl. Acad. Sci. U.S.A. 82, 3871-3875 (1985).
- Schwartz, L. B., Austen, K. F., Wasserman, S. I. Immunological release of beta-hexosaminidase and beta-glucuronidase from purified rat serosal mast-cells. J. Immunol. 123, 1445-1450 (1979).
- Kjaerheim, V., Barkvoll, P., Waaler, S. M., Rolla, G. Triclosan inhibits histamine-induced inflammation in human skin. J. Clin. Periodontol. 22, 423-426 (1995).
- Barkvoll, P., Rolla, G. Triclosan reduces the clinical symptoms of the allergic patch test reaction (APR) elicited with 1-percent nickel sulfate in sensitized patients. J. Clin. Periodontol. 22, 485-487 (1995).
- Tan, W. P., Suresh, S., Tey, H. L., Chiam, L. Y., Goon, A. T. A randomized double-blind controlled trial to compare a triclosan-containing emollient with vehicle for the treatment of atopic dermatitis. Clin. Exp. Dermatol. 35, e109-e112 (2010).
- Sporik, R., Kemp, A. S. Topical triclosan treatment of atopic dermatitis. J. Allergy Clin. Immunol. 99, 861(1997).
- Wohlrab, J., Jost, G., Abeck, D. Antiseptic efficacy of a low-dosed topical triclosan/chlorhexidine combination therapy in atopic dermatitis. Skin Pharmacol. Physiol. 20, 71-76 (2007).
- Wong-Wah-Chung, P., Rafqah, S., Voyard, G., Sarakha, M. Photochemical behaviour of triclosan in aqueous solutions: Kinetic and analytical studies. J. Photochem. Photobiol. A Chem. 191, 201-208 (2007).
- Blank, U., Essig, M., Scandiuzzi, L., Benhamou, M., Kanamaru, Y. Mast cells and inflammatory kidney disease. Immunol. Rev. 217, 79-95 (2007).
- Gri, G., et al. Mast cell: an emerging partner in immune interaction. Frontiers in Immunology. 3, (2012).
- Kuby, J. Immunology. , W.H. Freeman. (1997).
- Farrell, D. J., et al. Intrahepatic mast-cells in chronic liver-diseases. Hepatology. 22, 1175-1181 (1995).
- Cookson, W. The alliance of genes and environment in asthma and allergy. Nature. 402, 5-11 (1999).
- Ferris, C. D., Huganir, R. L., Supattapone, S., Snyder, S. H. Purified inositol 1,4,5-triphosphate receptor mediates calcium flux in reconstituted lipid vesicles. Nature. 342, 87-89 (1989).
- Foreman, J. C., Mongar, J. L., Gomperts, B. D. Calcium ionospheres and movement of calcium ions following physiological stimulus to a secretory process. Nature. 245, 249-251 (1973).
- Siraganian, R. P., Kulczycki, A., Mendoza, G., Metzger, H. Ionophore A-23187 induced histamine-release from mast-cells and rat basiphil leukemia (RBL-1) cells. J. Immunol. 115, 1599-1602 (1975).
- Demo, S. D., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry. 36, 340-348 (1999).
- Hutchinson, L. M., et al. Inorganic arsenite inhibits IgE receptor-mediated degranulation of mast cells. J. Appl. Toxicol. 31, 231-241 (2011).
- Dann, A. B., Hontela, A. Triclosan: environmental exposure, toxicity and mechanisms of action. J. Appl. Toxicol. 31, 285-311 (2011).
- Jones, R. D., Jampani, H. B., Newman, J. L., Lee, A. S. Triclosan: A review of effectiveness and safety in health care settings. Am. J. Infect. Control. 28, 184-196 (2000).
- Levy, C. W., et al. Molecular basis of triclosan activity. Nature. 398, 383-384 (1999).
- McMurry, L. M., Oethinger, M., Levy, S. B. Triclosan targets lipid synthesis. Nature. 394, 531-532 (1998).
- Allmyr, M., Adolfsson-Erici, M., McLachlan, M. S., Sandborgh-Englund, G. Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products. Sci. Total Environ. 372, 87-93 (2006).
- Allmyr, M., et al. The influence of age and gender on triclosan concentrations in Australian human blood serum. Sci. Total Environ. 393, 162-167 (2008).
- Geens, T., Neels, H., Covaci, A. Distribution of bisphenol-A, triclosan and n-nonylphenol in human adipose tissue, liver and brain. Chemosphere. 87, 796-802 (2012).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: A national reconnaissance. Environ. Sci. Technol. 36, 1202-1211 (2002).
- Black, J. G., Howes, D. Percutaneous absorption of triclosan from toilet preparations. J. Soc. Cosmet. Chem. 26, 205-215 (1975).
- Black, J. G., Howes, D., Rutherford, T. Percutaneous absorption and metabolism of Irgasan DP300. Toxicology. 3, 33-47 (1975).
- Kanetoshi, A., et al. Acute toxicity, percutaneous-absorption and effects on hepatic mixed-function oxidase activities of 2,4,4'-trichloro-2'-hydroxydiphenyl ether (Irgasan(R) DP300) and its chlorinated derivatives. Arch. Environ. Contam. Toxicol. 23, 91-98 (1992).
- Sandborgh-Englund, G., Adolfsson-Eric, M., Odham, G., Ekstrand, J. Pharmacokinetics of Triclosan in man. J. Dental Res. 81, 0937(2002).
- Sandborgh-Englund, G., Adolfsson-Erici, M., Odham, G., Ekstrand, J. Pharmacokinetics of triclosan following oral ingestion in humans. J. Toxicol. Environ. Health A. 69, 1861-1873 (2006).
- Lin, Y. J. Buccal absorption of triclosan following topical mouthrinse application. Am. J. Dent. 13, 215-217 (2000).
- Queckenberg, C., et al. Safety of Triclosan after Dermal Administration. Antimicrob. Agents Chemother. 54, 570-572 (2010).
- Breneman, D. L., Hanifin, J. M., Berge, C. A., Keswick, B. H., Neumann, P. B. The effect of antibacterial soap with 1.5% triclocarban on Staphylococcus aureus in patients with atopic dermatitis. Cutis. 66, 296-300 (2000).
- Udoji, F., Martin, T., Etherton, R., Whalen, M. M. Immunosuppressive effects of triclosan, nonylphenol, and DDT on human natural killer cells in vitro. J. Immunotoxicol. 7, 205-212 (2010).
- Ahn, K. C., et al. In vitro biologic activities of the antimicrobials triclocarban, its analogs, and triclosan in bioassay screens: Receptor-based bioassay screens. Environ. Health Perspect. 116, 1203-1210 (2008).
- Foran, C. M., Bennett, E. R., Benson, W. H. Developmental evaluation of a potential nonsteroidal estrogen: triclosan. Mar. Environ. Res. 50, 153-156 (2000).
- Gee, R. H., Charles, A., Taylor, N., Darbre, P. D. Oestrogenic and androgenic activity of triclosan in breast cancer cells. J. Appl. Toxicol. 28, 78-91 (2008).
- Helbing, C. C., van Aggelen, G., Veldhoen, N. Triclosan Affects Thyroid Hormone-Dependent Metamorphosis in Anurans. Toxicol. Sci. 119, 417-418 (2011).
- Ishibashi, H., et al. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and induction of hepatic vitellogenin. Aquat. Toxicol. 67, 167-179 (2004).
- Kumar, V., Chakraborty, A., Kural, M. R., Roy, P. Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan. Reprod. Toxicol. 27, 177-185 (2009).
- Matsumura, N., et al. Effects of nonylphenol and triclosan on production of plasma vitellogenin and testosterone in male South African clawed frogs (Xenopus laevis. Biol. Pharm. Bull. 28, 1748-1751 (2005).
- Veldhoen, N., et al. The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development. Aquat. Toxicol. 80, 217-227 (2006).
- Raut, S. A., Angus, R. A. Triclosan has endocrine-disrupting effects in male western mosquitofish, Gamusia affins. Environ. Toxicol. Chem. 29, 1287-1291 (2010).
- Park, H. G., Yeo, M. K. The toxicity of triclosan, bisphenol A, bisphenol A diglycidyl ether to the regeneration of cnidarian, Hydra magnipapillata. Mol. Cell. Toxicol. 8, 209-216 (2012).
- Vandhanaa, S., Deepa, P. R., Aparna, G., Jayanthi, U., Krishnakumar, S. Evaluation of suitable solvents for testing the anti-proliferative activity of triclosan - a hydrophobic drug in cell culture. Indian J. Biochem. Biophys. 47, 166-171 (2010).
- Skaare, A. B., Kjaerheim, V., Barkvoll, P., Rolla, G. Does the nature of the solvent affect the anti-inflammatory capacity of triclosan? An experimental study. J. Clin. Periodontol. 24, 124-128 (1997).
- Rufli, H. Introduction of moribund category to OECD fish acute test and its effect on suffering and LC50 values. Environ. Toxicol. Chem. 31, 1107-1112 (2012).
- Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Aquat. Toxicol. 76, 69-92 (2006).
- Toivari, M., Maki, T., Suutarla, S., Eklund, K. K. Ethanol inhibits IgE-induced degranulation and cytokine production in cultured mouse and human mast cells. Life Sci. 67 (00), 2795-2806 (2000).
- Kennedy, R. H., Pelletier, J. H., Tupper, E. J., Hutchinson, L. M., Gosse, J. A. Estrogen mimetic 4-tert-octylphenol enhances IgE-mediated degranulation of RBL-2H3 mast cells. J. Toxicol. Environ. Health A. 75, 1451-1455 (2012).
- Fort, D. J., et al. Triclosan and Thyroid-Mediated Metamorphosis in Anurans: Differentiating Growth Effects from Thyroid-Driven Metamorphosis in Xenopus laevis. Toxicol. Sci. 121, 292-302 (2011).
- Fiori, J., et al. Macromolecular Symposia. in Brazilian Polymer Congress. Pinto, J. C. 299-300, 26-33 (2011).
- Mezcua, M., et al. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples. Anal. Chim. Acta. 524, 241-247 (2004).
- Soto, E. O., Pecht, I. A monoclonal-antibody that inhibits secretion from rat basophilic leukemia-cells and binds to a novel membrane component. Journal of Immunology. 141, 4324-4332 (1988).
- Pierini, L., Harris, N. T., Holowka, D., Baird, B. Evidence supporting a role for microfilaments in regulating the coupling between poorly dissociable IgE-Fc epsilon RI aggregates and downstream signaling pathways. Biochemistry. 36, 7447-7456 (1997).
- Aketani, S., Teshima, R., Umezawa, Y., Sawada, J. Correlation between cytosolic calcium concentration and degranulation in RBL-2H3 cells in the presence of various concentrations of antigen-specific IgEs. Immunol. Lett. 75, 185-189 (2001).
- Koo, N., Kim, K. M. Distinct effects on M-2-type pyruvate kinase are involved in the dimethylsulfoxide-induced modulation of cellular proliferation and degranulation of mast cells. Arch. Pharmacal Res. 32, 1637-1642 (2009).
- Senyshyn, J., Baumgartner, R. A., Beaven, M. A. Quercetin sensitizes RBL-2H3 cells to polybasic mast cell secretagogues through increased expression of Gi GTP-binding proteins linked to a phospholipase C signaling pathway. J. Immunol. 160, 5136-5144 (1998).
- Yang, C. Z., Yaniger, S. I., Jordan, V. C., Klein, D. J., Bittner, G. D. Most Plastic Products Release Estrogenic Chemicals: A Potential Health Problem that Can Be Solved. Environ. Health Perspect. 119, 989-996 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados