Method Article
Ein Mikroplatten Assay Chemical Auswirkungen auf die RBL-2H3 Mastzelldegranulation bewerten: Effekte von Triclosan ohne Verwendung eines organischen Lösungsmittels
In diesem Artikel
Zusammenfassung
Mastzelldegranulation, die Freisetzung von allergischen Mediatoren ist in Allergie, Asthma und Parasiten Verteidigung wichtig. Hier haben wir Techniken 1 für die Beurteilung Auswirkungen von Drogen und Giften auf Degranulation demonstrieren, Methodik kürzlich genutzt, um die leistungsfähige hemmende Wirkung von antibakteriellen Wirkstoff Triclosan 2 aufweisen.
Zusammenfassung
Mastzellen spielen eine wichtige Rolle bei allergischen Erkrankungen und Immunabwehr gegen Parasiten. Einmal aktiviert (z. B. durch ein Allergen), sie degranulieren, ein Prozess, dass die Ergebnisse in der Exozytose von allergischen Mediatoren. Modulation von Mastzelldegranulation durch Medikamente und Giftstoffe können positive oder negative Auswirkungen auf die menschliche Gesundheit. Mastzellfunktion wurde im Detail unter Verwendung von Ratten-Basophilenleukämie Mastzellen (RBL-2H3), eine allgemein anerkannte Modell der menschlichen Schleimhaut Mastzellen 3-5 seziert. Mastzellen Granulat-Komponente und der allergischen Mediator β-Hexosaminidase, der linear zusammen mit Histamin aus Mastzellen 6 freigegeben, leicht und zuverlässig durch die Reaktion mit einem fluorogenen Substrat gemessen werden, was messbar Fluoreszenzintensität in einem Mikroplatten-Assay, der zugänglich ist, Hochdurchsatz-Studien 1. Zitat von Naal et al. 1 veröffentlicht, haben wir diese Degranulation Assay für das Screening o angepasstf Drogen und Giften und demonstrieren ihren Einsatz hier.
Triclosan ist ein Breitspektrum-Antibiotikum, die in vielen Verbraucherprodukten ist und sich als ein therapeutisches Hilfsmittel in menschlichen allergischen Hauterkrankungen 7-11, obwohl der Mechanismus für diesen Effekt ist nicht bekannt. Hier zeigen wir einen Assay für die Wirkung von Triclosan auf Mastzellen Degranulation. Wir haben kürzlich gezeigt, dass Triclosan wirkt sich stark auf Mastzellfunktion 2. In dem Bemühen, den Einsatz eines organischen Lösungsmittels zu vermeiden, wird Triclosan direkt in wässrigem Puffer mit Wärme und unter Rühren gelöst, und die daraus resultierende Konzentration die Bestätigung mit UV-Vis-Spektroskopie (mit ε 280 = 4,200 L / M / cm) 12. Dieses Protokoll hat das Potential, mit einer Vielzahl von Chemikalien verwendet werden, um ihre Wirkung auf Mastzellen Degranulation bestimmt, und im weiteren Sinne, deren allergenes Potential.
Einleitung
Mastzellen sind sehr Immuneffektorzellen, die als Schlüssel dienen Mediatoren bei Asthma, Allergien, Parasiten Verteidigung und Krebsentstehung 13-16 granuliert. Sie in fast jedem vaskularisierten Gewebe 15 wohnen, wo sie sicher speichern allergischen und entzündlichen Mediatoren in zytoplasmatischen Granula bis aktiviert degranulieren. Degranulation der Exozytose von Membran-gebundenen Granulaten, was zur Freisetzung pharmakologisch aktiver Mediatoren, wie Histamin, Tryptase, Leukotriene und 15 ergibt. Dieses Verfahren führt bei der Initiierung von Typ I Überempfindlichkeitsreaktionen, die entscheidend bei der Montage Verteidigung gegen Parasiten sowie Initiierung Allergiker, Asthmatiker und krebserregend sind 15 Antworten.
Mastzellen und Basophilen auszudrücken Fc &egr; RI-Rezeptoren, die mit hoher Affinität Rezeptoren für Immunglobulin E (IgE) 17. Die Exposition gegenüber einem Allergen oder Antigen verursacht Aggregation mehrerer IgE-Rezeptoren gebundenen Fc &egr; RI 17, und es ist diese so genannte "Vernetzung" von IgE-gebundenen Fc-Rezeptoren, die die Degranulation einleitet: eine Kaskade von Tyrosinphosphorylierung Ereignisse, die Aktivierung von Phospholipase C, Austausch von Calcium aus internen Speichern und Einstrom von Calcium in die Zelle 18. Das Calcium-Einstrom ist für Degranulation, und ferner Signale Granulat Fusion mit der Membran vor verursacht Granulat Exozytose 15. Experimentell kann ein Calcium-Ionophor zur Haltestelle Calcium direkt über die Zellmembran 19, die im wesentlichen umgeht alle Signaltransduktion Schritte vor der Calcium-Einstrom Schritt 20 verwendet werden, die die Identifizierung eines Weges vorbei durch einen Giftstoff als vor oder hinter Calcium-Signalgebung 20.
Degranulation können schnell und effektiv durch die Überwachung der Freisetzung von β-Hexosaminidase in Zellüberstand, die linear aus dem Granulat neben Histamin freigesetzt 6 gemessen werden, aber ichs viel leichter zu detektieren unter Verwendung eines einfachen Enzym-Substrat-Reaktion und eines Mikroplatten-Lesegeräts zum Testen des fluoreszierenden Produkts. Diese Mikroplattenassay, wie im Protokoll Abschnitt beschrieben, ist auf einem robusten Verfahren ursprünglich von Naal et al. 1, die die Spaltung des fluorogenen Substrates 4-Methylumbelliferyl-N-acetyl-β-D-glucosaminid quantifiziert durch β-Basis Hexosaminidase. Wir haben den Test zu Test Wirkungen von Arzneimitteln und Giftstoffen Änderungsdatum, mit Triclosan hier hervorgehoben. Diese Methode zuverlässig quantifiziert Degranulation, ist eine kostengünstige Alternative zu z. B. Durchflusszytometrie basierende Nachweisverfahren 21 und hat das Potenzial, sich gut eignen, um High-Throughput-Screening von einer Vielzahl von Anti-Allergie-Medikamente sowie immunotoxische oder allergene Chemikalien. Dieser letzte Punkt ist besonders wichtig im Hinblick auf die 2007 National Research Council Bericht "Toxicity Testing in das 21. Jahrhundert: Eine Vision und eine Stratgie "( http://www.nap.edu/openbook.php?record_id=11970 ), die für die Entwicklung von High-Throughput-toxikologischen Tests, die Zellkultur zu nutzen, um den kostspieligen Einsatz von traditionellen Labortieren wie Mäusen reduzieren befürwortet. Die Degranulation Protokoll Naal et al. 1 entwickelt und modifiziert von uns 2, nutzt die RBL-2H3-Zelllinie, die ein gut akzeptiertes Modell homolog zu menschlichen Schleimhaut Mastzellen oder Basophilen 3-5 ist. (Methoden zur Kultivierung von RBL-2H3-Zellen werden in Hutchinson et al beschrieben. 22). Dieser Test könnte wahrscheinlich auf einem angeschlossenen Mastzellen Typ angepasst werden.
Triclosan (TCS) ist ein Breitspektrum-Antibiotika, die für mehr als 30 Jahren in Krankenhäusern, Körperpflegeprodukte und Konsumgüter 23,24 verwendet. Die Wirkungsweise für die antimikrobielle Eigenschaft TCS ist die Hemmung der Fettsäure-Biosynthese, wahrscheinlich durch Hemmung der Enoyl-AcylCarrier-Protein-Reduktase 25,26. Es wird weltweit in einer breiten Palette von Konsumgütern wie Duschgel, Handcreme, Zahnpasta, Mundwasser, und in der Hand Seifen in Konzentrationen bis zu 0,3% oder 10 mM 24. Der flächendeckende Einsatz von TCS hat in nachweisbaren Mengen beim Menschen 27-29 und in Flüssen und Bächen 30 geführt. Eine Studie von Allmyr et al. Gezeigt, dass 27 TCS und seinen Metaboliten, die sowohl im Plasma und Milch von stillenden Müttern sind. Wichtig ist, dass TCS leicht in die Haut absorbiert 31-37. Queckenberg et al. Gefunden 37 ~ 10% Absorption eines ~ 70 mM TCS-Creme in die menschliche Haut innerhalb von 12 Stunden, was zu erheblichen Konzentration in der Haut, wo Mastzellen befinden.
TCS wurde klinisch für die menschliche allergische Hautkrankheit 7-11 verwalten gezeigt, aber der Mechanismus, durch den TCS lindert allergische Hauterkrankungen ist unbekannt 38. Mit dem fluoreszierenden Mikroplattenassay detailed in diesem Video haben wir vor kurzem gezeigt, dass TCS in Konzentrationen so niedrig wie 2 um, deutlich dämpft Mastzellfunktion und Degranulation und bietet eine mögliche Erklärung für diesen klinischen Daten 2. Neben der Bereitstellung eine Erklärung für diesen klinischen Daten, unsere Erkenntnisse in Palmer et al. 2 legen nahe, dass TCS Signalmoleküle stromabwärts von Calcium-Einstrom zielt. Aufgrund der Bedeutung von Calcium-Signalisierung in vielen immunologischen und andere biologische Prozesse könnten TCS potentiell nachteilige Auswirkungen auf eine Vielzahl von biologischen Prozessen erforderlich. In der Tat zeigte Udoji et al., Dass 39 TCS menschliche natürliche Killerzellen lytische Aktivität unterdrückt, ein weiterer wichtiger angeborenen Immunfunktion.
Jenseits sein Potenzial als therapeutische Hilfe bei allergischen Hauterkrankungen (oder umgekehrt, als immunotoxicant) kann TCS auch eine endokrine Disruptoren 40-49 sein. So ein klares Verfahren, wie diese Chemikalie in Lösung herzustellen is von Interesse Toxikologen. Da TCS ist ein kleines hydrophobes Molekül werden organische Fahrzeugen häufig verwendet, um es in Wasser löslich. In den meisten Toxizitätsstudien, wo TCS getestet wurde, wurde Herstellung Auflösung in Wasser mit Hilfe eines organischen Lösungsmittels, wie Ethanol, Aceton oder Öl 2,50,51 beteiligt. Doch oftmals diese Lösungsmittel sind biologisch aktiv selbst erschweren dadurch Interpretation des Tests chemische Daten 51. In der Tat, nach Rufli et al. 52 und andere 53, empfiehlt es sich, Testlösungen für aquatische Toxizität Experimente werden unter Verwendung physikalischer Methoden auf chemische Verfahren, durch das Potenzial von chemischen Lösungsmitteln Toxizität Artefakte zu erstellen. Wir haben zuvor gezeigt, dass TCS in 0,24% Ethanol / Wasser (v / v) gelöst und 30 min mit Ultraschall behandelt dämpft RBL Mastzelldegranulation 2. Ethanol bei höheren Konzentrationen als 0,24% wurde gezeigt, dass Mastzellen Degra dämpfennulation 54,55-Beispiele für die möglicherweise verwirren Auswirkungen von organischen Lösungsmitteln auf Toxizität.
Es ist nicht nur wichtig, um die Wirkung von Lösungsmitteln auf den Organismus oder Zellen zur Untersuchung verwendeten betrachten, sondern es ist auch wichtig, um die Wirkung von Lösungsmitteln aus der Prüfsubstanz selbst überwachen. Zum Beispiel Skaare et al. Fanden heraus, dass 51 Auflösen TCS in Polyethylenglykol (häufig in Zahnpasten und Mundwasser gefunden) geschwächt anti-bakterielle und anti-Plaque-Effekte bei gesunden weiblichen Frauen, während in Auflösung Öle verursacht einen vollständigen Verlust der Funktion. Daher ist die Fähigkeit von verschiedenen Lösungsmitteln zu modulieren Giftstoff und Arzneimittel, einschließlich TCS sollte Effekte in Assays berücksichtigt werden. Verwendung von Ölen oder Geschmack Additive können mit den Auswirkungen der TCS in verschiedenen Produkten 50,51 stören.
In dem Bemühen, die Notwendigkeit der Verwendung organischer Lösungsmittel zu beseitigen, verbesserten wir auf unsere Methode zum Lösen TCS 2 durch den Wegfall der Verwendung eines organischen Solentlüften. In der vorliegenden Protokoll, wir lösen TCS Granulat direkt in wässrigem Puffer mit Wärme (≤ 50 ° C), und überprüfen Sie dann die Konzentration dieser TCS Lager durch UV-Vis-Spektroskopie. Diese Verbesserungen sind möglich, weil TCS löslich ist in Wasser bis zu 40 um ( http://www.epa.gov/oppsrrd1/REDs/2340red.pdf ) und es wurde gezeigt, um den Abbau zu widerstehen, wenn auf 50 ° C (erhitzt http:// / oehha.ca.gov/prop65/public_meetings/052909coms/triclosan/ciba3.pdf ) 56,57. Wir haben auch den zusätzlichen Vorteil der UV-Vis-Spektroskopie, wie TCS ist auch bekannt, bei 280 nm stark absorbieren 58 mit einem molaren Extinktionskoeffizienten von 4200 L / mol / cm 12.
Dieses Protokoll bietet eine einfache, aber effektive Möglichkeit, TCS Granulat in einen Puffer zu lösen, ohne die Hilfe eines organischen Lösungsmittels, einschließlich Low-Cost und schnelle ÜberprüfungKonzentration, beschreibt und eine leistungsfähige fluoreszierenden Mikroplattenassay zur Überwachung chemischer Effekte auf Mastzelldegranulation.
Protokoll
Beachten Sie, dass alle Puffer Rezepte in einer Tabelle am Ende des Protokolls Text enthalten.
TAG 1:
1. Vorbereitung der Zellen
- Planen Platte mit 96 Vertiefungen Setupverfahren Zentrierung Testproben auf dem Layout, um Randeffekte zu vermeiden. Ordnen Sie drei Wiederholungen für jede Konzentration TCS getesteten (± Degranulation Stimulans des Antigens oder Ionophor) sowie Triplikate für spontane Freisetzung (kein Degranulation Stimulans), maximale Freisetzung (0,2% Triton X-100 [TX] Detergenslyse) sowie Brunnen für Hintergrund Proben (die keine Zellen enthalten) reserviert. Für jede Wiederholung experimentellen Tag, wählen Sie eine neue randomisierte Layout der TCS Probenkonzentrationen.
- Warm RBL Medien (Rezept in der Tabelle zur Verfügung gestellt) und Trypsin in 37 ° C warmes Wasserbad.
- Prüfen RBL-Zellen in T-25-Kolben (2-4 Tage seit dem letzten Durchgang und weniger als 3-4 Monate, da sie aufgetaut waren) für allgemeine Zeichen der guten health: richtige pH-Wert durch Farbe von Medien angegeben, und das Fehlen der Bewölkung. Der Kolben wird unter einem Lichtmikroskop zu bestätigen, dass der Kolben frei von Verunreinigungen ist, und dass die Zellen gesund erscheinen, richtig konfluent, und meist angebracht. Beachten Sie, dass Zellen für Mykoplasmen-Kontaminationen etwa alle sechs Wochen 22 überprüft werden.
| Behandlung | Triplikate |
| Angeregt, 0 uM TCS | A7, B7, C7, F4, G4, H4 |
| Angeregt, 0,001 uM TCS | F6, G6, H6 |
| Angeregt, 0,1 uM TCS | A4, B4, C4 |
| Angeregt, 1 uM TCS | A6, B6, C6 |
| Angeregt, 5 uM TCS | F5, G5, H5 |
| Angeregt, 10 uM TCS | A3, B3, C3 |
| Angeregt, 15 uM TCS | A5, B5, C5 |
| Angeregt, 20 uM TCS | F7, G7, H7 |
| Angeregt, zzgl. höchsten [TCS] | F3, G3, H3 |
| Spontan, (enthält spottet) No TCS | A10, A11, A12, B10, B11, B12 A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, No TCS | D10, D11, D12, E10, E11, E12 |
| Keine Cells, Hintergrund, zzgl. höchsten [TCS] | G10, G11, G12, H10, H11, H12 |
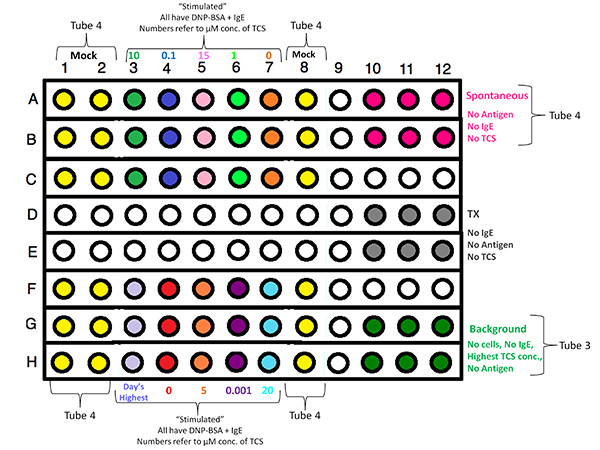
Klicken Sie hier für eine größere Ansicht .
- Nehmen Sie die RBL Zelle Kolben in den sterilen Gewebekultur (TC) Kapuze. Die Zellen werden auf der Unterseite angebracht isttom des Kolbens. Die unter der Haube TC und unter Verwendung von Standard sterilen Technik entfernen alle Medien aus Kolben mit sterilen Pipette, bleiben die Zellen an dem Boden des Kolbens. Weiter spülen Kolben mit 2 ml Trypsin, dann verwerfen diese waschen.
- In genau 2 ml Trypsin Boden des Kolbens zu decken. Setzen in 37 ° C Inkubator für 5 min, um die Zellen vom Boden der Flasche lösen.
- Nach 5 min, schlug die Seite der Kolben mit einem offenen Handfläche, um Zellen zu lösen. Unmittelbar, fügen 18 ml RBL Medien Zellen aus den Kolben waschen und um das Trypsin zu stillen. Sofort nehmen die Zelle-media-Trypsin Mischung aus der Flasche und Transfer zu einem neuen, sterilen 50-ml-Tube (das Gesamtvolumen in diesem Rohr ist nun 20 ml).
- Nach dem Mischen vorsichtig, aber gründlich, entfernen 50 ul Zellsuspension aus diesem Rohr und übertragen in ein 1,5 ml sterile Mikrozentrifugenröhrchens, die eine Probe zu zählen ist. Nehmen Sie dieses Beispiel, wie auch die 50 ml0; Rohr mit dem Handy-media-Trypsin Mischung aus dem TC Haube mit dem Labortisch.
- Drehen Sie das 50-ml-Tube in Zentrifuge (mit entsprechender Balance) für 8 min bei 500 xg; diese Kraft Pellets Zellen effektiv.
- Während der Drehzeit, zählen Sie die Zellen in der Probe, die vor dem Spinnen isoliert wurden. Um dies zu tun, fügen Sie zunächst 50 ul Trypanblaufarbstoff bis 50 ul der Zellen in 1,5 ml-Tube, und sanft, aber gründlich und Abpipettieren 5x zu mischen. Unmittelbar, übertragen 10 ul dieser Mischung auf dem Glas Zählkammer und zählen Zellen im Netzbereich nach Anweisungen des Herstellers. Zählen Sie mindestens 100 Zellen für einen vernünftigen statistischen Ergebnisse.
- Zurück im TC Haube, entfernen Überstand von Zellen, die abzentrifugiert wurden.
- Verschließen Sie die Zelle Rohr, und Flick Pellet am Boden des Röhrchens, um Zellen zu lösen.
- In Medien trypsinierten Zellen, um eine Dichte von 0,5 x 10 6 Zellen / ml, auf die Zellzahl bezogen ergeben.
- Gut mischen aber vorsichtig, um Zellen während der Verfahren der Oberflächenbehandlung suspendiert zu halten. Mit einem Pipetman, legte 100 ul Zellen / Well in einer 96-Well-Platte (flach, schwarz unten), im Anschluss an die Platte Vorlage Blatt. Randomize wie Zellen in die Vertiefungen werden hinzugefügt, um systematische Fehler und mischen nach jedem Satz von drei Brunnen zu vermeiden wird hinzugefügt. Achten Sie darauf, nicht zu den Zellen in die Vertiefungen für die Proben Hintergrund gekennzeichnet und etikettiert sind.
- Sobald alle Zellen übertragen worden sind, wird die Platte Deckel auf die Platte, und übertragen in den Inkubator (37 ° C / 5% CO 2) über Nacht. Aufräumen nach Standard steriler Technik.
TAG 2:
2. Herstellung von Triclosan
- Mit einem Messzylinder, messen 250 ml Tyrodes Buffer (Rezept in der Tabelle zur Verfügung gestellt) in einen 500 ml Erlenmeyerkolben mit der Aufschrift "TCS-Puffer." Add rühren bar. Verwenden Glaswaren, Rührstab, Thermometer für den Einsatz mit nur TCS bezeichnet.
- Ebenfalls zu dieser Zeit, Maß 250ml Tyrodes in einem separaten 500 mL Erlenmeyerkolben, die mit "Steuerung-Puffer." Use Glaswaren, Rührstab, Thermometer, die nicht für TCS bezeichnet werden. In rühren bar.
- Abwiegen 0,0022 g Granulat TCS und Transfer zum "TCS-Puffer" Kolben (enthält 250 ml Tyrodes Buffer). Um effizient zu übertragen Granulat Erlenmeyerkolben, verwenden 10 ml aus den gemessenen 250 ml Tyrodes abzuwaschen wiegen Boot, so dass alle TCS übertragen wurde.
- Place "TCS-Puffer" Kolben auf eine Kombination Kochplatte / Magnetrührplatte, und legen Sie sie an einem überschaubaren hoher Geschwindigkeit rühren. Nachdem gut gemischt, wird TCS stock nominell 30 uM (tatsächliche Konzentration wird nach dem Erhitzen berechnet werden). (Haben alle Mischen in einer chemischen Abzugshaube.)
- Ebenfalls zu dieser Zeit, legen Sie die "control buffer" Kolben (enthält keine TCS) auf eine zweite Kombination Kochplatte / Magnetrührplatte, und setzen Sie ihn auf mit einer ähnlichen Geschwindigkeit rühren.
- Schalten Sie UV / Vis-Lampe zum Aufwärmen der Lampe für eine spätere Verwendung.
- Erhitzen Sie das "TCS-Puffer" Lösung auf 50 ° C unter ständigem Rühren. Einmal auf Temperatur, Zeit für 90 min. Während der 90 Minuten, weiter auf 50 ° C Temperatur und entsprechende Rührgeschwindigkeit häufig überwachen.
- Gleichzeitig heizen die "control buffer" Lösung (das ist nur 250 ml von einfachen Tyrodes Puffer) bis 50 ° C unter ständigem Rühren. Nach Erreichen von 50 ° C, für 90 min, während welcher Zeit Temperatur (Halten bei 50 ° C) und Rühren sowohl überwacht werden.
- Am Ende der 90 Minuten, nehmen beide Erlenmeyerkolben aus den Heizplatten und Transfer zum Labortisch.
- Mit dem Wellenlängen-Scan-Funktion auf einem UV / Vis-Spektrophotometer, leer die Maschine auf 1 ml des erwärmten "control Puffer"-Lösung vor dem Scannen 1 ml erwärmter "TCS-Puffer"-Lösung. Überprüfen Sie die Form des Spektrums eind Rekord Absorption bei 280 nm auf. Um die Konzentration zu bestimmen, verwenden Sie die Beer-Lambert Gleichung (A 280 = 280 ℓ ε c) unter Verwendung eines ε 280 von 4200 L / mol / cm 12 und ℓ von 1 cm.
- Nach der Bestimmung der Konzentration TCS, fügen Sie 0,249 g Rinderserumalbumin (BSA), um die restlichen 249 ml des "TCS-Puffer"-Lösung, und gut mischen.
- Gleichzeitig fügen 0,249 g BSA auf den verbleibenden 249 ml "control buffer" Lösung, und gut mischen.
TAG 2:
3. Antigen-stimulierte Degranulation Assay mit RBL-2H3 Zellen
- Bevor Sie beginnen, den pH-Wert aller Puffer verwendet wird, und sicherzustellen, dass sie klar und nicht trüb sind: Dazu gehören Tyrodes Puffer-, Natrium-Acetat-Puffer und Glycin-Puffer (Rezepte in der Tabelle zur Verfügung gestellt).
- Warm RBL Medien und Trypsin in 37 ° C warmes Wasserbad.
- Als BT (1 mg / ml0; BSA in Tyrodes Puffer): 0,05 g BSA + 50 ml Tyrodes Buffer (X2). Setzen Sie in 37 ° C warmes Wasserbad.
- Als 0,2% Triton X-100: 3.136 ml BT + 64 ul 10% Triton X-100 (Endkonzentration von Triton X-100 ist 0,2%). Gut mischen durch Umdrehen, aber nicht vortexen. Setzen Sie in 37 ° C warmes Wasserbad.
- Startvorbereitung des TCS und beheiztem Tyrodes Puffer (Schritte "2", oben). Hinweis: Starten Sie nicht den nächsten Schritt (IgE Exposition) bis zum "TCS-Puffer" und "Kontrolle Puffer"-Lösungen bis zu 50 ° C und rühren die ersten 70 min des 90 min Hitze / Rühren Zeit.
- Sobald beide Lösungen bei 50 ° C wurden für 70 min gerührt wurde, Make-up 0,1 ug / ml anti-DNP IgE Maus (Sigma) in RBL Medien für Probenvertiefungen sensibilisiert werden (100 ul / well). IgE Lager sollten nicht älter als 30 Tage bei Lagerung bei 4 ° C; aufzeichnen, wie alt ist die Aktie. Flick zu mischen, aber nicht vortexen IgE.
- Unter einem TC Kapuze,hinzuzufügen 0,6 ul IgE Lager (Aktie ist 1 mg / ml) bis 6 ml RBL Medien in einer 50 ml Tube. In einem zweiten 50-ml-Tube, 6 ml Ebene RBL Medien nur (das ist für nichtsensibilisiertes Proben bestimmt).
- Sichern Sie alle Medien aus 96-Well-Platte (das wurde am Tag 1 hergestellt) in Waschbecken, und bringen die Platte unter dem TC Kapuze.
- Zufällig 100 l media / IgE Mischung Brunnen, stimuliert (48 Brunnen insgesamt) werden sollte. Das Gemisch ist nicht für "spontane" gedacht, "TX" und "Hintergrund" Proben.
- Zufällig werden 100 ul Ebene RBL Medien nur auf "TX", "spontan" und "Hintergrund" Brunnen.
- Legen Platte Deckel auf dem Teller, und verschieben Sie dann Platte in 5% CO 2/37 ° C Inkubator für 1 Stunde.
- Während 1 h Inkubation, folgen Sie den Schritten von 3,13 bis 3,24.
- Auf dem Labortisch, bereiten die Antigenverdünnungen. In 0,53 ul von 1,6 mg / ml stock DNP-BSA + 850 ul & #160; BT, um eine Antigen-Konzentration von 1 ug / ml. Vortex und schwenken diese Aktie zu mischen.
- Once "TCS-Puffer" und "Kontrolle Puffer" wurden erhitzt und dann gerührt für 90 min bei 50 ° C, weiter mit dem Rest der Vorbereitung für die TCS-Protokoll (gehen Sie zu Schritt 2.6 - 2.8.1). Nachdem das BSA in beide Lösungen gelöst, unter fortzusetzen.
- Start der Vorbereitung der Exposition Puffer, mit ± Ag, ± TCS. Erstens geht aus der 249 ml-Probe des "TCS-Puffer"-Lösung (die bereits erhitzt und für 90 min gerührt), Transfer 50 ml zu einem neuen 50 ml konischen Röhrchen. Entfernen 20 ul dieser 50 ml Aliquot und ersetzen Sie es mit 20 ul der 1 ug / ml Antigen früher für eine endgültige Antigen-Konzentration von 0,0004 g / ml DNP-BSA vorbereitet. Vortex und umzukehren.
- Etikett diese "Tube 1, hohe TCS / + Ag / + BT." Es ist für Verdünnungen und höchste Konzentration TCS Belichtung verwendet.
- Von der 249-ml-Probe der "Kontrolle Puffer"-Lösung, 50 ml zu übertragen, um ein neues 50-ml-Tube. Entfernen 20 ul dieser neuen 50-ml-Aliquot und ersetzen mit 20 ul der 1 ug / ml Antigen früher für eine endgültige Antigen-Konzentration von 0,0004 g / ml DNP-BSA vorbereitet. Vortex und umzukehren.
- Etikett dieses "Tube 2, No TCS / + Ag / + BT". Verwendet für TCS Verdünnungen und 0 uM TCS Konzentration Exposition.
- Jetzt nehmen Sie 50 ml "TCS-Puffer"-Lösung und in einem anderen 50-ml-Tube. Entfernen 20 ul von dieser neuen 50-ml-Aliquot und ersetzen Sie es mit 20 ul Ebene BT. Vortex und umzukehren. Kein Antigen hinzugefügt wird.
- Beschriften Sie diese "Tube 3, hohe TCS / Nein Ag / + BT." Dies wird für den Hintergrund verwendet.
- Übertragen Sie 50 ml der "Kontrolle Puffer"-Lösung zu einer anderen 50-ml-Tube. Nehmen Sie 20 ul von diesem ne w 50-ml-Aliquot und ersetzen Sie es mit 20 ul Ebene BT. Vortex und umzukehren. (Nr. Ag zugegeben wird.)
- Beschriften Sie diese "Tube 4, No TCS / Nein Ag / + BT." Dies wird für Hintergrund und spontanen Proben verwendet.
| BSA | TCS | Antigen | |
| Rohr 1 |  | Hoch [] |  |
| Tube 2 |  | NO |  |
| Rohr 3 | / Files/ftp_upload/50671/check.jpg "width =" 15px "/> | Hoch [] | NO |
| Rohr 4 |  | NO | NO |
- Berechnen und notieren Bände für Verdünnungen nach der Bestimmung der Konzentration des "TCS-Puffer" auf Lager. Gesamtvolumen für jede Verdünnung Konzentration sollte 1 ml und sollte in einem sterilen Mikrozentrifugenröhrchens hergestellt werden. Nur kalibrierte P2 und P1000 Pipetman.
| Konzentration | Hohe Triclosan + + Tyrodes BSA 0,0004 g / ml Ag (Tube 1 von oben) | Beheizt BT 0,0004 g / ml Ag (Tube 2 von oben) |
| 20 pM | ||
| 15 pM | ||
| 10 uM | ||
| 5 uM | ||
| 1 uM | ||
| 0,1 uM | ||
| 0.001 pM | ||
| 0 uM (Oberseite der Platte) | ----------------------- | 500 ul plus weitere 500 ul |
| 0 uM (Unterseite der Platte) | ----------------------- | 500 ul plus weitere 500 ul |
- Nach 1-stündigen Inkubation IgE nehmen Platte von Inkubator und werfen alle Medien in den Ausguss. (Hinweis: Wenn Testchemikalien bekannt sind, werden toxischer als die Consumer-Produkt TCS, Entsorgung gefährlicher Abfälle erforderlich sein.)
- Mit einem Combitip zufällig waschen Zellen in 96-Well-Platte mit BSA-Tyrodes Puffer (200ul / well). Lassen Sie den Waschpuffer auf den Seiten der Brunnen, anstatt direkt auf die anhaftenden Zellen, um zu verhindern, daß die anhaftenden Zellen. Wiederholen Sie den Vorgang ein zweites Mal.
- Behandlungen für die Anwendung, Wirbel vorzubereiten und zu invertieren Verdünnungen rechts vor der Zugabe zu der Platte.
- Beginnend mit dem oberen Abschnitt der Platte: Zufällig hinzufügen dreifach von 200 ul jeder der Antigen-Lösungen (mit der richtigen Konzentrationen von TCS) in die entsprechenden Wells. Weiter zur Unterseite der Platte. In "control buffer" Lösung Plus AG (von "Tube 2" oben), um alle "spottet" auf der Platte.
- In 200 ul geeignete Lösungen zu entsprechenden Vertiefungen:
- In 200 ul 0,2% Triton X-100 zu "TX"-Kavitäten.
- Als Nächstes fügen Sie 200 ul Rohr 3 zu den 3 Brunnen mit der Aufschrift "Background (Bkgd)-Höchster TCS" auf der Platte.
- Schließlich, fügen Sie 200 ulvon Rohr 4 bis 6 Brunnen mit der Aufschrift "Spontan".
- Inkubieren Sie die Platte für 1 Stunde in 37 ° C / 5% CO 2.
- Während 1 h Inkubation: Holen Sie zwei Eimer Eis (eine für "alte" Platte im Inkubator und eine für neue Platte). Thaw 4-methylumbelliferyl-N-Acetyl-beta-D-glucosaminid (4-MU) bei Raumtemperatur bis zu 40 min, halten in der Folie, weil es lichtempfindliche ist.
- Nach 4-MU Lager wird aufgetaut, Make-up 4-MU funktionierende Lösung: 150 ul stock + 14.85 ml kaltem Acetatpuffer (Rezept in der Tabelle angegeben); Wirbel und umzukehren. Halten Sie in 50 ml Zentrifugenröhrchen, in Folie verpackt, und auf Eis bis zum Gebrauch.
- Mit Combitip, nach dem Zufallsprinzip 100 l kaltes 4-MU funktionierende Lösung in die ganz unten auf jeder Vertiefung einer NEW Grenier schwarzen 96-Well-Platte (auf Eis Eimer # 2). Starten Sie, indem Sie die erste funktionierende Lösung zufällig innerhalb der Oberseite der Platte, die zufällig in der Unterseite der Platte, die zufällig in Triton X-100 Brunnen,und schließlich zufällig innerhalb Hintergrund Brunnen.
- Holen Sie sich neue Schachtel P200 Tipps für den nächsten Schritt.
- Am Ende der 1-stündigen Inkubation gebracht Zellplatte von Inkubator auf Eisbehälter # 1, Pipette Überstand oben und unten 4-5x (schonendes Einführen von Bläschen nicht), geht um die auch für eine gute Durchmischung, aber weder Kontakt mit den Zellen unter Mischen . Systematisch, nehmen Sie 25 ul Probe von jedem Ort und auch in die neue Platte mit dem Substrat (gleiche Reihenfolge der Proben, wie ursprünglich geplant out). Pipette nach oben und unten zu Probe gründlich zu mischen, wenn sie in neue, gut, ohne dabei Blasen.
- Inkubieren für 30 min bei 37 ° C / 5% CO 2.
- Nach 30 min Inkubation zufällig mit 200 ul kaltem Glycin-Carbonat-Puffer pro Well (mit Combitip) in die Vertiefungen füllen bis zu 325 ul insgesamt. (Machen Sie diese zusätzlich zu den Triton X-100 Proben letzten, um Triton X-100 Übergreifen zu vermeiden). Überprüfen Sie vor dem Lesen Blasen Platte (Sack mit sauberem P10 Pipettete Spitze bis Pop alle Blasen).
- Führen Sie die Platte in der Fluoreszenz-Reader (gehen Sie zu Abschnitt 4).
TAG 2:
4. Fluorescent Plate Reader Anleitung und Datenanalyse
- Öffnen Gen5 Programm, und öffnen Sie Versuchsteil.
- Drehen auf dem Teller Leser und Einlegeplatte (linke obere Ecke ist A1).
- Protokoll
 Vorgehensweise
Vorgehensweise  Lesen Sie, um benutzerdefinierte Werte gesetzt. Fügen Sie nicht alles über Proben, repliziert, etc., um den rohen Fluoreszenz Daten von jedem gut zu sammeln.
Lesen Sie, um benutzerdefinierte Werte gesetzt. Fügen Sie nicht alles über Proben, repliziert, etc., um den rohen Fluoreszenz Daten von jedem gut zu sammeln. - Unter "Lesen" wählen Sie "Fluoreszenz", "Endpoint", "Normale", "Gain 40", "Anregung 360/40", "Emission 460/40," Optics Position: Top 50%. Top optischen Versatz: 7mm. Kein Schütteln, keine Verzögerung, keine Kinetik, kein Monitor gut, Temperatur: Inkubator aus.
- Wählen flachen schwarzen Boden, 96-Well-Platte (Grenier 96-well, flacher Boden).
- Deal mit der Platte Layout: Protokoll
 Platte Layout. Einrichten Proben ohne Angabe wiederholt, Verdünnungen usw.
Platte Layout. Einrichten Proben ohne Angabe wiederholt, Verdünnungen usw. - Teller
 lesen.
lesen. - Datei speichern: Klicken Sie auf "Excel"-Taste, die Datendatei in Excel exportieren. Tun Sie dies für Platte und Layout für Matrix. Speichern Sie die Datei auf dem Computer und auf einem USB-Laufwerk.
- In Excel, subtrahieren die durchschnittliche Hintergrund Lesung aus jeder Probe, einschließlich Triton X-100 Brunnen.
- Berechnen relativen% Degranulation indem jeder Wert (bereits gehabt Hintergrund subtrahiert) durch die durchschnittliche Triton X-100-Wert, und dann mit 100 multiplizieren, um es ein Prozentsatz.
- Durchschnittlich alle Triplikate und berechnen Standardabweichung. Graph Daten in Excel als Mittelwerte ± Standardabweichung. Für statistische Tests, jetzt bewegen, um Prism Software GraphPad.
TAG 2:
5. Ionophor stimulierte Degranulation Assay mit RBL-2H3 Zellen
- Folgen Protokoll für "Herstellung von Zellen" (§ 1, Tag 1) und "Herstellung von Triclosan" (§ 2, Tag 2), wie oben angewiesen. Die Platte Layout Beispiel für Ionophor Stimulation ist unten dargestellt.
| Behandlung | Triplikate |
| Angeregt, 0 uM TCS | A7, B7, C7, F4, G4, H4 |
| Angeregt, 0,001 uM TCS | F6, G6, H6 |
| Angeregt, 0,01 pM TCS | F3, G3, H3 |
| Angeregt, 0,1 uM TCS | A4, B4, C4 |
| Angeregt, 1 uM TCS | A6, B6, C6 |
| Angeregt, 5 uM [TCS | F5, G5, H5 |
| Angeregt, 10 uM TCS | A3, B3, C3 |
| Angeregt, 15 uM TCS | A5, B5, C5 |
| Angeregt, 20 uM TCS | F7, G7, H7 |
| Spontan, mit DMSO, kein TCS (beinhaltet spottet) | A10, A11, A12, B10, B11, B12 A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, mit DMSO, kein TCS | D10, D11, D12, E10, E11, E12 |
| Keine Zellen Hintergrund, mit DMSO, zzgl. höchsten [TCS] | G10, G11, G12, H10, H11, H12 |

Klicken Sie hier für eine größere Ansicht .
- Bevor Sie beginnen, den pH-Wert aller Puffer verwendet wird, und sicherzustellen, dass sie klar und nicht trüb sind. Tyrodes, Natriumacetatpuffer und Glycin-Puffer (Rezepturen in Tabelle vorgesehen).
- Bereiten Sie eine 50 ml konischen Röhrchen von BT durch Zugabe von 0,05 g BSA auf 50 ml Tyrodes Puffer und durch Vortexen gut mischen. Inkubation in 37 ° C warmes Wasserbad.
- Als 0,2% Triton X-100 mit 0,0032% DMSO (die endgültige Calciumionophor Fahrzeug Konzentration) durch Zugabe von 96 ul 10% Triton X-100 bis 4,704 ml BT. Gut mischen. Als nächstes nehmen 0.155 ul dieser Lösung und entsorgen. Fügen Sie nun zurück in 0.155 ul 100% DMSO.
- Bereiten Sie eine 5 mM Lager (2,5 mg / ml) von A23187 Ionophor aus Pulver durch Zugabe von 400 ul frisch 100% DMSO in das Fläschchen und Ionophor Vortexen mischen. Sobald in Lösung,Transfer in ein 1,5-ml konischen Röhrchen, Rekord Inhalt und das heutige Datum und Ablauf (3 Monate von der Vorbereitung, wenn sie richtig bei -20 ° C gelagert).
- Alternativ, wenn mit einem gefrorenen heute Tauwetter auf Eis, und überprüfen, ob die 5 mM A23187 Ionophor gut gemischt und klar ist. Vortex, Flick, und schwenken diese Aktie vor dem Gebrauch. Stichtag der Vorbereitung und Lot # dieser A23187.
- Once "TCS-Puffer" und "Kontrolle Puffer" wurden erwärmt und gerührt für 90 min, weiterhin den Rest der Vorbereitung für TCS-Protokoll (gehen Sie zu Schritt 2.6-2.8.1). Nach dem BSA wird gut gemischt in beiden Lösungen mit den restlichen Protokoll Schritten fort.
- Von der 249 ml-Probe des "TCS-Puffer"-Lösung, übertragen 50 ml zu einem neuen 50 ml konischen Röhrchen. Entfernen 1,8 ul der 50 ml Aliquot und fügen 1,8 ul 5 mM Ionophor Lager. Vortex 3x 8 Sek. lang und 3x invertieren. Finale Ionophor Konzentration 180 nM. Beachten Sie, dass diese Konzentration von A23187 wird je nach Papier Potenz, und ein Ionophor A23187 Dosis wird empfohlen, um eine Konzentration von A23187, die eine Degranulation Niveau von rund 20% maximale Freisetzung, die als zytotoxische zu RBL-2H3 identifiziert wurde entlockt identifizieren Zellen durch Zytotoxizitätsassay (siehe 2).
- Etikett diese "Tube 1, hohe TCS / + Ionophor / + BT." Für Verdünnungen und höchste Konzentration TCS Exposition Gebrauchtwagen.
- Von der 249-ml-Probe der "Kontrolle Puffer"-Lösung, übertragen 50 ml zu einem neuen 50 ml konischen Röhrchen. Nehmen Sie 1,8 ul der 50 ml Aliquot und fügen Sie zurück in 1,8 ul 5 mM Ionophor Lager. Vortex 3x 8 Sek. lang und 3x invertieren. Finale Ionophor Konzentration ist 180 Nm.
- Etikett dieses "Tube 2, No TCS / + Ionophor / + BT." Dies ist für Verdünnungen und 0 uM TCS Konzentrationen verwendet.
- Von der 249-ml-Probe von R 20; TCS-Puffer "-Lösung, übertragen 50 ml zu einem neuen 50 ml konischen Röhrchen. Nehmen Sie 1,8 ul der neuen 50 ml Aliquot und fügen 1,8 ul 100% DMSO. Vortex 3x 8 Sek. lang und invertieren 3x; kein Ionophor hinzugefügt wird.
- Etikett diese "Tube 3, hohe TCS / Nein Ionophor / + BT / + DMSO", für Hintergrund verwendet.
- Von der 249-ml-Probe der "Kontrolle Puffer"-Lösung, übertragen 50 ml zu einem neuen 50 ml konischen Röhrchen. Nehmen Sie 1,8 ul von der neuen 50 ml Aliquot und fügen 1,8 ul 100% DMSO. Vortex 3x 8 Sek. lang und 3x invertieren. Kein Ionophor aufgenommen.
- Etikett diese "Tube 4, No TCS / Nein Ionophor / + BT / + DMSO", für spontane Freisetzung Proben verwendet.
| BSA | TCS | Ionophor | Hinzugefügt 100% DMSO | |
| Rohr 1 | "Src =" / files/ftp_upload/50671/check.jpg "width =" 15px "/> | Hoch [] |  | NO |
| Tube 2 |  | NO |  | NO |
| Rohr 3 |  | Hoch [] | NO |  |
| Rohr 4 |  | NO | NO | eck mark "fo: content-width =" .1 "src =" / files/ftp_upload/50671/check.jpg "width =" 15px "/> |
- Berechnen und notieren Bände für Verdünnungen nach der Bestimmung der Konzentration des "TCS-Puffer" auf Lager. Nur kalibrierte P2 und P1000 Pipetman. Gesamtvolumen für jede Verdünnung Konzentration sollte 1 ml, und sollte in einem sterilen Mikrozentrifugenröhrchens hergestellt werden:
| Konzentration | Hohe Triclosan + + Tyrodes BSA +180 nM A23187 (Tube 1 von oben) | Beheizt BT +180 nM A23187 (Tube 2 von oben) |
| 20 pM | ||
| 15 pM | ||
| 10 uM | ||
| 5 uM | ||
| 1 uM | ||
| 0,1 uM | ||
| 0.001 pM | ||
| 0 uM (Oberseite der Platte) | ---------------------------------- | 500 ul plus weitere 500 ul |
| 0 uM (Unterseite der Platte) | ---------------------------------- | 500 ul plus weitere 500 ul |
- Nehmen Sie die Zellen ausplattiert gestern aus dem Inkubator und leere die Medien in die Spüle. Mit einem Combitip, zufällig waschen Zellen im 96-Well-Platte mit BT (200 ul / well). Wiederholen Sie die Wäsche ein zweites Mal.
- Behandlungen für die Anwendung, Wirbel vorzubereiten und zu invertieren Verdünnungen rechts vor der Zugabe zu der Platte. Beginnend mit dem oberen Abschnitt der Platte: Zufällig hinzufügen dreifach von 200 ul jeweils der richtigen Konzentration von TCS zur korrespnden gut. Weiter zur Unterseite der Platte. In "control buffer" Lösung zzgl. A23187 (von "Tube 2" oben), um alle "spottet" auf der Platte.
- In 200 ul geeignete Lösungen zu entsprechenden Vertiefungen:
- In 200 ul 0,2% Triton X-100 zu "TX"-Kavitäten.
- Als Nächstes fügen Sie 200 ul Rohr 3 zu den 3 Brunnen mit der Aufschrift "Background (Bkgd)-Höchster TCS" auf der Platte.
- Schließlich, fügen Sie 200 ul Rohr 4 bis sechs Brunnen mit der Aufschrift "Spontan".
- Inkubieren Sie die Platte für 1 Stunde in 37 ° C / 5% CO 2.
- Während der 1-stündigen Inkubation: Holen Sie zwei Eimer Eis (eine für "alte" Platte im Inkubator und eine für neue Platte). Thaw 4-methylumbelliferyl-N-Acetyl-beta-D-glucosaminid (4-MU) bei Raumtemperatur bis zu 40 min, halten in der Folie, weil es lichtempfindliche ist.
- Nach 4-MU Lager wird aufgetaut, Make-up 4-MU working Löauf: 150 ul stock + 14.85 ml kaltem Acetatpuffer (Rezept in der Tabelle angegeben); Wirbel und umzukehren. Halten Sie in 50 ml Zentrifugenröhrchen, in Folie verpackt, und auf Eis bis zum Gebrauch.
- Mit Combitip, nach dem Zufallsprinzip 100 l kaltes 4-MU funktionierende Lösung in die ganz unten auf jeder Vertiefung einer NEW Grenier schwarzen 96-Well-Platte (auf Eis Eimer # 2): zum ersten Mal starten, indem Sie die funktionierende Lösung zufällig innerhalb der Spitze der Platte, die zufällig innerhalb der unteren Seite der Platte, die zufällig innerhalb von Triton X-100 Vertiefungen und schließlich zufällig innerhalb Hintergrund Vertiefungen.
- Holen Sie sich neue Schachtel P200 Tipps für den nächsten Schritt.
- Am Ende der 1-stündigen Inkubation gebracht Zellplatte von Inkubator auf Eisbehälter # 1, Pipette Überstand oben und unten 4-5x (schonendes Einführen von Bläschen nicht), geht um die auch für eine gute Durchmischung, aber weder Kontakt mit den Zellen unter Mischen . Systematisch, nehmen Sie 25 ul Probe von jedem Ort und auch in die neue Platte mit dem Substrat (gleiche Reihenfolge von samples, als ursprünglich) geplant. Pipette nach oben und unten zu Probe gründlich zu mischen, wenn sie in neue, gut, ohne dabei Blasen.
- Inkubieren für 30 min bei 37 ° C / 5% CO 2.
- Nach 30 min Inkubation zufällig mit 200 ul kaltem Glycin-Carbonat-Puffer pro Well (mit Combitip) in die Vertiefungen füllen bis zu 325 ul total (machen diese zusätzlich zu den Triton X-100 Proben letzten, um Triton X-100 Übergreifen zu vermeiden). Überprüfen Sie vor dem Lesen Blasen Platte (Sack mit sauberem P10 Pipettenspitze keine Blasen Pop).
- Führen Sie die Platte in der Fluoreszenz-Reader (Befolgen Sie alle Schritte in Abschnitt 4).
Ergebnisse
Beim Erwärmen auf 50 ° C für 90 min, erzeugt das UV-Vis-Absorptionsspektrum für TCS eine starke, glatte Kurve zwischen ~ 260 und 300 nm, mit einem Peak bei 280 nm, wie in Abbildung 1 gezeigt. UV-Vis-Spektroskopie ist daher ein wichtiges Instrument, das verwendet wird, um die Konzentration berechnet werden kann, da die veröffentlichte molaren Absorptionskoeffizienten bei 280 nm 4,200 l / mol / cm 12. Wir haben festgestellt, dass TCS nicht aus der Lösung während des Zeitrahmens der gesamten Degranulation Experiment nach der 50 ° C Heizung (Daten nicht gezeigt).
Nach der Anwendung dieser Methode zur Erwärmung TCS direkt lösen sich in wässrigem Puffer, untersuchten wir die Wirkung von TCS auf Mastzelldegranulation Verwendung eines Fluoreszenz-basierten Assays, die aus Naal et al optimiert wurde. 1 Dieser Test zeichnet das Niveau der β-Hexosaminidase aus den Mastzellen freigesetzt Zellen nach einstündiger Inkubation durch Erfassen eines fluorogenen Substrats Produkt. Ob angeregt degranulieren von DNP-BSA-Antigen (Abbildung 2) oder Calcium-Ionophor A23187 (Abbildung 3), kann man deutlich sehen, dass TCS eine signifikante Dosis-responsive Hemmung der Freisetzung von β-Hexosaminidase (dh Degranulation) verursacht.
Fig. 2 ist stellvertretend für IgE-sensibilisierte RBL-Zellen, die für 1 Stunde in "TCS-Puffer" oder "Kontrolle Puffer" inkubiert und belichtet, um ein DNP-BSA-Antigen Dosis von 0,0004 g / ml erhalten. Diese Konzentration der DNP-BSA löste eine durchschnittliche absolute Degranulation Antwort von 22,5% ± 0,1 (Mittelwert ± Standardabweichung) in Abwesenheit des TCS. Statistisch signifikante Hemmung der Degranulation begann um 5 um, wo Degranulation Werte waren 0,79-fach ± 0,05 (Mittelwert ± Standardabweichung) der 0 uM TCS Kontrolle Ebenen. Da die TCS-Konzentration zunimmt, gibt es eine größere Dämpfungswirkung TCS, die eine starke Dosis-Wirkungs-Beziehung. TCS, bei 20 pM, almost vollständig hebt die Degranulation Antwort auf ein Niveau etwa gleich zu spontanen Degranulation (soweit kein Antigen vorhanden ist). Insgesamt zeigt diese Figur eine starke Hemmung des polyvalenten, Antigen-stimulierten Mastzellen Degranulation durch Konzentration bestätigter TCS, ohne die Verwendung von organischen Lösungsmitteln.
In Abbildung 3 wurde Calcium A23187 als einen Weg, um den Mechanismus der TCS-induzierten Dämpfung der Degranulation in RBL Mastzellen untersucht werden. A23187 als Alternative Stimulans verwendet, weil es die Fc &egr; RI Vernetzung und andere Signalwege vor Kalziumeinstrom umgeht, aber immer noch bewirkt Degranulation. RBL Mastzellen wurden 1 Stunde in "TCS-Puffer" oder "Kontrolle Puffer", die eine Calcium-Ionophor Dosis von 180 nM inkubiert. In Abwesenheit von TCS, entlockte diese Konzentration von A23187 eine durchschnittliche absolute Degranulation Antwort von 25,1% ± 4,7 (Mittelwert ± Standardabweichung). Die Hemmung der Degranulation wargefunden mit so wenig wie 1 uM TCS (0,63 ± 0,11 [Mittelwert ± SD]). Als TCS Konzentration zunimmt, nimmt auch die Schwere der Inhibition: bei 5 uM, 0,21-fach ± 0,04 der 0 uM TCS Kontrolle Ebenen; bei 10 uM, 0,09 ± 0,05; bei 15 pM, 0,077 ± 0,006 und bei 20 uM , 0,09 ± 0,02 (Mittelwert ± SD). In der Tat, von 5 um und höhere Konzentrationen von TCS wurden Ebenen der A23187-induzierte Degranulation gefunden in der Nähe der Ebene der spontanen Kontrolle (wo kein A23187 überhaupt vorhanden ist) sein. Insgesamt 3 in Verbindung mit Fig. 2 zeigt, daß die molekularen Ereignisse, die von TCS gezielte wahrscheinlich stromabwärts Kalziumeinstrom sind.

Abbildung 1:. Vertreter TCS UV-Vis Absorptionsspektrum TCS verfügt über eine robuste Erbsek bei 280 nm, was eine einfache Bestimmung eines 280, aber auch wegen der Fähigkeit des molaren Extinktionskoeffizienten von 4200 L / mol / cm 12 verwenden, um die tatsächliche Konzentration in TCS Tyrodes Puffer zu bestimmen. Die gelbe Linie zeigt den Peak bei 280 nm. In diesem Beispiel ist die Absorption bei 280 nm 0,11876, was auf eine Konzentration von TCS 28.28 pM. Klicken Sie hier für eine größere Ansicht .

Abbildung 2:. Ein Vertreter Degranulation Reaktion der IgE-sensibilisierten RBL Mastzellen ausgesetzt 0,0004 g / ml DNP-BSA-Antigen und TCS (0-20 uM) Eine spontane Freisetzung Wert (kein Antigen vorhanden) wird als Referenz dargestellt. Werte stellen Mittelwerte7; Standardabweichung von dreifachen Proben. Wie dargestellt, wurden die Daten, die Kontrolle (0 uM TCS) normalisiert, und signifikante Unterschiede wurden in Prism-Software mit einem one-way ANOVA von einem Tukey post hoc Test (Vergleiche mit 0,001 uM TCS durchschnittliche Antwortzeit gemacht) festgestellt. Bedeutung wird vertreten durch *** p <0,001. Klicken Sie hier für eine größere Ansicht .
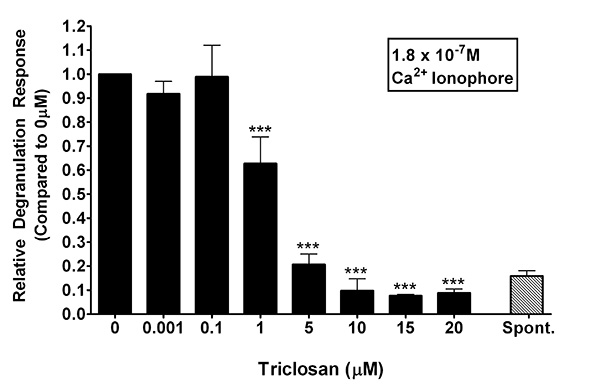
Abbildung 3:. Ein Vertreter Degranulation Antwort von RBL Mastzellen mit 180 nM A23187 Calciumionophor in Anwesenheit von TCS (0-20 uM) stimuliert Eine spontane Freisetzung Probe (kein Ionophor vorhanden) wird als Referenz dargestellt. Die Werte stellen Mittelwerte ± Standardabweichung von dreifachen Proben. Wie presented, werden die Daten, die Kontrolle (0 uM TCS) normalisiert, und signifikante Unterschiede wurden in Prism-Software mit einem one-way ANOVA von einem Tukey post hoc Test (Vergleiche mit 0,001 uM TCS durchschnittliche Antwortzeit gemacht) festgestellt. Bedeutung wird durch *** p <0,001 vertreten; ** p <0,01. Klicken Sie hier für eine größere Ansicht .
Diskussion
Im Jahr 2004 entwickelte Naal et al. 1 ein Mastzellen Biosensor für das Hochdurchsatz-Tests Degranulation. Es ist ein robustes Assay, dass wir für unsere TCS Studien angepasst und detailliert in diesem Video. Vor der Naal et al. 1-Test, hatte Mastzelldegranulation routinemäßig über β-Hexosaminidase 59-61 beurteilen, aber diese frühen Verfahren verwendet Fluorometern in denen eine Probe zu einer Zeit gelesen wurde. Wichtig ist, Naal et al. gegründet direkte Übereinstimmung zwischen ihren mehr High-Throughput-Verfahren unter Verwendung eines Mikroplatten-Reader und dem früheren Verfahren, bei dem Proben ein-at-a-time zu lesen in einem Fluorometer wurden. In Summe, Naal et al. 1 stark die Geschwindigkeit, Leistung, Einfachheit und Zuverlässigkeit des Tests durch die Anpassung an einen High-Throughput-Mikroplatten-Plattform verbessert, sowie durch die Einbeziehung mehrerer Änderungen in den Workflow. Hier haben wir weitere diesen Test für eine Untersuchung der verschiedenen Testchemikalien angepasst, insbesondere hier, Die allgegenwärtige Droge TCS. Das Video beschreibt die Schritte dieser Test sehr nützlich. Darüber hinaus haben wir auch eine organische-Lösungsmittel-freie Verfahren zum Aufbringen von TCS in wässrigem Puffer entwickelt, und wir zeigen, eine einfache und kostengünstige Verfahren zur Ermittlung der Konzentration TCS. Diese Methoden sollten hilfreich sein, um die scheinbar wachsenden Bereich der Toxikologie Triclosan. In dieser Diskussion, detail wir einige Überlegungen für die Verwendung dieses Degranulation Assay auf andere Chemikalien sowie testen.
TCS wurde direkt in wässrige Puffer ohne Hilfe von organischen Lösungsmitteln hergestellt, wurde die Konzentration von UV-Vis-Spektroskopie (Abbildung 1) bestätigt, und dann die Wirkung des TCS (<30 pM) wurde am Mastzelldegranulation untersucht (Abbildungen 2 und 3) unter Verwendung eines Fluoreszenz-Mikroplatten-Assay, um das Vorhandensein von β-Hexosaminidase, einem Surrogat-Marker für Degranulation erkennen. Wir haben festgestellt, dass TCS in der Lage, deutlich dämpfen die Freisetzung von β-hexosa istminidase von RBL Mastzellen, wenn in einer niedrigen Konzentration von Ethanol (0,24% Vol / Vol) 2 oder, wie hier dargestellt, unmittelbar in wässrigen Puffer gelöst. Durch den Verzicht auf organische Lösungsmittel, wir tatsächlich sehen ausgeprägter Dämpfung in Antigen-induzierte Degranulation gegenüber unseren Studien, in denen TCS in 0,24% Ethanol gelöst wurde (vol / vol). Zum Beispiel, hier haben wir eine> 50% ige Reduktion der Antigen-induzierte Degranulation (0,46-fach ± 0,07), die viel größer als die ~ 25% Ermäßigung, die wir für 10 uM TCS in 0,24% Ethanol gelöst berichtet (0,76-fach ist nachgewiesen ± 0,02) 2. In die gleiche Richtung haben wir festgestellt, für A23187-stimulierte Zellen, die durch 5 uM hemmt TCS Degranulation auf spontane Freisetzung Ebenen; dieser Effekt wurde erst 10 uM TCS in unseren früheren, Ethanol-Nutzung, Studie 2 zeigte. Es gibt zwei mögliche Gründe für diese Diskrepanz: entweder eine 0,24% Ethanol Fahrzeug 2 dämpft TCS die Fähigkeit zur aktiven Mast cel hemmenl Degranulation oder der TCS waren wir mit weniger konzentriert war als erwartet (seit Konzentrationen nicht durch UV-Vis-Spektroskopie in der vorherigen Studie 2 bestätigt). In Bezug auf die molekulare Zielstruktur für die Hemmung der TCS Mastzelldegranulation, ist es wahrscheinlich auftretenden irgendwo in den Signaltransduktionskaskade nachgeschaltet Calciumeinstrom 2. Wir verwendeten Calcium A23187 als Degranulation Stimulans frühen Signalwege zu umgehen, und TCS die hemmende Effekt hielt, was darauf hinweist, dass das Ziel für TCS-Hemmung in der Degranulation Weg nicht wahrscheinlich vor Calciumeinstrom entfernt. Wir haben bereits gezeigt, dass die Membran Kräuseln dieser Zellen auch unterdrückt wird aufgrund TCS Behandlung, was auf die Möglichkeit eines gemeinsamen Weges Ziel 2.
Frühere Studien haben das Absorptionsspektrum TCS mit einem maximalen Peak bei 280 nm und einen molaren Absorptionskoeffizienten evaluiert bis 4200 L / mol / cm an diesem wavelen gefundenGTH (bei pH-Werten unterhalb des pK a) 12. Es hat sich gezeigt, dass die Erwärmung der TCS nicht um eine thermische Zersetzung 57 führen, und eine andere Studie Erfolg bei der Auflösung in Wasser TCS angezeigt, während sie auf 50 ° C ohne Zuhilfenahme eines organischen Lösungsmittels 56 erhitzt. Wenn eine neue Prüfsubstanz verwendet wird, dessen Löslichkeit in der wässrigen Puffer, muss natürlich sorgfältig geprüft werden. Wir haben auch gefunden, dass bei Erwärmen der TCS, die Form der spektralen Anzeige unberührt, ob es für 40-90 min (Daten nicht gezeigt) erwärmt wird: dies deutet auf eine mangelnde Abbau der TCS, wenn für einen längeren Zeitraum erwärmt Zeit. Beachten Sie jedoch, dass TCS Auflösung größer bei 90 min über 40 min. Wir haben bestätigt, dass TCS nicht aus der Lösung für die Dauer des Experiments Degranulation (Daten nicht gezeigt).
Die DNP-BSA-Antigen und Calcium-Ionophor Konzentrationen in dieser Studie verwendet wurden auf der Grundlage der Antigen-und Ionophor-Dosis-Wirkungs-Assays ausgewählt, eind wurden ausgewählt, um moderate Degranulation Ebenen für die repräsentativen Figuren 2 und 3 zu entlocken. Ein Beispiel für ein Antigen Dosis-Wirkungs-Test kann in 1A unserer früheren Arbeit 2 ersichtlich. Bei der Bestimmung des Antigens oder Ionophor-Konzentration in Ihrem Experiment verwendet werden, ist es wichtig zu wissen, dass stimulierende Dosis-Wirkungs-Experimente regelmäßig durchgeführt werden, in der Regel mindestens alle zwei Monate brauchen, da RBL-2H3-Zellen manchmal variabel funktionieren. Die Konzentration, die die gewünschte Degranulation prozentualen Ausbeuten in Abhängigkeit vom Alter der Zellen und Antigen / Ionophor Herstellung variieren. Auch, wie wir mit anorganischen arsenite 22 gesehen haben, kann absolute Degranulation Prozentsätze (Level von Antigen verwendet) Ebenen der Giftstoff Auswirkungen auf RBL Degranulation beeinflussen, so Giftstoff Dosis-Reaktionen an verschiedenen Antigen / Ionophor Konzentrationen getan werden sollte. Es ist auch wichtig, um die endgültige conce betrachtenntration DMSO Fahrzeug bei der Stimulation mit Ionophor Degranulation, da Degranulation von DMSO 62 betroffen ist. Wir haben festgestellt, die DMSO-Konzentrationen in diesem Protokoll verwendet haben keinen Einfluss auf Degranulation Hintergrund Lesungen, oder 0,2% Triton X-100-Werte 2.
Neben dem polyvalenten, Antigen DNP-BSA und dem Calcium-Ionophor A23187, gibt es verschiedene andere Methoden RBL-2H3-Stimulation. Eine dieser Methoden ist die Stimulation durch Einwirkung von 48/80 zusammen mit Quercetin 63 verschlimmern. Ein weiteres ist die Vernetzung von IgE-gebundenen Rezeptoren mit einem Anti-IgE-IgG, wie wir vorher zusammen mit TCS Exposition 2 getestet. Viele andere Stimulation Methoden existieren, und jedes dieser Verfahren wird ein anderes mechanistischen Aspekt Mastzelldegranulation. Diese Platte Leser Assay kann zur Verwendung mit vielen dieser alternativen Stimulatoren angepasst werden, den weiteren Ausbau ihrer Nützlichkeit.
Diese Degranulation Protokoll hat das Potential, mit einer Vielzahl von che verwendet werdenmikalien. In einer Studie mit einem Test-Chemikalie in diesem Test müssen die Kontrollen für die folgenden ausgeführt werden: (1) Wirkung der Prüfsubstanz auf den Hintergrund (keine Zellen) Lesungen, (2) Wirkung der Chemikalie auf spontane Degranulation (Zellen ohne IgE , kein Antigen kein Ionophor), (3) Wirkung der Chemikalie auf die Triton-X-100-Werte von lysierten Zellen (kein Antigen kein Ionophor). Diese Tests können leicht in die Platte Layout eingearbeitet werden. Zuvor fanden wir das TCS wirkt keines dieser drei Parameter 2. Darüber hinaus sollten Tests durchgeführt, um zu bestimmen, dass die Prüfsubstanz nicht mit dem β-Hexosaminidase Enzym / Substrat-Reaktion selbst in einem zellfreien Vorbereitung, wie in Abbildung S1 der Anlage A Zusatzdaten Abschnitt Palmer et al stören. 2 Wir fanden, dass TCS nicht mit der Fähigkeit β-Hexosaminidase zur Spaltung des fluorogenen Substrats 4-MU 2 eingreifen. Effekte von Lösungsmitteln verwendet werden, müssen ebenfalls berücksichtigt werdenIn all diesen Kontrollversuchen. Zum Beispiel haben wir bestätigt, dass DMSO, das Lösungsmittel für das Ionophor, keinen Einfluss auf Triton-X-100 Probenfluoreszenz Ebenen (Daten nicht gezeigt) aufweist. Wir stellen ferner fest, dass wir alle Kunststoffe in dieser Studie für nicht mit der Drüseunterbrecherscheibe Bisphenol A verwendet werden, ausgewählt, leider aber alle Kunststoffe derzeit auf dem Markt wahrscheinlich nicht enthalten einige endokrine disruptive Wirkung, die möglicherweise verwirren könnten Daten 64.
In dem Fall, dass Fehlerdiagnose erforderlich ist, sollten mehrere mögliche Aspekte dieses Protokolls überprüft. Zum Beispiel kann es sein, dass (1) die spontane Freisetzung zu hoch (höher als ca. 7% der Lyse Werte), (2) eine Dosis-Wirkungs entweder mit Stimulanzien und / oder Prüfsubstanz wird nicht beobachtet, oder (3) der TCS-Konzentration in der Lösung zu niedrig ist (weniger als 20 uM). Im ersten Fall kann eine hohe spontane Ebene ein Hinweis auf die Zellen in Kultur zu lang oder mit Mycoplasmen kontaminiert sein, deshalb, Versuchen Sie diese Experimente mit RBL-2H3-Zellen, die in Kultur zwischen 2-20 Wochen wurden und regelmäßig auf Mykoplasmen testen. Wenn ein Stimulans Dosis nicht beachtet wird, kann das gelöste Stimulans Konzentration zu niedrig, und die Bestände werden sollte erneuert. Als Beispiel Calcium-Ionophor typischerweise als dünner Film mit DMSO aufgelöst werden, sofern unter sorgfältiger Berücksichtigung und viel Vortexen. Darüber hinaus könnte eine neue Ionophor Lager mit einer anderen Chargennummer haben eine andere Potenz einfach aufgrund viel-zu-viel Variation, daher ein Degranulation Dosis wird mit jedem neu gekauften Ionophor stock empfohlen. Es ist auch erwähnenswert, dass ein offensichtlicher Mangel an Effekt mit einer bestimmten chemischen Test könnte ein Indiz dafür, dass diese Chemikalie kann eine längere Inkubationszeit benötigen, um einen Effekt verursachen. Wenn Sie nicht zu erreichen sind, eine hohe Ausbeute TCS in Lösung, überprüfen Sie, dass die Temperatur konstant geblieben ist (50 ° C ± 5), während die Körner in den Puffer lösen sich auf. Ter Thermometer sollten nie den Boden berühren des Kolbens, eine Position, die in einer Überschätzung der Temperatur der Lösung führen würde. Also, stellen Sie sicher, es ist konstant kräftigem Rühren und dass die 90 min Countdown nicht gestartet, bis die Temperatur 50 ° C zuerst erreicht
Tabelle für die Problembehandlung.
Problem | Mögliche Ursache | Lösung |
TCS Lager ist entschlossen, <20 um | Eine ungleichmäßige Erwärmung der Lösung | Sicherstellen, dass das Thermometer so positioniert ist, dass es in der Lösung suspendiert und berührt nicht den Boden des Kolbens. |
Rühren ist nicht kräftig genug | Steigern Magnetrühren auf Stir-Platte auf ein Niveau von unter Rühren das ist kräftig, ohne die Lösung zu springen aus dem Kolben zu erreichen. Stellen Sie sicher, dass ein geeigneter Größe magnetischen Rührstab verwendet wird. | |
Probleme mit Spektralphotometer | Erlauben Sie für die richtige Aufwärmen der UV-Lampe (typischerweise 10 min), oder Glühlampe ersetzen, wenn nötig. | |
Spontane Degranulation Ebenen sind zu hoch (> ~ 7%) | Cells haben abnorme genetische Mutationen durch zu viel Zeit in Kultur erworben | Führen Sie Experimente mit einer neuen Zelle Tauwetter. |
Die Zellen werden durch mechanische Scherung Sterben | Beim Hinzufügen von Puffer oder Behandlungen anhaftenden Zellen, vorsichtig sein, nicht, um die Zellen zu stören, indem diese Mengen sorgfältig zu den Seiten der Mikrotiterplatten. Üben Sie mit dem Combitip. | |
IgE / DNP-BSA verursacht keine Freisetzung von Beta-Hexosaminidase über spontane Freisetzung Ebenen | IgE ist älter als 30 Tage oder ausgesetzt war Tauwetter einfrieren | Verwenden Sie eine neue, richtig gelagert Aliquot IgE. |
DNP-BSA wurde nicht richtig gemischt | Achten Sie darauf, vorsichtig das kleine Volumen der DNP-BSA mit dem konischen Rohr und to gründlich vortexen. | |
A23187 Ionophor verursacht keine Freisetzung von Beta-Hexosaminidase über spontane Freisetzung Ebenen | A23187 Lager wurde nicht richtig wiederhergestellt | Produkt kommt als "thin film", und müssen mit Sorgfalt und viel Verwirbelung rekonstituiert werden. Übertragen rekonstituiert Lager in ein neues 1,5-ml-Röhrchen für die Lagerung. |
A23187 Lager wurde nicht richtig gespeichert | Die Bestände sind lichtempfindlich. Nach der Rekonstitution Parafilm die Besten, und speichern Sie in Folie bei -20 ° C eingewickelt Wenn es eine Frage nach der Speicherung von einem Lager, verwerfen und beginnen Tests mit einem neuen Lager. | |
180 nM A23187 Ionophor nicht entlockendas gleiche Niveau der relativen Degranulation Antwort, als dass in einem früheren Test gefunden | Lot-zu-Lot Variation A23187 Ionophor | Führen Sie eine Dosis-Wirkungs-Experiment für jede neue Ionophor. Es wird auch empfohlen, dass Aktien aus der gleichen Charge getestet, wegen möglicher Schwankungen in der Rekonstitutionsprozess werden. |
Wie in jedem Toxikologie / Pharmakologie Experiment muss die Prüfsubstanz nicht offen giftig bei den getesteten Konzentrationen. Wir empfehlen, dass Methoden Test sowohl Apoptose und Nekrose, entweder einzeln oder in Kombination (z. B. mit klonogenen Assays) sowie Prüfverfahren von Schäden an der Plasmamembran (wie Lactatdehydrogenase Leckage). TCS, in Konzentrationen in dieser Studie gezeigt, ist nicht zytotoxisch RBL-2H3-Zellen 2. Eine besondere Kenntnis Sorge mit dem Ionophor Studien ist, dass Ionophor zzgl. Ionophor Fahrzeug(Wahrscheinlich DMSO), plus Prüfsubstanz, sowie alle organische Lösungsmittel verwendet, könnte eine potenziell zytotoxischen brauen, die sorgfältig kontrolliert werden muss, wie in Palmer et al durchgeführt werden. 2
Unsere Vorschrift zur Herstellung von TCS Lösungen ohne Verwendung eines organischen Lösungsmittels werden die für die weitere toxikologische Prüfung des ubiquitären chemischen, ohne störende Artefakte Lösungsmittel eine besonders wichtige Überlegung in aquatischen Toxizität. Diese Verfahren ermöglichen auch die Überprüfung der Konzentration von TCS in Lösung und Quantifizierung der Effekte, die Chemikalien wie TCS, haben auf Mastzelldegranulation. Dieses Protokoll kann verwendet werden, um die Auswirkungen einer Vielzahl von Chemikalien auf Mastzellen Degranulation wie Verdacht endokrin wirksamen Substanzen 55 herangezogen werden, und können möglicherweise für Hochdurchsatz-Screening skaliert werden. Zusätzlich können andere Arten von Mastzellen in diesem Assay in künftigen Arbeiten verwendet werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
LMW und RHK werden von der Graduate School of Biomedical UMaine Science and Engineering (GSBSE) unterstützt; RHK wurde auch von der Maine Agricultural Experiment Station & Wälder unterstützt. Zusätzliche Mittel wurde von der National Institute of General Medical Sciences (NIH P20-GM103423), die Maine Agricultural Experiment Station & Wald (Grant Number ME08004-10, JAG), der University of Maine ADVANCE Rising Tide-Center (NSF Grant # 1008498) zur Verfügung gestellt und ein Forschungs-Starter Grant Pharmakologie / Toxikologie vom PhRMA Stiftung (JAG). Wir danken Drs.. David Holowka und Barbara Baird für das Antigen und Zellen. Wir sind dankbar, dass Hina Hashmi, Alejandro Velez und Andrew Abovian für die Hilfe bei Ausrüstung und Aufträge. Dies ist Maine Agricultural Experiment Station & Wälder Veröffentlichung Nummer 3311.
Materialien
| Name | Company | Catalog Number | Comments |
| RBL-2H3 Cells | ATCC | CRL-2256 | The cells we used were a gift, but they are also available from ATCC |
| Triclosan/Irgasan | Sigma | 72779 CAS# 3380-34-5 | Should be stored in a low humidity environment |
| Trypsin | Gibco | 25300-054 CAS# 3380-34-5 | |
| EMEM | Lonza | 12-611F | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Gentamycin Sulfate | Lonza Biological Sciences | 17-518 | |
| Albumin, Bovine Serum | Calbiochem | 12659 CAS# 9048-46-8 | |
| Surfact-Amps X-100 (Triton X-100; 10% solution) | Pierce | 28314 CAS# 9002-93-1 | |
| HEPES | J.T Baker | 4153-01 CAS# 75277-39-3 | |
| Magnesium Chloride | VWR | BDH0244-500G CAS# 7791-18-6 | |
| D-(+)-Glucose | Biomedicals | 152527 CAS# 50-99-7 | |
| Potassium Chloride Crystal | J.T Baker | 3046-01 CAS# 7447-40-7 | |
| Calcium chloride dihyrdate | Acros Organics | 207780010 CAS# 10035-04-8 | |
| Glycine | Sigma | G8898 CAS# 56-40-6 | |
| 4-Methylumbelliferyl-N-acetyl-β-D-glucosaminide (4-MU) | EMD Biosciences | 474502-250MG CAS # 37067-30-4 | Wrap in foil – is light-sensitive |
| Anti-DNP Mouse IgE | Sigma | D8406 | Reagent has concentration of 1 mg/ml. Aliquot 25 µl of reagent into separate microcentrifuge tubes and Parafilm. Store aliquots at -20 °C that are not being used and store aliquot that is being used at 2-8 °C for no longer than 1 month. |
| DNP-BSA | Gift from Dr. David Holowka and Dr. Barbara Baird, Cornell University | Suggest: life technologies DNP-BSA catalog# A23018 | |
| Calcium Ionophore A23187 | Sigma | C75-22-1mg | Ionophore was made from a powder by adding 400 µl of fresh 100% DMSO into the ionophore vial and is kept at -20 °C Note: we have used the ionophore past its 3 month expiration date successfully |
| DMSO | Sigma | D2650 CAS# 67-68-5 | |
| Acetic Acid | VWR | BDH3094-2 CAS# 64-19-7 | |
| Anhydrous Sodium Carbonate | Sigma | 222321 CAS# 497-19-8 | |
| Sodium Chloride | Sigma | 71376 CAS# 7647-14-5 | |
| Hydrochloric Acid | VWR | BDH3026 CAS# 7647-01-0 | |
| Reference Buffer, pH 7 | VWR | BDH5046 | |
| Reference Buffer, pH 10 | VWR | BDH5072 | |
| Reference Buffer, pH 4 | VWR | BDH5018 | |
| pH electrode storage solution | VWR | 14002-828 | |
| Equipment: | |||
| DU 7500 Spectrophotometer | Beckmann | No longer sold | |
| Synergy 2 plate reader Uses Gen5 Microplate Data Collection and Analysis Software | BioTek | Module S | |
| Hematocytometer | Hausser Scientific | 3110 | |
| 7 x 7 CER HOT/STIR 120 V Combination hot plate/magnetic stir plate | VWR | 97042-634 | |
| Centrifuge | Eppendorf | 5430 | |
| Tissue culture water bath | VWR | Model# 89032-206 | |
| Tissue Culture biological safety cabinet SafeGARD (TC hood) | The Baker Company | Model# SG403A-HE | |
| Tissue culture incubator | ThermoScientific | Model# 3598 | |
| Pipetman | VWR | Range: P2-P1000 | |
| Balance | Mettler Toledo | Model# AG204 | |
| pH meter | Symphony/VWR | Model# SB70P | |
| Pipet-Aid | Drummond Scientific | 4-000-100 | |
| Combitip dispenser | Eppendorf | 4981 000.019 | |
| Recipes: | |||
| Acetate Buffer, pH 4.4 | Make 0.12 M acetic acid and titrate to pH 4.4 with 10 N NaOH. This is 5.3 ml glacial acetic acid into 1 L of MilliQ water: (1 L)*(0.12 mol/L)*(60 g/mol)*(ml/1.37 g) = 5.3 ml because density of glacial is 1.37 g/ml | Sterile Filter into autoclaved glass bottle | |
| Substrate (4-MU) | Sigma M-2133, 250 mg, C18H21NO8, FW 379.4 CAS (37067-30-4) Store in -20°C Stock: 0.12 M in DMSO (46 mg in 1 ml DMSO), warm to 37 °C, vortex, sonicate 10 min. in water-bath sonicator with warm water, vortex again | For each experiment, make fresh solution of substrate in acetate buffer (100x dilution), for final concentration of 1.2 mM in acetate buffer | |
| Glycine Carbonate Buffer, pH 10 | 26.7 g glycine 47.1 g anhydrous sodium carbonate Add deionized water for 1 L, and adjust pH to 10 | Sterile filter into autoclaved glass bottle | |
| Tyrodes (2 L), pH 7.4 | 135 mM NaCl: 15.78 g (or 270 ml of 1 M) 5 mM KCl: 10 ml of 1 M stock 1.8 mM CaCl2: 7.20 ml of 0.5 M stock 1 mM MgCl2: 4.00 ml of 0.5 M stock 5.6 mM glucose: 2.02 g (11.2 ml of 1 M) 20 mM HEPES: 40 ml of 1 M stock Using concentrated HCl pH from ~9.7-7.4 | Sterile filter into autoclaved glass bottle | |
| RBL Cell Media | Thaw fetal bovine serum (FBS, stored at -20 °C) for about 4 hours in 37 °C water bath Follow standard sterile technique Get out 1 L minimum essential medium (MEM) with L-glutamine (with Earle’s salts) Pour off some MEM to have 800 ml MEM, add 200 mL warm FBS Add 1 ml gentamicin sulfate antibiotic to 1 L of media with sterile pipette Only use media bottles that have been autoclaved and marked for cell culture use only. | Sterile filter (0.2 mm) into autoclaved glass bottle | |
| Plastic material used: | |||
| 200 µl Disposable sterile pipet tips with graduations in 96 rack | VWR | 53509-009 | polypropylene |
| 1,000 µl Sterile aerosol pipet tips with HighRecovery | VWR | 89003-420 | polyethylene |
| 10 µl micro tip low binding sterile | VWR | 14217-704 | polypropylene |
| Disposable/conical Microcentrifuge tubes for high G-force | VWR | 20170-038 | polypropylene |
| Disposable/graduated/conical/sterile 50 ml centrifuge tubes with screw caps | VWR | 21008-178 | polypropylene |
| Disposable/graduated/conical/sterile 15 ml centrifuge tubes with screw caps | VWR | 21008-103 | polypropylene |
| CELLSTAR Tissue Culture Treated T-25 Flask w/ Filter Cap | Greiner Bio One | 690175 | polystyrene |
| CELLSTAR Tissue Culture Treated T-75 Flask w/ Filter Cap | Greiner Bio One | 658175 | polystyrene |
| CELLSTAR 10 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 607180 | polystyrene |
| CELLSTAR 2 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 710180 | polystyrene |
| CELLSTAR 5 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 606180 | polystyrene |
| CELLSTAR 25 ml Paper /Plastic Wrapped Serological Pipette | Greiner Bio One | 760180 | polystyrene |
| 1 cm cuvettes | N/A | N/A | polystyrene |
| CELLSTAR, 96W Microplate, Tissue-Culture Treated, Black, with Lid 96-well Plate | Greiner Bio One | 655086 | polystyrene |
| Combitips | Eppendorf | 022266501 | Polypropylene/ polyethylene |
Referenzen
- Naal, R., Tabb, J., Holowka, D., Baird, B. In situ measurement of degranulation as a biosensor based on RBL-2H3 mast cells. Biosens. Bioelectron. 20, 791-796 (2004).
- Palmer, R. K., et al. Antibacterial agent triclosan suppresses RBL-2H3 mast cell function. Toxicol. Appl. Pharmacol. 258, 99-108 (2012).
- Fewtrell, C., Kessler, A., Metzger, H. Comparative aspects of secretion from tumor and normal mast cells. Adv. Inflam. Res. 1, 205-221 (1979).
- Metzger, H., et al. The receptor with high-affinity for immunoglobulin-E. Annu. Rev. Immunol. 4, 419-470 (1986).
- Seldin, D. C., et al. Homology of the rat basophilic leukemia-cell and the rat mucosal mast-cell. Proc. Natl. Acad. Sci. U.S.A. 82, 3871-3875 (1985).
- Schwartz, L. B., Austen, K. F., Wasserman, S. I. Immunological release of beta-hexosaminidase and beta-glucuronidase from purified rat serosal mast-cells. J. Immunol. 123, 1445-1450 (1979).
- Kjaerheim, V., Barkvoll, P., Waaler, S. M., Rolla, G. Triclosan inhibits histamine-induced inflammation in human skin. J. Clin. Periodontol. 22, 423-426 (1995).
- Barkvoll, P., Rolla, G. Triclosan reduces the clinical symptoms of the allergic patch test reaction (APR) elicited with 1-percent nickel sulfate in sensitized patients. J. Clin. Periodontol. 22, 485-487 (1995).
- Tan, W. P., Suresh, S., Tey, H. L., Chiam, L. Y., Goon, A. T. A randomized double-blind controlled trial to compare a triclosan-containing emollient with vehicle for the treatment of atopic dermatitis. Clin. Exp. Dermatol. 35, e109-e112 (2010).
- Sporik, R., Kemp, A. S. Topical triclosan treatment of atopic dermatitis. J. Allergy Clin. Immunol. 99, 861(1997).
- Wohlrab, J., Jost, G., Abeck, D. Antiseptic efficacy of a low-dosed topical triclosan/chlorhexidine combination therapy in atopic dermatitis. Skin Pharmacol. Physiol. 20, 71-76 (2007).
- Wong-Wah-Chung, P., Rafqah, S., Voyard, G., Sarakha, M. Photochemical behaviour of triclosan in aqueous solutions: Kinetic and analytical studies. J. Photochem. Photobiol. A Chem. 191, 201-208 (2007).
- Blank, U., Essig, M., Scandiuzzi, L., Benhamou, M., Kanamaru, Y. Mast cells and inflammatory kidney disease. Immunol. Rev. 217, 79-95 (2007).
- Gri, G., et al. Mast cell: an emerging partner in immune interaction. Frontiers in Immunology. 3, (2012).
- Kuby, J. Immunology. , W.H. Freeman. (1997).
- Farrell, D. J., et al. Intrahepatic mast-cells in chronic liver-diseases. Hepatology. 22, 1175-1181 (1995).
- Cookson, W. The alliance of genes and environment in asthma and allergy. Nature. 402, 5-11 (1999).
- Ferris, C. D., Huganir, R. L., Supattapone, S., Snyder, S. H. Purified inositol 1,4,5-triphosphate receptor mediates calcium flux in reconstituted lipid vesicles. Nature. 342, 87-89 (1989).
- Foreman, J. C., Mongar, J. L., Gomperts, B. D. Calcium ionospheres and movement of calcium ions following physiological stimulus to a secretory process. Nature. 245, 249-251 (1973).
- Siraganian, R. P., Kulczycki, A., Mendoza, G., Metzger, H. Ionophore A-23187 induced histamine-release from mast-cells and rat basiphil leukemia (RBL-1) cells. J. Immunol. 115, 1599-1602 (1975).
- Demo, S. D., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry. 36, 340-348 (1999).
- Hutchinson, L. M., et al. Inorganic arsenite inhibits IgE receptor-mediated degranulation of mast cells. J. Appl. Toxicol. 31, 231-241 (2011).
- Dann, A. B., Hontela, A. Triclosan: environmental exposure, toxicity and mechanisms of action. J. Appl. Toxicol. 31, 285-311 (2011).
- Jones, R. D., Jampani, H. B., Newman, J. L., Lee, A. S. Triclosan: A review of effectiveness and safety in health care settings. Am. J. Infect. Control. 28, 184-196 (2000).
- Levy, C. W., et al. Molecular basis of triclosan activity. Nature. 398, 383-384 (1999).
- McMurry, L. M., Oethinger, M., Levy, S. B. Triclosan targets lipid synthesis. Nature. 394, 531-532 (1998).
- Allmyr, M., Adolfsson-Erici, M., McLachlan, M. S., Sandborgh-Englund, G. Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products. Sci. Total Environ. 372, 87-93 (2006).
- Allmyr, M., et al. The influence of age and gender on triclosan concentrations in Australian human blood serum. Sci. Total Environ. 393, 162-167 (2008).
- Geens, T., Neels, H., Covaci, A. Distribution of bisphenol-A, triclosan and n-nonylphenol in human adipose tissue, liver and brain. Chemosphere. 87, 796-802 (2012).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: A national reconnaissance. Environ. Sci. Technol. 36, 1202-1211 (2002).
- Black, J. G., Howes, D. Percutaneous absorption of triclosan from toilet preparations. J. Soc. Cosmet. Chem. 26, 205-215 (1975).
- Black, J. G., Howes, D., Rutherford, T. Percutaneous absorption and metabolism of Irgasan DP300. Toxicology. 3, 33-47 (1975).
- Kanetoshi, A., et al. Acute toxicity, percutaneous-absorption and effects on hepatic mixed-function oxidase activities of 2,4,4'-trichloro-2'-hydroxydiphenyl ether (Irgasan(R) DP300) and its chlorinated derivatives. Arch. Environ. Contam. Toxicol. 23, 91-98 (1992).
- Sandborgh-Englund, G., Adolfsson-Eric, M., Odham, G., Ekstrand, J. Pharmacokinetics of Triclosan in man. J. Dental Res. 81, 0937(2002).
- Sandborgh-Englund, G., Adolfsson-Erici, M., Odham, G., Ekstrand, J. Pharmacokinetics of triclosan following oral ingestion in humans. J. Toxicol. Environ. Health A. 69, 1861-1873 (2006).
- Lin, Y. J. Buccal absorption of triclosan following topical mouthrinse application. Am. J. Dent. 13, 215-217 (2000).
- Queckenberg, C., et al. Safety of Triclosan after Dermal Administration. Antimicrob. Agents Chemother. 54, 570-572 (2010).
- Breneman, D. L., Hanifin, J. M., Berge, C. A., Keswick, B. H., Neumann, P. B. The effect of antibacterial soap with 1.5% triclocarban on Staphylococcus aureus in patients with atopic dermatitis. Cutis. 66, 296-300 (2000).
- Udoji, F., Martin, T., Etherton, R., Whalen, M. M. Immunosuppressive effects of triclosan, nonylphenol, and DDT on human natural killer cells in vitro. J. Immunotoxicol. 7, 205-212 (2010).
- Ahn, K. C., et al. In vitro biologic activities of the antimicrobials triclocarban, its analogs, and triclosan in bioassay screens: Receptor-based bioassay screens. Environ. Health Perspect. 116, 1203-1210 (2008).
- Foran, C. M., Bennett, E. R., Benson, W. H. Developmental evaluation of a potential nonsteroidal estrogen: triclosan. Mar. Environ. Res. 50, 153-156 (2000).
- Gee, R. H., Charles, A., Taylor, N., Darbre, P. D. Oestrogenic and androgenic activity of triclosan in breast cancer cells. J. Appl. Toxicol. 28, 78-91 (2008).
- Helbing, C. C., van Aggelen, G., Veldhoen, N. Triclosan Affects Thyroid Hormone-Dependent Metamorphosis in Anurans. Toxicol. Sci. 119, 417-418 (2011).
- Ishibashi, H., et al. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and induction of hepatic vitellogenin. Aquat. Toxicol. 67, 167-179 (2004).
- Kumar, V., Chakraborty, A., Kural, M. R., Roy, P. Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan. Reprod. Toxicol. 27, 177-185 (2009).
- Matsumura, N., et al. Effects of nonylphenol and triclosan on production of plasma vitellogenin and testosterone in male South African clawed frogs (Xenopus laevis. Biol. Pharm. Bull. 28, 1748-1751 (2005).
- Veldhoen, N., et al. The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development. Aquat. Toxicol. 80, 217-227 (2006).
- Raut, S. A., Angus, R. A. Triclosan has endocrine-disrupting effects in male western mosquitofish, Gamusia affins. Environ. Toxicol. Chem. 29, 1287-1291 (2010).
- Park, H. G., Yeo, M. K. The toxicity of triclosan, bisphenol A, bisphenol A diglycidyl ether to the regeneration of cnidarian, Hydra magnipapillata. Mol. Cell. Toxicol. 8, 209-216 (2012).
- Vandhanaa, S., Deepa, P. R., Aparna, G., Jayanthi, U., Krishnakumar, S. Evaluation of suitable solvents for testing the anti-proliferative activity of triclosan - a hydrophobic drug in cell culture. Indian J. Biochem. Biophys. 47, 166-171 (2010).
- Skaare, A. B., Kjaerheim, V., Barkvoll, P., Rolla, G. Does the nature of the solvent affect the anti-inflammatory capacity of triclosan? An experimental study. J. Clin. Periodontol. 24, 124-128 (1997).
- Rufli, H. Introduction of moribund category to OECD fish acute test and its effect on suffering and LC50 values. Environ. Toxicol. Chem. 31, 1107-1112 (2012).
- Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Aquat. Toxicol. 76, 69-92 (2006).
- Toivari, M., Maki, T., Suutarla, S., Eklund, K. K. Ethanol inhibits IgE-induced degranulation and cytokine production in cultured mouse and human mast cells. Life Sci. 67 (00), 2795-2806 (2000).
- Kennedy, R. H., Pelletier, J. H., Tupper, E. J., Hutchinson, L. M., Gosse, J. A. Estrogen mimetic 4-tert-octylphenol enhances IgE-mediated degranulation of RBL-2H3 mast cells. J. Toxicol. Environ. Health A. 75, 1451-1455 (2012).
- Fort, D. J., et al. Triclosan and Thyroid-Mediated Metamorphosis in Anurans: Differentiating Growth Effects from Thyroid-Driven Metamorphosis in Xenopus laevis. Toxicol. Sci. 121, 292-302 (2011).
- Fiori, J., et al. Macromolecular Symposia. in Brazilian Polymer Congress. Pinto, J. C. 299-300, 26-33 (2011).
- Mezcua, M., et al. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples. Anal. Chim. Acta. 524, 241-247 (2004).
- Soto, E. O., Pecht, I. A monoclonal-antibody that inhibits secretion from rat basophilic leukemia-cells and binds to a novel membrane component. Journal of Immunology. 141, 4324-4332 (1988).
- Pierini, L., Harris, N. T., Holowka, D., Baird, B. Evidence supporting a role for microfilaments in regulating the coupling between poorly dissociable IgE-Fc epsilon RI aggregates and downstream signaling pathways. Biochemistry. 36, 7447-7456 (1997).
- Aketani, S., Teshima, R., Umezawa, Y., Sawada, J. Correlation between cytosolic calcium concentration and degranulation in RBL-2H3 cells in the presence of various concentrations of antigen-specific IgEs. Immunol. Lett. 75, 185-189 (2001).
- Koo, N., Kim, K. M. Distinct effects on M-2-type pyruvate kinase are involved in the dimethylsulfoxide-induced modulation of cellular proliferation and degranulation of mast cells. Arch. Pharmacal Res. 32, 1637-1642 (2009).
- Senyshyn, J., Baumgartner, R. A., Beaven, M. A. Quercetin sensitizes RBL-2H3 cells to polybasic mast cell secretagogues through increased expression of Gi GTP-binding proteins linked to a phospholipase C signaling pathway. J. Immunol. 160, 5136-5144 (1998).
- Yang, C. Z., Yaniger, S. I., Jordan, V. C., Klein, D. J., Bittner, G. D. Most Plastic Products Release Estrogenic Chemicals: A Potential Health Problem that Can Be Solved. Environ. Health Perspect. 119, 989-996 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten