Method Article
Un ensayo de microplacas para evaluar los efectos químicos sobre RBL-2H3 mástil degranulación: Efectos de Triclosan y sin uso de un disolvente orgánico
En este artículo
Resumen
Degranulación de los mastocitos, la liberación de mediadores alérgicos, es importante en la alergia, el asma, y la defensa parásito. Aquí demostramos técnicas 1 para evaluar los efectos de las drogas y las sustancias tóxicas en la degranulación, la metodología utilizada recientemente para exhibir el poderoso efecto inhibidor del agente antibacteriano triclosán 2.
Resumen
Los mastocitos juegan un papel importante en la enfermedad alérgica y la defensa inmune contra parásitos. Una vez activado (por ejemplo, por un alergeno), se desgranulan, un proceso que resulta en la exocitosis de mediadores alérgicos. La modulación de la degranulación de los mastocitos por las drogas y las sustancias tóxicas pueden tener efectos positivos o negativos sobre la salud humana. La función de los mastocitos ha sido diseccionado en detalle con el uso de mastocitos de rata leucémicas basófilas (RBL-2H3), un modelo ampliamente aceptado de mastocitos de la mucosa humanos 3-5. Mástil componente de células granulares y el mediador alérgica β-hexosaminidasa, que se libera linealmente en tándem con histamina de los mastocitos 6, se pueden medir fácilmente y de forma fiable a través de la reacción con un sustrato fluorogénico, dando la intensidad de fluorescencia medible en una microplaca de ensayo que es susceptible de alto rendimiento estudios 1. Publicado originalmente por Naal et. Al 1, hemos adaptado este ensayo degranulación para la detección of drogas y sustancias tóxicas y demostrar su uso aquí.
El triclosán es un agente antibacteriano de amplio espectro que está presente en muchos productos de consumo y se ha encontrado para ser una ayuda terapéutica en la enfermedad alérgica de la piel humana 7-11, aunque se desconoce el mecanismo de este efecto. Aquí se demuestra un ensayo para el efecto de triclosán en la degranulación de los mastocitos. Recientemente, hemos mostrado que el triclosán afecta en gran medida la función de los mastocitos 2. En un esfuerzo por evitar el uso de un disolvente orgánico, el triclosán se disuelve directamente en tampón acuoso con calor y agitación, y la concentración resultante se confirmó usando espectrofotometría UV-Vis (utilizando ε 280 = 4.200 L / M / cm) 12. Este protocolo tiene el potencial para ser utilizado con una variedad de productos químicos para determinar sus efectos sobre la desgranulación de los mastocitos, y en términos más generales, su potencial alérgico.
Introducción
Los mastocitos son altamente granular células inmunes efectoras que sirven como mediadores en el asma, las alergias, parásitos de defensa y la carcinogénesis 13-16. Ellos residen en casi todos los tejidos vascularizados 15, donde se almacenan de forma segura mediadores inflamatorios y alérgicos en los gránulos citoplasmáticos hasta que se activa a degranulación. La desgranulación es la exocitosis de gránulos unidos a la membrana, lo que resulta en la liberación de mediadores farmacológicamente activos, tales como histamina, triptasa, y los leucotrienos 15. Este proceso resulta en la iniciación de las reacciones de hipersensibilidad de tipo I que son críticos en la defensa contra los parásitos de montaje, así como el inicio de las respuestas alérgicas, asmáticas, y carcinogénicos 15.
Los mastocitos y basófilos expresan receptores varepsilon RI, los receptores de alta afinidad para la inmunoglobulina E (IgE) 17. La exposición a un alérgeno o antígeno provoca la agregación de múltiples receptores varepsilon RI de IgE enlazados a 17, y es este so-llamado "reticulación" de los receptores de Fc de IgE unidas a que inicie el proceso de desgranulación: una cascada de eventos de fosforilación de tirosina, la activación de la fosfolipasa C, flujo de calcio desde las reservas internas, y la afluencia de calcio en la célula 18. Este influjo de calcio es necesario para la desgranulación, y, además, señales de fusión de gránulos con la membrana antes de causar la exocitosis de los gránulos 15. Experimentalmente, un ionóforo de calcio se puede utilizar para transportar calcio directamente a través de la membrana de la célula 19, que esencialmente no pasa por todos los pasos de transducción de señales antes de la etapa influjo de calcio 20, lo que permite la identificación de un objetivo por vía de un tóxico como aguas arriba o aguas abajo de señalización de calcio 20.
La desgranulación se puede medir con rapidez y eficacia mediante el control de la liberación de β-hexosaminidasa en sobrenadante de células, que se libera linealmente a partir de los gránulos junto con histamina 6, pero is mucho más fácil de detectar utilizando una reacción enzima-sustrato simple y un lector de microplacas a ensayo el producto fluorescente. Esta microplaca de ensayo, como se detalla en la sección de protocolo, se basa en un método robusto desarrollado originalmente por Naal et al. 1, que cuantifica la escisión del sustrato fluorogénico 4-metilumbeliferil-N-acetil-β-D-glucosaminida por β- hexosaminidasa. Hemos modificado el ensayo a efectos de prueba de los fármacos y sustancias tóxicas, con triclosán resaltado aquí. Este método cuantifica con fiabilidad la desgranulación, es una alternativa económica a, por ejemplo, métodos de detección de citometría de flujo basados en 21, y tiene el potencial de que se presta muy bien a la selección de alto rendimiento de una amplia variedad de fármacos contra la alergia, así como inmunotóxicos o sustancias químicas alergénicas. Este último punto es particularmente importante a la luz de las "Pruebas de Toxicidad 2007 informe del Consejo Nacional de Investigación en el siglo 21: una visión y una Stratgia "( http://www.nap.edu/openbook.php?record_id=11970 ), que aboga por el desarrollo de las pruebas de toxicología de alto rendimiento que utilizan cultivo de células para reducir el costoso uso de animales de laboratorio tradicionales tales como ratones. El protocolo desarrollado por la desgranulación de Naal et al. 1 y modificado por nosotros 2, utiliza la línea de células RBL-2H3, que es un modelo bien aceptado homóloga a mastocitos de la mucosa humanos o basófilos 3-5. (Los métodos para el cultivo de células RBL-2H3 se detallan en Hutchinson et al. 22). Este ensayo probablemente podría ser adaptado a cualquier tipo de célula mástil adjunto.
Triclosan (TCS) es un antimicrobiano de amplio espectro que se ha utilizado durante más de 30 años en los hospitales, productos de cuidado personal, y bienes de consumo 23,24. El modo de acción antimicrobiana de la característica de TCS es la inhibición de la biosíntesis de ácidos grasos, probablemente mediante la inhibición de enoil-aciloproteína portadora reductasa 25,26. Se encuentra en todo el mundo en una amplia gama de productos de consumo, tales como gel de ducha, loción para las manos, pasta de dientes, enjuague bucal, y en jabones de tocador en concentraciones de hasta el 0,3% o 10 mM 24. El uso generalizado de TCS se ha traducido en niveles detectables en los seres humanos 27 a 29 y en los ríos y arroyos 30. Un estudio realizado por Allmyr et al. 27 demostró que los ECT y sus metabolitos están presentes tanto en el plasma y la leche de las madres lactantes. Es importante destacar que, TCS se absorbe fácilmente en la piel 31-37. Queckenberg et al. Encontraron 37 ~ 10% de absorción de un ~ 70 mM de TCS crema en la piel humana dentro de 12 horas, lo que resulta en una concentración significativa en la piel, donde residen las células cebadas.
TCS ha demostrado clínicamente para controlar la enfermedad alérgica en la piel humana 7-11, pero el mecanismo por el cual TCS alivia las enfermedades alérgicas de la piel ha sido desconocido 38. Uso de la microplaca de ensayo fluorescente detailed en este video, recientemente hemos demostrado que TCS, a concentraciones tan bajas como 2 M, amortigua significativamente la función de los mastocitos y degranulación, proporcionando una posible explicación de estos datos clínicos 2. Además de proporcionar una explicación de estos datos clínicos, nuestros hallazgos en Palmer et al. 2 sugieren que los ECT se dirige a moléculas de señalización aguas abajo de la entrada de calcio. Debido a la importancia de la señalización de calcio en muchos inmunológica y otros procesos biológicos, TCS potencialmente podría tener efectos adversos en una amplia variedad de procesos biológicos necesarios. De hecho, Udoji et al. 39 demostraron que TCS suprime la actividad lítica de las células asesinas naturales humanos, otra importante función inmune innata.
Más allá de su potencial como una ayuda terapéutica en la enfermedad alérgica de la piel (o, a la inversa, como un inmunotóxico), TCS también puede ser un disruptor endocrino 40-49. Así, un procedimiento claro sobre cómo preparar esta sustancia química en solución is de interés para los toxicólogos. Debido a TCS es una pequeña molécula hidrófoba, los vehículos orgánicos se utilizan a menudo para que sea más soluble en agua. En la mayoría de los estudios de toxicidad donde TCS ha sido probado, la preparación ha implicado la disolución en agua con la ayuda de un disolvente orgánico tal como etanol, acetona, o aceite 2,50,51. Sin embargo, muchas veces estos disolventes son biológicamente activos a sí mismos, lo que complica la interpretación de los datos de la sustancia problema 51. De hecho, de acuerdo con Rufli et al. 52 y otros 53, se recomienda que las soluciones de prueba para los experimentos de toxicidad acuática se preparan utilizando métodos físicos sobre los métodos químicos, debido a la posibilidad de disolventes químicos para crear artefactos de toxicidad. Hemos demostrado anteriormente que los ECT disolvió en 0,24% de etanol / agua (vol / vol) y se sometió a ultrasonidos durante 30 min amortigua RBL degranulación de los mastocitos 2. El etanol a concentraciones más altas que 0,24% se ha demostrado para amortiguar la degradación de los mastocitoscanulación 54,55-ejemplos de los efectos de confusión potenciales de disolventes orgánicos en los estudios de toxicidad.
No sólo es importante tener en cuenta el efecto de los disolventes sobre el organismo o las células utilizadas para el estudio, pero también es importante para controlar el efecto de un disolvente sobre la propia sustancia de ensayo. Por ejemplo, Skaare et al. 51 encontraron que la disolución de TCS en polietileno glicol (comúnmente encontrado en los dentífricos y enjuagues bucales) debilitada efectos anti-bacterianos y anti-placa en las mujeres sanas, mientras que la disolución en aceites causó una pérdida completa de la función. Por lo tanto, la capacidad de los diferentes disolventes para modular tóxico y drogas, incluyendo TCS, efectos deben ser considerados en el diseño de ensayo. Uso de aceites o aditivos de sabor puede interferir con los efectos de TCS en diversos productos 50,51.
En un esfuerzo por eliminar la necesidad de utilizar disolventes orgánicos, hemos mejorado sobre nuestro método para disolver TCS 2 mediante la eliminación de la utilización de un sol orgánicodesahogarse. En el presente protocolo, disolvemos gránulos TCS directamente en tampón acuoso con el calor (≤ 50 ° C), a continuación, compruebe que la concentración de esta población TCS por espectrofotometría UV-Vis. Estas mejoras son posibles porque TCS es soluble en agua hasta 40 mM ( http://www.epa.gov/oppsrrd1/REDs/2340red.pdf ) y se ha demostrado para resistir la degradación cuando se calienta a 50 ° C ( http:// / oehha.ca.gov/prop65/public_meetings/052909coms/triclosan/ciba3.pdf ) 56,57. También tenemos el beneficio añadido de espectrofotometría UV-Vis, como TCS también se conoce para absorber fuertemente a 280 nm 58 con un coeficiente de extinción molar de 4200 L / mol / cm 12.
Este protocolo proporciona una manera sencilla, pero eficaz para disolver gránulos de TCS en un tampón sin la ayuda de un disolvente orgánico, incluyendo bajo costo y verificación rápidade la concentración, y describe un potente microplaca de ensayo fluorescente para el seguimiento de los efectos químicos sobre la desgranulación de los mastocitos.
Protocolo
Tenga en cuenta que todas las recetas de amortiguamiento se incluyen en una tabla al final del texto del protocolo.
DÍA 1:
1. Preparación de las células
- Planificar de 96 pocillos esquema de configuración de la placa, centrado muestras de ensayo en el diseño con el fin de evitar los efectos de borde. Asignar tres réplicas para cada concentración probada TCS (± desgranulación estimulante de antígeno o ionóforo), así como por triplicado para la liberación espontánea (sin estimulante degranulación), liberación máxima (0,2% de Triton X-100 [TX] lisis con detergente), así como pozos reservado para muestras de fondo (que no contienen células). Para cada día experimental réplica, elija un nuevo diseño aleatorio de las concentraciones de la muestra de TCS.
- Medios Warm RBL (Receta proporcionada en la tabla) y tripsina en 37 ° C baño de agua.
- Compruebe células RBL en matraz T-25 (2-4 días desde el paso ya menos de 3 a 4 meses desde que fueron descongelados) para el estado general de buena curath: pH adecuado se indica por el color de los medios de comunicación, y la falta de nubosidad. Colocar el matraz bajo un microscopio de luz para confirmar que el frasco que está libre de contaminación y que las células parecen saludables, adecuadamente confluente, y sobre todo unida. Tenga en cuenta que las células deben ser revisados de contaminación por micoplasma aproximadamente cada seis semanas 22.
| Tratamiento | Triplicado |
| Estimulado, 0 mM TCS | A7, B7, C7, F4, G4, H4 |
| Estimulado, 0,001 mM TCS | F6, G6, H6 |
| Estimulado, 0,1 mM TCS | A4, B4, C4 |
| Estimulado, 1 mM TCS | A6, B6, C6 |
| Estimulado, 5 mM TCS | F5, G5, H5 |
| Estimulado, 10 mM TCS | A3, B3, C3 |
| Estimulado, 15 mM TCS | A5, B5, C5 |
| Estimulado, 20 mM TCS | F7, G7, H7 |
| Estimulado, más alto [TCS] | F3, G3, H3 |
| Espontánea, No TCS (incluye burla) | A10, A11, A12, B10, B11, B12, A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, No TCS | D10, D11, D12, E10, E11, E12 |
| Sin Cells, Fondo, más alto [TCS] | G10, G11, G12, H10, H11, H12 |
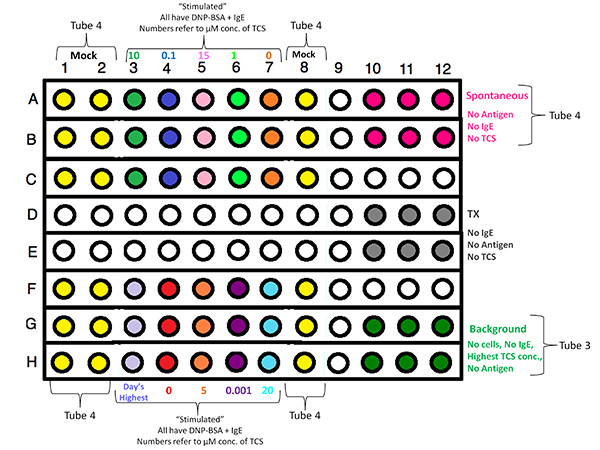
Haz clic aquí para ver la imagen más grande .
- Tome el frasco de células RBL en el cultivo de tejido estéril (TC) campana. Las células se unen a la bottom del matraz. Trabajando bajo el capó TC y utilizando una técnica estéril estándar, retire todos los soportes de frasco con pipeta estéril, las células permanecen unidas a la parte inferior de la botella. A continuación, enjuagar matraz con 2 ml de tripsina, luego descarta este lavado.
- Añada exactamente 2 ml de tripsina para cubrir el fondo del matraz. Poner en la incubadora de 37 ° C durante 5 minutos para permitir que las células se separan de la parte inferior del matraz.
- Después de 5 min, golpear el lado del matraz con una palma de la mano para aflojar las células. Inmediatamente, añadir media RBL 18 ml de lavar las células fuera del frasco y para saciar la tripsina. Tomar inmediatamente la mezcla de células-media-tripsina del matraz y transferir a un nuevo tubo estéril de 50 ml (volumen total de este tubo es ahora de 20 ml).
- Después de mezclar suavemente pero a fondo, eliminar 50 l de suspensión de células a partir de este tubo, y transferir a un tubo de microcentrífuga estéril ml de 1,5, que es una muestra para ser contados. Tome esta muestra, así como los 50 ml0; tubo que contiene la mezcla de células-medios de comunicación-tripsina a cabo de la campana TC a la mesa de trabajo.
- Girar el tubo de 50 ml en centrifugadora (con equilibrio adecuado) durante 8 minutos a 500 xg; esta fuerza células pellets de manera efectiva.
- Durante el tiempo de giro, contar las células en la muestra que se aislaron antes del hilado. Para ello, primero se añaden 50 l de colorante azul de tripano a 50 l de células en el tubo de 1,5 ml, y suavemente pero a fondo pipetear arriba y abajo 5 veces para mezclar. Inmediatamente, la transferencia de 10 l de esta mezcla a la hematocitómetro vidrio, y contar las células en el área de la cuadrícula siguiendo las instrucciones del fabricante. Contar al menos 100 células de los resultados estadísticos razonables.
- De vuelta en el capó TC, eliminar el sobrenadante de las células que fueron hilar abajo.
- Se tapa el tubo de células, y la película de sedimento en la parte inferior del tubo para aflojar las células.
- Añadir los medios de comunicación a las células tratadas con tripsina para producir una densidad de 0,5 x 10 6 células / ml, basado en el recuento de células.
- Mezclar bien pero con cuidado para mantener las células en suspensión durante el procedimiento de recubrimiento. El uso de un Pipetman, poner 100 células l / pocillo en una placa de 96 pocillos (llano, pie negro), siguiendo la hoja de plantilla de la placa. Se añade Randomize cómo se añaden las células a los pocillos para evitar el error sistemático, y la mezcla después de cada conjunto de tres pozos. Asegúrese de no poner las células en los pocillos marcados para las muestras de fondo.
- Una vez que todas las células se han transferido, coloque la placa de tapa en la placa y transferir a la incubadora (CO 2 37 ° C / 5%) durante la noche. Limpie siguiendo una técnica estéril estándar.
DÍA 2:
2. Preparación de Triclosán
- El uso de un cilindro graduado, mida 250 ml Tyrodes Buffer (Receta proporcionada en la tabla) en un matraz Erlenmeyer de 500 ml con la etiqueta "TCS-buffer." Agregar una barra de agitación. Utilizar material de vidrio, una barra de agitación, termómetro designada para su uso con TCS solamente.
- También en este tiempo, medida 250Tyrodes ml en un matraz separado 500 ml Erlenmeyer, "tampón de control." marcado uso de vidrio, una barra de agitación, un termómetro que no sean designados a TCS. Añadir una barra de agitación.
- Pesar 0,0022 g de gránulos de TCS y transferir a un matraz "TCS-buffer" (que contiene 250 ml Buffer Tyrodes). Para transferir eficientemente gránulos de erlenmeyer, utilice 10 ml de las medidas Tyrodes 250 ml de lavar pesar barco, asegurándose de que todos los TCS se ha transferido.
- Lugar frasco "TCS-buffer" en una combinación de placa / placa de agitación magnética, y la dejó en agitación a un manejable de alta velocidad. Una vez bien mezclados, esta población TCS nominalmente 30 mM (concentración real se calculará después de calentar). (No todas las mezclas en una campana química.)
- También en este tiempo, coloque el frasco de "tampón de control" (que no contiene TCS) en una segunda placa / placa de agitación magnética combinación, y la puso en agitación a una velocidad similar.
- Encienda la lámpara UV / Vis para calentar la lámpara para su uso posterior.
- Calentar la solución "TCS-tampón" a 50 ° C mientras se agitaba constantemente. Una vez a la temperatura, el tiempo de 90 min. Durante los 90 minutos, seguirá de cerca 50 ° C de temperatura y velocidad de agitación adecuada frecuencia.
- Al mismo tiempo, calentar la solución "buffer de control" (que es sólo 250 ml de tampón de Tyrode normal) a 50 ° C con agitación continua. Al llegar a 50 ° C, tiempo durante 90 min, tiempo durante el cual la temperatura (manteniendo a 50 ° C) y agitación son ambos controlados.
- Al final de los 90 minutos, tome dos matraces Erlenmeyer de las placas y la transferencia a la mesa de trabajo caliente.
- Uso de la función de exploración de longitud de onda en un espectrofotómetro UV / Vis, espacio en blanco en la máquina 1 ml de la solución calentada "control de tampón" antes de escanear 1 ml de solución calentada "TCS-tampón". Compruebe la forma del espectro, und Valor de absorbancia record a 280 nm. Para determinar la concentración, utilizar la ecuación de Beer-Lambert (A 280 = 280 ε ℓ c) usando un ε 280 de 4200 L / mol / cm y 12 ℓ de 1 cm.
- Después de determinar la concentración de TCS, añadir 0,249 g de albúmina de suero bovino (BSA) a la 249 ml restantes de la solución "TCS-tampón", y mezclar bien.
- Al mismo tiempo, añadir 0,249 g BSA al 249 ml restantes de la solución "buffer de control", y mezclar bien.
DÍA 2:
3. Estimulados por antígenos Ensayo de desgranulación Uso de células RBL-2H3
- Antes de comenzar, compruebe el pH de todos los buffers que se utilizan, y asegurarse de que son claras y no turbia: incluye Tyrodes, tampón de acetato de sodio y carbonato de buffer glicina (recetas muestran en la tabla).
- RBL medios cálidos y tripsina en 37 ° C baño de agua.
- Hacer BT (1 mg / ml0; BSA en tampón de Tyrode): 0,05 g de BSA + 50 ml de tampón Tyrodes (X2). Añadir a 37 ° C baño de agua.
- Hacer 0,2% de Triton X-100: 3.136 ml de BT + 64 l de 10% de Triton X-100 (concentración final de Triton X-100 es 0,2%). Mezclar bien por inversión, pero no lo hacen vórtice. Añadir a 37 ° C baño de agua.
- Iniciar la preparación de la TCS y tampón Tyrodes climatizada (pasos "2", más arriba) Nota:. No inicie el siguiente paso (exposición IgE) hasta que el "TCS-buffer" y soluciones "buffer de control" alcanzan 50 ° C y se agita durante los primeros 70 minutos de la hora 90 min calentamiento / agitación.
- Una vez que ambas soluciones se han agitó a 50 ° C durante 70 min, hasta hacer 0,1 g / ml de anti-DNP IgE de ratón (Sigma) en los medios de comunicación RBL para pocillos de muestras a ser sensibilizados (100 l / pocillo). IgE de valores no debe ser mayor de 30 días cuando se almacena a 4 º C, registrar la edad de la población está. Deslice el dedo para mezclar, pero no vortex IgE.
- Bajo una campana TC,añadir 0,6 l de stock de IgE (de valores es 1 mg / ml) a los medios de RBL 6 ml en un tubo de 50 ml. En un segundo tubo de 50 ml, añadir 6 ml de sólo media RBL lisos (que está destinada a muestras no sensibilizados).
- Volcar todos los medios de la placa de 96 pocillos (que se preparó en el día 1) en el lavamanos, y llevar la placa bajo el capó TC.
- Añadir al azar 100 l / medios IgE mezcla de pozos que deben ser estimuladas (48 pozos en total). Esta mezcla no está diseñado para "espontánea", las muestras "de fondo" "TX", y.
- Añadir al azar 100 l medios RBL llanura sólo a "pozos de fondo" TX "," espontáneo "y".
- Ponga la tapa en la placa de la placa, y luego pasar placa en 5% CO 2/37 ° C incubadora durante 1 hora.
- Durante 1 hora de incubación, siga los pasos 3.13 a 3.24.
- En la mesa de trabajo, preparar las diluciones de antígeno. Añadir 0,53 l de 1,6 mg / ml de caldo de DNP-BSA + 850 l & #160, BT para obtener una concentración de antígeno de 1 mg / ml. Vortex e invertir esta población para mezclar.
- Una vez "TCS-tampón" y "tampón de control" se han calentado y luego se agitó durante 90 min a 50 ° C, seguir adelante con el resto de la preparación para el protocolo TCS (vaya a los pasos 2.6 - 2.8.1). Después de que la BSA se disuelve en ambas soluciones, continúe a continuación.
- Comienza la preparación de las memorias intermedias de exposición, con ± Ag, ± TCS. En primer lugar, a partir de la muestra de ml de la solución de "TCS-tampón" (que ya ha sido calentada y se agitó durante 90 min), la transferencia de 50 ml a un nuevo tubo cónico de 50 ml de 249. Eliminar 20 l de esta alícuota de 50 ml y reemplazarlo con 20 l de la 1 mg / ml de antígeno preparado con anterioridad para una concentración final de antígeno de 0,0004 g / ml de DNP-BSA. Vortex e invertir.
- Etiqueta este "tubo 1, de alta TCS / Ag + / + BT." Se utiliza para la dilución y la concentración más alta de exposición TCS.
- A partir de la muestra ml de solución de "tampón de control" 249, transferir 50 ml a un nuevo tubo de 50 ml. Eliminar 20 l de esta nueva parte alícuota de 50 ml y reemplazar con 20 l de la 1 g / ml de antígeno preparado con anterioridad para una concentración final de antígeno de 0,0004 g / ml de DNP-BSA. Vortex e invertir.
- Etiqueta este "tubo 2, No TCS / Ag + / + BT". Se utiliza para diluciones TCS y 0 mM de exposición concentración TCS.
- Ahora tomar 50 ml de la solución "TCS-buffer" y poner en otro tubo de 50 ml. Eliminar 20 l de esta nueva parte alícuota de 50 ml y reemplazarlo con 20 l de llanura BT. Vortex e invertir. No se añade ningún antígeno.
- Etiqueta este "tubo 3, High TCS / No Ag / + BT." Esto se utiliza para el fondo.
- Transferir 50 ml de "tampón de control" solución a otro tubo de 50 ml. Sacar 20 l de esta ne W-50 ml alícuota y reemplazarlo con 20 l de llanura BT. Vortex e invertir. (No se añade Ag).
- Etiqueta este "tubo 4, No TCS / No Ag / + BT." Esto se utiliza para el fondo y las muestras espontáneas.
| BSA | TCS | Antígeno | |
| Tube 1 |  | Alto [] |  |
| Tube 2 |  | NO |  |
| Tube 3 | / Files/ftp_upload/50671/check.jpg "width =" 15px "/> | Alto [] | NO |
| Tubo 4 |  | NO | NO |
- Calcular y registrar los volúmenes para las diluciones después de la determinación de la concentración de la población "TCS-tampón". Volumen total para cada concentración de la dilución debe ser de 1 ml y debe ser preparado en un tubo estéril de microcentrífuga. Usa P2 calibrado y P1000 Pipetman.
| Concentración | High Triclosan + Tyrodes + BSA 0,0004 g / ml Ag (Tubo 1 de arriba) | Climatizada BT 0.0004 mg / ml Ag (Tubo 2 de la anterior) |
| 20 mM | ||
| 15 mM | ||
| 10 M | ||
| 5 mM | ||
| 1 mM | ||
| 0,1 mM | ||
| 0,001 mM | ||
| 0 m (parte superior de la placa) | ----------------------- | 500 l, más otros 500 l |
| 0 m (parte inferior de la placa) | ----------------------- | 500 l, más otros 500 l |
- Después de 1 hora de incubación IgE, tome la placa de la incubadora y mezclar todos los medios de comunicación en el fregadero. (Nota: si se sabe que los productos químicos de prueba a ser más tóxico que el producto TCS consumidor, puede ser necesaria la eliminación de residuos peligrosos.)
- El uso de un Combitip, lavar las células al azar en la placa de 96 pocillos con BSA-tampón Tyrodes (200l / pocillo). Soltar el tampón de lavado sobre los lados de los pocillos, en lugar de directamente sobre las células unidas, con el fin de no molestar a las células unidas. Repita el proceso una segunda vez.
- Para preparar tratamientos para la aplicación, vórtice e invertir diluciones derecho antes de la adición a la placa.
- Comenzando con la sección superior de la placa: añadir al azar por triplicado de 200 l cada una de las soluciones de antígeno (con concentraciones correctas de TCS) a los pocillos correspondientes. Continuar hasta el fondo del plato. Añadir la solución "buffer control" plus Ag (de "Tube 2" más arriba) para todos "se burla" de la placa.
- Añadir 200 l de soluciones apropiadas a los pocillos correspondientes:
- Añadir 200 l de 0,2% de Triton X-100 pozos a "TX"-designados.
- A continuación, añadir 200 l de tubo 3 a los 3 pozos marcados "fondo (BKGD)-TCS más alta" en la placa.
- Por último, añadir 200 lTubo de 4 a 6 pozos etiquetados como "espontáneo".
- Incubar la placa durante 1 hora en 37 ° C / 5% CO 2.
- Durante 1 hora de incubación: Obtener dos cubos de hielo (una para la placa "viejo" en incubadora y una para nueva placa). Thaw 4metilumbeliferil-N-acetil-beta-D-glucosaminida (4-MU) a temperatura ambiente durante un máximo de 40 min, manteniendo en papel, ya que es sensible a la luz.
- Una vez 4-MU Stock se descongela, conforman 4-MU solución de trabajo: 150 Stock l + 14,85 ml de tampón de etilo frío (receta dada en la tabla); vortex e invertir. Tenga en tubo de centrífuga de 50 ml, envuelto en papel de aluminio, y en hielo hasta su uso.
- Usando Combitip, añada al azar 100 l de solución de trabajo 4-MU fría en la parte inferior de cada pocillo de una nueva Grenier negro placa de 96 pocillos (en cubo de hielo # 2). Iniciar la primera mediante la adición de la solución de trabajo al azar dentro de la parte superior de la placa, al azar dentro de la parte inferior de la placa, al azar dentro de Triton X-100 pozos,y, finalmente, al azar dentro de los pozos de fondo.
- Salga nueva caja de P200 consejos para el próximo paso.
- Al final de la incubación de 1 hora, poner placa de células de la incubadora en cubo de hielo # 1, pipeta sobrenadante arriba y hacia abajo 4-5x (suavemente, no introducir burbujas), pasando alrededor del pozo para un buen mezclado, pero sin tocar las células mientras se mezcla . Sistemáticamente, sacar 25 l de la muestra de cada pocillo y colocar en la nueva placa con sustrato (mismo orden de las muestras, como se había previsto originalmente). Pipetear hacia arriba y hacia abajo para mezclar la muestra a fondo cuando en pozo nuevo, sin introducir burbujas.
- Incubar durante 30 min a 37 ° C / 5% CO 2.
- Después de 30 minutos de incubación, agregar al azar 200 l de tampón glicina-carbonato de frío por pocillo (con Combitip) para llenar los pozos de hasta 325 l total. (Hacer esta adición a los Triton X-100 muestras último, para evitar Triton X-100 desbordamiento). Compruebe si hay burbujas antes de placa de lectura (codazo limpio con pipeta P10te tip para hacer estallar las burbujas).
- Ejecutar la placa en el lector de placas de fluorescencia (ir a la sección 4).
DÍA 2:
4. Instrucciones lector de placas fluorescentes y análisis de datos
- Abra Gen5 programa, y la sección experimento abierto.
- Encienda el lector de placas y la placa de inserción (en la esquina superior izquierda es A1).
- Protocolo
 Procedimiento
Procedimiento  Leer para establecer lecturas personalizadas. No añadir nada de muestras, repeticiones, etc, con el fin de recoger los datos de fluorescencia primas de cada pocillo.
Leer para establecer lecturas personalizadas. No añadir nada de muestras, repeticiones, etc, con el fin de recoger los datos de fluorescencia primas de cada pocillo. - En "Leer" elegir "fluorescente", "Punto final", "velocidad normal", "Resultado 40", "excitación 360/40", "emisión 460/40," La posición Óptica: Top 50%. Top óptica desplazamiento: 7mm. No agitar, sin demora, no cinéticas, sin monitor así, temperatura: incubadora fuera.
- Elija fondo negro mate, placa de 96 pocillos (Grenier 96 pocillos, de fondo plano).
- Hacer frente a la disposición de la placa: Protocolo
 diseño de la placa. Configure muestras sin indicar repite, diluciones, etc
diseño de la placa. Configure muestras sin indicar repite, diluciones, etc - Placa
 leer.
leer. - Guardar archivo: Haga clic en el botón "Excel", que exportará el archivo de datos de Excel. Haga esto por disposición de la placa y de matriz. Guarde el archivo en el ordenador y en una unidad USB.
- En Excel, restar la lectura de fondo promedio de todas las muestras, incluyendo Triton X-100 pozos.
- Calcular% degranulación relativa dividiendo cada valor (que ya ha había sustraído de fondo) por el promedio X-100 Triton valor, y luego se multiplica por 100 para obtener un porcentaje.
- Promedio todo triplicados, y calcula la desviación estándar. Datos del gráfico en Excel como valores medios ± desviación estándar. Para la prueba estadística, mueve ahora con el software GraphPad Prism por.
DÍA 2:
5. Ensayo de desgranulación ionóforo estimulada Uso de células RBL-2H3
- Siga el protocolo de "Preparación de las células" (Sección 1, Día 1) y "Preparación de triclosan" (Sección 2, Día 2), como se indica más arriba. En el ejemplo de diseño de la placa para la estimulación ionóforo se muestra a continuación.
| Tratamiento | Triplicado |
| Estimulado, 0 mM TCS | A7, B7, C7, F4, G4, H4 |
| Estimulado, 0,001 mM TCS | F6, G6, H6 |
| Estimulado, 0,01 mM TCS | F3, G3, H3 |
| Estimulado, 0,1 mM TCS | A4, B4, C4 |
| Estimulado, 1 mM TCS | A6, B6, C6 |
| Estimulados, 5 mM [TCS | F5, G5, H5 |
| Estimulado, 10 mM TCS | A3, B3, C3 |
| Estimulado, 15 mM TCS | A5, B5, C5 |
| Estimulado, 20 mM TCS | F7, G7, H7 |
| Espontánea, con DMSO, sin TCS (incluye burla) | A10, A11, A12, B10, B11, B12, A1, A2, A8, B1, B2, B8, C1, C2, C8, F1, F2, F8, G1, G2, G8, H1, H2, H8 |
| TX-100, con DMSO, sin TCS | D10, D11, D12, E10, E11, E12 |
| No hay células fondo, con DMSO, además de más alta [TCS] | G10, G11, G12, H10, H11, H12 |

Haz clic aquí para ver la imagen más grande .
- Antes de comenzar, compruebe el pH de todos los buffers que se utilizan, y asegurarse de que son claras y no turbia. Tyrodes, tampón de acetato de sodio y carbonato de buffer glicina (recetas muestran en la tabla).
- Preparar un tubo cónico de 50 ml de la lengua azul mediante la adición de 0,05 g de BSA a 50 ml de tampón tyrodes y por agitación para mezclar bien. Incubar en baño de agua a 37 ° C.
- Hacer 0,2% de Triton X-100 con 0,0032% de DMSO (la concentración final de vehículo ionóforo de calcio) mediante la adición de 96 l de 10% de Triton X-100 a 4,704 ml de BT. Mezclar bien. A continuación, sacar 0.155 l de esta solución y desechar. Ahora agregue de nuevo en 0.155 l de DMSO al 100%.
- Preparar una madre 5 mM (2,5 mg / ml) de ionóforo A23187 a partir de polvo mediante la adición de 400 l de fresco 100% de DMSO en el vial ionóforo y agitación en vórtex para mezclar. Una vez en solución,transferir a un tubo cónico de 1,5 ml, el contenido del registro y la fecha de caducidad y de hoy (3 meses de preparación, cuando son correctamente almacenados a -20 ° C).
- Alternativamente, si se utiliza una acción congelada hoy, descongelar en hielo, y compruebe que el ionóforo A23187 5 mM es bien mezclado y claro. Vortex, película, e invertir esta población antes de usar. Fecha de apunte de preparación y de este Lote # A23187.
- Una vez "TCS-tampón" y "tampón de control" se han calentado y se agitó durante 90 min, continuar con el resto de la preparación para el protocolo TCS (vaya a los pasos 2.6-2.8.1). Después de la BSA está bien mezclado en ambas soluciones, continúe con los pasos del protocolo restantes.
- A partir de la muestra ml de solución de "TCS-tampón" 249, transferir 50 ml a un nuevo tubo cónico de 50 ml. Retirar 1,8 l de la parte alícuota de 50 ml y añadir 1,8 l de 5 mM de stock ionóforo. Vortex 3x durante 8 s e invertir 3x. La concentración final de ionóforo es 180 Nm. Tenga en cuenta que esta concentración de A23187 va a variar dependiendo de la potencia, y se recomienda una respuesta a la dosis ionóforo A23187 para identificar una concentración de A23187 que provoca un nivel de más o menos la desgranulación de 20% de liberación máxima, que ha sido identificado como un no citotóxico para RBL-2H3 células por ensayo de citotoxicidad (véase 2).
- Etiqueta este "tubo 1, de alta TCS / + ionóforo / + BT." Utilizados para diluciones y mayor exposición a la concentración TCS.
- A partir de la muestra ml de solución de "tampón de control" 249, transferir 50 ml a un nuevo tubo cónico de 50 ml. Saque 1,8 l de la parte alícuota de 50 ml y añadir de nuevo en 1,8 l de 5 mM de stock ionóforo. Vortex 3x durante 8 s e invertir 3x. La concentración final de ionóforo es de 180 nM.
- Etiqueta este "tubo 2, No TCS / + ionóforo / + BT." Esto se utiliza para diluciones y concentraciones mu M 0 TCS.
- Desde el ml muestra de R 249 20; tampón TCS-solución ", transferir 50 ml a un nuevo tubo cónico de 50 ml. Saque 1,8 l de la nueva alícuota de 50 ml y añadir 1,8 l de DMSO al 100%. No se añade ionóforo; Vortex 3x durante 8 s e invertir 3x.
- Etiqueta este "tubo 3, High TCS / No ionóforo / BT + / + DMSO", que se utiliza para el fondo.
- A partir de la muestra ml de solución de "tampón de control" 249, transferir 50 ml a un nuevo tubo cónico de 50 ml. Saque 1,8 l de la nueva alícuota de 50 ml y añadir 1,8 l de DMSO al 100%. Vortex 3x durante 8 s e invertir 3x. No se añade ningún ionóforo.
- Etiqueta este "tubo 4, No TCS / No ionóforo / BT + / + DMSO", que se utiliza para las muestras de liberación espontánea.
| BSA | TCS | Ionóforo | Añadido DMSO al 100% | |
| Tube 1 | "Src =" files/ftp_upload/50671/check.jpg "width =" / 15px "/> | Alto [] |  | NO |
| Tube 2 |  | NO |  | NO |
| Tube 3 |  | Alto [] | NO |  |
| Tubo 4 |  | NO | NO | eck marca "fo: content-width =" 0.1 en "src =" / files/ftp_upload/50671/check.jpg "width =" 15px "/> |
- Calcular y registrar los volúmenes para las diluciones después de la determinación de la concentración de la población "TCS-tampón". Usa P2 calibrado y P1000 Pipetman. Volumen total para cada concentración de la dilución debe ser de 1 ml, y debe ser preparado en un tubo de microcentrífuga estéril:
| Concentración | High Triclosan + Tyrodes + BSA 180 nM A23187 (Tubo 1 de arriba) | Climatizada BT 180 nM A23187 (Tube 2 de arriba) |
| 20 mM | ||
| 15 mM | ||
| 10 M | ||
| 5 mM | ||
| 1 mM | ||
| 0,1 mM | ||
| 0,001 mM | ||
| 0 m (parte superior de la placa) | ---------------------------------- | 500 l, más otros 500 l |
| 0 m (parte inferior de la placa) | ---------------------------------- | 500 l, más otros 500 l |
- Tome las células chapada ayer de la incubadora, y vaciar los medios de comunicación en el fregadero. El uso de un Combitip, lavar las células al azar en la placa de 96 pocillos con BT (200 l / pocillo). Repetir el lavado una segunda vez.
- Para preparar tratamientos para la aplicación, vórtice e invertir diluciones derecho antes de la adición a la placa. Comenzando con la sección superior de la placa: añadir al azar por triplicado de 200 l cada uno de la concentración correcta de ECT a la corresponding también. Continuar hasta el fondo del plato. Añadir la solución "buffer control" plus A23187 (de "Tube 2" más arriba) para todos "se burla" de la placa.
- Añadir 200 l de soluciones apropiadas a los pocillos correspondientes:
- Añadir 200 l de 0,2% de Triton X-100 pozos a "TX"-designados.
- A continuación, añadir 200 l de tubo 3 a los 3 pozos marcados "fondo (BKGD)-TCS más alta" en la placa.
- Por último, añadir 200 l de tubo 4 a seis pozos con la etiqueta "espontánea".
- Incubar la placa durante 1 hora en 37 ° C / 5% CO 2.
- Durante la incubación de 1 hora: Obtener dos cubos de hielo (una para la placa "viejo" en incubadora y una para nueva placa). Thaw 4metilumbeliferil-N-acetil-beta-D-glucosaminida (4-MU) a temperatura ambiente durante un máximo de 40 min, manteniendo en papel, ya que es sensible a la luz.
- Una vez 4-MU Stock se descongela, conforman 4-MU trabajo solutien: 150 l acción + 14,85 ml de tampón de etilo frío (receta dada en la tabla); vortex e invertir. Tenga en tubo de centrífuga de 50 ml, envuelto en papel de aluminio, y en hielo hasta su uso.
- Uso de Combitip, añadir al azar 100 l de solución de trabajo 4-MU frío en la parte inferior de cada pocillo de una nueva Grenier negro placa de 96 pocillos (en cubo de hielo # 2): iniciar primero mediante la adición de la solución de trabajo al azar dentro de la parte superior de la placa, al azar dentro de la parte inferior de la placa, al azar dentro de Triton X-100 pozos, y finalmente al azar dentro de los pozos de fondo.
- Salga nueva caja de P200 consejos para el próximo paso.
- Al final de la incubación de 1 hora, poner placa de células de la incubadora en cubo de hielo # 1, pipeta sobrenadante arriba y hacia abajo 4-5x (suavemente, no introducir burbujas), pasando alrededor del pozo para un buen mezclado, pero sin tocar las células mientras se mezcla . Sistemáticamente, sacar 25 l de la muestra de cada pocillo y colocar en la nueva placa con sustrato (mismo orden de samples, como estaba previsto originalmente). Pipetear hacia arriba y hacia abajo para mezclar la muestra a fondo cuando en pozo nuevo, sin introducir burbujas.
- Incubar durante 30 min a 37 ° C / 5% CO 2.
- Después de 30 min de incubación, añadir al azar 200 l frío tampón de glicina-carbonato por pocillo (usando Combitip) para llenar los pozos de hasta 325 l total de (hacer esta adición a los Triton X-100 muestras últimos, para evitar Triton X-100 desbordamiento). Compruebe si hay burbujas antes de placa de lectura (empuje con la limpieza P10 punta de pipeta para hacer estallar las burbujas).
- Ejecutar la placa en el lector de placas de fluorescencia (Siga todos los pasos de la sección 4).
Resultados
Cuando se calienta a 50 ° C durante 90 min, el espectro de absorbancia de UV-Vis para TCS produce una fuerte curva, suave entre ~ 260 y 300 nm, con un pico a 280 nm, como se muestra en la Figura 1. Espectrofotometría UV-Vis es, por lo tanto, una herramienta importante que puede ser utilizado para calcular la concentración, ya que el coeficiente de absorción molar publicado a 280 nm es 4200 L / mol / cm 12. Hemos encontrado que los ECT no se caiga fuera de la solución durante el marco de tiempo de todo el experimento desgranulación, después de la calefacción 50 ° C (datos no mostrados).
Después de usar este método de calentamiento para disolver TCS directamente en tampón acuoso, hemos examinado el efecto de TCS en la degranulación de los mastocitos utilizando un ensayo basado en la fluorescencia que se ha optimizado de Naal et al. 1 Este ensayo registra el nivel de β-hexosaminidasa liberada de mástil las células después de la incubación de una hora mediante la detección de un producto sustrato fluorogénico. Ya sea estimulado a desgranulan por DNP-BSUn antígeno (Figura 2) o ionóforo de calcio A23187 (Figura 3), se puede ver claramente que TCS provoca una inhibición dosis-respuesta significativa de la liberación de β-hexosaminidasa (es decir, la desgranulación).
La Figura 2 es representativa de los resultados obtenidos para las células RBL-IgE sensibilizados, que se incubaron durante 1 h en "TCS-tampón" o "tampón de control," y se expusieron a una dosis de antígeno DNP-BSA de 0,0004 g / ml. Esta concentración de DNP-BSA provocó una respuesta media de la desgranulación absoluto de 22,5% ± 0,1 (media ± desviación estándar) en ausencia de TCS. La inhibición estadísticamente significativa de la degranulación comenzó a los 5 m, donde los niveles de degranulación eran 0,79 veces ± 0,05 (media ± DE) de los niveles de control TCS 0 m. A medida que aumenta la concentración de TCS, hay un mayor efecto amortiguador de TCS, que muestra una relación dosis-respuesta fuerte. TCS, a los 20 M, Almost abroga completamente la respuesta desgranulación, a niveles aproximadamente iguales a la desgranulación espontánea (donde ningún antígeno está presente). En general, esta figura muestra una fuerte inhibición de antígeno multivalente estimulada por la desgranulación de mastocitos debido a la concentración verificada-TCS, sin el uso de disolventes orgánicos.
En la Figura 3, ionóforo de calcio A23187 se utilizó como una forma de investigar el mecanismo de TCS-inducida amortiguación de la desgranulación de los mastocitos en RBL. A23187 se utiliza como un estimulante alternativa, ya que no pasa por la reticulación varepsilon RI y otros eventos de señalización aguas arriba de la entrada de calcio, pero todavía ocasiona la desgranulación. Mastocitos RBL se incubaron durante 1 h en "TCS-tampón" o "tampón de control," que contiene una dosis ionóforo de calcio de 180 nM. En la ausencia de TCS, esta concentración de A23187 provocó una respuesta promedio de la desgranulación absoluta de 25,1% ± 4,7 (media ± desviación estándar). La inhibición de la desgranulación fueencontrado con un mínimo de 1 mM TCS (0,63 ± 0,11 [media ± DE]). A medida que aumenta la concentración de TCS, también lo hace la gravedad de la inhibición de: a 5 mM, 0,21 ± 0,04 veces de los niveles de control de 0 TCS mu M; en 10 mM, 0,09 ± 0,05; en 15 mM, 0,077 ± 0,006, y en 20 mu M , 0,09 ± 0,02 (media ± DE). De hecho, a partir de 5 mM y concentraciones más altas de TCS, se encontraron niveles de degranulación inducida por A23187 estar cerca del nivel de control espontánea (donde hay A23187 está presente en absoluto). En general, la figura 3, en combinación con la Figura 2, indica que los eventos moleculares dirigidas por TCS son probables aguas abajo de la entrada de calcio.

Figura 1:. Representante TCS espectro de absorción UV-Vis TCS tiene un guisante robustak a 280 nm, permitiendo una fácil determinación de A 280, así como que proporcione la capacidad de utilizar el coeficiente de extinción molar de 4200 L / mol / cm 12 para determinar la concentración real de TCS disuelto en tampón de Tyrode. La línea amarilla indica el pico a 280 nm. En este ejemplo, el valor de la absorbancia a 280 nm es de 0,11876, lo que indica una concentración TCS de 28,28 m. Haz clic aquí para ver la imagen más grande .

Figura 2:. Una respuesta degranulación representante de los mastocitos RBL IgE sensibilizados expuestos a 0,0004 mg / ml DNP-BSA antígeno y TCS (0-20 mM) Un valor liberación espontánea (sin presencia del antígeno) se representa como referencia. Los valores representan la media7; desviación típica de muestras por triplicado. Tal como se presenta, los datos se normalizaron con el control (0 mM TCS), y se determinaron diferencias significativas en el software Prism con un ANOVA de un factor seguido por el test de Tukey post-hoc (comparaciones hechas a 0,001 mM TCS medio de respuesta). Importancia está representado por *** p <0,001. Haz clic aquí para ver la imagen más grande .
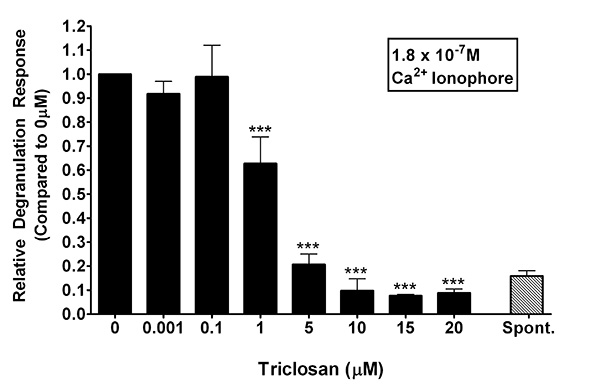
Figura 3:. Una respuesta representativa de la desgranulación de los mastocitos RBL estimuladas con 180 nM de ionóforo de calcio A23187 en la presencia de TCS (0-20 mM) Una muestra de liberación espontánea (sin presencia del ionóforo) se representa para referencia. Los valores representan la media ± desviación estándar de las muestras por triplicado. Como Presented, los datos se normalizan para el control (0 mM TCS), y se determinaron diferencias significativas en el software Prism con un ANOVA de un factor seguido por el test de Tukey post-hoc (comparaciones hechas a 0,001 mM TCS medio de respuesta). Importancia está representado por *** p <0,001; ** p <0,01. Haz clic aquí para ver la imagen más grande .
Discusión
En 2004, Naal et. Al 1 desarrolló un biosensor de los mastocitos para pruebas de alto rendimiento de la degranulación. Se trata de un ensayo robusto que hemos adaptado para nuestros estudios de TCS y detallados en este video. Antes de la Naal et al. 1 ensayo, la desgranulación de mastocitos se ha evaluado de forma rutinaria a través de β-hexosaminidasa 59-61, pero estos primeros métodos utilizados fluorómetros en el que una muestra se leyó a la vez. Es importante destacar que, Naal et al. concordancia directa establecido entre su método de más alto rendimiento utilizando un lector de microplacas y el método anterior en el que las muestras se leyeron uno-a-un-tiempo en un fluorómetro. En suma, Naal et. Al 1 mejoró en gran medida la velocidad, la potencia, la sencillez y fiabilidad del ensayo mediante la adaptación a una plataforma de microplacas de alto rendimiento, así como mediante la incorporación de varios cambios en el flujo de trabajo. Aquí, hemos adaptado además este ensayo para un estudio de diversas sustancias químicas de prueba, en particular, aquí, El TCS drogas en todas partes. Los detalles del vídeo los pasos de este ensayo muy útil. Además, también hemos desarrollado un método de disolventes orgánicos libres de aplicar TCS en tampón acuoso, y nos mostrará un procedimiento sencillo y de bajo costo para la verificación de la concentración de TCS. Estos métodos pueden ser de utilidad a la aparentemente creciente campo de la toxicología triclosan. En esta discusión, se detallan una serie de consideraciones para el uso de este ensayo degranulación de probar otros productos químicos también.
TCS se preparó directamente en tampón acuoso sin la ayuda de disolventes orgánicos, la concentración fue verificado por espectrofotometría UV-Vis (Figura 1), y a continuación, se examinó el efecto de TCS (<30 mM) en la degranulación de los mastocitos (Figuras 2 y 3) , usando un ensayo de microplaca de fluorescencia para detectar la presencia de β-hexosaminidasa, un marcador sustituto para la desgranulación. Hemos encontrado que los ECT es capaz de amortiguar significativamente la liberación de β-hexosaminidase de los mastocitos RBL cuando se disuelve en una concentración baja de etanol (0,24% vol / vol) 2 o, tal como se representa aquí, directamente en tampón acuoso. Por renunciar disolvente orgánico, que en realidad vemos más pronunciada amortiguación en la desgranulación inducida por antígeno en comparación con nuestros estudios en los que se disolvió en etanol TCS 0,24% (vol / vol). Por ejemplo, aquí hemos demostrado una reducción> 50% en la desgranulación inducida por antígeno (0,46 ± 0,07 veces), que es mucho mayor que el 25% de reducción de ~ se informó de 10 mM TCS disolvió en etanol 0,24% (0,76 veces ± 0,02) 2. En el mismo sentido, se determinó para las células estimuladas con A23187-que, por 5 mM, TCS inhibe la degranulación de los niveles de liberación espontánea; este efecto no se demostró hasta 10 mM TCS en nuestra anterior, la utilización de etanol-, estudio 2. Hay dos posibles razones para esta discrepancia: ya sea un vehículo de 0,24% de etanol 2 atenúa la capacidad de TCS para inhibir cel mástil activol degranulación o el TCS que utilizábamos era menos concentrada de lo previsto (ya que las concentraciones no fueron verificadas por espectrofotometría UV-Vis en el estudio anterior 2). En cuanto a la diana molecular para la inhibición de la degranulación de los mastocitos de TCS, que se está produciendo probablemente en algún lugar de las de transducción de señales en cascada aguas abajo de la entrada de calcio 2. Se utilizó ionóforo de calcio A23187 como un estimulante para evitar la desgranulación de los eventos de señalización temprana, y el efecto inhibitorio de TCS persistía, lo que indica que la diana para la inhibición de TCS en la ruta de la desgranulación no es probable situado aguas arriba de la entrada de calcio. Hemos demostrado previamente que el fruncido de la membrana de estas células también se suprime debido al tratamiento TCS, lo que sugiere la posibilidad de un objetivo vía común 2.
Estudios previos han encontrado que el espectro de absorbancia de TCS que tiene un pico máximo a 280 nm y un coeficiente de absorción molar fue evaluado a ser 4200 L / mol / cm en este wavelenGTH (a valores de pH por debajo del pKa) 12. Se ha demostrado que el calentamiento de la TCS no conduce a la degradación térmica 57, y otro estudio ha demostrado éxito en la disolución de TCS en el agua mientras se calienta a 50 ° C sin la ayuda de un disolvente orgánico 56. Cuando se utiliza cualquier nueva sustancia de ensayo, su solubilidad en el tampón acuoso, por supuesto, debe ser considerado cuidadosamente. Hemos encontrado también que, cuando se calienta el TCS, la forma de la lectura espectral no se ve afectada si se calienta durante 40-90 min (datos no mostrados): esto sugiere una ausencia de degradación de la TCS cuando se calienta durante un periodo de tiempo tiempo. Nótese, sin embargo, que los ECT disolución es mayor a los 90 min de 40 min. También hemos confirmado que TCS no se caiga fuera de la solución para la duración del experimento desgranulación (datos no mostrados).
El antígeno DNP-BSA y las concentraciones de ionóforo de calcio utilizada en este estudio se eligieron sobre la base de antígenos y ensayos de respuesta ionóforo de dosis, unad se selecciona para obtener los niveles de degranulación moderadas para las figuras representativas 2 y 3. Un ejemplo de un ensayo de respuesta a la dosis de antígeno se puede ver en la Figura 1A de nuestro trabajo anterior 2. Cuando se determina la concentración de antígeno o ionóforo para ser utilizado en el experimento, es importante tener en cuenta que los experimentos de dosis-respuesta estimulantes deben realizarse periódicamente, por lo general al menos cada dos meses, ya que las células RBL-2H3 veces funcionan de forma variable. La concentración que produce el porcentaje desgranulación deseado puede variar dependiendo de la edad de las células y en la preparación de antígeno / ionóforo. Además, como hemos visto con inorgánica arsenito 22, los porcentajes degranulación absolutos (los niveles de antígeno utilizadas) pueden afectar los niveles de efectos de sustancias tóxicas en la degranulación de RBL, por lo tóxico de dosis-respuesta se debe hacer en varias diferentes concentraciones de antígeno / ionóforo. También es importante considerar la conce definitivantration de vehículo DMSO durante la estimulación de la desgranulación con ionóforo, desde la desgranulación se ve afectada por DMSO 62. Hemos encontrado las concentraciones de DMSO usadas en este protocolo no afectan a la desgranulación, lecturas de fondo, o 0.2% valores de Triton X-100 2.
Además del antígeno multivalente DNP-BSA y el ionóforo de calcio A23187, existen varios otros métodos de estimulación RBL-2H3. Uno de estos métodos es la estimulación a través de la exposición al compuesto 48/80, junto con quercetina 63. Otro es el entrecruzamiento de los receptores de IgE unidas con una IgG anti-IgE, ya que previamente arrojaron junto con la exposición TCS 2. Existen muchos otros métodos de estimulación, y cada uno de estos métodos aborda un aspecto diferente mecanicista de la degranulación de los mastocitos. Este ensayo de lector de placas puede ser adaptado para su uso con muchos de estos estimuladores alternativos, ampliando aún más su utilidad.
Este protocolo desgranulación tiene el potencial para ser utilizado con una amplia variedad de chetancias químicas. En un estudio de cualquier sustancia problema utilizando este ensayo, los controles deben ser ejecutados por el siguiente: (1) el efecto de la sustancia de ensayo en el fondo (sin células) lecturas, (2) el efecto de la sustancia química en la degranulación espontánea (células sin IgE , sin antígeno, sin ionóforo); (3) efecto de la sustancia química en 100 Triton-X-valores de las células lisadas (sin antígeno, sin ionóforo). Estas pruebas pueden ser fácilmente trabajado en la disposición de la placa. Anteriormente, hemos encontrado el TCS afecta a ninguno de estos tres parámetros 2. Además, las pruebas se deben ejecutar para determinar que la sustancia de ensayo no interfiere con la reacción enzima / sustrato β-hexosaminidasa sí en una preparación libre de células, como se describe en la figura S1 del Apéndice A sección de datos suplementaria de Palmer et al. 2 Se encontró que TCS no interfiere con la capacidad de β-hexosaminidasa para escindir el sustrato fluorogénico 4-MU 2. Efectos de los disolventes utilizados también deben ser consideradosen todos estos experimentos de control. Por ejemplo, hemos confirmado que el DMSO, el disolvente para el ionóforo, no tiene efecto en Triton X-100-los niveles de fluorescencia de la muestra (datos no mostrados). También observamos que se seleccionaron todos los plásticos que se utilizan en este estudio por no contener el disruptor endocrino bisfenol A, por desgracia, sin embargo, todos los plásticos actualmente en el mercado probablemente contienen algunas actuar como perturbadores endocrinos, lo que podría confundir a los datos 64.
En el caso de que se requiere la solución de problemas, varios aspectos potenciales de este protocolo deben ser revisados. Por ejemplo, puede ser que (1) los niveles de liberación espontánea son demasiado alto (superior a ~ 7% de los valores de lisis); (2) no se observó una relación dosis-respuesta con ya sea estimulante y / o sustancia de ensayo, o (3) la concentración en la solución de TCS es demasiado bajo (inferior a 20 M). En el primer caso, un nivel espontáneo de alta podría ser una indicación de las células en cultivo son demasiado largo o está contaminada con micoplasma, por lo tanto, Pruebe estos experimentos con células RBL-2H3 que han estado en la cultura entre 2-20 semanas, y poner a prueba regularmente por micoplasma. Si no se observa una relación dosis-respuesta estimulante, la concentración estimulante disuelto puede ser demasiado baja, y las acciones deben ser rehecho. Como un ejemplo, ionóforo de calcio normalmente se proporciona como una película delgada, para ser reconstituida con DMSO, que requiere una cuidadosa atención y mucho agitación con vórtex. Además, una nueva acción ionóforo con un número de lote diferente podría tener una potencia diferente, simplemente debido a la variación de lote a lote, por lo tanto, se recomienda una dosis-respuesta degranulación con cada acción ionóforo que acaba de adquirir. También vale la pena señalar que una aparente falta de efecto con un producto químico de ensayo dado podría ser una indicación de que este producto químico puede requerir un período de incubación más largo con el fin de causar un efecto. Si usted no está alcanzando un alto rendimiento de TCS en solución, asegúrese de que la temperatura se ha mantenido constante (50 ° C ± 5), mientras que los gránulos se disuelven en el buffer. Tque el termómetro no debe tocar el fondo del frasco, una posición que pueda dar lugar a una sobreestimación de la temperatura de la solución. También, asegúrese de que hay agitación vigorosa constante y que la cuenta atrás de 90 minutos no se inicia hasta que la temperatura haya alcanzado primero 50 ° C.
Tabla de solución de problemas.
Problema | Motivo Potencial | Solución |
TCS acción se determina que es <20 mM | No uniforme calentamiento de la solución | Asegúrese de que el termómetro se coloca de modo que se suspende en la solución y no está en contacto con el fondo del matraz. |
La agitación no es suficientemente vigorosa | Aumentar la agitación magnética en agitación de la placa para conseguir un nivel de agitación que es vigoroso sin causar la solución a saltar fuera del matraz. Asegúrese de que se utiliza una barra de agitación magnética de tamaño adecuado. | |
Problemas con el espectrofotómetro | Permitir calentamiento adecuado de la lámpara UV (normalmente 10 minutos), o reemplace la bombilla si es necesario. | |
Niveles degranulación espontáneas son muy altos (> ~ 7%) | Las células han adquirido las mutaciones genéticas anormales debido a demasiado tiempo en la cultura | Lleve a cabo experimentos con un nuevo deshielo celular. |
Las células están muriendo por cizallamiento mecánico | Cuando se añade tampón o tratamientos de células adherentes, tenga cuidado de no molestar a las células, mediante la adición de estos volúmenes cuidadosamente a los lados de los pocillos. Practique el uso del Combitip. | |
IgE / DNP-BSA no provoca liberación de beta-hexosaminidasa sobre los niveles de liberación espontánea | IgE es mayor de 30 días o se ha sometido a congelar deshielo | Utilice una nueva alícuota almacenada adecuadamente de IgE. |
DNP-BSA no ha sido debidamente mezclado | Asegúrese de añadir con cuidado el pequeño volumen de DNP-BSA al tubo cónico y to mezclar bien. | |
Ionóforo A23187 no provoca liberación de beta-hexosaminidasa sobre los niveles de liberación espontánea | A23187 de valores no ha sido debidamente reconstituida | Producto llega como una "película fina", y debe reconstituirse con mucho cuidado y agitación en vórtex. Transferencia reconstituido de stock a un nuevo tubo de 1,5 ml para el almacenamiento. |
A23187 de valores no se ha guardado correctamente | Las acciones son sensibles a la luz. Una vez reconstituido, Parafilm la parte superior, y la tienda envuelto en papel de aluminio a -20 ° C. Si hay alguna duda sobre el almacenamiento de existencias, desechar y comenzar las pruebas con un nuevo lote. | |
180 nM de ionóforo A23187 no provocanel mismo nivel de respuesta de la desgranulación relativa, como la que se encuentra en un ensayo anterior | Variación de lote a lote de ionóforo A23187 | Lleve a cabo un experimento de dosis-respuesta para cada nuevo lote de ionóforo. También se recomienda que las existencias del mismo lote ser probados, debido a la posible variabilidad en el proceso de reconstitución. |
Como en cualquier toxicología / farmacología experimento, la sustancia de ensayo no debe ser abiertamente tóxico en las concentraciones ensayadas. Se recomienda el uso de métodos de prueba para que tanto la apoptosis y la necrosis, ya sea individualmente o combinados (por ejemplo, con ensayos por clonación), así como las pruebas de daño general a la membrana plasmática (por ejemplo, fugas de lactato deshidrogenasa). TCS, en concentraciones mostradas en este estudio, no es citotóxico para las células RBL-2H3 2. Una nota particular de preocupación por los estudios ionóforo es que ionóforo más ionóforo vehículo(Probable DMSO), además de sustancia de ensayo, además de los disolventes orgánicos utilizados, podrían ser una cerveza potencialmente citotóxicos, que debe ser controlada cuidadosamente, como se ha hecho en Palmer et al. 2
El protocolo para la preparación de soluciones TCS sin el uso de un disolvente orgánico será útil para realizar más pruebas toxicológicas de este producto químico en todas partes, sin la interferencia de los artefactos de disolvente, una consideración especialmente importante en toxicología acuática. Estos métodos también permiten la verificación de la concentración de TCS en solución y la cuantificación de los efectos que los productos químicos, tales como TCS, tienen en la degranulación de los mastocitos. Este protocolo se puede utilizar para evaluar los efectos de una amplia variedad de productos químicos en la degranulación de los mastocitos, como la sospecha de los perturbadores endocrinos 55, y potencialmente se puede escalar para cribado de alto rendimiento. Además, otros tipos de células cebadas se pueden utilizar en este ensayo en el trabajo futuro.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
LMW y RHK son apoyados por la Escuela de Graduados de Ciencias Biomédicas e Ingeniería (GSBSE) de UMaine; RHK también fue apoyada por el Maine Agrícola y la Estación Experimental Forestal. Igualmente está subvencionado por el Instituto Nacional de Ciencias Médicas Generales (NIH P20-GM103423), el Maine Agrícola y la Estación Experimental Forestal (número de concesión ME08004-10, JAG), la Universidad de Maine ADVANCE Rising Tide Center (NSF Grant # 1008498) y una investigación Starter Grant en Farmacología / Toxicología de la Fundación PhRMA (JAG). Agradecemos a los Dres. David Holowka y Barbara Baird por el antígeno y células. Estamos muy agradecidos a Hina Hashmi, Alejandro Vélez, y Andrew Abovian para obtener ayuda con equipos y pedidos. Se trata de Maine Agrícola y Forestal de la Estación Experimental número de publicación 3311.
Materiales
| Name | Company | Catalog Number | Comments |
| RBL-2H3 Cells | ATCC | CRL-2256 | The cells we used were a gift, but they are also available from ATCC |
| Triclosan/Irgasan | Sigma | 72779 CAS# 3380-34-5 | Should be stored in a low humidity environment |
| Trypsin | Gibco | 25300-054 CAS# 3380-34-5 | |
| EMEM | Lonza | 12-611F | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Gentamycin Sulfate | Lonza Biological Sciences | 17-518 | |
| Albumin, Bovine Serum | Calbiochem | 12659 CAS# 9048-46-8 | |
| Surfact-Amps X-100 (Triton X-100; 10% solution) | Pierce | 28314 CAS# 9002-93-1 | |
| HEPES | J.T Baker | 4153-01 CAS# 75277-39-3 | |
| Magnesium Chloride | VWR | BDH0244-500G CAS# 7791-18-6 | |
| D-(+)-Glucose | Biomedicals | 152527 CAS# 50-99-7 | |
| Potassium Chloride Crystal | J.T Baker | 3046-01 CAS# 7447-40-7 | |
| Calcium chloride dihyrdate | Acros Organics | 207780010 CAS# 10035-04-8 | |
| Glycine | Sigma | G8898 CAS# 56-40-6 | |
| 4-Methylumbelliferyl-N-acetyl-β-D-glucosaminide (4-MU) | EMD Biosciences | 474502-250MG CAS # 37067-30-4 | Wrap in foil – is light-sensitive |
| Anti-DNP Mouse IgE | Sigma | D8406 | Reagent has concentration of 1 mg/ml. Aliquot 25 µl of reagent into separate microcentrifuge tubes and Parafilm. Store aliquots at -20 °C that are not being used and store aliquot that is being used at 2-8 °C for no longer than 1 month. |
| DNP-BSA | Gift from Dr. David Holowka and Dr. Barbara Baird, Cornell University | Suggest: life technologies DNP-BSA catalog# A23018 | |
| Calcium Ionophore A23187 | Sigma | C75-22-1mg | Ionophore was made from a powder by adding 400 µl of fresh 100% DMSO into the ionophore vial and is kept at -20 °C Note: we have used the ionophore past its 3 month expiration date successfully |
| DMSO | Sigma | D2650 CAS# 67-68-5 | |
| Acetic Acid | VWR | BDH3094-2 CAS# 64-19-7 | |
| Anhydrous Sodium Carbonate | Sigma | 222321 CAS# 497-19-8 | |
| Sodium Chloride | Sigma | 71376 CAS# 7647-14-5 | |
| Hydrochloric Acid | VWR | BDH3026 CAS# 7647-01-0 | |
| Reference Buffer, pH 7 | VWR | BDH5046 | |
| Reference Buffer, pH 10 | VWR | BDH5072 | |
| Reference Buffer, pH 4 | VWR | BDH5018 | |
| pH electrode storage solution | VWR | 14002-828 | |
| Equipment: | |||
| DU 7500 Spectrophotometer | Beckmann | No longer sold | |
| Synergy 2 plate reader Uses Gen5 Microplate Data Collection and Analysis Software | BioTek | Module S | |
| Hematocytometer | Hausser Scientific | 3110 | |
| 7 x 7 CER HOT/STIR 120 V Combination hot plate/magnetic stir plate | VWR | 97042-634 | |
| Centrifuge | Eppendorf | 5430 | |
| Tissue culture water bath | VWR | Model# 89032-206 | |
| Tissue Culture biological safety cabinet SafeGARD (TC hood) | The Baker Company | Model# SG403A-HE | |
| Tissue culture incubator | ThermoScientific | Model# 3598 | |
| Pipetman | VWR | Range: P2-P1000 | |
| Balance | Mettler Toledo | Model# AG204 | |
| pH meter | Symphony/VWR | Model# SB70P | |
| Pipet-Aid | Drummond Scientific | 4-000-100 | |
| Combitip dispenser | Eppendorf | 4981 000.019 | |
| Recipes: | |||
| Acetate Buffer, pH 4.4 | Make 0.12 M acetic acid and titrate to pH 4.4 with 10 N NaOH. This is 5.3 ml glacial acetic acid into 1 L of MilliQ water: (1 L)*(0.12 mol/L)*(60 g/mol)*(ml/1.37 g) = 5.3 ml because density of glacial is 1.37 g/ml | Sterile Filter into autoclaved glass bottle | |
| Substrate (4-MU) | Sigma M-2133, 250 mg, C18H21NO8, FW 379.4 CAS (37067-30-4) Store in -20°C Stock: 0.12 M in DMSO (46 mg in 1 ml DMSO), warm to 37 °C, vortex, sonicate 10 min. in water-bath sonicator with warm water, vortex again | For each experiment, make fresh solution of substrate in acetate buffer (100x dilution), for final concentration of 1.2 mM in acetate buffer | |
| Glycine Carbonate Buffer, pH 10 | 26.7 g glycine 47.1 g anhydrous sodium carbonate Add deionized water for 1 L, and adjust pH to 10 | Sterile filter into autoclaved glass bottle | |
| Tyrodes (2 L), pH 7.4 | 135 mM NaCl: 15.78 g (or 270 ml of 1 M) 5 mM KCl: 10 ml of 1 M stock 1.8 mM CaCl2: 7.20 ml of 0.5 M stock 1 mM MgCl2: 4.00 ml of 0.5 M stock 5.6 mM glucose: 2.02 g (11.2 ml of 1 M) 20 mM HEPES: 40 ml of 1 M stock Using concentrated HCl pH from ~9.7-7.4 | Sterile filter into autoclaved glass bottle | |
| RBL Cell Media | Thaw fetal bovine serum (FBS, stored at -20 °C) for about 4 hours in 37 °C water bath Follow standard sterile technique Get out 1 L minimum essential medium (MEM) with L-glutamine (with Earle’s salts) Pour off some MEM to have 800 ml MEM, add 200 mL warm FBS Add 1 ml gentamicin sulfate antibiotic to 1 L of media with sterile pipette Only use media bottles that have been autoclaved and marked for cell culture use only. | Sterile filter (0.2 mm) into autoclaved glass bottle | |
| Plastic material used: | |||
| 200 µl Disposable sterile pipet tips with graduations in 96 rack | VWR | 53509-009 | polypropylene |
| 1,000 µl Sterile aerosol pipet tips with HighRecovery | VWR | 89003-420 | polyethylene |
| 10 µl micro tip low binding sterile | VWR | 14217-704 | polypropylene |
| Disposable/conical Microcentrifuge tubes for high G-force | VWR | 20170-038 | polypropylene |
| Disposable/graduated/conical/sterile 50 ml centrifuge tubes with screw caps | VWR | 21008-178 | polypropylene |
| Disposable/graduated/conical/sterile 15 ml centrifuge tubes with screw caps | VWR | 21008-103 | polypropylene |
| CELLSTAR Tissue Culture Treated T-25 Flask w/ Filter Cap | Greiner Bio One | 690175 | polystyrene |
| CELLSTAR Tissue Culture Treated T-75 Flask w/ Filter Cap | Greiner Bio One | 658175 | polystyrene |
| CELLSTAR 10 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 607180 | polystyrene |
| CELLSTAR 2 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 710180 | polystyrene |
| CELLSTAR 5 ml Paper/Plastic Wrapped Serological Pipette | Greiner Bio One | 606180 | polystyrene |
| CELLSTAR 25 ml Paper /Plastic Wrapped Serological Pipette | Greiner Bio One | 760180 | polystyrene |
| 1 cm cuvettes | N/A | N/A | polystyrene |
| CELLSTAR, 96W Microplate, Tissue-Culture Treated, Black, with Lid 96-well Plate | Greiner Bio One | 655086 | polystyrene |
| Combitips | Eppendorf | 022266501 | Polypropylene/ polyethylene |
Referencias
- Naal, R., Tabb, J., Holowka, D., Baird, B. In situ measurement of degranulation as a biosensor based on RBL-2H3 mast cells. Biosens. Bioelectron. 20, 791-796 (2004).
- Palmer, R. K., et al. Antibacterial agent triclosan suppresses RBL-2H3 mast cell function. Toxicol. Appl. Pharmacol. 258, 99-108 (2012).
- Fewtrell, C., Kessler, A., Metzger, H. Comparative aspects of secretion from tumor and normal mast cells. Adv. Inflam. Res. 1, 205-221 (1979).
- Metzger, H., et al. The receptor with high-affinity for immunoglobulin-E. Annu. Rev. Immunol. 4, 419-470 (1986).
- Seldin, D. C., et al. Homology of the rat basophilic leukemia-cell and the rat mucosal mast-cell. Proc. Natl. Acad. Sci. U.S.A. 82, 3871-3875 (1985).
- Schwartz, L. B., Austen, K. F., Wasserman, S. I. Immunological release of beta-hexosaminidase and beta-glucuronidase from purified rat serosal mast-cells. J. Immunol. 123, 1445-1450 (1979).
- Kjaerheim, V., Barkvoll, P., Waaler, S. M., Rolla, G. Triclosan inhibits histamine-induced inflammation in human skin. J. Clin. Periodontol. 22, 423-426 (1995).
- Barkvoll, P., Rolla, G. Triclosan reduces the clinical symptoms of the allergic patch test reaction (APR) elicited with 1-percent nickel sulfate in sensitized patients. J. Clin. Periodontol. 22, 485-487 (1995).
- Tan, W. P., Suresh, S., Tey, H. L., Chiam, L. Y., Goon, A. T. A randomized double-blind controlled trial to compare a triclosan-containing emollient with vehicle for the treatment of atopic dermatitis. Clin. Exp. Dermatol. 35, e109-e112 (2010).
- Sporik, R., Kemp, A. S. Topical triclosan treatment of atopic dermatitis. J. Allergy Clin. Immunol. 99, 861(1997).
- Wohlrab, J., Jost, G., Abeck, D. Antiseptic efficacy of a low-dosed topical triclosan/chlorhexidine combination therapy in atopic dermatitis. Skin Pharmacol. Physiol. 20, 71-76 (2007).
- Wong-Wah-Chung, P., Rafqah, S., Voyard, G., Sarakha, M. Photochemical behaviour of triclosan in aqueous solutions: Kinetic and analytical studies. J. Photochem. Photobiol. A Chem. 191, 201-208 (2007).
- Blank, U., Essig, M., Scandiuzzi, L., Benhamou, M., Kanamaru, Y. Mast cells and inflammatory kidney disease. Immunol. Rev. 217, 79-95 (2007).
- Gri, G., et al. Mast cell: an emerging partner in immune interaction. Frontiers in Immunology. 3, (2012).
- Kuby, J. Immunology. , W.H. Freeman. (1997).
- Farrell, D. J., et al. Intrahepatic mast-cells in chronic liver-diseases. Hepatology. 22, 1175-1181 (1995).
- Cookson, W. The alliance of genes and environment in asthma and allergy. Nature. 402, 5-11 (1999).
- Ferris, C. D., Huganir, R. L., Supattapone, S., Snyder, S. H. Purified inositol 1,4,5-triphosphate receptor mediates calcium flux in reconstituted lipid vesicles. Nature. 342, 87-89 (1989).
- Foreman, J. C., Mongar, J. L., Gomperts, B. D. Calcium ionospheres and movement of calcium ions following physiological stimulus to a secretory process. Nature. 245, 249-251 (1973).
- Siraganian, R. P., Kulczycki, A., Mendoza, G., Metzger, H. Ionophore A-23187 induced histamine-release from mast-cells and rat basiphil leukemia (RBL-1) cells. J. Immunol. 115, 1599-1602 (1975).
- Demo, S. D., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry. 36, 340-348 (1999).
- Hutchinson, L. M., et al. Inorganic arsenite inhibits IgE receptor-mediated degranulation of mast cells. J. Appl. Toxicol. 31, 231-241 (2011).
- Dann, A. B., Hontela, A. Triclosan: environmental exposure, toxicity and mechanisms of action. J. Appl. Toxicol. 31, 285-311 (2011).
- Jones, R. D., Jampani, H. B., Newman, J. L., Lee, A. S. Triclosan: A review of effectiveness and safety in health care settings. Am. J. Infect. Control. 28, 184-196 (2000).
- Levy, C. W., et al. Molecular basis of triclosan activity. Nature. 398, 383-384 (1999).
- McMurry, L. M., Oethinger, M., Levy, S. B. Triclosan targets lipid synthesis. Nature. 394, 531-532 (1998).
- Allmyr, M., Adolfsson-Erici, M., McLachlan, M. S., Sandborgh-Englund, G. Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products. Sci. Total Environ. 372, 87-93 (2006).
- Allmyr, M., et al. The influence of age and gender on triclosan concentrations in Australian human blood serum. Sci. Total Environ. 393, 162-167 (2008).
- Geens, T., Neels, H., Covaci, A. Distribution of bisphenol-A, triclosan and n-nonylphenol in human adipose tissue, liver and brain. Chemosphere. 87, 796-802 (2012).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: A national reconnaissance. Environ. Sci. Technol. 36, 1202-1211 (2002).
- Black, J. G., Howes, D. Percutaneous absorption of triclosan from toilet preparations. J. Soc. Cosmet. Chem. 26, 205-215 (1975).
- Black, J. G., Howes, D., Rutherford, T. Percutaneous absorption and metabolism of Irgasan DP300. Toxicology. 3, 33-47 (1975).
- Kanetoshi, A., et al. Acute toxicity, percutaneous-absorption and effects on hepatic mixed-function oxidase activities of 2,4,4'-trichloro-2'-hydroxydiphenyl ether (Irgasan(R) DP300) and its chlorinated derivatives. Arch. Environ. Contam. Toxicol. 23, 91-98 (1992).
- Sandborgh-Englund, G., Adolfsson-Eric, M., Odham, G., Ekstrand, J. Pharmacokinetics of Triclosan in man. J. Dental Res. 81, 0937(2002).
- Sandborgh-Englund, G., Adolfsson-Erici, M., Odham, G., Ekstrand, J. Pharmacokinetics of triclosan following oral ingestion in humans. J. Toxicol. Environ. Health A. 69, 1861-1873 (2006).
- Lin, Y. J. Buccal absorption of triclosan following topical mouthrinse application. Am. J. Dent. 13, 215-217 (2000).
- Queckenberg, C., et al. Safety of Triclosan after Dermal Administration. Antimicrob. Agents Chemother. 54, 570-572 (2010).
- Breneman, D. L., Hanifin, J. M., Berge, C. A., Keswick, B. H., Neumann, P. B. The effect of antibacterial soap with 1.5% triclocarban on Staphylococcus aureus in patients with atopic dermatitis. Cutis. 66, 296-300 (2000).
- Udoji, F., Martin, T., Etherton, R., Whalen, M. M. Immunosuppressive effects of triclosan, nonylphenol, and DDT on human natural killer cells in vitro. J. Immunotoxicol. 7, 205-212 (2010).
- Ahn, K. C., et al. In vitro biologic activities of the antimicrobials triclocarban, its analogs, and triclosan in bioassay screens: Receptor-based bioassay screens. Environ. Health Perspect. 116, 1203-1210 (2008).
- Foran, C. M., Bennett, E. R., Benson, W. H. Developmental evaluation of a potential nonsteroidal estrogen: triclosan. Mar. Environ. Res. 50, 153-156 (2000).
- Gee, R. H., Charles, A., Taylor, N., Darbre, P. D. Oestrogenic and androgenic activity of triclosan in breast cancer cells. J. Appl. Toxicol. 28, 78-91 (2008).
- Helbing, C. C., van Aggelen, G., Veldhoen, N. Triclosan Affects Thyroid Hormone-Dependent Metamorphosis in Anurans. Toxicol. Sci. 119, 417-418 (2011).
- Ishibashi, H., et al. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and induction of hepatic vitellogenin. Aquat. Toxicol. 67, 167-179 (2004).
- Kumar, V., Chakraborty, A., Kural, M. R., Roy, P. Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan. Reprod. Toxicol. 27, 177-185 (2009).
- Matsumura, N., et al. Effects of nonylphenol and triclosan on production of plasma vitellogenin and testosterone in male South African clawed frogs (Xenopus laevis. Biol. Pharm. Bull. 28, 1748-1751 (2005).
- Veldhoen, N., et al. The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development. Aquat. Toxicol. 80, 217-227 (2006).
- Raut, S. A., Angus, R. A. Triclosan has endocrine-disrupting effects in male western mosquitofish, Gamusia affins. Environ. Toxicol. Chem. 29, 1287-1291 (2010).
- Park, H. G., Yeo, M. K. The toxicity of triclosan, bisphenol A, bisphenol A diglycidyl ether to the regeneration of cnidarian, Hydra magnipapillata. Mol. Cell. Toxicol. 8, 209-216 (2012).
- Vandhanaa, S., Deepa, P. R., Aparna, G., Jayanthi, U., Krishnakumar, S. Evaluation of suitable solvents for testing the anti-proliferative activity of triclosan - a hydrophobic drug in cell culture. Indian J. Biochem. Biophys. 47, 166-171 (2010).
- Skaare, A. B., Kjaerheim, V., Barkvoll, P., Rolla, G. Does the nature of the solvent affect the anti-inflammatory capacity of triclosan? An experimental study. J. Clin. Periodontol. 24, 124-128 (1997).
- Rufli, H. Introduction of moribund category to OECD fish acute test and its effect on suffering and LC50 values. Environ. Toxicol. Chem. 31, 1107-1112 (2012).
- Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Aquat. Toxicol. 76, 69-92 (2006).
- Toivari, M., Maki, T., Suutarla, S., Eklund, K. K. Ethanol inhibits IgE-induced degranulation and cytokine production in cultured mouse and human mast cells. Life Sci. 67 (00), 2795-2806 (2000).
- Kennedy, R. H., Pelletier, J. H., Tupper, E. J., Hutchinson, L. M., Gosse, J. A. Estrogen mimetic 4-tert-octylphenol enhances IgE-mediated degranulation of RBL-2H3 mast cells. J. Toxicol. Environ. Health A. 75, 1451-1455 (2012).
- Fort, D. J., et al. Triclosan and Thyroid-Mediated Metamorphosis in Anurans: Differentiating Growth Effects from Thyroid-Driven Metamorphosis in Xenopus laevis. Toxicol. Sci. 121, 292-302 (2011).
- Fiori, J., et al. Macromolecular Symposia. in Brazilian Polymer Congress. Pinto, J. C. 299-300, 26-33 (2011).
- Mezcua, M., et al. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples. Anal. Chim. Acta. 524, 241-247 (2004).
- Soto, E. O., Pecht, I. A monoclonal-antibody that inhibits secretion from rat basophilic leukemia-cells and binds to a novel membrane component. Journal of Immunology. 141, 4324-4332 (1988).
- Pierini, L., Harris, N. T., Holowka, D., Baird, B. Evidence supporting a role for microfilaments in regulating the coupling between poorly dissociable IgE-Fc epsilon RI aggregates and downstream signaling pathways. Biochemistry. 36, 7447-7456 (1997).
- Aketani, S., Teshima, R., Umezawa, Y., Sawada, J. Correlation between cytosolic calcium concentration and degranulation in RBL-2H3 cells in the presence of various concentrations of antigen-specific IgEs. Immunol. Lett. 75, 185-189 (2001).
- Koo, N., Kim, K. M. Distinct effects on M-2-type pyruvate kinase are involved in the dimethylsulfoxide-induced modulation of cellular proliferation and degranulation of mast cells. Arch. Pharmacal Res. 32, 1637-1642 (2009).
- Senyshyn, J., Baumgartner, R. A., Beaven, M. A. Quercetin sensitizes RBL-2H3 cells to polybasic mast cell secretagogues through increased expression of Gi GTP-binding proteins linked to a phospholipase C signaling pathway. J. Immunol. 160, 5136-5144 (1998).
- Yang, C. Z., Yaniger, S. I., Jordan, V. C., Klein, D. J., Bittner, G. D. Most Plastic Products Release Estrogenic Chemicals: A Potential Health Problem that Can Be Solved. Environ. Health Perspect. 119, 989-996 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados