Method Article
Isolamento de células primário do mouse trofoblasto e Ensaio invasão do trofoblasto
Neste Artigo
Resumo
Neste protocolo, descreve-se a dissecção de placenta de rato sobre a gravidez d10.5, seguido de isolamento das células trofoblásticas, utilizando um gradiente de Percoll. Em seguida, demonstrar o uso de células isoladas, num ensaio de invasão de Matrigel.
Resumo
A placenta é responsável para o transporte de nutrientes, gases e factores de crescimento para o feto, bem como a eliminação de desperdícios. Assim, defeitos de desenvolvimento da placenta ter importantes conseqüências para o feto ea mãe, e são uma das principais causas de letalidade embrionária. O principal tipo de célula da porção fetal da placenta é o trofoblasto. Primários de rato trofoblasto da placenta é uma ferramenta útil para o estudo do desenvolvimento normal e anormal da placenta, e ao contrário de linhas de células, pode ser isolado e utilizado para estudar trofoblasto em fases específicas da gravidez. Além disso, a culturas primárias de trofoblasto de ratinhos transgénicos podem ser utilizados para estudar o papel de genes específicos em células da placenta. O protocolo aqui apresentado é baseado na descrição por Thordarson et al. 1, no qual um gradiente de Percoll é usado para obter uma população de células relativamente puro trofoblasto da placenta de rato isolados. Ele é similar ao utilizar mais amplamented humano métodos para isolamento 2-3 trofoblasto célula. A pureza pode ser avaliada por coloração imunocitoquímica das células isoladas para citoqueratina 7 4. Aqui, as células isoladas são então analisadas utilizando um ensaio de invasão para avaliar a capacidade de invasão de matrigel trofoblasto in vitro 5-6. As células invadidas são analisados por imunocitoquímica e coradas para contagem.
Protocolo
1. Dissecção da placenta do mouse
- Configure pares de acasalamento dos ratos.
- Em cada um dos dias seguintes, para verificar a presença de um tampão copulatório. O dia em que é detectada uma ficha é considerada 0,5 dias pós-coito (dpc) 7.
- Placentas podem ser obtidas na fase desejada da gestação, com uma dissecção limpa do início placenta possível com o desenvolvimento da placenta madura em d 10,5. Aqui, nós demonstramos 14,5 dpc. Nos volumes indicados, 40-60 placentas de 10,5 dpc, e 10-20 placentas de 14,5 dpc produzirá uma camada de células de trofoblasto claramente visível.
- Eutanásia do rato prenhe, e remover o útero, o colo do útero em corte, e ao longo da mesométrio.
- Com uma tesoura afiada, corte entre cada concepto (Figura 1A).
- Utilizando dois pares de pinças, segure a parede uterina no bordo de corte, e separar, a remoção do miométrio (Figura 1B) . Um par serrilhada, fórceps moderadamente finas (curvo ou reto), além de um par de fórceps muito finas (# 5, por exemplo) é recomendado.
- Em frente à placenta, abra a decídua com pinças ou tesouras, expondo placenta. Agarrando o tecido uterino com um par fórceps, deslize por baixo da outra pinça para separar a placenta (Figura 1C). Se o feto, necessário separar e da placenta. Não é possível remover todo o tecido decidual por dissecção sem também perder tecido placentário, mas o tecido decidual adicional (pálido) pode ser removida da superfície da placenta suavemente por descamação com um fórceps. Contamos com o gradiente de Percoll para posterior purificação.
- Coloque cada placenta dissecada em 25 ml de tampão gelada dissociação em um tubo de 50 ml cônico até que todas as dissecações estão completos. Em fases posteriores, grosseiramente picada tecido placentário com tesoura ou lâmina de barbear antes de se transferir para o buffer dissociação.
- Vagamente tubo tampa cônica e coloque em banho a 37 ° C por 45-60 minutos. Misturar a solução de dissociação por pipetagem vigorosa aproximadamente a cada 10 min. O tempo de digestão total deve ser acompanhada de perto e provavelmente vai exigir alguma tentativa e erro para conseguir a recuperação celular ideal. Os tecidos devem ser capazes de ser passado através de uma pipeta de 10 ml, mas pedaços visíveis de tecido permanecerá. Overdigestion irá resultar em sobrevivência celular pobre e a eficiência de plaqueamento. A sobrevivência das células e eficiência de plaqueamento óptima ocorrerão quando aglomerados de algumas células estão presentes, e não quando a dissociação completa seja alcançada. Por outro lado, underdigestion levará a pureza reduzida após separação percoll. Quando o ponto de digestão tiver sido atingido, o tubo de colocar em gelo para parar a actividade da colagenase.
- Filtrar a solução através de um filtro celular para remover os materiais não digeridos, e centrifugar @ 500 xg durante 5 minutos.
- Para lavar, removasobrenadante e ressuspender as células em 10 ml de solução de lavagem. Centrifugar @ 500 xg durante 5 minutos.
- Durante a centrifugação, preparar uma solução de Percoll, misturando 9,6 ml de Percoll, 13,4 ml de solução de lavagem e de 1,1 ml de meio de 10x 199 em um tubo de 50 ml, apropriado para centrifugação de alta velocidade.
- Remover o sobrenadante e ressuspender o sedimento de células em 2 ml de solução de lavagem.
- Adicionar células a solução de Percoll e centrifuga @ 30000 xg durante 30 minutos a 4 ° C.
- Retire o tubo de centrífuga, sem perturbar o gradiente. Para visualizar o gradiente tubo lugar, em frente de uma fonte de luz brilhante. Localizar a banda trofoblasto (Figura 2) e, com uma pipeta de aspiração, tendo o cuidado de não perturbar a banda de células vermelhas do sangue a seguir. Volume da banda trofoblasto será 5-8 ml.
- Transferir células trofoblásticas para um tubo cónico de 50 ml. Adicionar solução de lavagem para um volume total de 45 ml.
- Centrifugar @ 500 xg durante 5 minutos. Remover o sobrenadante e ressuspender em cultura medihm (NCTC-135). As células podem ser cultivadas em camada fina matrigel ou de plástico de cultura de tecidos a 37 ° C e 5% CO 2. No dia 10,5, cada placenta produz cerca de 50.000 células vivas, dos quais 80-90% são citoqueratina positivas.
3. Ensaio de invasão do trofoblasto
- Adicionar 1-2 ml meio de cultura (NCTC-135) para cada uma das câmaras de matrigel e incubar a 37 ° C, 5% CO 2 por 30-90 min.
- Remover meio e adicionar 1,5 ml x 10 5 células isoladas de fresco em meio de 2 ml de câmara superior. Adicionar 1 ml de meio de câmara inferior para cobrir a superfície inferior da membrana.
- As células de cultura em inserções durante 18-24 horas.
- Células raspar e Matrigel da inserção utilizando um cotonete de espuma.
- Enxaguar o topo e fundo da câmara, em 2 ml de PBS.
- Fix, durante 5 min em 1 ml de paraformaldeído 4% em PBS.
- Stain de enchimento da câmara inferior com 400 ul de DAPI (300 nM), e incubar durante 30 min.
- Lavar três vezes brevemente em PBS.
- Remover as membranas a partir de pastilhas com uma lâmina afiada bisturi.
- Adicionar uma gota de 10 ul de meio de montagem (glicerol a 50% em PBS) a deslizar. Utilizando uma pinça, colocar membrana em queda. Adicionar outra gota de 10 ul de meio, em seguida, cuidadosamente lamela.
- Células fotografia e contagem. Certifique-se de orientar adequadamente a membrana (célula voltada para cima ou célula-side down) para o microscópio que está sendo usado. Imagem de J software (National Institutes of Health) inclui uma característica de contagem manual que pode ser utilizado para este fim, como pode o Adobe Photoshop ou um contador manual.
4. Resultados representativos
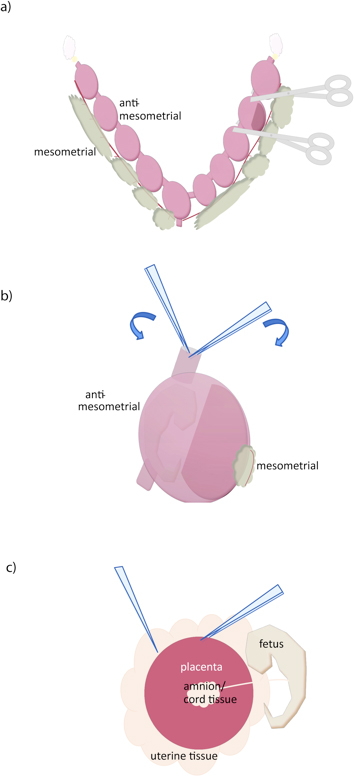
Figura 1. Dissecção da placenta de rato. (A) O útero é removido através de corte ao longo dos ovidutos (amarelo), ao longo da superfície mesometrial, e no colo do útero (parte inferior). Conceptos individuais podem então ser separadas por corte com uma tesoura imediata. (B) O uterino parede é removido colocando duas pinças na superfície de corte do útero, e ao rasgamento ao longo do lado anti-mesometrial, perto do feto e para longe da placenta. (C) A placenta é então isolado por meio de agarramento com uma pinça deslizante e uma outra entre a placenta e tecido uterino. Cordão umbilical e outras membranas extra-embrionário pode então ser separado da placenta.

Figura 2. Percoll separação das células trofoblásticas. Após a centrifugação, três bandas principais será visível, como mostrado em desenhos animados à esquerda, e uma fotografia à direita. A banda superior contém detritos celulares e os fibroblastos e será mais aparente. Uma banda (vermelho) apertado perto da parte inferior que contém as células vermelhas do sangue será visível logo abaixo da banda difusa trofoblasto. Agregados celulares provavelmente visto na banda de trofoblasto, como nos dois mostrada à esquerda da seta na fotografia.
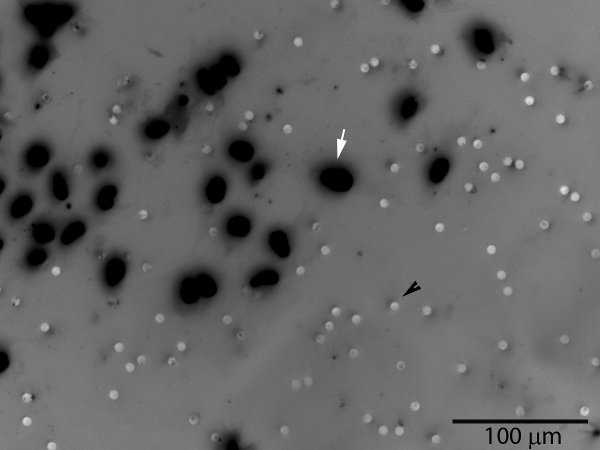
Figura 3. Células trofoblásticas invasoras (seta branca) vai passar através da camada de matrigel e os poros da membrana, que aparece sobre a superfície inferior da membrana. Os poros também são visíveis (seta preta). O número de células na superfície da membrana inteira ou uma área de amostra representativa pode ser contado. Uma imagem em tons de cinza de coloração fluorescente DAPI nuclear foi invertido para melhorar a visualização das células.

As células trofoblásticas Figura 4. Podem ser identificados, e a pureza da população isolada avaliada, por imunocoloração para citoqueratina 7 (centro, magenta). As células são contrastadas com DAPI (topo, azul). Incorporada imagem de baixo,.
Discussão
Neste vídeo, demonstramos o isolamento de células trofoblásticas da placenta de rato. Depois, mostramos um ensaio in vitro para a invasão do trofoblasto. Utilizando este procedimento, uma grande parte, mas não totalmente, população pura de células trofoblásticas pode ser obtida. Se a pureza é necessária mais, separação magnética ou grânulo de citometria de fluxo pode ser realizada, como já foi descrito para as células trofoblásticas humanas primárias. O comprimento adequado do passo de dissociação com colagenase deve ser determinada com cada experiência, e vai ser aprendido com a experiência. Sobre-digestão irá reduzir severamente a recuperação de células, ao passo que sob-digestão pode levar a pureza reduzida, bem como número reduzido. Embora nos mostram o uso de câmaras de matrigel invasão comercialmente preparados, podem também ser preparados por adição de câmaras de matrigel Transwell não revestidos na espessura desejada.
Divulgações
Não temos nada a revelar.
Agradecimentos
Os autores gostariam de agradecer à equipa Serviços Criativos da Universidade de Missouri Centro de Apoio Acadêmico, que produziu este vídeo. Este trabalho foi financiado pelo Eunice Kennedy Shriver National Institute of Child Development Saúde e Humanos do Instituto Nacional de Saúde, subvenção número HD055231
Referências
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados