Method Article
Isolation of Primary Maus Trophoblastzellen und Trophoblastinvasion Assay
In diesem Artikel
Zusammenfassung
In diesem Protokoll beschreiben wir die Zerlegung der Plazenten von der Maus auf die Schwangerschaft d10.5, durch Isolation von Trophoblastzellen mit einem Percoll-Gradienten folgen. Wir demonstrieren dann Verwendung der isolierten Zellen in einem Matrigel Invasionsassay.
Zusammenfassung
Die Plazenta ist verantwortlich für den Transport von Nährstoffen, Gasen und Wachstumsfaktoren für den Fötus, sowie die Beseitigung von Abfällen. So haben Mängel in Plazentaentwicklung wichtige Konsequenzen für den Fötus und Mutter, und sind eine der Hauptursachen für embryonale Letalität. Der wesentliche Zelltyp des fetalen Teils der Plazenta ist die Trophoblasten. Primäre Maus plazentalen Trophoblastenzellen sind ein nützliches Werkzeug für die Untersuchung normalen und abnormalen Plazentaentwicklung, und anders als Zelllinien, können isoliert und verwendet werden, um Trophoblasten in spezifischen Stadien der Schwangerschaft zu studieren. Zusätzlich kann Primärkulturen von Trophoblasten aus transgenen Mäusen verwendet, um die Rolle von bestimmter Gene in Plazenta-Zellen zu studieren. Die hier vorgestellten Protokoll basiert auf der Beschreibung von Thordarson et al. 1, bei dem eine Percoll Gradienten verwendet werden, um ein relativ reines Trophoblasten Zellpopulation aus isolierten Maus Plazenten erhalten wird. Es ist ähnlich wie die weiter verbreitet verwendetd Methoden für menschliche Trophoblasten Zellisolation 2-3. Reinheit kann durch immuncytochemische Anfärben der isolierten Zellen für Cytokeratin 7 4 bewertet werden. Hier werden die isolierten Zellen dann unter Verwendung eines Assays, um Matrigel Invasion Trophoblasten Invasivität in vitro 5-6 beurteilen. Die befallenen Zellen werden durch Immunzytochemie und gebeizt zum Zählen analysiert.
Protokoll
Ein. Dissection der Maus Plazenta
- Richten Sie Fügepaaren von Mäusen.
- An jedem der folgenden Tage, für die Anwesenheit eines copulator Stecker überprüfen. Der Tag, an dem ein Stecker erkannt wird als 0,5 Tage post-coitus (DPC) 7.
- Plazenten können zu einem gewünschten Stadium der Schwangerschaft gesammelt werden, mit einem sauberen Dissektion der Plazenta möglichen Beginn mit der Entwicklung des reifen Plazenta auf d 10.5. Hier zeigen wir, 14,5 dpc. Bei den angegebenen Laufwerken wird 40-60 Plazenten auf 10,5 dpc und 10-20 Plazenten auf 14,5 dpc ergeben eine deutlich sichtbare Trophoblasten Zellschicht.
- Euthanize die schwangere Maus, und entfernen Sie die Gebärmutter, Schneiden an der Zervix, und entlang der mesometrium.
- Mit einer scharfen Schere zwischen jedem conceptus (Abbildung 1A) geschnitten.
- Mit zwei Paar Zangen, fassen Sie die Gebärmutterwand an der Schnittkante und auseinanderziehen, das Entfernen des Myometrium (Abbildung 1B) . Ein Paar gezackte, mäßig fein (gebogen oder gerade) Pinzette plus ein Paar sehr feinen Pinzette (# 5, zum Beispiel) wird empfohlen.
- Gegenüber der Plazenta, öffnen Sie das decidua mit einer Pinzette oder Schere, Aussetzen Plazenta. Greifen Gebärmuttergewebe mit einer Pinzette Paar, schieben weitere Pinzette unterhalb der Plazenta zu trennen (Abbildung 1C). Falls erforderlich, separate Fötus und fetalen Membranen aus Plazenta. Es ist nicht möglich, alle dezidualen Gewebe durch Dissektion ohne auch verlieren Plazentagewebe entfernen, aber zusätzliche dezidualen Gewebe (blass) können von der Oberfläche der Plazenta durch leichtes Ablösen mit einer Pinzette entfernt werden. Wir werden auf der Percoll-Gradienten zur weiteren Reinigung angewiesen.
- Platzieren Sie jede seziert Plazenta in 25 ml eiskaltem Dissoziationspuffer in einem 50 ml konischen Röhrchen, bis alle Sektionen vollständig sind. In späteren Stadien, grob zerkleinern Plazentagewebe mit einer Schere oder Rasierklinge, bevor sie in Dissoziationspuffer übertragen.
- Locker cap konischen Rohr und in einem 37 ° C Bad für 45-60 Minuten. Mischen Sie die Dissoziation Lösung kräftig durch Pipettieren ca. alle 10 min. Die gesamte Dauer der Verdauung sollten engmaschig überwacht werden und wird wahrscheinlich verlangen einige trial and error, um eine optimale Erholung der Zellen zu erreichen. Gewebe sind in der Lage, durch einen 10 ml-Pipette übergeben werden, aber sichtbar Gewebestücke bleibt. Overdigestion wird in armen Zellüberleben und Platierungseffizienz führen. Optimal Zellüberleben und Platierungseffizienz wird auftreten, wenn Klumpen von wenigen Zellen vorhanden sind, anstatt wenn vollständige Dissoziation erreicht. Umgekehrt wird underdigestion reduziert Reinheit nach Percoll Trennung führen. Wenn die richtige Verdauung Punkt erreicht ist, an Ort Röhrchen auf Eis zu stoppen Kollagenase-Aktivität.
- Übergeben Sie die Lösung durch eine Zelle Sieb, um unverdaute Materialien zu entfernen, und zentrifugieren @ 500 xg für 5 Minuten.
- Zu waschen, zu entfernenÜberstand und resuspendieren Zellen in 10 ml Waschlösung. Zentrifuge @ 500 xg für 5 Minuten.
- Während der Zentrifugation, bereiten Percoll Lösung durch Mischen 9,6 ml Percoll, 13,4 ml Waschlösung und 1,1 ml 10x Medium 199 in einem 50-ml-Röhrchen für geeignete Hochgeschwindigkeitszentrifugation.
- Überstand entfernen und Zellpellet in 2 ml Waschlösung.
- Hinzufügen von Zellen zur Lösung Percoll und zentrifugieren @ 30.000 xg für 30 Minuten bei 4 ° C.
- Röhrchen aus Zentrifuge, ohne die Steigung. Um den Gradienten, Platz Rohr vor einer hellen Lichtquelle zu visualisieren. Suchen Sie den Trophoblasten Band (Abbildung 2), und saugen mit einer Pipette, kümmert sich nicht um die roten Blutkörperchen Band unterhalb stören. Volume des Trophoblasten Band 5-8 ml betragen.
- Übertragen Trophoblastenzellen mit einem 50 ml konischen Röhrchen. Hinzufügen Waschlösung auf ein Gesamtvolumen von 45ml.
- Zentrifuge @ 500 xg für 5 Minuten. Überstand entfernen, und resuspendieren in Kultur medium (NCTC-135). Zellen können auf dünnschichtigen Matrigel oder Gewebekultur-Plastik bei 37 ° C und 5% CO 2 kultiviert werden. Am Tag 10,5 ergibt jeweils Plazenta rund 50.000 lebenden Zellen, von denen 80-90% Cytokeratin positive sind.
3. Trophoblastinvasion Assay
- 1-2 ml Kulturmedium (NCTC-135) zu jedem Matrigel Kammer und bei 37 °, 5% CO 2 für 30-90 min.
- Entfernen Medium und 1,5 ml x 10 5 frisch isolierten Zellen in 2ml mittleren bis oberen Kammer. 1 ml Medium unteren Kammer unteren Membran bedecken.
- Kultur Zellen in Einsätze für 18-24 Stunden.
- Scrape Zellen und Matrigel aus dem Einsatz mit einem Schaum-Tupfer.
- Spülen der Oberseite und der Unterseite der Kammer in 2 ml PBS.
- Fix für 5 min in 1 ml 4% Paraformaldehyd in PBS.
- Stain, indem untere Kammer mit 400 ul DAPI (300nm) und Inkubation für 30 min.
- Dreimal kurz in PBS.
- entfernen Membranen aus Einsätzen mit einem scharfen Skalpell.
- Fügen Sie einen 10 ul Tropfen Eindeckmedium (50% Glycerin in PBS) zu rutschen. Mit einer Pinzette, lag Membran auf Drop. Hinzufügen 10 ul Tropfen des Mediums, dann vorsichtig Deckglas.
- Photograph und Anzahl Zellen. Seien Sie sicher zu orientieren die Membran entsprechend (Zell-Seite nach oben oder Zell-Seite nach unten) für das Mikroskop verwendet wird. Image J Software (National Institutes of Health) eine manuelle Zählung Funktion, die für diesen Zweck verwendet werden können, ebenso wie Adobe Photoshop oder einem manuellen Zähler.
4. Repräsentative Ergebnisse
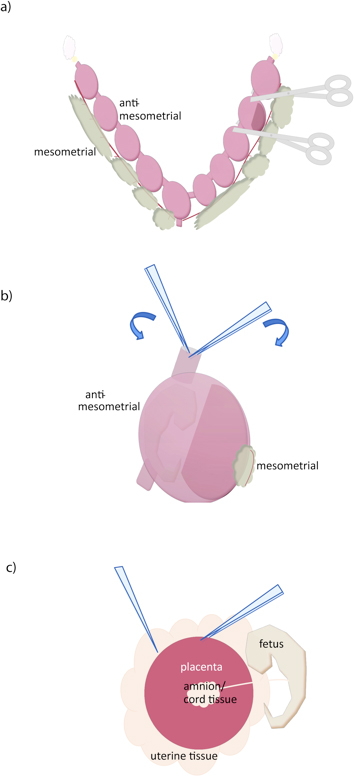
Abbildung 1. Dissection der Maus Plazenta. (A) Der Uterus wird durch Schneiden entlang den Eileiter (gelb), entlang der Oberfläche mesometrial entfernt und an der Zervix (unten). Individuelle conceptuses kann dann durch Schneiden mit einer Schere getrennt dargestellt werden. (B) Der Uterus Wand durch Anordnen zweier Pinzetten im Schnitt uterinen Oberfläche und Reißen entlang der Anti-mesometrial Seite, in der Nähe des Fötus und weg von der Plazenta entnommen. (C) Die Plazenta wird dann durch Greifen mit einer Zange und einem anderen zwischen der gleitenden Plazenta und Gebärmuttergewebe isoliert. Nabelschnur und anderen extraembryonalen Membranen können dann aus der Plazenta abgetrennt werden.

Abbildung 2. Percoll Trennung von Trophoblastzellen. Nach dem Zentrifugieren wird drei großen Bands zu sehen sein, wie in der Karikatur auf der linken Seite gezeigt, und fotografieren rechts. Die obere Bande enthält Zelltrümmern und Fibroblasten und erst am deutlichsten. Eine enge (rot) Band nahe der Unterseite mit roten Blutkörperchen sichtbar sein wird knapp unterhalb der diffuse Trophoblasten Band. Zellaggregate wird wahrscheinlich in den Trophoblasten Band gesehen, wie in den beiden direkt links des Pfeils auf dem Foto gezeigt.
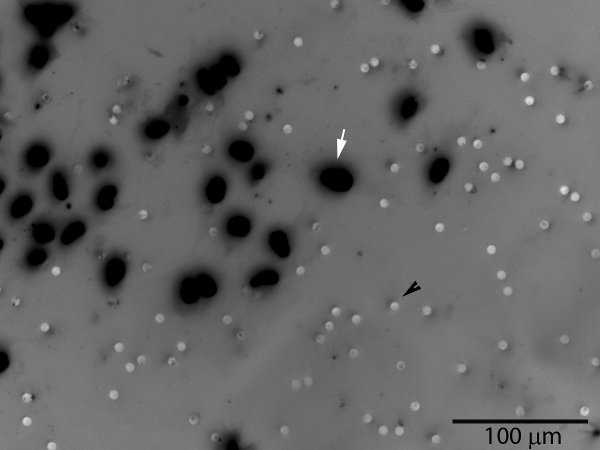
Abbildung 3. Invasive Trophoblastenzellen (weißer Pfeil) wird durch die Schicht und den Matrigel-Membran Poren passieren, die auf der unteren Oberfläche der Membran. Die Poren sind sichtbar (schwarz Pfeilspitze). Die Anzahl der Zellen auf der gesamten Membranoberfläche oder einer repräsentativen Bereich gezählt werden. Ein Graustufenbild fluoreszierender DAPI Kernfärbung wurde umgedreht, um Visualisierung von Zellen zu verbessern.

Abbildung 4. Trophoblastzellen können identifiziert werden, und die Reinheit des isolierten Population beurteilt, durch Immunfärbung für Cytokeratin 7 (Mitte, Magenta). Die Zellen werden mit DAPI (oben, blau) gegengefärbt. Zusammengefügte Bild, unten.
Diskussion
In diesem Video zeigen wir die Isolierung von Trophoblastzellen aus der Maus Plazenta. Wir zeigen dann eine in vitro-Assay für Trophoblastinvasion. Mit diesem Verfahren wird eine weitgehend, aber nicht vollständig, können reine Population von Trophoblasten Zellen gewonnen werden. Wenn weitere Reinheit erforderlich ist, könnte Magnetkügelchen Trennung oder Durchflusszytometrie durchgeführt werden, wie es für primäre humane Trophoblastenzellen beschrieben worden. Die richtige Länge der Kollagenase Dissoziationsschritt müssen bei jedem Experiment bestimmt werden, und wird mit Erfahrung gelernt werden. Over-Verdauung wird stark reduziert Erholung der Zellen, während unter-Verdauung zu reduzierten Reinheit, sowie reduzierte Zahlen führen kann. Obwohl wir die Verwendung von kommerziell hergestellten Matrigel Invasion Kammern zeigen, können sie auch durch Zugabe von Matrigel unbeschichteten Transwell Kammern auf der gewünschten Dicke hergestellt werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten die Creative Services Team an der University of Missouri Academic Support Center, die dieses Video produziert danken. Diese Arbeit wurde von der Eunice Kennedy Shriver National Institute of Child Health & Human Development des National Institutes of Health, Grantnummer HD055231 unterstützt
Materialien
Specific reagents and equipment:
Wash Solution (filter sterilize after mixing)
| Name | Company | Catalog Number | Comments |
| Reagent | Amount | Final concentration | |
| 10x Medium 199 | 50ml | 1X | |
| Hepes | 2.383 g | 0.02M | |
| sodium bicarbonate | 0.42 g | 0.01M | |
| Penicllin-Streptomycin | 5 mL | 100 U- 100 μg /ml | |
| Sterile dH20 | to 500 mL |
Dissociation solution (make fresh and filter sterilize)
| Reagent | Amount | Final concentration |
| Wash Solution | 100 mL | |
| DNase | 1 vial (2000 U) | 20 U/mL |
| Collagenase | 100 mg | 125 digestion units/mL |
| Name of the reagent | Company | Catalogue number | Comments |
| Collagenase | Sigma | C9891 | This is Clostridium collagenase. Bovine pancreatic collagenase would likely work as well |
| NCTC-135 | Sigma | D4263 | Add FBS to 10% |
| Matrigel invasion chambers | BD Biosciences | 354481 | |
| 10x Medium 199 | Sigma | M9163 | |
| Penicillin-Streptomycin | Invitrogen | 15140 | |
| DNase | Sigma | D4263 | |
| 100 μm Cell strainer | Fisher | 22363549 | |
| Antibody to cytokeratin 7 | DAKO | M7018 | Used at 1:100 dilution |
Equipment
Standard cell culture equipment including a CO2 incubator is required. In addition, a centrifuge rotor capable of spinning 50 ml tubes at 30,000 x g is needed. Note that this exceeds the maximum speed of most conical centrifuge tubes and will likely require an Oak Ridge style tube.
Referenzen
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten