Method Article
マウスの主栄養膜細胞と絨毛浸潤アッセイの分離
要約
このプロトコルでは、パーコール勾配を用いた栄養膜細胞の分離に続いて妊娠d10.5、上のマウスから胎盤の解剖について説明します。次に、マトリゲル浸潤アッセイで単離された細胞の使用例を示します。
要約
胎盤は、胎児への栄養、ガスや成長因子の輸送だけでなく、廃棄物の除去を担当しています。したがって、胎盤発育における欠陥は胎児と母親のための重要な結果を持っており、胚性致死の主な原因です。胎盤の胎児部分の主要な細胞型は栄養です。初代マウス胎盤栄養膜細胞は、正常および異常な胎盤の発達を研究するための有用なツールであり、細胞株とは異なり、単離され、妊娠の特定の段階で栄養を研究するために使用することができる。また、トランスジェニックマウスからの栄養膜細胞の初代培養を胎盤細胞中の特定の遺伝子の役割を研究するために用いることができる。ここで紹介するプロトコルはThordarson らの説明に基づいています。パーコール勾配が単離したマウスの胎盤から比較的純粋な栄養膜細胞集団を得るために使用されている1。それは、より広く使用するために類似しています人間の栄養膜細胞単離2-3 dの方法。純度は、サイトケラチン7 4の単離された細胞の免疫細胞化学的染色によって評価することができる。ここでは、単離された細胞は、その後、 体外 5-6 に栄養膜侵襲性を評価するために、マトリゲル浸潤アッセイを用いて分析する。浸潤細胞をカウントするための免疫細胞化学及び染色によって分析される。
プロトコル
1。マウス胎盤の解剖
- マウスの交配のペアを設定します。
- 次の日のそれぞれで、膣栓の有無をチェックする。プラグインが検出された日は0.5日後に性交(DPC)7とみなされます。
- 胎盤は、d 10.5成熟胎盤の発達と胎盤可能初めのクリーン郭清を、妊娠の所望の段階で収集することができる。ここでは、14.5 DPCを実証している。指定されたボリュームで、10.5 DPCに40から60胎盤、および14.5 DPCに10から20胎盤がはっきり見える栄養膜細胞層が得られます。
- 妊娠マウスを安楽死させると、子宮を取り出し、子宮頸部で、かつ子宮間膜に沿って切断する。
- 各受胎産物( 図1A)との間で切断鋭いはさみを使用して。
- 鉗子の2ペアを使用して、カットエッジで子宮壁をつかみ、引き離し、( 図1B)子宮筋層を除去 。ワンペア鋸歯、(湾曲またはストレート)適度に細かい鉗子プラス1対の非常に細かい鉗子(#5、例えば)を推奨します。
- 胎盤向かい、胎盤を露出して、鉗子またはハサミで脱落を開きます。 1鉗子ペアで子宮組織を把持すると、分離するために胎盤( 図1C)の下に別の鉗子をスライドさせます。胎盤から、必要に応じて独立した胎児と胎膜場合。また、胎盤組織を失うことなく、切開によってすべて脱落膜組織を削除することはできませんが、追加の脱落膜組織は、(青白い)そっとピンセットで剥離することにより、胎盤の表面から除去することができる。我々は、さらに精製するためのパーコール勾配に依存するようになります。
- すべての解剖が完了するまで、50 mlコニカルチューブに25 mlの氷冷解離バッファ内の各解剖胎盤を置きます。後の段階で、粗く解離バッファに転送する前にハサミやカミソリの刃で胎盤組織をミンチ。
- 45〜60分間37℃の水浴中で緩くキャップコニカルチューブおよび場所。約10分毎にピペッティングすることにより積極的に解離液を混ぜる。合計消化時間は密接に監視されるべきであると可能性が高いいくつかの試行錯誤が最適な細胞の回復を達成するために必要になります。組織は、10mlのピペットを通過することができるべきであるが、組織の目に見える部分が残ったままになります。過剰消化が悪く、細胞の生存やめっき効率になります。少数の細胞の塊が存在するときに最適な細胞の生存および平板効率はむしろ完全な解離が達成されたときよりも、発生します。逆に、underdigestionはパーコール分離後純度減少につながる。適切な消化のポイントに達した場合には、コラゲナーゼ活性を停止するためにチューブを氷上に置きます。
- 消化されていない物質を除去するために細胞ストレーナーを通してソリューションを渡すと、5分間@ 500×gで遠心する。
- 洗浄するには、削除10mlの洗浄溶液の上清と細胞を懸濁。 5分間@ 500×gで遠心します。
- 遠心分離の間に、9.6ミリリットルパーコール、13.4ミリリットルの洗浄液と高速遠心分離に適した50mlチューブで1.1ミリリットル10倍培地199を混合することにより、パーコール溶液を調製します。
- 2 mLの洗浄液に上澄みを再懸濁し、細胞ペレットを取り外します。
- 4℃で30分間溶液と遠心@3万XGをパーコールにセルを追加℃に
- 勾配を乱すことなく、遠心分離器からチューブを取り外します。明るい光源の前に勾配、場所の管を可視化する。トロホブラストバンド( 図2)を見つけて、下の赤血球バンドを動かさないように注意しながら、ピペットで吸引します。栄養バンドの音量は5-8 mlとなります。
- 50mlコニカルチューブに栄養膜細胞を転送します。 45ミリリットルの全体積に対するソリューションを洗う追加。
- 5分間@ 500×gで遠心します。上清を除去し、培養メディに再懸濁し、(NCTC-135)ええと。細胞を37℃、5%CO 2で薄層マトリゲルまたは組織培養プラスチック上で培養することができます。 10.5日で、各胎盤は80〜90%が肯定しているケラチンの約50,000生きた細胞を、もたらします。
3。栄養膜浸潤アッセイ
- 37℃、5%30から90分間、CO 2で各マトリゲル室とインキュベートに1-2 mlの培地(NCTC-135)を追加します。
- 培地を除去し、上部チャンバーに2ミリリットル中に1.5ミリリットル×10 5新たに単離した細胞を追加します。低いメンブレン表面を覆うのに、下部チャンバーに1 mlの培地を追加します。
- 18〜24時間用のインサートで培養細胞。
- スポンジ綿棒を使ってインサートからの細胞とマトリゲルをこすり取る。
- 2mlのPBSでチャンバの上部と下部をすすぐ。
- PBS中で1ミリリットルを4%パラホルムアルデヒドで5分間固定してください。
- 400μlのDAPI(300nm以下)と下部チャンバーを充填することによって染色し、30分間インキュベートします。
- PBS中で簡潔に3回洗浄する。
- は鋭いメスの刃のインサートからの膜を取り除きます。
- スライドさせて取り付け培地(PBS中50%グリセロール)10μlのドロップを追加します。ピンセットを使って、ドロップ上の膜に横たわっていた。媒体の別の10μlのドロップを追加してから、慎重にカバースリップ。
- 写真とカウント細胞。使用されている顕微鏡の適切東洋メンブレン(ダウンセルサイドアップまたはセル·サイド)に確認してください。画像Jソフトウェア(国立衛生研究所)、Adobe Photoshopまたは手動のカウンターができるように、この目的のために使用することができる手動計数機能を備えています。
4。代表的な結果
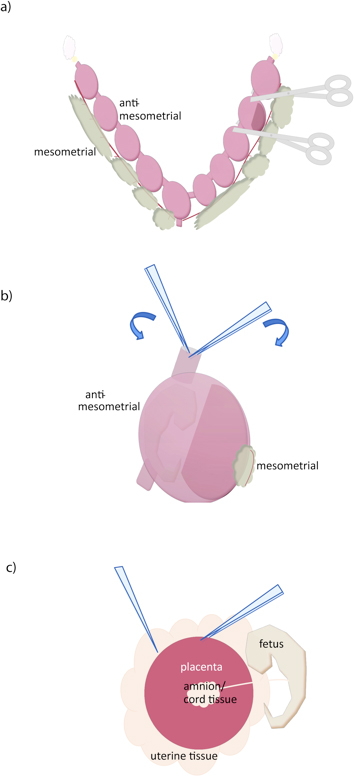
図1マウスの胎盤の解剖。 (a)は、子宮はmesometrial表面に沿って、子宮頸部(下)で、卵管(黄色)に沿って切断することにより除去される。個々の受胎は、次に示すように、ハサミで切断することによって分離することができる。 (b)の子宮壁はカット子宮の表面に2鉗子を置き、胎児近く離れて胎盤から、抗mesometrial側面に沿って引き裂くことによって除去される。 (c)の胎盤は、その後、鉗子で把持し、胎盤と子宮の組織との間に別のものをスライドさせて分離されています。臍帯および他の胚体外膜は、その後胎盤から分離することができる。

図2:栄養膜細胞のパーコール分離。左の漫画に示すように、遠心分離した後、三大バンドが見えるようになりますと、右の写真。上部のバンドは、細胞破片および繊維芽細胞が含まれており、最も明らかになるであろう。赤血球を含む下部付近タイト(赤)バンドはちょうどびまん性栄養膜バンドの下に表示されます。ちょうど写真の矢印の左側に示すように2のように、細胞凝集塊は、おそらく、栄養膜帯で見られるでしょう。
図3侵襲栄養膜細胞(白矢印)は、膜の底面に現れる、マトリゲル層と膜孔を通過することになる。毛穴(黒矢印)も表示されます。全体の膜表面または代表試料領域のセルの数をカウントすることができる。蛍光DAPIで核染色のグレースケール画像は、細胞の可視化を向上させるために反転されました。

図4:栄養膜細胞が同定され、単離された集団の純度はサイトケラチン7(センター、マゼンタ)の免疫染色により、評価することができる。細胞はDAPI(上、青)で対比されています。マージされた画像、下部。
ディスカッション
このビデオでは、マウスの胎盤から栄養膜細胞の単離を示しています。次に、栄養膜侵入のためのin vitroアッセイを示しています。この手順を用いて、主にではなく、完全に、栄養膜細胞の純粋な集団を得ることができる。さらに純度が要求されている場合は、一次ヒト栄養膜細胞のために記載されているように、磁性ビーズ分離またはフローサイトメトリーは、実行することができる。コラゲナーゼ解離工程の適切な長さは、それぞれの実験で決定されなければならない、と経験で学習されます。アンダー消化が減少純度ならびに削減数値につながる可能性があり、一方過剰消化が厳しく、細胞の回復を減らすことができます。我々は商業的に調製マトリゲル浸潤チャンバーの使用を示しているが、彼らはまた、所望の厚さでコーティングされていないトランスウェルチャンバーにマトリゲルを添加することにより調製することができる。
開示事項
我々は、開示することは何もない。
謝辞
著者らは、このビデオを制作し、ミズーリ大学学術支援センターでクリエイティブサービスチームに感謝したいと思います。この作品は、国立衛生研究所の母子保健と人間開発のユニスケネディシュライバー国立研究所、助成番号HD055231によってサポートされていました
資料
Specific reagents and equipment:
Wash Solution (filter sterilize after mixing)
| Name | Company | Catalog Number | Comments |
| Reagent | Amount | Final concentration | |
| 10x Medium 199 | 50ml | 1X | |
| Hepes | 2.383 g | 0.02M | |
| sodium bicarbonate | 0.42 g | 0.01M | |
| Penicllin-Streptomycin | 5 mL | 100 U- 100 μg /ml | |
| Sterile dH20 | to 500 mL |
Dissociation solution (make fresh and filter sterilize)
| Reagent | Amount | Final concentration |
| Wash Solution | 100 mL | |
| DNase | 1 vial (2000 U) | 20 U/mL |
| Collagenase | 100 mg | 125 digestion units/mL |
| Name of the reagent | Company | Catalogue number | Comments |
| Collagenase | Sigma | C9891 | This is Clostridium collagenase. Bovine pancreatic collagenase would likely work as well |
| NCTC-135 | Sigma | D4263 | Add FBS to 10% |
| Matrigel invasion chambers | BD Biosciences | 354481 | |
| 10x Medium 199 | Sigma | M9163 | |
| Penicillin-Streptomycin | Invitrogen | 15140 | |
| DNase | Sigma | D4263 | |
| 100 μm Cell strainer | Fisher | 22363549 | |
| Antibody to cytokeratin 7 | DAKO | M7018 | Used at 1:100 dilution |
Equipment
Standard cell culture equipment including a CO2 incubator is required. In addition, a centrifuge rotor capable of spinning 50 ml tubes at 30,000 x g is needed. Note that this exceeds the maximum speed of most conical centrifuge tubes and will likely require an Oak Ridge style tube.
参考文献
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved