Method Article
Isolamento di cellule primarie trofoblasto mouse e Invasion Assay trofoblasto
In questo articolo
Riepilogo
In questo protocollo, si descrive la dissezione placentae dal mouse sulla gravidanza D10.5, seguito da isolamento di cellule trofoblastiche mediante gradiente di Percoll. Abbiamo poi dimostrare l'utilizzo delle cellule isolate in un saggio di invasione Matrigel.
Abstract
La placenta è responsabile per il trasporto di sostanze nutritive, gas e fattori di crescita per il feto, nonché l'eliminazione dei rifiuti. Così, difetti di sviluppo della placenta hanno importanti conseguenze per il feto e la madre, e sono una delle principali cause di mortalità embrionale. Il tipo cellulare principale della porzione fetale della placenta è trofoblasto. Primarie trofoblasti placentari topo sono un utile strumento per studiare normale e anormale sviluppo placentare, ea differenza linee cellulari, possono essere isolati e utilizzati per studiare trofoblasto in determinate fasi della gravidanza. Inoltre, colture primarie di trofoblasto di topi transgenici possono essere utilizzati per studiare il ruolo di particolari geni in cellule placentari. Il protocollo qui presentato è basato sulla descrizione da Thordarson et al. 1, in cui viene utilizzato un gradiente Percoll per ottenere una popolazione di cellule relativamente puro trofoblasto da placente mouse isolato. È simile a utilizzare il più ampiamentemetodi per l'uomo d 2-3 isolamento cellulare trofoblasto. Purezza può essere valutata mediante colorazione immunocitochimica delle cellule isolate per citocheratina 7 4. Qui, le cellule isolate vengono quindi analizzati utilizzando un saggio di invasione matrigel a valutare invasività trofoblasto in vitro 5-6. Le cellule invase vengono analizzati mediante immunocitochimica e tinto per il conteggio.
Protocollo
1. Dissezione della placenta del mouse
- Impostare coppie di accoppiamento di topi.
- In ciascuno dei giorni seguenti, verificare la presenza di una spina copulatore. Il giorno in cui viene rilevato un tappo è considerato 0,5 giorni post-coito (DPC) 7.
- Placente possono essere raccolte nella fase desiderata della gravidanza, con una dissezione pulita dell'inizio placenta possibile con lo sviluppo della placenta maturo d 10,5. In questo studio dimostriamo 14,5 dpc. Ai volumi dati, 40-60 placente da 10,5 dpc, e 10-20 su placente 14,5 dpc produrrà un ben visibile strato di cellule del trofoblasto.
- Eutanasia il mouse in stato di gravidanza, e togliere l'utero, il taglio al collo dell'utero, e lungo il mesometrium.
- Utilizzo di forbici affilate, tagliate tra ogni concepimento (Figura 1A).
- Utilizzando due coppie di pinze, afferrare la parete uterina al bordo di taglio, e separare, rimuovendo il miometrio (Figura 1B) . Un paio seghettato, pinze moderatamente fini (curvo o diritto) più una coppia pinza molto fini (# 5, per esempio) è raccomandato.
- Di fronte la placenta, aprire la decidua con pinze o forbici, esponendo placenta. Cogliere tessuto uterino con una coppia pinze, far scorrere un altro pinza sotto la placenta per separare (Figura 1C). Se necessario, il feto separato e membrane fetali di placenta. Non è possibile rimuovere tutti i tessuti decidual da dissezione anche senza perdere tessuto placentare, ma ulteriore tessuto decidual (pale) può essere rimosso dalla superficie della placenta peeling delicatamente con una pinza. Contiamo sul gradiente Percoll per ulteriore purificazione.
- Mettete ogni placenta sezionato in 25 ml di tampone di ghiaccio freddo dissociazione in una provetta da 50 ml fino a quando tutte le dissezioni sono completi. Nelle fasi successive, tritare grossolanamente tessuto placentare con le forbici o lama di rasoio prima del trasferimento nel buffer di dissociazione.
- Liberamente provetta con tappo conico e posto in un bagno a 37 ° C per 45-60 minuti. Miscelare la soluzione dissociazione vigorosamente pipettando circa ogni 10 min. Il tempo di digestione totale dovrebbe essere attentamente monitorati e probabilmente richiederà un po 'di tentativi ed errori per ottenere un recupero ottimale delle cellule. Tessuti dovrebbe essere in grado di essere fatto passare attraverso una pipetta 10 ml, ma visibili pezzi di tessuto rimarranno. Overdigestion si tradurrà in scarsa sopravvivenza delle cellule e l'efficienza placcatura. Sopravvivenza cellulare ottimale e l'efficienza placcatura si verifica quando grumi di poche cellule sono presenti, piuttosto che quando completa dissociazione è raggiunto. Al contrario, underdigestion porterà a purezza ridotta in seguito alla separazione Percoll. Quando il punto di digestione è stato raggiunto, il tubo posto in ghiaccio per fermare le attività collagenasi.
- Filtrare la soluzione attraverso un colino cellula per rimuovere i materiali non digeriti, e centrifugare a 500 xg per 5 minuti.
- Per il lavaggio, rimuoverecellule surnatante e risospendere in 10 ml di soluzione di lavaggio. Centrifugare a 500 xg per 5 minuti.
- Durante la centrifugazione, preparare la soluzione di Percoll miscelando 9,6 ml di Percoll, 13,4 ml di soluzione di lavaggio e di 1,1 ml di mezzo 10x 199 in un tubo da 50 ml appropriato per centrifugazione ad alta velocità.
- Rimuovere il surnatante e risospendere il pellet di cellule in 2 ml di soluzione di lavaggio.
- Aggiungere celle Percoll soluzione e centrifugare @ 30.000 xg per 30 minuti a 4 ° C.
- Rimuovere il tubo da centrifuga senza disturbare il gradiente. Per visualizzare il, tubo posto gradiente di fronte a una fonte di luce intensa. Individuare la banda trofoblasto (Figura 2), e aspirare con una pipetta, facendo attenzione a non disturbare la banda rossa globuli sotto. Volume della band trofoblasto sarà 5-8 ml.
- Trasferimento cellule del trofoblasto in una provetta da 50 ml. Aggiungere la soluzione di lavaggio per un volume totale di 45 ml.
- Centrifugare a 500 xg per 5 minuti. Rimuovere il surnatante e risospendere nella cultura medium (NCTC-135). Cellule possono essere coltivate su strato sottile o matrigel coltura tissutale di plastica a 37 ° C e 5% di CO 2. Al giorno 10.5, ogni placenta produce circa 50.000 cellule vive, di cui il 80-90% sono citocheratina positivi.
3. Trofoblasto invasione Assay
- Aggiungere 1-2 ml di terreno di coltura (NCTC-135) a ciascuna camera di matrigel e incubare a 37 °, 5% CO2 per 30-90 min.
- Estrarre il supporto e aggiungere 1,5 ml x 10 5 cellule isolate di fresco in mezzo 2ml di camera superiore. Aggiungere 1 ml di mezzo di camera inferiore per coprire superficie della membrana inferiore.
- Cellule in coltura per 18-24 ore inserti.
- Cellule raschiare e Matrigel da l'inserto utilizzando un tampone di schiuma.
- Risciacquare parte superiore e inferiore della camera in 2 ml di PBS.
- Fix per 5 min in 1 ml di paraformaldeide 4% in PBS.
- Stain compilando Camera bassa con 400 microlitri DAPI (300 nM) e incubare per 30 min.
- Lavare tre volte brevemente in PBS.
- Rimuovi membrane da inserti con una lama affilata bisturi.
- Aggiungere una goccia 10 ml di mezzo di montaggio (50% glicerolo in PBS) a scivolare. Utilizzando pinze, laici membrana su goccia. Aggiungi un'altra goccia 10 ml di mezzo, quindi coprioggetti con attenzione.
- Fotografie e il numero di cellule. Accertarsi di orientare la membrana in modo appropriato (cellulare rivolta verso l'alto o cellulare rivolto verso il basso) per il microscopio utilizzato. Software Image J (National Institutes of Health) include una funzione di conteggio manuale che può essere utilizzato per questo scopo, come può Adobe Photoshop o un contatore manuale.
4. Risultati rappresentativi
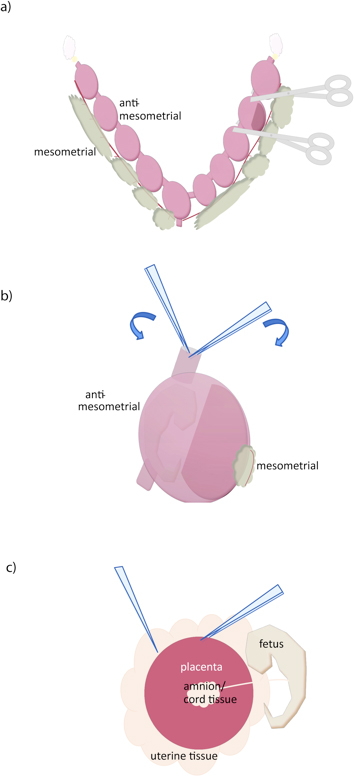
Figura 1. Dissezione della placenta mouse. (A) L'utero viene rimosso tagliando lungo le ovidotti (giallo), lungo la superficie mesometrial, e nella cervice (in basso). Conceptuses individuali possono essere separati mediante taglio con le forbici come mostrato. (B) Il uterina parete viene rimossa inserendo due pinze nella superficie di taglio uterina, e strappando lungo l'anti-mesometrial lato, vicino al feto e dalla placenta. (C) La placenta viene poi isolato afferrando con una pinza e scorrevole altro tra la placenta e tessuto uterino. Cordone ombelicale e altre membrane extraembrionali può quindi essere separata dalla placenta.

Figura 2. Percoll separazione di cellule trofoblastiche. Dopo la centrifugazione, tre fasce principali sarà visibile, come mostrato nella vignetta a sinistra, e la fotografia a destra. La fascia superiore contiene residui cellulari e fibroblasti e sarà più evidente. A stretto (rossa) banda in prossimità del fondo contenente globuli rossi sarà visibile appena sotto la fascia trofoblasto diffuso. Aggregati cellulari probabilmente visto nella banda trofoblasto, come mostrato nelle due appena a sinistra della freccia nella fotografia.
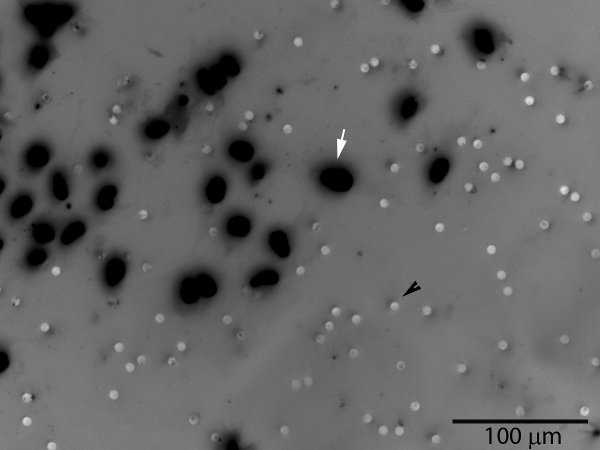
Figura 3. Trofoblasti invasive (freccia bianca) passerà attraverso lo strato di matrigel e dei pori della membrana, che appare sulla superficie inferiore della membrana. I pori sono visibili anche (nero punta di freccia). Il numero di cellule sulla superficie della membrana intera o una zona campione rappresentativo può essere contato. Una scala di grigi di colorazione fluorescente DAPI nucleare è stato invertito per migliorare la visualizzazione delle cellule.

Cellule del trofoblasto Figura 4. Possono essere identificati, e la purezza della popolazione isolata valutato, mediante immunocolorazione per la citocheratina 7 (centro, magenta). Cellule sono colorate con DAPI (alto, blu). Uniti immagine, in basso.
Discussione
In questo video, dimostriamo l'isolamento di cellule del trofoblasto della placenta mouse. Abbiamo poi mostrano un saggio in vitro per l'invasione del trofoblasto. Utilizzando questa procedura, una gran parte, ma non completamente, popolazione pura di cellule trofoblastiche può essere ottenuta. Se la purezza è necessario un ulteriore, separazione magnetica tallone o citometria di flusso potrebbe essere eseguita, come è stato descritto per primarie cellule trofoblastiche umane. La corretta lunghezza del passo collagenasi dissociazione deve essere determinata con ogni esperimento, e sarà appreso con esperienza. Over-digestione ridurrà drasticamente il recupero delle cellule, mentre sotto-digestione può portare a purezza ridotta, così come i numeri ridotti. Sebbene ci mostrano l'uso di preparati commercialmente camere invasione del Matrigel, essi possono anche essere preparato aggiungendo matrigel a non rivestiti camere transwell allo spessore desiderato.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare il team Creative Services presso l'Università del Missouri Centro di supporto accademico che ha prodotto questo video. Questo lavoro è stato sostenuto dal Kennedy Eunice Shriver National Institute of Child Development & Salute umana del National Institutes of Health, un numero di concessione HD055231
Materiali
Specific reagents and equipment:
Wash Solution (filter sterilize after mixing)
| Name | Company | Catalog Number | Comments |
| Reagent | Amount | Final concentration | |
| 10x Medium 199 | 50ml | 1X | |
| Hepes | 2.383 g | 0.02M | |
| sodium bicarbonate | 0.42 g | 0.01M | |
| Penicllin-Streptomycin | 5 mL | 100 U- 100 μg /ml | |
| Sterile dH20 | to 500 mL |
Dissociation solution (make fresh and filter sterilize)
| Reagent | Amount | Final concentration |
| Wash Solution | 100 mL | |
| DNase | 1 vial (2000 U) | 20 U/mL |
| Collagenase | 100 mg | 125 digestion units/mL |
| Name of the reagent | Company | Catalogue number | Comments |
| Collagenase | Sigma | C9891 | This is Clostridium collagenase. Bovine pancreatic collagenase would likely work as well |
| NCTC-135 | Sigma | D4263 | Add FBS to 10% |
| Matrigel invasion chambers | BD Biosciences | 354481 | |
| 10x Medium 199 | Sigma | M9163 | |
| Penicillin-Streptomycin | Invitrogen | 15140 | |
| DNase | Sigma | D4263 | |
| 100 μm Cell strainer | Fisher | 22363549 | |
| Antibody to cytokeratin 7 | DAKO | M7018 | Used at 1:100 dilution |
Equipment
Standard cell culture equipment including a CO2 incubator is required. In addition, a centrifuge rotor capable of spinning 50 ml tubes at 30,000 x g is needed. Note that this exceeds the maximum speed of most conical centrifuge tubes and will likely require an Oak Ridge style tube.
Riferimenti
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon