Method Article
בידוד של תאים ראשוניים עכבר Trophoblast וAssay הפלישה Trophoblast
In This Article
Summary
בפרוטוקול זה, אנו מתארים את הנתיחה של placentae מהעכבר על ההריון d10.5, ואחרי הבידוד של תאי trophoblast באמצעות שיפוע Percoll. אז אנחנו מדגימים שימוש בתאים המבודדים בassay פלישת matrigel.
Abstract
השליה אחראית להובלה של חומרים מזינים, גזים וגורמי גדילה לעובר, כמו גם החיסול של פסולת. לכן, פגמים בהתפתחות שליה יש לו השלכות רבות על העובר ואמו, והם גורם עיקרי של הקטלניות עובריות. סוג התא העיקרי של החלק העוברי של השליה הוא trophoblast. תאי trophoblast שליה ראשוניים עכבר הם כלי שימושי לחקר התפתחות שליה רגילה ונורמלית, ולא כמו שורות תאים, עשוי להיות מבודדים ומשמשים ללמוד trophoblast בשלבים מסוימים של הריון. בנוסף, תרבויות העיקריות של trophoblast מעכברים מהונדסים עלולות לשמש כדי לחקור את תפקידם של גנים מסוימים בתאי שליה. הפרוטוקול המובא כאן מבוסס על התיאור של Thordarson et al. 1, שבו שיפוע percoll משמש להשגת אוכלוסיית תא trophoblast טהורה יחסית משליות עכבר בודדות. זה דומה לשימוש נרחב יותרשיטות ברה 2-3 בידוד תא trophoblast אנושיים. טוהר יכול להיות מוערך על ידי צביעת immunocytochemical של התאים המבודדים ל7 4 cytokeratin. הנה, התאים הבודדים לאחר מכן, נותחו באמצעות assay פלישה matrigel להעריך הפולשנות trophoblast במבחנת 5-6. התאים פלשו מנותחים immunocytochemistry ומוכתם לספירה.
Protocol
1. נתיחה של עכבר השליה
- הגדרת זוגות הזדווגות של עכברים.
- בכל אחד מהימים הבאים, לבדוק את קיומו של תקע הזדווגות. היום שבו תקע מזוהה נחשב 0.5 ימים לאחר זק (DPC) 7.
- שליות ניתן לגבות בשלב הרצוי של הריון, עם נתיחה נקיה של התחילה האפשרית השליה עם ההתפתחות של השליה הבוגרת בד 10.5. הנה, אנחנו מדגימים 14.5 DPC. בכרכים שניתנו, 40-60 שליות על 10.5 DPC, ו10-20 שליות על 14.5 DPC תנבנה שכבת תא trophoblast נראית בבירור.
- להרדים את העכבר בהריון, ולהוציא את הרחם, חיתוך בצוואר הרחם, ולאורך mesometrium.
- בעזרת מספריים חדים, לחתוך בין כל conceptus (איור 1 א).
- שימוש בשני זוגות של מלקחיים, לתפוס את דופן הרחם בקצה החתך, ומושך לגזרים, הסרת myometrium (האיור 1B) . זוג אחד משונן, מלקחיים עדינים מתון (מעוגל או ישר) וזוג אחד מלקחיים עדינים מאוד (# 5, לדוגמה) מומלצים.
- היפך השליה, פתח decidua עם מלקחיים או מספריים, חושף שליה. אחיזת רקמת רחם עם זוג אחד מלקחיים, עוד שקופית מלקחיים מתחת לשליה להפריד (התרשים 1C). אם עובר צורך נפרד וקרומים עובריים משלייה. לא ניתן להסיר את כל רקמת decidual ידי נתיחה מבלי שאבד אף רקמת שליה, אבל רקמת decidual נוספת (חיוור) ניתן להסיר מפני השטח של השליה על ידי קילוף בעדינות עם מלקחיים. אנו נסתמך על שיפוע Percoll לטיהור נוספת.
- למקם כל שליה גזורה בחיץ 25 מיליליטר קרח קר דיסוציאציה בצינור חרוטים 50 מ"ל עד שכל הניתוחים הושלמו. בשלבים מאוחר יותר, גס לרכך רקמת שליה עם מספריים או סכין גילוח ולפני ההעברה לחיץ דיסוציאציה.
- רופף צינור כובע חרוטים ומקום באמבטית 37 ° C עבור 45-60 דקות. מערבב את פתרון דיסוציאציה נמרצות על ידי pipetting בערך כל 10 דקות. זמן העיכול הכולל צריך להיות תחת פיקוח הדוק וכפי הנראה ידרוש קצת ניסוי וטעייה על מנת להשיג התאוששות תא אופטימלית. רקמות אמורות להיות מסוגלות לעבור דרך pipet מ"ל 10, אך חלקים גלויים של רקמה יישארו. Overdigestion יגרום הישרדות תא מסכנת ויעילות ציפוי. הישרדות תא אופטימלית ויעילות ציפוי תתרחשנה כאשר גושים של כמה תאים הם הווה, ולא כאשר הניתוק מוחלט מושג. לעומת זאת, underdigestion יוביל לטוהר מופחת בעקבות פרידת percoll. כאשר נקודת העיכול התקינה כבר הגיעה, צינור מקום בקרח כדי להפסיק את פעילות collagenase.
- להעביר את הפתרון דרך מסננת תא כדי להסיר חומרים לא מעוכלים, וחובצה @ 500 XG במשך 5 דקות.
- לשטוף, להסירתאי supernatant ו resuspend בפתרון 10 מ"ל לשטוף. צנטריפוגה @ 500 XG במשך 5 דקות.
- במהלך צנטריפוגה, להכין תמיסת percoll ידי ערבוב 9.6 המ"ל percoll, פתרון 13.4 מ"ל לשטוף ובינוני 1.1 מ"ל 10x 199 בצינור מ"ל 50 מתאים לצנטריפוגה במהירות גבוהה.
- הסרת תאי supernatant ו resuspend גלולה בפתרון 2 מ"ל לשטוף.
- הוסף לתאי percoll פתרון וסרכזת @ 30000 XG במשך 30 דקות ב 4 ° C.
- הסר מצינור צנטריפוגה ללא מפריע את השיפוע. כדי להמחיש את השיפוע, צינור המקום מול מקור אור בהיר. אתר להקת trophoblast (איור 2), ולשאוב עם pipet, נזהר שלא להפריע ללהקת תאי הדם האדומה בהמשך. נפח של להקת trophoblast יהיה 5-8 מ"ל.
- העברת תאי trophoblast לצינור 50 מיליליטר חרוטים. הוסף לשטוף פתרון להיקף כולל של 45ml.
- צנטריפוגה @ 500 XG במשך 5 דקות. הסרת supernatant, resuspend ובתרבות Mediאממ (NCTC-135). תאים יכולים להיות מתורבתים בmatrigel שכבה דקה או פלסטיק תרביות רקמה על 37 המעלות צלזיוס ו 5% CO 2. ביום 10.5, כל שליה מניבה כ 50,000 תאים חיים, מתוכם 80-90% הם cytokeratin חיוביים.
3. Assay הפלישה Trophoblast
- הוסף מדיום תרבות מ"ל 1-2 (NCTC-135) לכל תא ולדגור matrigel על 37 מעלות, CO 2% 5 עבור 30-90 דקות.
- הסר בינוני, ומוסיף 1.5 מ"ל x 10 5 תאים מבודדים טרי במדיום 2ml לבית העליון. הוסף 1 מ"ל בינוני לחדר תחתון כדי לכסות את פני שטח קרום תחתונים.
- תאי תרבות במוסיפה ל18-24 שעות.
- תאים לגרד וmatrigel מלהוסיף באמצעות קיסם קצף.
- שטוף את החלק העליון והתחתון של החדר ב2 המ"ל PBS.
- תקן למשך 5 דקות במ"ל paraformaldehyde 1 4% ב PBS.
- כתם על ידי מילוי החלל נמוך עם 400 DAPI μl (300nM) ו דגירה למשך 30 דקות.
- לשטוף שלוש פעמים לזמן קצר בערוץ המדע.
- הסרת קרומים ממוסיף עם להב אזמל חד.
- הוסף טיפת μl 10 של מדיום הרכבה (גליצרול 50% ב PBS) להחליק. באמצעות מלקחיים, שכב על קרום טיפה. הוסף עוד טיפת μl 10 של מדיום, אז coverslip בזהירות.
- תאים לצלם ולספור. הקפד למקם את הקרום כראוי (עד תא בצד תא או בצד למטה) למיקרוסקופ בשימוש. תמונת J תוכנה (המכונים הלאומיים לבריאות) כוללת תכונת ספירה ידנית שניתן להשתמש בו למטרה זו, כפי שניתן Adobe Photoshop או דלפק ידני.
4. נציג תוצאות
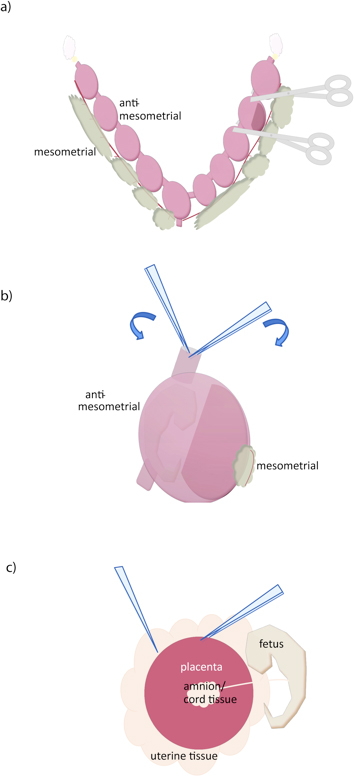
איור 1. Dissection של שלית העכבר. () הרחם הוסר על ידי חיתוך לאורך oviducts (צהוב), על פני שטח mesometrial, ובצוואר הרחם (למטה). conceptuses בודד אז יכול להיות מופרד על ידי חיתוך במספריים כפי שמוצג. (ב) הרחם הקיר הוסר על ידי צבת שני מלקחיים במשטח רחם החתך, וקרע בצד אנטי mesometrial, סמוך לעובר ומן השליה. (ג) השליה אז בודד על ידי אחיזה עם מלקחיים והחלקה נוספת בין השלייה ורקמות רחם. חבל טבור וקרומי extraembryonic אחרים אז ניתן להפריד את השליה.

איור 2. הפרדת Percoll של תאי trophoblast. לאחר צנטריפוגה, שלוש להקות עיקריות תהיינה גלויות כפי שמוצג בסרט מצויר בצד שמאל, ותמונה בצד ימין. הרצועה העליונה מכילה פסולת וfibroblasts סלולרי ויהיה ברור ביותר. רצועה הדוקה (אדום) הקרוב לתחתית המכילה תאי דם אדומים תהיה גלויה ממש מתחת ללהקת trophoblast המפוזרת. אגרגטים סלולריים יהיו סביר ראו בלהקת trophoblast, כמו בשניים שמוצגים רק בצד השמאל של החץ בתמונה.
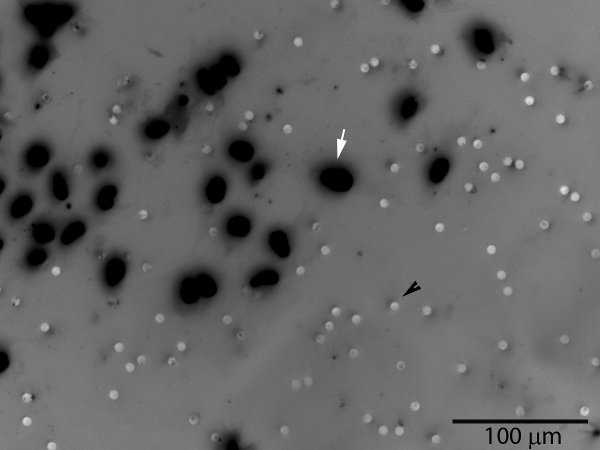
איור 3. תאי trophoblast פולשים (חץ לבן) יעבור דרך שכבת matrigel ואת הנקבוביות בממברנה, המופיע על פני השטח התחתונים של הקרום. הנקבובי הם גם גלויים (ראש החץ שחור). מספר התאים על פני הקרום או כל אזור מדגם מייצג ניתן לספור. תמונה בגוונים האפורים של צביעה גרעינית ניאון DAPI כבר מתהפך לשיפור הדמיה של תאים.

תאי Trophoblast איור 4. ניתן לזהות, והטוהר של האוכלוסייה המבודדת העריך, על ידי immunostaining ל7 cytokeratin (מרכז, מגנט). תאי counterstained עם DAPI (למעלה, כחול). תמונה, תחתון ממוזגת.
Discussion
בסרטון הזה, אנחנו מדגימים את הבידוד של תאים משלית trophoblast העכבר. אז אנחנו מראים assay חוץ גופייה בפלישה לtrophoblast. שימוש בהליך זה, במידה רבה, אבל לא לגמרי, אוכלוסייה טהורה של תאי trophoblast ניתן להשיג. אם טוהר נוסף נדרש, הפרדה מגנטית חרוז או הזרימה cytometry יכול להתבצע, כפי שכבר תאר לתאי trophoblast אנושיים ראשוניים. האורך הנכון של צעד דיסוציאציה collagenase צריך להיקבע בכל ניסוי, ויילמד עם ניסיון. יתר עיכול יהיה קשה להפחית התאוששות תא, בעוד שלפי-עיכול עלול להוביל לטוהר מופחת, כמו גם מספרים מופחתים. למרות שאנו מציגים את השימוש בתאים שהוכנו מסחרי matrigel פלישה, הם יכולים גם להיות מוכנים על ידי הוספת matrigel לתאי ציפוי transwell בעובי הרצוי.
Disclosures
אין לנו מה למסור.
Acknowledgements
המחברים מבקשים להודות לצוות השירותים יצירתיים באוניברסיטת מרכז תמיכה האקדמית מיזורי שהפיק בסרטון זה. עבודה זו נתמכה על ידי יוניס קנדי שרייבר המכון הלאומי לבריאות והתפתחות ילד האנושית של המכונים הלאומיים לבריאות, מספר מענק HD055231
Materials
Specific reagents and equipment:
Wash Solution (filter sterilize after mixing)
| Name | Company | Catalog Number | Comments |
| Reagent | Amount | Final concentration | |
| 10x Medium 199 | 50ml | 1X | |
| Hepes | 2.383 g | 0.02M | |
| sodium bicarbonate | 0.42 g | 0.01M | |
| Penicllin-Streptomycin | 5 mL | 100 U- 100 μg /ml | |
| Sterile dH20 | to 500 mL |
Dissociation solution (make fresh and filter sterilize)
| Reagent | Amount | Final concentration |
| Wash Solution | 100 mL | |
| DNase | 1 vial (2000 U) | 20 U/mL |
| Collagenase | 100 mg | 125 digestion units/mL |
| Name of the reagent | Company | Catalogue number | Comments |
| Collagenase | Sigma | C9891 | This is Clostridium collagenase. Bovine pancreatic collagenase would likely work as well |
| NCTC-135 | Sigma | D4263 | Add FBS to 10% |
| Matrigel invasion chambers | BD Biosciences | 354481 | |
| 10x Medium 199 | Sigma | M9163 | |
| Penicillin-Streptomycin | Invitrogen | 15140 | |
| DNase | Sigma | D4263 | |
| 100 μm Cell strainer | Fisher | 22363549 | |
| Antibody to cytokeratin 7 | DAKO | M7018 | Used at 1:100 dilution |
Equipment
Standard cell culture equipment including a CO2 incubator is required. In addition, a centrifuge rotor capable of spinning 50 ml tubes at 30,000 x g is needed. Note that this exceeds the maximum speed of most conical centrifuge tubes and will likely require an Oak Ridge style tube.
References
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved