Method Article
기본 마우스 Trophoblast 셀 및 Trophoblast의 침략 분석의 절연
요약
이 프로토콜에서는, 우리는 Percoll 기울기를 사용하여 trophoblast 세포의 분리에 이어 임신 d10.5에 마우스에서 placentae의 절개를 설명합니다. 우리는 matrigel의 침공 분석에서 분리 된 세포의 사용을 보여줍니다.
초록
태반은 태아에게 영양분, 가스 및 성장 요인의 운송뿐만 아니라 폐기물의 제거를 담당하고 있습니다. 따라서, 태반 개발에 결함이 태아와 어머니에 대한 중요한 결과를 가지고 있고, 배아 lethality의 주요 원인입니다. 태반의 태아 부분의 주요 세포 유형은 trophoblast입니다. 기본 마우스 태반 trophoblast 세포는 정상과 비정상 태반 개발을 공부에 유용한 도구이며, 세포 라인과는 달리, 격리 및 임신의 특정 단계에서 trophoblast을 공부하는 데 사용할 수 있습니다. 또한, 유전자 변형 생쥐에서 trophoblast의 주 문화는 태반 세포에서 특정 유전자의 역할을 연구하는 데 사용할 수 있습니다. 여기에 제시된 프로토콜은 Thordarson 외하여 설명에 따라 달라집니다. percoll 기울기는 절연 마우스 태반에서 비교적 순수한 trophoblast 세포 인구를 얻기 위해 사용되는 1. 그것은 더 널리 사용하는 유사합니다인간 trophoblast 세포 절연 2-3에 D 방법. 순도는 cytokeratin 7 4에 대한 격리 세포의 immunocytochemical 착색에 의해 평가 될 수 있습니다. 여기서, 절연 셀은 다음 체외 5-6에 trophoblast의 invasiveness을 평가하기 위해 matrigel 침공 분석을 사용하여 분석하고 있습니다. 침입 세포는 계산에 대한 immunocytochemistry과 스테인드에 의해 분석됩니다.
프로토콜
1. 마우스 태반의 해부
- 마우스의 결합 쌍을 설정합니다.
- 다음과 같은 일의 각에서 copulatory 플러그의 존재를 확인합니다. 플러그가 감지되는 날은 0.5 일 이후의 성교 (dpc) 7 간주됩니다.
- 태반은 D 10.5에 성숙 태반의 발달과 태반 가능한 시작의 깨끗한 절개로, 임신의 원하는 단계에서 수집 될 수 있습니다. 여기, 우리는 14.5 dpc을 보여줍니다. 주어진 볼륨에서 10.5 dpc에 40-60 태반, 그리고 14.5 dpc에 10-20 태반은 명확하게 볼 수 trophoblast 세포 레이어를 얻을 수 있습니다.
- 임신 마우스를 안락사시켜야하고, 자궁 경부에서 절단, 자궁을 제거하고 mesometrium 따라.
- 각 conceptus (그림 1A) 사이에 컷 날카로운 가위를 사용합니다.
- 포셉의 두 쌍을 사용하여 절단 가장자리에 자궁 벽을 파악하고, 분열, myometrium (그림 1B)를 제거 . 한 쌍의 톱니 모양 (곡선 또는 직선) 적당히 고급 집게와 한 쌍의 아주 좋은 포셉 (# 5, 예를 들어)을 권장합니다.
- 태반 맞은 편에 태반 노출, 집게 가위로 decidua를 엽니 다. 한 포셉 쌍과 자궁 조직을 파악하는 것은 분리 할 수있는 태반 (그림 1C) 아래에 다른 집게를 끼 웁니다. 만약 태반에서 필요한, 별도의 태아와 태아 막의. 또한 태반 조직을 잃지 않고 절개로 모든 decidual 조직을 제거 할 수는 없지만 추가 decidual 조직은 (창백한) 부드럽게 집게와 필링하여 태반의 표면에서 제거 할 수 있습니다. 우리는 더 정화를위한 Percoll 기울기에 의존합니다.
- 모든 dissections이 완료 될 때까지 50 ML 원뿔 튜브 25 ML의 얼음 차가운 해리 버퍼에있는 각 해부 태반를 놓습니다. 나중에 단계에서, coarsely 해리 버퍼에 전송하기 전에 보 또는 면도날과 태반 세포를 이기다.
- 45-60분을위한 37 ° C의 물에 대충 모자 원뿔 튜브 및 장소. 대략 10 분 pipetting하여 힘차게 분리 솔루션을 섞는다. 총 소화 시간이 면밀히 모니터해야하며 가능성이 몇 가지 시행 착오를 최적의 세포 복구를 달성하기 위해 필요합니다. 조직은 10 ML의 pipet 통과 할 수 있어야하지만, 조직의 표시 부분은 유지됩니다. Overdigestion 가난 세포 생존과 도금 효율이 높아집니다. 몇 세포의 clumps이 존재하는 경우 최적의 세포 생존과 도금 효율은 비교적 분리가 달성 될 때보다 발생합니다. 반대로, underdigestion는 percoll 분리에 따라 감소 순도로 이어질 것입니다. 적절한 소화 지점에 도달했을 때, 얼음에 장소 튜브 collagenase의 활동을 중지 할 수 있습니다.
- 소화되지 않은 물질을 제거하고 5 분 @ 500 XG를 원심 분리기하는 셀 스트레이너를 통해 솔루션을 전달합니다.
- 씻어 제거10 ML 세척 솔루션의 표면에 뜨는 및 resuspend 세포. 5 분 @ 500 XG를 원심 분리기.
- 원심 분리하는 동안, 9.6 ML percoll, 13.4 ML 세척 솔루션과 고속 원심 분리에 적합한 50 ML 튜브에 1.1 ML 10 배 중간 199 혼합하여 percoll 솔루션을 준비합니다.
- 2 ML 세척 용액에 표면에 뜨는 및 resuspend 세포 펠렛을 제거합니다.
- 솔루션을 percoll와 4에서 30 분 @ 30,000 XG를 원심 분리기에 셀을 추가 ° C.
- 기울기를 방해하지 않으면 서 원심 분리기에서 튜브를 제거합니다. 밝은 광원 앞의 그라데이션, 장소 튜브를 시각화합니다. trophoblast 밴드 (그림 2)을 찾아 아래 적혈구 밴드를 방해하지 돌보는, pipet을 대기음. trophoblast 대역의 볼륨은 5-8 ML 될 것입니다.
- 50 ML 원뿔 튜브에 trophoblast 세포를 전송합니다. 45ml의 총 볼륨에 대한 솔루션을 씻어 추가 할 수 있습니다.
- 5 분 @ 500 XG를 원심 분리기. 표면에 뜨는 제거하고, 문화 메디에 resuspend음 ... (NCTC-135). 세포는 37 ° C 5 % CO 2에서 얇은 층 matrigel 또는 조직 배양 플라스틱에 배양 할 수 있습니다. 일 10.5에서 각 태반은 80-90% 긍정적 인 cytokeratin되는 대략 50,000 라이브 세포를 산출.
3. Trophoblast의 침공 분석
- 37 각 matrigel 챔버 및 품다 1-2 ML 문화 매체 (NCTC-135)을 추가 °, 30-90 분에 대한 5% CO 2.
- 미디어를 제거하고, 상부 챔버에 2ml 매체에 1.5 ML × 10 5 갓 고립 된 세포를 추가 할 수 있습니다. 낮은 막 표면을 충당하기 위해 하부 챔버에 1 ML 매체를 추가 할 수 있습니다.
- 18~24시간에 대한 삽입의 문화 세포.
- 거품 면봉을 사용하여 삽입에서 다쳤고, 셀 및 matrigel.
- 2 ML PBS의 상단과 챔버의 바닥을 씻어.
- PBS 1 ML 4 % paraformaldehyde에 5 분 수정.
- 400 μl DAPI (300nM)와 하부 챔버 채워 청바지 30 분에 품다.
- PBS에서 간단히 세 번 씻으십시오.
- 을 날카로운 메스 블레이드와 삽입에서 세포막을 제거합니다.
- 슬라이드 마운트 매체 (PBS의 50 % 글리세롤)의 10 μl 방울을 추가합니다. 집게를 사용하여 드롭에 막 놓여 있었다. 매체의 또 다른 10 μl 방울을 추가 한 다음 조심스럽게 coverslip.
- 사진 및 count 세포. 사용중인 현미경에 대한 적절한 방향 막 (아래 셀 사이드 업 또는 셀 측)에 있는지 확인하십시오. 이미지 J 소프트웨어 (보건 국립 연구소)이 목적을 위해 사용할 수있는 수동 계산 기능을 포함 할 수 있습니다 어도비 포토샵 또는 수동 카운터 있습니다.
4. 대표 결과
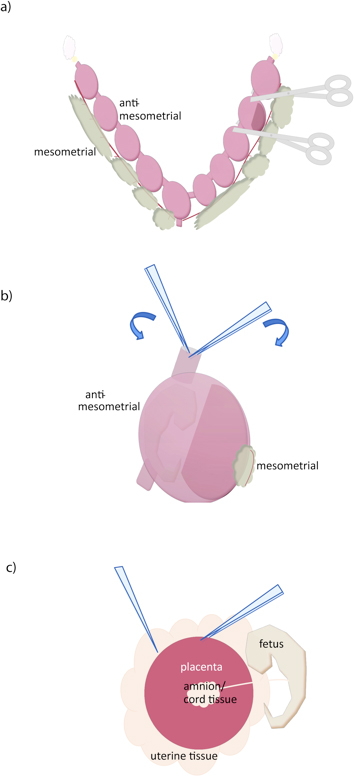
그림 1. 마우스 태반의 해부. (A) 자궁이 mesometrial 표면을 따라, (노란색) oviducts 따라 절단하여 제거하고 자궁 경부 (아래)에 있습니다. 개인 conceptuses 그런 다음 그림과 같이 가위로 절단하여 분리 할 수 있습니다. (B) 자궁 벽은 컷 자궁 표면에있는 두 집게을 배치하고, 태아 근처에 떨어진 태반에서 반 mesometrial 쪽을 따라 찢어 의해 제거됩니다. (C) 태반은 다음 집게로 물체를 움켜 태반과 자궁 사이에 서로를 슬라이딩으로 절연되어 있습니다. 탯줄 및 기타 extraembryonic 멤브레인은 다음 태반에서 분리 할 수 있습니다.

trophoblast 세포의 그림 2. Percoll 분리. 원심 분리 후, 세 가지 주요 밴드가 왼쪽에 만화 같이 볼 수 있으며, 사진 오른쪽 것입니다. 위 밴드는 세포 파편과 섬유 아세포를 포함하고 가장 명백 할 것이다. 적혈구가 포함 된 하단에 꼭 (빨간색) 밴드는 확산 trophoblast 밴드 아래에 표시됩니다. 단지 사진의 화살표의 왼쪽에 표시된 두에서와 같이 셀을 합산 가능성이, trophoblast 밴드에서 볼 수 있습니다.
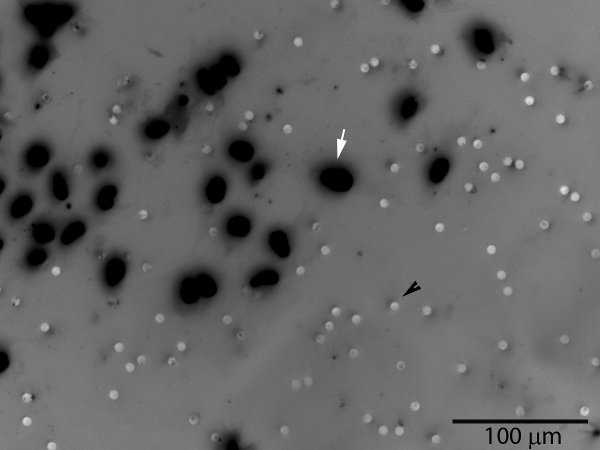
그림 3. 침윤성 trophoblast 세포 (흰색 화살표)는 멤브레인의 바닥 표면에 게재 matrigel 층과 막 숨구멍을 통과하게된다. 모공은 (검은 색 화살촉)도 볼 수 있습니다. 전체 막 표면 또는 대표 샘플 지역에 세포의 수는 계산 될 수 있습니다. 형광 DAPI 핵 염색의 그레이 스케일 이미지는 세포의 시각화를 개선하기 위해 반전되었습니다.

그림 4. Trophoblast 세포는 식별 및 격리 인구의 순도는 cytokeratin 7 (센터, 마젠타)에 immunostaining에 의해 평가 될 수있다. 세포는 DAPI (위, 청색)로 counterstained 있습니다. 통합 이미지 하단에.
토론
이 동영상에서는, 우리는 마우스 태반에서 trophoblast 세포의 절연을 보여줍니다. 우리는 trophoblast의 침략에의 시험 관내 분석을 보여줍니다. 이 절차를 사용은 크게,하지만 완전히 trophoblast 세포의 순수한 인구는 얻을 수 있습니다. 더 순도가 필요한 경우 기본 인간 trophoblast 세포에 대한 설명 되었기 때문에, 자기 비드 분리 또는 유동 세포 계측법은 수행 할 수 있습니다. collagenase 분리 단계의 적절한 길이는 각 실험 결정해야하며, 경험을 배울 수 있습니다. 이하 소화가 감소 순도뿐만 아니라, 감소 숫자로 이어질 수 있습니다 반면 이상 - 소화는 심각하게, 세포 복구를 줄일 수 있습니다. 우리가 상업적으로 준비 matrigel의 침략 챔버의 사용을 보여 있지만, 그들은 또한 원하는 두께의 코팅 transwell 챔버에 matrigel을 추가하여 준비 할 수 있습니다.
공개
우리는 공개 할 아무 것도 없습니다.
감사의 말
저자는이 비디오를 제작 미주리 학술 지원 센터의 대학에서 크리에이티브 서비스 팀에게 감사하고 싶습니다. 이 작품은 국립 보건원의 아동 건강 및 인간 발달의 유니스 케네디 Shriver 국립 연구소, 교부금 번호 HD055231에 의해 지원되었다
자료
Specific reagents and equipment:
Wash Solution (filter sterilize after mixing)
| Name | Company | Catalog Number | Comments |
| Reagent | Amount | Final concentration | |
| 10x Medium 199 | 50ml | 1X | |
| Hepes | 2.383 g | 0.02M | |
| sodium bicarbonate | 0.42 g | 0.01M | |
| Penicllin-Streptomycin | 5 mL | 100 U- 100 μg /ml | |
| Sterile dH20 | to 500 mL |
Dissociation solution (make fresh and filter sterilize)
| Reagent | Amount | Final concentration |
| Wash Solution | 100 mL | |
| DNase | 1 vial (2000 U) | 20 U/mL |
| Collagenase | 100 mg | 125 digestion units/mL |
| Name of the reagent | Company | Catalogue number | Comments |
| Collagenase | Sigma | C9891 | This is Clostridium collagenase. Bovine pancreatic collagenase would likely work as well |
| NCTC-135 | Sigma | D4263 | Add FBS to 10% |
| Matrigel invasion chambers | BD Biosciences | 354481 | |
| 10x Medium 199 | Sigma | M9163 | |
| Penicillin-Streptomycin | Invitrogen | 15140 | |
| DNase | Sigma | D4263 | |
| 100 μm Cell strainer | Fisher | 22363549 | |
| Antibody to cytokeratin 7 | DAKO | M7018 | Used at 1:100 dilution |
Equipment
Standard cell culture equipment including a CO2 incubator is required. In addition, a centrifuge rotor capable of spinning 50 ml tubes at 30,000 x g is needed. Note that this exceeds the maximum speed of most conical centrifuge tubes and will likely require an Oak Ridge style tube.
참고문헌
- Thordarson, G., Folger, P., Talamantes, F. Development of a placental cell culture system for studying the control of mouse placental lactogen II secretion. Placenta. 8, 573-585 (1987).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods. Mol. Med. 121, 203-217 (2006).
- Kliman, H. J., Nestler, J. E., Sermasi, E., Sanger, J. M., Strauss, J. F. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology. 118, 1567-1582 (1986).
- Blaschitz, A., Weiss, U., Dohr, G., Desoye, G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta. 21, 733-741 (2000).
- Librach, C. L. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell. Biol. 113, 437-449 (1991).
- Schulz, L. C., Widmaier, E. P. The effect of leptin on mouse trophoblast cell invasion. Biol. Reprod. 71, 1963-1967 (2004).
- Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A., Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science. 282, 2072-2075 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유