Method Article
Allografting ortotópico intracraniana de Células Meduloblastoma em camundongos imunocomprometidos
Neste Artigo
Resumo
Este protocolo descreve o isolamento e dissociação do mouse tecido meduloblastoma, e subsequente allografting das células tumorais em camundongos imunocomprometidos destinatário a fim de iniciar meduloblastoma secundário.
Resumo
Meduloblastoma é o tumor mais comum em idade pediátrica do sistema nervoso. Um grande número de estudos com animais tem se concentrado em precursores granulares do cerebelo neurônio (CGNPs) como a célula de origem para meduloblastoma 1-4. No entanto, as diversas apresentações clínicas de subtipos de meduloblastoma em pacientes humanos (nodular, desmoplásico, clássicos e grandes células / anaplásico), eo fato de que meduloblastoma é encontrado em um subgrupo de pacientes humanos com nenhuma expressão ectópica de CGNP marcador 5, sugerem que o origens celular e molecular de meduloblastoma são mais complexas e longe de ser completamente decifrado. Portanto, é essencial para determinar se existe um tumor meduloblastoma alternativa de células de origem com base em qual tipo de célula-modalidade terapêutica específica pode ser desenvolvida. Para este fim, ortotópico intracraniana allografting de organismos geneticamente marcadas tipos de células do tumor seguido por análises subseqüentes do desenvolvimento do tumor secundário em receptores permitirá a determinação da origem celular do tumor, iniciando células. Aqui nós descrevemos o protocolo experimental para ortotópico intracraniana allografting meduloblastoma de células derivadas do tecido do tumor primário, e esse procedimento também pode ser usado para o transplante de células de linhagens celulares estabelecidas.
Protocolo
1. Micro dissecção de Tumor-rolamento Cerebelo e dissociação do tecido tumoral
- Recuperação do tecido tumoral
- Ratos doentes são muitas vezes tendo meduloblastoma runted, e exibir hidrocefalia e típicos sintomas neurológicos, incluindo paralisia posterior e insuficiência de recuperar a postura, quando capotou. Para recuperar tecido tumoral, euthanize ratos por inalação de dióxido de carbono. É imporant não realizar deslocamento cervical, um procedimento que gera pressão para a posterior do crânio e pode comprometer a integridade do tecido do tumor.
- Decapitação é realizada imediatamente após a morte usando um par de tesouras, a remoção de pêlos e tecido muscular, tanto quanto possível para uma boa visualização do crânio. Limpe a superfície do crânio com Kimwipe embebido com álcool 95%.
- Use uma tesoura fina para cortar uma abertura ao longo da linha média do crânio, e remover o tecido usando uma pinça fina crânio, altura em que todo o cérebro, incluindo tumor-rolamento cerebelo é exposto.
- Enquanto o cerebelo de adultos saudáveis mostrar bem definidas hemisférios e vermis, o cerebelo de camundongos portadores de tumor são muitas vezes alargada, amorfa com uma superfície lisa e vasos sanguíneos visíveis. Usando técnicas estéreis, recuperar o tumor cerebelar usando uma pinça e coloque em gelada de tampão fosfato salina (PBS) sem Mg 2 + e Ca 2 +.
Nota: todos os instrumentos são desinfectados em etanol 95% e vapor autoclavado antes da utilização.
- Dissociação do tecido tumoral
- Transferir o tecido tumoral a partir de PBS para Accutase 50% (diluído em PBS), que é cerca de 4 vezes o volume do tecido tumoral, mince o tecido com uma tesoura bem por 3 minutos em temperatura ambiente, seguido de incubação a 37 ° C por 4 minutos , após o qual o tecido passa por pipetagem repetitiva com um Pipetman de 1 ml por mais 3 minutos. Este método deve render uma mistura de células isoladas e pequenos agregados celulares.
- Diluir a suspensão celular 3 vezes com PBS e centrifugar durante 5 minutos a 1000xg para agregar as células. (Os procedimentos acima foram descritos em "enriquecimento de isolamento e manutenção de células-tronco meduloblastoma", Jove no prelo)
Ressuspender o pellet celular em recém-preparados meio de células-tronco neurais consistem de médio Neurobasal com glutamina, penicilina-estreptomicina, N2, B27, EGF humano (25 ng / mL) e FGF básico (25 ng / mL). Calcular a densidade de células da solução e as devidas diluições com meio de células-tronco neurais adicionais, que se pode carregar 4 mL de solução com um número adequado de células tumorais dissociada, por exemplo, 5x10 5, para uma seringa com ponta de bisel estéril 10μL. O número exato de células a serem inoculadas devem ser determinados pelo pesquisador de acordo com requisitos específicos experimental. Manter a solução de células em um tubo de microcentrífuga mini-200μL (tubo PCR) no gelo.
2. Procedimentos de anestesia para o destinatário Ratos
Para o procedimento cirúrgico, uma área dedicada à cirurgia desinfectados roedores é necessário para a duração do procedimento. Idealmente, criar um banco comprido, com áreas separadas, mas adjacente para a preparação de animais, campo operatório e recuperação animal. Luvas cirúrgicas, luvas não exame, são necessários para a cirurgia. Técnica asséptica é mantido por dar as mãos com luvas acima da cintura e usado apenas para manipular objetos estéril de uma superfície seca e esterilizada.
- Uma mistura de cetamina (100 mg de cetamina por 1 kg de peso do mouse) e xilazina (10 mg de xilazina por 1 kg de peso mouse) é usado para anestesia. Administrar os anestésicos por via intraperitoneal.
- Ele normalmente leva 3-5 minutos para os anestésicos para tirar pleno efeito. Determinar se um mouse é totalmente anestesiado por tep / cauda pinch. Coloque uma pequena quantidade de pomada oftálmica nos olhos do mouse. Trazer o mouse totalmente anestesiado para a área operacional, monitorando constantemente para se certificar de que o mouse está respirando normalmente.
3. Intracraniana Grafting das células tumorais
- Raspar a região da cabeça dorsal posterior do mouse, usando um cortador de cabelo, para revelar o crânio posterior acima do mesencéfalo e cerebelo.
- Aplicar a solução sobre o couro cabeludo Betadine expostos usando um cotonete, seguido de limpeza com uma compressa embebida em álcool. Repita essas duas etapas de esterilização duas vezes.
- Faça uma incisão quarto de polegada no couro cabeludo posterior, usando um bisturi esterilizado. Perfurar um orifício de trepanação 0,5 milímetros 2 milímetros para a direita e 2 mm posterior à lambda usando uma broca estéril dental.
- Posicione o mouse em um quadro estereotáxico ligando seus incisivos para o porão frame. Cuidadosamente descer e posição do bisel com ponta de seringa de 10 mL carregado com 4 mL de solução de células tumorais no furo da rebarba. Uma vez que o chanfro do SyriESL agulha está abaixo da superfície do crânio, descendo para outro de 3 mm e, em seguida, subir para 0,5 mm. Injecte lentamente a quantidade desejada de células tumorais, com uma força constante em um período de tempo de 30 segundos, para o cerebelo do destinatário. Deixe a agulha em seu lugar após o término da injeção por mais dois minutos. Em seguida, retire a agulha e seringa. Clipe da ferida usando um autoclip.
- Mantenha o mouse sobre um cobertor aquecimento após a cirurgia para ajudar a manter a sua temperatura corporal. Padrões de mobilidade e respiratórias serão observados de forma contínua. Uma vez que o mouse se recupera da anestesia, coloque-o novamente em uma gaiola de habitação estéril. Monitorar diariamente para consumo de alimentos e água, comportamento, aparência e coloração vermelho dos olhos. Verifique se há sinais de infecção no local da incisão. Remover o autoclips no dia após a cirurgia 7.
Manter os ratos para uma média de 2-6 meses e sacrifício daqueles que apresentem sintomas típicos meduloblastoma para estudos posteriores.
4. Resultados representante
Meduloblastomas secundário desenvolvido em camundongos altamente destinatário se assemelhavam aos dos tumores primários. O cerebelo portadores de tumores secundários foram ampliadas frequentemente, amorfa com os vasos sanguíneos ectópica aparente quando visto como um todo-montagens. Imunohistoquímica do tecido do tumor secundário revelou que as células do tumor são altamente proliferativas, expressa forte SmoM2-YFP e marcadores de precursores granulares do cerebelo neurônio, como Math1 e Pax6. Quando dissociado e cultivadas através de métodos relatados ("O isolamento de enriquecimento, e manutenção de células-tronco meduloblastoma", Jove no prelo), as células do tumor secundário meduloblastoma podem ser expandidas rapidamente, marcadores de células-tronco expressar múltiplos, são clonogênica e pode ainda iniciar a formação de tumores quando transplantadas para recipientes adicionais imunocomprometidos.
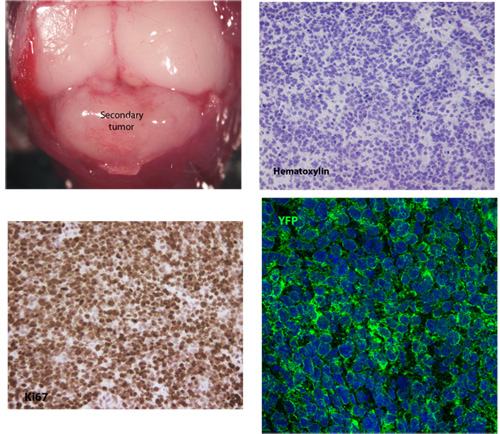
Figura 1. Típico de todo o monte e vistas de secções de um tecido meduloblastoma secundário
Um exemplo típico de tecido meduloblastoma secundário desenvolvido 26 dias após a injeção de 5x10 5 células tumorais primárias. Coloração com hematoxilina revela a morfologia típica celular de meduloblastoma, incluindo relação nuclear / cytoplasmic elevada e polimorfismo nuclear. Estas células tumorais secundárias são altamente proliferativas, como indicado pela expressão Ki67 e também expressar robustamente membranosa SmoM2-YFP.
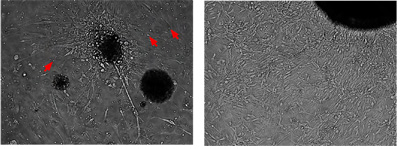
Figura 2. Meduloblastoma células secundárias podem ser cultivadas e expandidas in vitro
Utilizando o protocolo descrito para as células primário do mouse meduloblastoma ("Isolamento de enriquecimento, e manutenção de células-tronco meduloblastoma", Jove no prelo), essas células meduloblastoma secundário pode ser cultivado e expandido para passagens múltiplas. A imagem mostra a colônia mesmo tumor cultivadas representante de 4 dias e 14 dias. As células tumorais cultivadas são bipolares, alongadas com citoplasma escasso e muitas vezes irradiam a partir de um núcleo denso do agregado celular. Eles não apresentam inibição por contato crescimento. As células pequenas redondas são as células vermelhas do sangue.
Discussão
Vários fatores críticos para garantir a célula meduloblastoma sucesso allografting que produz a formação de tumores secundários são os seguintes: Primeiro, use apenas Accutase 50% para o tecido dissociação e não mais de digerir o tecido como o tratamento enzimático prolongada leva à redução significativa da viabilidade celular. Também usar apenas o tamanho Pipetman 1 mL como dicas menores também podem gerar dano físico às células dissociadas. É bom ter uma mistura de células individuais e agregados pequenos para allografting. Segunda, misturar e equilibrar a solução de células tumorais de cada vez antes de carregar a seringa Hamilton. Não use mais de 4 mL para cada injeção como um maior volume geraria muita pressão intracraniana e resistência. Última, é importante esperar um adicional de 2 minutos para que a solução injetada dissipar no tecido cerebelar após cada injecção.
Os procedimentos aqui descritos permitem a determinação do tipo de células geneticamente marcadas (s) que podem iniciar e propagar tumores. Este protocolo também se aplica a situações em que as células a ser injetado não são derivados diretamente do tecido do tumor primário, mas a partir de linhagens estáveis de células em cultura. Pode-se preparar o número apropriado de células por uma digestão enzimática e / ou pipetagem repetitiva, e começar a partir da Etapa 2 do presente protocolo. Portanto, também podemos testar as funções de genes candidatos e o efeito inibitório de compostos químicos com uma leitura de tumor in vivo de crescimento.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este estudo foi suportado por concessões do Vanderbilt-Ingram Cancer Center de Suporte Grant (P30 CA068485), a Childhood Foundation tumor cerebral e os Institutos Nacionais de Saúde (NS042205).
Materiais
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Stereotaxic instrument | Stoelting Co. | 51730 | |
| Foredom flexible shaft drill, hang-up style | Stoelting Co. | 58650 | |
| Large probe holder | Stoelting Co. | 51633 | |
| 10 μL syringe, 26 ga., bevel tip | Stoelting Co. | 51105 | |
| Drill bit .75mm | Stoelting Co. | 51455-3 |
Referências
- Schuller, U. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh-induced medulloblastoma. Cancer Cell. 14, 123-134 (2008).
- Yang, Z. J. Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell. 14, 135-145 (2008).
- Kessler, J. D. N-myc alters the fate of preneoplastic cells in a mouse model of medulloblastoma. Genes Dev. 23, 157-170 (2009).
- Flora, A., Klisch, T. J., Schuster, G., Zoghbi, H. Y., Y, H. Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma. Science. 326, 1424-1427 (2009).
- Salsano, E. Expression of the neurogenic basic helix-loop-helix transcription factor NEUROG1 identifies a subgroup of medulloblastomas not expressing ATOH1. Neuro Oncol. 9, 298-307 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados