Method Article
Aloinjerto intracraneal ortotópico de células de meduloblastoma en ratones inmunodeficientes
En este artículo
Resumen
Este protocolo describe el aislamiento y la disociación de los tejidos del ratón meduloblastoma, y la posterior aloinjerto de las células tumorales en ratones inmunodeprimidos receptores a fin de iniciar el meduloblastoma secundaria.
Resumen
El meduloblastoma es el tumor pediátrico más común del sistema nervioso. Una gran cantidad de estudios realizados en animales se ha centrado en cerebelosa gránulo precursores de neuronas (CGNPs) como la célula de origen para el meduloblastoma 1-4. Sin embargo, las diversas presentaciones clínicas de los subtipos de meduloblastoma en pacientes humanos (nodular, desmoplásico, clásica y de células grandes / anaplásico), y el hecho de que el meduloblastoma se encuentra en un subgrupo de pacientes humanos, sin expresión ectópica de CGNP marcador 5, sugieren que la origen celular y molecular de meduloblastoma son más complejos y lejos de ser descifrado. Por lo tanto, es esencial para determinar si hay un tumor meduloblastoma alternativa de células de origen sobre la base de que tipo de células específicas de modalidad terapéutica puede ser desarrollada. Con este fin, ortotópico intracraneal aloinjerto de marcadas genéticamente tipos de células del tumor seguida de análisis posteriores del desarrollo del tumor secundario en los receptores que permiten determinar el origen celular de células iniciadoras del tumor. A continuación se describe el protocolo que se ortotópico intracraneal aloinjerto de células de meduloblastoma derivadas del tejido del tumor primario, y este procedimiento también se puede utilizar para el trasplante de células de líneas celulares establecidas.
Protocolo
1. Microdisección de portadores de tumores del cerebelo y la disociación del tejido tumoral
- Recuperación del tejido tumoral
- Los ratones enfermos teniendo meduloblastoma son a menudo runted, y mostrar hidrocefalia y típicos síntomas neurológicos, incluyendo parálisis posterior y el fracaso para recuperar la posición en caso de vuelco. Para recuperar el tejido tumoral, la eutanasia a los ratones por inhalación de dióxido de carbono. Es imporante no llevar a cabo la dislocación cervical, un procedimiento que genera una presión en el cráneo posterior y pueden poner en peligro la integridad del tejido tumoral.
- La decapitación se realiza inmediatamente después de la muerte con un par de tijeras, quitar el pelo y el tejido muscular tanto como sea posible para una buena visualización del cráneo. Limpie la superficie del cráneo con Kimwipe empapado con etanol al 95%.
- Use tijeras finas para cortar una abertura a lo largo de la línea media del cráneo, y eliminar el tejido del cráneo con unas pinzas finas, momento en el que todo el cerebro incluyendo el cerebelo con tumores está expuesto.
- Mientras que el cerebelo de los adultos sanos pantalla bien definida hemisferios y el vermis, el cerebelo de ratones portadores de tumores a menudo son ampliadas, amorfa con una superficie lisa y los vasos sanguíneos visibles. El uso de técnicas estériles, recuperar el tumor cerebeloso con unas pinzas y colocar en el hielo frío tampón fosfato salino (PBS) sin Mg 2 + y Ca 2 +.
Nota: todos los instrumentos son desinfectados en etanol al 95% y el vapor en autoclave antes de su uso. - La disociación del tejido tumoral
- Transferir el tejido tumoral de PBS al 50% Accutase (diluido en PBS), que es de aproximadamente 4 veces el volumen del tejido del tumor, el picadillo de tejido con tijeras finas durante 3 minutos a temperatura ambiente, seguido de incubación a 37 ° C durante 4 minutos , tras lo cual el tejido se somete a pipetear repetitivo con un Pipetman de 1 ml por un período adicional de 3 minutos. Este método se debe dar una mezcla de células individuales y pequeños agregados celulares.
- Diluir la suspensión celular 3 veces con PBS y centrifugar durante 5 minutos a 1000xg para precipitar las células. (Los procedimientos anteriores se han descrito en "El aislamiento, el enriquecimiento y el mantenimiento de las células madre meduloblastoma", Jove, en prensa)
Resuspender el botón celular en el medio recién preparado de células madre neurales que consta de medio Neurobasal con glutamina, penicilina-estreptomicina, N2, B27, EGF humano (25 ng / mL) y el FGF básico (25 ng / mL). Calcular la densidad de las células de la solución y hacer las diluciones con medio adicional de células madre neurales de tal manera que uno puede cargar 4 L de solución con un número adecuado de células tumorales disociada, por ejemplo, 5x10 5, en una estéril bisel jeringa con punta de 10μL. El número exacto de las células para ser inoculados deben ser determinados por el investigador de acuerdo a las necesidades concretas de experimentación. Mantenga la solución de células en un tubo de microcentrífuga 200μL mini (tubo de PCR) en el hielo.
2. Los procedimientos anestésicos de los ratones receptores
Para el procedimiento quirúrgico, un área desinfectadas dedicadas exclusivamente a la cirugía de roedores es necesario para la duración del procedimiento. Lo ideal es establecer un banco largo, con áreas separadas pero contiguas para la preparación de los animales, el campo de operación y de recuperación de animales. Guantes quirúrgicos, guantes de examen no, son necesarios para la cirugía. La técnica aséptica se mantiene gracias a la mano enguantada por encima de la cintura y se utiliza sólo para manipular objetos estériles de una superficie estéril seca.
- Una mezcla de ketamina (100 mg de ketamina por 1 kg de peso del ratón) y xilazina (10 mg xilazina por 1 kg de peso del ratón) se utiliza para la anestesia. Administrar los anestésicos por vía intraperitoneal.
- Por lo general, tarda 3-5 minutos para que la anestesia surta efecto completo. Determinar si el ratón está completamente anestesiado por una pizca tep / cola. Coloque una pequeña cantidad de ungüento oftálmico en los ojos del ratón. Lleve el ratón anestesiado completamente al área de operación, un seguimiento constante para asegurarse de que el ratón está respirando normalmente.
3. Intracraneal injerto de las células tumorales
- Afeitado de la región dorsal posterior de la cabeza del ratón, utilizando una cortadora de cabello, para revelar el cráneo posterior por encima del mesencéfalo y el cerebelo.
- Aplique una solución de Betadine en el cuero cabelludo expuesto con un hisopo de algodón, seguido de la limpieza con una gasa con alcohol. Repita estos dos pasos de esterilización dos veces.
- Haga una incisión de medio centímetro en el cuero cabelludo posterior con un bisturí esterilizado. Perforar un agujero de trépano de 0,5 mm 2 mm hacia la derecha y 2 mm por detrás del lambda con un taladro dental estéril.
- Coloque el ratón sobre un marco estereotáxico, enganchando sus incisivos en la bodega del marco. Cuidadosamente descender y la posición del bisel en la punta una jeringa de 10 l cargado con 4 l de solución de células tumorales en el agujero de trépano. Una vez que el bisel de la aguja de la jeringa es por debajo de la superficie del cráneo, descend por otro de 3 mm y luego ascender a 0,5 mm. Inyecte lentamente la cantidad deseada de las células tumorales, con una fuerza constante en un marco de tiempo de 30 segundos, en el cerebelo de los receptores. Deje la aguja en su lugar después de la finalización de la inyección durante dos minutos. A continuación, retire la aguja y la jeringa. Clip de la herida utilizando una autoclip.
- Mantenga el ratón sobre una manta térmica después de la cirugía para ayudar a mantener su temperatura corporal. Los patrones de movilidad y las vías respiratorias se observó de forma continua. Una vez que el ratón se recupera de la anestesia, volver a meterla en una jaula de vivienda estéril. Diario de los alimentos y la ingesta de agua, comportamiento, preparación y tinción con rojo de los ojos. Inspeccione en busca de signos de infección en el sitio de la incisión. Retire la autoclips después de la cirugía en el día 7.
Mantener a los ratones durante un promedio de 2.6 meses y el sacrificio de los que presentan síntomas típicos de meduloblastoma para estudios posteriores.
4. Resultados representante
Meduloblastomas secundaria desarrollados en ratones receptores muy parecidos a los de los tumores primarios. El cerebelo con tumores secundarios eran a menudo ampliada, amorfo con los vasos sanguíneos aparentes ectópico cuando se ve como todo el montaje. Análisis inmunohistoquímico del tejido tumoral secundaria reveló que las células tumorales son altamente proliferativas, expresan su gran SmoM2-YFP y los marcadores de las neuronas del cerebelo gránulo precursores, como Math1 y Pax6. Cuando disociadas y cultivadas con métodos reportados ("El aislamiento, el enriquecimiento y el mantenimiento de las células madre meduloblastoma", Jove, en prensa), las células de meduloblastoma secundaria tumor puede extenderse rápidamente, expresan varios marcadores de células madre, se clonigénicas y además puede iniciar la formación de tumores en trasplantadas en otros las personas inmunodeprimidas.
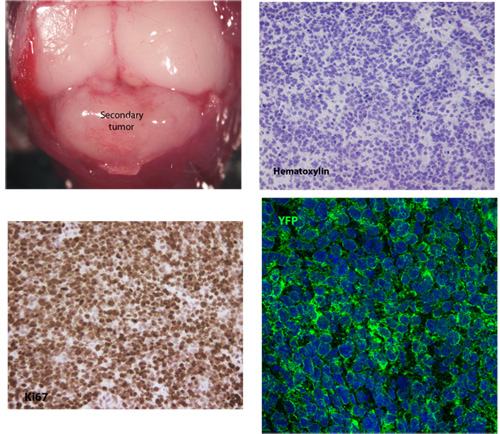
Figura 1. Típico de todo el montaje y vistas en sección de un tejido meduloblastoma secundaria
Un ejemplo típico del tejido meduloblastoma secundaria desarrollado 26 días después de la inyección de 5x10 5 células del tumor primario. Tinción hematoxilina revela la morfología típica de celulares de meduloblastoma, incluidos los de alta nuclear / citoplasma y el polimorfismo nuclear. Estas células tumorales secundarias son altamente proliferativas, como se indica por expresión de Ki67 y también con firmeza expresar membranosa SmoM2-YFP.
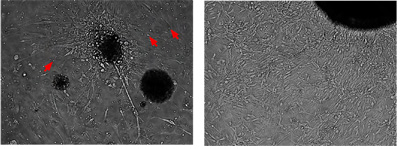
Figura 2. Las células secundarias meduloblastoma pueden ser cultivadas y expandidas in vitro
Utilizando el protocolo descrito para células primarias de ratón meduloblastoma ("El aislamiento, el enriquecimiento y el mantenimiento de las células madre meduloblastoma", Jove, en prensa), estas células de meduloblastoma secundarios pueden ser cultivados y ampliados para el paso múltiple. La imagen muestra la colonia representante tumor mismo culto a los 4 días y 14 días. Las células tumorales cultivadas son bipolares, alargada, con escaso citoplasma y emitir a menudo de un denso núcleo de agregados celulares. Ellos no muestran inhibición del crecimiento de contacto. Las células pequeñas y redondas son los glóbulos rojos.
Discusión
Varios factores críticos para asegurar el éxito de células de meduloblastoma aloinjerto que la formación de los rendimientos de un tumor secundario son los siguientes: En primer lugar, utilice sólo Accutase 50% para el tejido de la disociación y no más de digerir el tejido como tratamiento enzimático prolongada conduce a una reducción significativa de la viabilidad celular. También utilizamos sólo la Pipetman 1 mL tamaño como pequeños consejos también pueden generar daño físico a las células disociadas. Es bueno tener una mezcla de células individuales y pequeños agregados de aloinjerto. En segundo lugar, mezclar y equilibrar la solución de las células tumorales antes de cada carga de la jeringa Hamilton. No use más de 4 l de cada inyección, como un mayor volumen generaría demasiada presión intracraneal y la resistencia. Por último, es importante esperar 2 minutos para dejar que la solución inyectada se disipan en el tejido del cerebelo después de cada inyección.
Los procedimientos descritos aquí permiten la determinación del tipo de células marcadas genéticamente (s) que pueden iniciar y propagar los tumores. Este protocolo también se aplica a situaciones en las células que se inyecta no se derivan directamente de los tejidos del tumor primario, sino de establecer líneas de células cultivadas. Se puede preparar el número adecuado de células por digestión enzimática o bien y / o pipeteo repetitivo, y empezar desde el paso 2 de este protocolo. Por lo tanto, también puede probar las funciones de los genes candidatos y el efecto inhibidor de los compuestos químicos con un estudio in vivo de tumores de crecimiento de lectura.
Divulgaciones
Agradecimientos
Este estudio fue apoyado por subvenciones del Vanderbilt-Ingram Cancer Center de Apoyo Grant (P30 CA068485), la Fundación cerebrales infantiles del tumor y de los Institutos Nacionales de Salud (NS042205).
Materiales
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Stereotaxic instrument | Stoelting Co. | 51730 | |
| Foredom flexible shaft drill, hang-up style | Stoelting Co. | 58650 | |
| Large probe holder | Stoelting Co. | 51633 | |
| 10 μL syringe, 26 ga., bevel tip | Stoelting Co. | 51105 | |
| Drill bit .75mm | Stoelting Co. | 51455-3 |
Referencias
- Schuller, U. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh-induced medulloblastoma. Cancer Cell. 14, 123-134 (2008).
- Yang, Z. J. Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell. 14, 135-145 (2008).
- Kessler, J. D. N-myc alters the fate of preneoplastic cells in a mouse model of medulloblastoma. Genes Dev. 23, 157-170 (2009).
- Flora, A., Klisch, T. J., Schuster, G., Zoghbi, H. Y., Y, H. Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma. Science. 326, 1424-1427 (2009).
- Salsano, E. Expression of the neurogenic basic helix-loop-helix transcription factor NEUROG1 identifies a subgroup of medulloblastomas not expressing ATOH1. Neuro Oncol. 9, 298-307 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados