Method Article
Intracrânienne allogreffe orthotopique de cellules dans des souris immunodéprimées Médulloblastome
Dans cet article
Résumé
Ce protocole décrit l'isolement et la dissociation des tissus médulloblastome de la souris, et après allogreffe de cellules tumorales dans des souris immunodéprimées bénéficiaires afin d'initier un médulloblastome secondaire.
Résumé
Le médulloblastome est la tumeur la plus fréquente en pédiatrie du système nerveux. Un grand nombre d'études ont porté sur des animaux précurseurs de neurones du cervelet granules (CGNPs) que la cellule d'origine pour un médulloblastome 1-4. Cependant, les diverses présentations cliniques des sous-types médulloblastome chez les patients humains (nodulaire, desmoplastique, classique et à grandes cellules / anaplasique), et le fait que le médulloblastome se trouve dans un sous-ensemble de patients humains sans aucune expression ectopique de CGNP marqueurs 5, suggèrent que le origines moléculaires et cellulaires de médulloblastome sont plus complexes et loin d'être entièrement déchiffré. Par conséquent, il est essentiel de déterminer s'il ya une tumeur médulloblastome alternatives de cellules d'origine sur la base duquel la cellule-type spécifique modalité thérapeutique peut être développée. À cette fin, orthotopique intracrânienne allogreffe d'organismes génétiquement marqués types de cellules tumorales suivie par des analyses ultérieures de développement de tumeurs secondaires chez les receveurs permettra de déterminer l'origine cellulaire des tumeurs initier les cellules. Nous décrivons ici le protocole expérimental pour orthotopique intracrânienne allogreffe de cellules provenant de tissus de médulloblastome tumeur primaire, et cette procédure peut également être utilisé pour la transplantation de cellules de lignées cellulaires établies.
Protocole
1. Micro-dissection des porteuses de tumeur cervelet et la dissociation du tissu tumoral
- Récupération de tissu tumoral
- Souris malades portant médulloblastome sont souvent chétifs, et afficher l'hydrocéphalie et typique des symptômes neurologiques, y compris paralysie des membres postérieurs et l'incapacité à retrouver une posture en cas de retournement. Pour récupérer le tissu tumoral, euthanasier les souris par inhalation de dioxyde de carbone. Il est imporant de ne pas effectuer dislocation cervicale, une procédure qui génère une pression sur le crâne postérieur et peut compromettre l'intégrité des tissus tumoraux.
- Décapitation est effectuée immédiatement après la mort en utilisant une paire de ciseaux, enlever les poils et les tissus musculaires, autant que possible pour une bonne visualisation du crâne. Nettoyer la surface du crâne avec Kimwipe imbibé d'éthanol à 95%.
- Utilisez des ciseaux pour couper fines une ouverture le long de la ligne médiane du crâne, et éliminer les tissus du crâne avec une pince fine, à quel point l'ensemble du cerveau, y compris porteurs d'une tumeur du cervelet est exposée.
- Alors que les cervelets des adultes sains d'affichage bien définis hémisphères et du vermis, les cervelets de souris porteuses de tumeurs sont souvent élargie, amorphe avec une surface lisse et les vaisseaux sanguins visibles. En utilisant des techniques stériles, extraire la tumeur du cervelet en utilisant une pince à épiler et le placer dans la glace froide tampon phosphate salin (PBS) sans Mg 2 + et Ca 2 +.
Remarque: tous les instruments sont désinfectés dans de l'éthanol à 95% et de vapeur autoclavés avant usage. - La dissociation du tissu tumoral
- Transférer le tissu tumoral du PBS pour Accutase 50% (dilué dans du PBS), qui est environ 4 fois le volume du tissu tumoral, émincer les tissus avec des ciseaux fins pour 3 minutes à température ambiante, suivie d'une incubation à 37 ° C pendant 4 minutes , après quoi le tissu subit pipetage répétitifs avec un Pipetman de 1 ml pendant 3 minutes supplémentaires. Cette méthode devrait donner un mélange de cellules individuelles et de petits agrégats cellulaires.
- Diluer la suspension cellulaire 3 fois avec du PBS et centrifuger pendant 5 minutes à 1000xg pour culotter les cellules. (Les procédures ci-dessus ont été décrits dans "L'isolement, l'enrichissement et la maintenance des cellules souches médulloblastome", Jupiter, sous presse)
Reprendre le culot cellulaire dans fraîchement préparés moyennes cellules souches neurales composé de milieu Neurobasal avec de la glutamine, pénicilline-streptomycine, N2, B27, EGF humain (25 ng / ml) et FGF basique (25 ng / ml). Calculer la densité de cellules de la solution appropriée et de faire d'autres dilutions moyennes avec d'autres cellules souches neurales de telle sorte que l'on peut charger 4 pi de solution avec un nombre approprié de cellules tumorales dissociées, par exemple 5x10 5, dans une stérile coniques à pointe seringue 10 ul. Le nombre exact de cellules à inoculer doit être déterminée par le chercheur en fonction des exigences spécifiques d'expérimentation. Conserver la solution de cellules dans un microtube 200 pl mini (tube de PCR) sur la glace.
2. Anesthésies pour les souris receveuses
Pour l'intervention chirurgicale, une zone désinfectée dédié à la chirurgie chez les rongeurs est nécessaire pour la durée de la procédure. Idéalement, mis en place un banc de long avec des zones séparées, mais voisines pour la préparation des animaux, champ opératoire et la récupération des animaux. Les gants chirurgicaux, des gants d'examen non, sont nécessaires pour la chirurgie. Une technique aseptique est maintenu en tenant les mains gantées dessus de la taille et utilisées uniquement pour traiter des objets stériles à partir d'une surface sèche stérile.
- Un mélange de kétamine (100 mg de kétamine par 1 kg de poids de la souris) et de xylazine (10 mg de xylazine par 1 kg de poids de la souris) est utilisée pour l'anesthésie. Administrer par voie intrapéritonéale d'anesthésiques.
- Il prend généralement 3-5 minutes pour les anesthésiques de prendre pleinement effet. Déterminer si une souris est totalement anesthésié par tep / queue de pincement. Placer une petite quantité de pommade ophtalmique dans les yeux de la souris. Apportez de la souris totalement anesthésiés à la zone d'exploitation, la surveillance constante pour s'assurer que la souris est à respirer normalement.
3. Intracrânienne greffe des cellules tumorales
- Raser la région de la tête dorsale postérieure de la souris, en utilisant une tondeuse à cheveux, pour révéler le crâne au-dessus du mésencéphale postérieur et le cervelet.
- Appliquer la solution Betadine sur le cuir chevelu exposés à l'aide d'un applicateur coton-tige, puis en l'essuyant avec une compresse imbibée d'alcool. Répétez ces deux étapes de stérilisation deux fois.
- Faire une incision un quart de pouce dans le cuir chevelu postérieure à l'aide d'un scalpel stérilisé. Percez un trou de 0,5 mm bavure 2 mm à droite et 2 mm en arrière du lambda en utilisant une perceuse stériles dentaire.
- Placez la souris sur un cadre stéréotaxique en accrochant ses incisives sur la cale de trame. Soigneusement descendre et la position du biseau incliné seringue de 10 uL chargé avec 4 pl de la solution de cellules tumorales dans le trou de trépan. Une fois que le biseau de l'aiguille de la seringue est inférieure à la surface du crâne, descend pour une autre de 3 mm et ensuite monter à 0,5 mm. Injecter lentement la quantité désirée de cellules tumorales, avec une force constante dans un délai de 30 secondes, dans le cervelet du destinataire. Laisser l'aiguille à sa place après la fin de l'injection d'un deux minutes supplémentaires. Ensuite, retirer l'aiguille et la seringue. Clip de la plaie en utilisant un autoclip.
- Gardez la souris sur une couverture chauffante après la chirurgie pour aider à maintenir sa température corporelle. Schémas de mobilité et respiratoires seront observés en permanence. Une fois que la souris se remet de l'anesthésie, le replacer dans une cage de logement stérile. Moniteur quotidienne de nourriture et d'eau, le comportement, le toilettage, et la coloration rouge des yeux. Inspectez les signes d'infection au site d'incision. Retirez le autoclips sur la chirurgie après jour 7.
Maintenir la souris pour une moyenne de 2-6 mois et le sacrifice celles affichant les symptômes typiques médulloblastome pour des études ultérieures.
4. Les résultats représentatifs
Médulloblastomes secondaire développé en souris receveuses très ressemblaient à celles des tumeurs primaires. Les cervelets portant des tumeurs secondaires ont souvent été élargie, amorphe avec des vaisseaux sanguins apparents ectopique lorsqu'elles sont considérées comme l'ensemble de montures. Analyses immunohistochimiques de tissus tumoraux secondaires ont révélé que les cellules tumorales sont très prolifératives, expriment une forte SmoM2-YFP et des marqueurs de cérébelleuse précurseurs de neurones granulaires, tels que Math1 et Pax6. Lorsque dissociés et cultivés selon des méthodes déclarés («L'isolement, l'enrichissement et la maintenance des cellules souches médulloblastome", Jupiter, sous presse), les cellules tumorales secondaires médulloblastome peut être développé rapidement, d'exprimer de multiples marqueurs des cellules souches, sont clonogéniques et peut encore initier la formation de tumeur lorsque transplantées dans d'autres destinataires immunodéprimés.
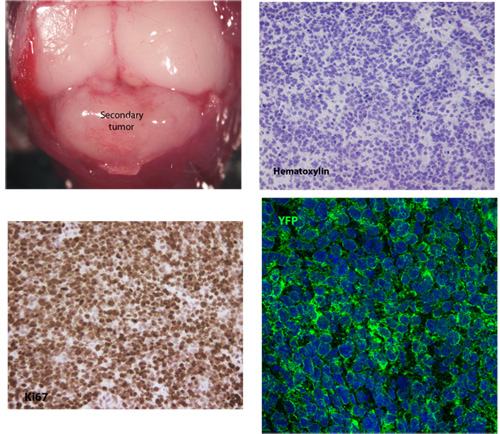
Figure 1. Typiques entier monture et des vues en coupe d'un tissu médulloblastome secondaires
Un exemple typique de tissu médulloblastome secondaires développé 26 jours après l'injection de 5x10 5 cellules tumorales primaires. Coloration hématoxyline révèle la morphologie cellulaire typique de médulloblastome, y compris nucléaires de haute activité / cytoplasmique ratio et le polymorphisme nucléaire. Ces cellules tumorales secondaires sont très proliférante, comme indiqué par l'expression de Ki67 et ils ont aussi robuste expresse membraneuse SmoM2-YFP.
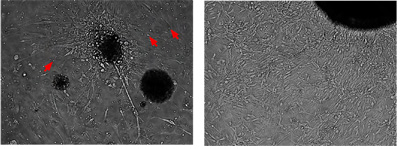
Figure 2. Cellules de médulloblastome secondaires peuvent être cultivées et développées in vitro
En utilisant le protocole décrit pour les cellules primaires médulloblastome de la souris («L'isolement, l'enrichissement et la maintenance des cellules souches médulloblastome", Jupiter, sous presse), ces cellules de médulloblastome secondaires peuvent être cultivées et élargi pour des passages multiples. La photo montre la colonie même représentant tumorales en culture à 4 jours et 14 jours. Les cellules tumorales en culture sont bipolaires, de forme allongée avec un cytoplasme peu et souvent rayonnent à partir d'un noyau dense d'agrégats cellulaires. Ils ne présentent pas d'inhibition de contact de la croissance. Les petites cellules rondes sont des globules rouges.
Discussion
Plusieurs facteurs essentiels pour assurer la cellule médulloblastome succès allogreffe que la formation de tumeurs secondaires sont des rendements comme suit: Premièrement, utilisez uniquement Accutase 50% pour les tissus de dissociation et de ne plus digérer le tissu comme traitement enzymatique prolongée conduit à une réduction significative de la viabilité cellulaire. Aussi utilisez uniquement le Pipetman taille 1 mL comme petits trucs peuvent aussi générer des dommages physiques aux cellules dissociées. C'est bien beau d'avoir un mélange de cellules individuelles et de petits agrégats d'allogreffe. Deuxièmement, mélanger et équilibrer la solution des cellules tumorales à chaque fois avant de charger la seringue Hamilton. Ne pas utiliser plus de 4 pl pour chaque injection comme un volume plus important serait de générer trop de pression intracrânienne et de résistance. Enfin, il est important d'attendre 2 minutes de plus pour laisser la solution injectée dans le tissu dissiper cérébelleuse après chaque injection.
Les procédures décrites ici permettent pour la détermination du type de cellules génétiquement marqué (s) qui peuvent initier et de propager des tumeurs. Ce protocole s'applique également aux situations où les cellules à injecter ne sont pas dérivés directement du tissu tumoral primaire, mais à partir de lignées cellulaires établies en culture. On peut préparer le nombre approprié de cellules par digestion enzymatique soit et / ou de pipetage répétitifs, et à partir de l'étape 2 de ce protocole. Par conséquent, nous pouvons également tester les fonctions des gènes candidats et l'effet inhibiteur des composés chimiques avec une tumeur in vivo la croissance de lecture.
Déclarations de divulgation
Remerciements
Cette étude a été soutenue par des subventions du Vanderbilt-Ingram Cancer Center Grant Support (P30 CA068485), la Fondation des tumeurs cérébrales enfance et les National Institutes of Health (NS042205).
matériels
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Stereotaxic instrument | Stoelting Co. | 51730 | |
| Foredom flexible shaft drill, hang-up style | Stoelting Co. | 58650 | |
| Large probe holder | Stoelting Co. | 51633 | |
| 10 μL syringe, 26 ga., bevel tip | Stoelting Co. | 51105 | |
| Drill bit .75mm | Stoelting Co. | 51455-3 |
Références
- Schuller, U. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh-induced medulloblastoma. Cancer Cell. 14, 123-134 (2008).
- Yang, Z. J. Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell. 14, 135-145 (2008).
- Kessler, J. D. N-myc alters the fate of preneoplastic cells in a mouse model of medulloblastoma. Genes Dev. 23, 157-170 (2009).
- Flora, A., Klisch, T. J., Schuster, G., Zoghbi, H. Y., Y, H. Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma. Science. 326, 1424-1427 (2009).
- Salsano, E. Expression of the neurogenic basic helix-loop-helix transcription factor NEUROG1 identifies a subgroup of medulloblastomas not expressing ATOH1. Neuro Oncol. 9, 298-307 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon