Method Article
Intracranica allotrapianto ortotopico di cellule di medulloblastoma in topi immunocompromessi
In questo articolo
Riepilogo
Questo protocollo descrive l'isolamento e la dissociazione del tessuto medulloblastoma mouse e allotrapianto successive delle cellule tumorali in topi immunocompromessi destinatario al fine di avviare medulloblastoma secondario.
Abstract
Il medulloblastoma è il tumore più comune pediatrici del sistema nervoso. Una grande quantità di studi sugli animali si è concentrata sui precursori neuronali dei granuli del cervelletto (CGNPs) come la cellula di origine per il medulloblastoma 1-4. Tuttavia, le diverse presentazioni cliniche dei sottotipi medulloblastoma nei pazienti umani (nodulare, desmoplastico, classica e grandi cellule / anaplastico), e il fatto che il medulloblastoma si trova in un sottogruppo di pazienti umani senza espressione ectopica di CGNP marcatore 5, suggeriscono che la origini cellulare e molecolare di medulloblastoma sono più complessi e lungi dall'essere completamente decifrato. Pertanto, è essenziale per determinare se vi è un tumore medulloblastoma alternativa di cellule di origine sulla base di quale tipo cellulare specifico modalità terapeutica può essere sviluppato. A tal fine, ortotopico intracranica allotrapianto di organismi geneticamente segnato tipi di cellule tumorali seguita da successive analisi secondaria di sviluppo del tumore nei pazienti consentirà di determinare l'origine cellulare delle cellule tumorali iniziare. Qui descriviamo il protocollo sperimentale per ortotopico intracranica allotrapianto di cellule derivate da medulloblastoma primario tessuto tumorale, e questa procedura può essere utilizzata anche per il trapianto di cellule provenienti da linee cellulari stabilizzate.
Protocollo
1. Micro-dissezione del tumore-cuscinetto cervelletto e dissociazione del tessuto tumorale
- Recupero del tessuto tumorale
- Topi malati cuscinetto medulloblastoma sono spesso runted e visualizzare idrocefalo e tipici sintomi neurologici, tra cui paralisi posteriore e l'incapacità di riacquistare la postura in caso di ribaltamento. Per recuperare tessuto tumorale, eutanasia topi per inalazione di anidride carbonica. E 'troppo importante per noi non eseguire dislocazione cervicale, una procedura che genera una pressione al cranio posteriore e può compromettere l'integrità del tessuto tumorale.
- Decapitazione viene eseguita subito dopo la morte con un paio di forbici, la rimozione dei capelli e tessuto muscolare il più possibile per una buona visualizzazione del cranio. Pulire la superficie del cranio con Kimwipe imbevuto di etanolo al 95%.
- Usare le forbici per tagliare bene un'apertura lungo la linea mediana del cranio, e rimuovere il tessuto cranio con una pinzetta sottile, a questo punto l'intero cervello compreso portatori di tumore cervelletto è esposto.
- Mentre il cervello dei degli adulti sani visualizzare ben definite emisferi e del verme, il tumore del cervello dei topi portatori sono spesso allargata, amorfo con una superficie liscia e vasi sanguigni cospicua. Usando tecniche sterili, recuperare il tumore del cervelletto con delle pinzette e mettere in ghiaccio freddo tampone fosfato (PBS) senza Mg 2 + e Ca 2 +.
Nota: tutti gli strumenti sono disinfettati in etanolo al 95% e del vapore in autoclave prima dell'uso.
- Dissociazione del tessuto tumorale
- Trasferire il tessuto tumorale da PBS al 50% Accutase (diluito in PBS) che è circa 4 volte il volume del tessuto tumorale, tritare il tessuto con le forbici multa per 3 minuti a temperatura ambiente, seguita da incubazione a 37 ° C per 4 minuti , dopo di che il tessuto subisce pipeting ripetitivi con un 1 mL Pipetman per altri 3 minuti. Questo metodo dovrebbe produrre un insieme di celle singole e piccoli aggregati cellulari.
- Diluire la sospensione cellulare di 3 volte con PBS e centrifugare per 5 minuti a 1000xg per agglomerare le cellule. (Le procedure di cui sopra sono stati descritti in "isolamento, l'arricchimento e il mantenimento delle cellule staminali medulloblastoma", Giove in stampa)
Risospendere il pellet di cellule in appena preparato medio di cellule staminali neurali composto medio Neurobasal con la glutamina, penicillina-streptomicina, N2, B27, umano EGF (25 ng / ml) e di base FGF (25 ng / mL). Calcolare la densità delle cellule della soluzione e le opportune diluizioni ulteriormente con l'aggiunta di cellule staminali neurali medio tale che si può carico di 4 ml di soluzione con un numero adeguato di cellule tumorali dissociata, ad esempio 5x10 5, in una sterile conici a punta siringa 10μL. Il numero esatto di cellule da inoculare deve essere determinato dal ricercatore in base alle specifiche esigenze sperimentali. Conservare la soluzione di cellule in una provetta da microcentrifuga mini 200μL (tubo PCR) su ghiaccio.
2. Procedure di anestetico per il Mice destinatario
Per la procedura chirurgica, una zona disinfettata dedicata alla chirurgia roditori è necessario per la durata della procedura. Idealmente, impostare una lunga panca con aree separate ma adiacenti per la preparazione degli animali, campo operatorio e il recupero degli animali. Guanti chirurgici, non guanti esame, sono necessari per l'intervento chirurgico. Tecnica asettica è mantenuta tenendo le mani guantate di sopra della vita e utilizzato solo per gestire gli oggetti sterili da una superficie asciutta sterile.
- Una miscela di ketamina (100 mg di ketamina per 1 kg di peso del mouse) e xilazina (10 mg xylazina per 1 kg di peso del mouse) è utilizzato per l'anestesia. Amministrare il intraperitoneale anestetici.
- Di solito, occorrono 3-5 minuti per il anestetici abbiano pieno effetto. Determinare se il mouse è completamente anestetizzato da tep / coda pizzico. Mettere una piccola quantità di pomata oftalmica sugli occhi del mouse. Portare il mouse completamente anestetizzati per l'area operativa, monitorando costantemente per assicurarsi che il mouse sta respirando normalmente.
3. Intracranica innesto delle cellule tumorali
- Radere la regione dorsale posteriore del capo del mouse, utilizzando un tagliatore di capelli, per rivelare il cranio posteriore sopra il mesencefalo e cervelletto.
- Applicare la soluzione di Betadine sul cuoio capelluto esposto utilizzando un cotton-fioc, seguiti strofinando con un tampone di alcool. Ripetere questi due passaggi di sterilizzazione per due volte.
- Fare un quarto di pollice incisione nel cuoio capelluto posteriore utilizzando un bisturi sterilizzato. Praticare un foro mm 0,5 bava 2 mm a destra e 2 mm posteriormente al lambda con un trapano sterile dentale.
- Posizionare il mouse su un telaio stereotassico agganciando la sua incisivi sul possesso telaio. Con attenzione scendere e posizionare il bisello a punta siringa da 10 microlitri caricata con 4 ml di soluzione delle cellule tumorali nel foro bava. Una volta che la smussatura dei SyriESN è l'ago sotto la superficie del cranio, si scende per un altro mm 3 e poi risalire per 0,5 mm. Iniettare lentamente la quantità desiderata di cellule tumorali, con una forza costante in un fotogramma 30 la seconda volta, nel cervelletto del destinatario. Lasciare l'ago al suo posto dopo il completamento di iniezione per altri due minuti. Quindi rimuovere l'ago e siringa. Clip della ferita utilizzando un autoclip.
- Tenere il mouse su una coperta riscaldamento dopo l'intervento per aiutare a mantenere la sua temperatura corporea. Modelli di mobilità e respiratorie verrà osservato continuamente. Una volta che il mouse recupera da anestesia, è posto di nuovo in una gabbia alloggiamento sterile. Monitorare giorno per l'assunzione di cibo e acqua, comportamento, governare, e la colorazione rossa degli occhi. Controllare eventuali segni di infezione nel sito di incisione. Rimuovere il autoclips al giorno 7 dopo l'intervento chirurgico.
Mantenere i topi per una media di 2-6 mesi e di sacrificio quelle che espongono i sintomi tipici medulloblastoma per ulteriori studi.
4. Rappresentante Risultati
Medulloblastomi secondario sviluppato in topi riceventi molto simile a quelle del tumore primario. Il cervello dei portatori di tumori secondari erano spesso allargata, amorfo con i vasi sanguigni ectopica evidente se visto nel suo complesso-monti. Analisi immunoistochimica del tessuto tumorale secondaria rivelato che le cellule tumorali sono altamente proliferative, esprimere forte SmoM2-YFP e marcatori dei precursori neuronali dei granuli cerebellari, come Math1 e Pax6. Quando i metodi con dissociato e colto riportato ("L'isolamento, l'arricchimento e il mantenimento delle cellule staminali medulloblastoma", Giove in stampa), il secondario cellule tumorali medulloblastoma possono essere espanse rapidamente, esprimere molteplici marcatori di cellule staminali, sono clonogenica e possono ulteriormente avviare la formazione di tumori quando trapiantate in ulteriori destinatari immunocompromessi.
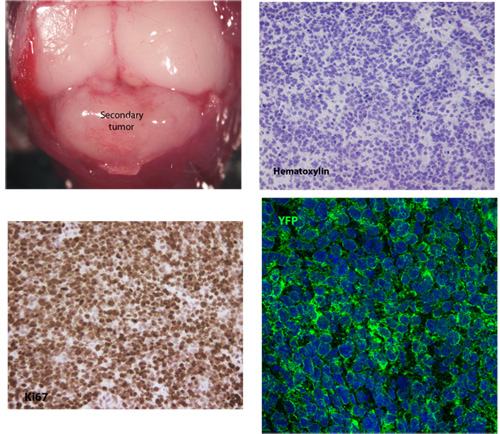
Figura 1. Tipica con tutto il supporto e viste in sezione di un tessuto medulloblastoma secondaria
Un tipico esempio di tessuto medulloblastoma secondario sviluppato 26 giorni dopo l'iniezione di 5x10 5 cellule del tumore primario. Colorazione ematossilina rivela la tipica morfologia cellulare del medulloblastoma, tra cui alti nucleare / citoplasma rapporto e il polimorfismo nucleare. Queste cellule tumorali secondarie sono altamente proliferative come indicato da Ki67 espressione e anche robusta esprimere membranose SmoM2-YFP.
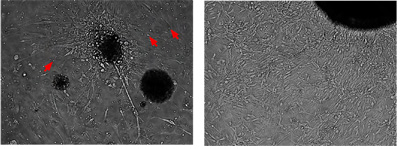
Figura 2. Cellule di medulloblastoma secondarie possono essere coltivate ed espanse in vitro
Utilizzando il protocollo descritto per le cellule primarie medulloblastoma del mouse ("L'isolamento, l'arricchimento e il mantenimento delle cellule staminali medulloblastoma", Giove in stampa), queste cellule secondarie medulloblastoma possono essere coltivate ed espanse per passaggi multipli. L'immagine mostra la stessa colonia tumore rappresentante colto in 4 giorni e 14 giorni. Le cellule tumorali in coltura sono bipolari, di forma allungata con citoplasma scarso e spesso si irradiano da un nucleo denso di aggregati cellulari. Essi non presentano contatto inibizione della crescita. Le piccole cellule rotonde sono globuli rossi.
Discussione
Diversi fattori critici di successo per garantire la cellula medulloblastoma allotrapianto che la formazione di tumori rendimenti secondarie sono le seguenti: in primo luogo, utilizzare solo Accutase 50% per il tessuto dissociazione e non oltre il digest del tessuto come trattamento enzimatico prolungata porta ad una significativa riduzione della vitalità delle cellule. Anche utilizzare solo il Pipetman taglia 1 ml più piccole punte può anche generare danni fisici alle cellule dissociate. E 'bene avere una miscela di celle singole e piccoli aggregati per allotrapianto. In secondo luogo, mescolare ed equilibrare la soluzione delle cellule tumorali ogni volta prima di caricare la siringa Hamilton. Non utilizzare più di 4 microlitri per ogni iniezione, come un volume maggiore genererebbe troppa pressione intracranica e la resistenza. Infine, è importante aspettare altri 2 minuti per consentire la soluzione iniettata dissipano nel tessuto cerebrale dopo ogni iniezione.
Le procedure descritte consentono la determinazione del tipo di cellule geneticamente marcato (s) in grado di avviare e propagare i tumori. Questo protocollo si applica anche alle situazioni in cui le cellule da iniettare non derivano direttamente dalla scuola primaria tessuto tumorale, ma da linee cellulari in coltura. Si può preparare un numero adeguato di cellule da uno digestione enzimatica e / o pipettaggio ripetitivo, e ripartire dal punto 2 del presente protocollo. Quindi, possiamo anche testare le funzioni dei geni candidati e l'effetto inibitorio di composti chimici con un tumore in vivo di crescita di lettura.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo studio è stato supportato anche da finanziamenti della Vanderbilt-Ingram Cancer Center Support Grant (P30 CA068485), il Brain Tumor Foundation Infanzia e il National Institutes of Health (NS042205).
Materiali
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Stereotaxic instrument | Stoelting Co. | 51730 | |
| Foredom flexible shaft drill, hang-up style | Stoelting Co. | 58650 | |
| Large probe holder | Stoelting Co. | 51633 | |
| 10 μL syringe, 26 ga., bevel tip | Stoelting Co. | 51105 | |
| Drill bit .75mm | Stoelting Co. | 51455-3 |
Riferimenti
- Schuller, U. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh-induced medulloblastoma. Cancer Cell. 14, 123-134 (2008).
- Yang, Z. J. Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell. 14, 135-145 (2008).
- Kessler, J. D. N-myc alters the fate of preneoplastic cells in a mouse model of medulloblastoma. Genes Dev. 23, 157-170 (2009).
- Flora, A., Klisch, T. J., Schuster, G., Zoghbi, H. Y., Y, H. Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma. Science. 326, 1424-1427 (2009).
- Salsano, E. Expression of the neurogenic basic helix-loop-helix transcription factor NEUROG1 identifies a subgroup of medulloblastomas not expressing ATOH1. Neuro Oncol. 9, 298-307 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon