Method Article
Intrakranielle orthotopen allogene von Medulloblastom Cells bei immungeschwächten Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Isolierung und Spaltung von Maus Medulloblastom Gewebe und anschließende allogene der Tumorzellen in immunsupprimierten Empfängermäuse um sekundäre Medulloblastom einzuleiten.
Zusammenfassung
Medulloblastom ist der häufigste pädiatrische Tumor des Nervensystems. Eine große Anzahl von Tierversuchen hat am Kleinhirn Granulat Neuron Vorstufen (CGNPs) als Zell-of-Origin für Medulloblastom 1-4 ausgerichtet. Allerdings deuten die vielfältigen klinischen Präsentationen Medulloblastom Subtypen bei menschlichen Patienten (knotige, desmoplastischen, klassische und große Zelle / anaplastischen), und die Tatsache, dass Medulloblastom in einer Untergruppe von menschlichen Patienten, die keine ektopische Expression von CGNP Marker 5 ist gefunden, dass die zellulären und molekularen Ursachen der Medulloblastom sind komplexer und weit davon entfernt, vollständig entschlüsselt. Daher ist es wichtig, festzustellen, ob es eine Alternative gibt Medulloblastom Tumorzelle-of-Origin auf dem Zelltyp-spezifische therapeutische Modalität entwickelt werden können basiert. Zu diesem Zweck wird intrakraniellen orthotopen Allotransplantaten von genetisch markierten Tumorzellen Arten durch nachträgliche Analysen der sekundären Entwicklung von Tumoren in Empfängern gefolgt ermöglichen die Bestimmung der zellulären Herkunft der Tumor-initiierende Zellen. Hier beschreiben wir die experimentelle Protokoll für intrakranielle orthotopen Allotransplantaten von Medulloblastom Zellen aus primären Tumorgewebe, und dieses Verfahren kann auch zur Transplantation von Zellen aus etablierten Zelllinien verwendet werden.
Protokoll
1. Micro-Dissektion der tumortragenden Kleinhirn und Dissoziation von Tumorgewebe
- Retrieval von Tumorgewebe
- Kranke Mäuse mit Medulloblastom oft runted und Display Hydrocephalus und typische neurologische Symptome, einschließlich posterior Lähmung und Unfähigkeit zur Haltung wieder, wenn umgeworfen. Zum Abrufen von Tumorgewebe, euthanize Mäusen durch Kohlendioxid Einatmen. Es ist imporant nicht Genickbruch, eine Prozedur, die Druck erzeugt, um den hinteren Schädel und kann Tumorgewebe Integrität Kompromiss führen.
- Enthauptung ist unmittelbar nach dem Tod mit einer Schere durchgeführt, das Entfernen von Haaren und Muskelgewebe so viel wie möglich für eine gute Visualisierung des Schädels. Reinigen Sie die Oberfläche des Schädels mit Kimwipe mit 95% Ethanol getränkt.
- Verwenden einer feinen Schere, um eine Öffnung entlang der Mittellinie des Schädels geschnitten, und entfernen Schädel Gewebe mit feinen Pinzette, an welcher Stelle das ganze Gehirn einschließlich tumortragenden Kleinhirn ausgesetzt ist.
- Während die cerebella von gesunden Erwachsenen gut definierten Hemisphären und Vermis-Display, sind die cerebella von Tumor-tragenden Mäusen oft vergrößert, amorph mit einer glatten Oberfläche und auffällige Blutgefäße. Mit sterilen Techniken, rufen Sie die Kleinhirntumor mit einer Pinzette und in eiskaltem Phosphat-gepufferter Kochsalzlösung (PBS) ohne Mg 2 + und Ca 2 +.
Hinweis: Alle Instrumente sind in 95% Ethanol und Dampf vor dem Gebrauch autoklaviert desinfiziert. - Die Dissoziation von Tumorgewebe
- Übertragen Sie die Tumorgewebe von PBS zu 50% Accutase (verdünnt in PBS), die etwa 4-mal das Volumen des Tumorgewebes ist, Hackfleisch das Gewebe mit einer feinen Schere für 3 Minuten bei Raumtemperatur, durch Inkubation bei 37 ° C für 4 Minuten , nach denen das Gewebe erfährt repetitive Pipettieren mit einer 1-mL Pipetman für weitere 3 Minuten. Diese Methode sollte Ausbeute eine Mischung aus Einzelzellen und kleine zelluläre Aggregate.
- Verdünnen Sie die Zellsuspension 3-fach mit PBS und zentrifugieren Sie für 5 Minuten bei 1000xg die Zellen zu pelletieren. (Die oben beschriebenen Verfahren haben in "Isolation, Anreicherung und Pflege von Medulloblastom Stammzellen" beschrieben worden, JoVE in press)
Zellpellet in frisch zubereiteten neuralen Stammzellen Medium, bestehend aus Neurobasal Medium mit Glutamin, Penicillin-Streptomycin, N2, B27, menschlichen EGF (25 ng / mL) und basic FGF (25 ng / mL). Berechnen Sie die Zelldichte der Lösung und entsprechende weitere Verdünnungen mit zusätzlichen neuralen Stammzellen Medium, so dass man 4 ul-Lösung mit einer entsprechenden Anzahl von dissoziierten Tumorzellen, zB 5x10 5 Last, in einen sterilen Kegel-Spitze 10 &mgr; l Spritze. Die genaue Zahl der Zellen geimpft werden sollten durch den Forscher nach bestimmten experimentellen Anforderungen bestimmt werden. Halten Sie die Zell-Lösung in einem Mini 200 ul Mikrozentrifugenröhrchen (PCR-Röhrchen) auf Eis.
2. Narkoseverfahren für die Empfängermäuse
Für den chirurgischen Eingriff, ist eine Desinfektion Bereich für Nager Operation für die Dauer des Verfahrens benötigt werden. Im Idealfall richten Sie eine lange Bank mit getrennten, aber benachbarten Gebieten für tierische Vorbereitung, OP-Feld und Tier Erholung. OP-Handschuhe, nicht Untersuchungshandschuhe sind für die Operation erforderlich. Aseptische Technik ist, indem behandschuhten Hände oberhalb der Taille gehalten und nur verwendet, um sterile Objekte aus einem trockenen und sterilen Oberfläche zu behandeln.
- Eine Mischung aus Ketamin (100 mg Ketamin pro 1 kg Maus Gewicht) und Xylazin (10 mg Xylazin pro 1 kg Maus Gewicht) ist für die Anästhesie verwendet. Verwalten Sie die Anästhetika intraperitoneal.
- Es dauert in der Regel 3-5 Minuten für die Anästhesie ihre volle Wirkung zu nehmen. Bestimmen Sie, ob eine Maus vollständig betäubt von toe / Schwanz kneifen wird. Legen Sie eine kleine Menge Augensalbe auf die Augen der Maus. Bringen Sie die vollständig narkotisierten Maus zum OP-Feld, die ständige Überwachung, um sicherzustellen, dass die Maus ist in der Regel zu atmen.
3. Intrakranielle Pfropfung der Tumorzellen
- Shave der dorsalen hinteren Kopfbereich der Maus, mit einer Haarschneidemaschine, mit der hinteren Schädel über das Mittelhirn und Kleinhirn zu enthüllen.
- Bewerben Betadine Lösung auf dem exponierten Kopfhaut mit einem Wattestäbchen, durch Abwischen mit einem Alkohol-Pad gefolgt. Wiederholen Sie diese beiden Sterilisationsschritte zweimal.
- Machen Sie einen Viertel-Zoll-Schnitt in der hinteren Kopfhaut mit einem sterilisierten Skalpell. Bohren Sie ein 0,5 mm Bohrloch 2 mm nach rechts und 2 mm hinter der Lambda mit einer sterilen Dentalbohrers.
- Platzieren Sie die Maus auf einen stereotaktischen Rahmen durch Einhaken seine Schneidezähne auf den Rahmen zu halten. Vorsichtig steigen und die Position der Kegel-Spitze 10 l-Spritze mit 4 ul Tumorzellen Lösung in das Bohrloch geladen. Sobald die Abschrägung der Nadel der Spritze unterhalb des Schädels Oberfläche, descend für weitere 3 mm und steigen dann für 0,5 mm. Langsam injizieren die gewünschte Menge von Tumorzellen, mit einem stetigen Kraft in einem 30 Sekunden Zeitfenster, in dem Kleinhirn des Empfängers. Lassen Sie die Nadel an ihrer Stelle nach Abschluss der Injektion für weitere zwei Minuten. Dann entfernen Sie die Nadel und Spritze. Clip die Wunde mit einem autoclip.
- Halten Sie die Maus auf eine wärmende Decke nach der Operation zur Aufrechterhaltung ihrer Körpertemperatur. Mobilität und Atemmuster wird kontinuierlich beobachtet werden. Sobald Sie die Maustaste wieder aus der Narkose, setzen Sie ihn wieder in eine sterile Gehäusekäfig. Monitor täglich für Futter-und Wasseraufnahme, Verhalten, Pflege, und Rot-Färbung der Augen. Überprüfen Sie auf Anzeichen einer Infektion an der Inzisionsstelle. Entfernen Sie die autoclips am Tag 7 nach der Operation.
Pflegen Sie die Maus für einen Durchschnitt von 2-6 Monaten und Opfer die Anzeige typischer Medulloblastom Symptome für weitere Studien.
4. Repräsentative Ergebnisse
Sekundäre Medulloblastome in Empfängermäuse entwickelt hoch ähnelten denen der primären Tumore. Die cerebella tragenden sekundären Tumoren waren oft vergrößert, amorph mit ektopischen Blutgefäße sichtbar, wenn sie als Ganzes-Halterungen angesehen. Immunhistochemische Analysen der sekundären Tumorgewebe ergab, dass die Tumorzellen stark proliferative sind, äußern starke SmoM2-YFP und Marker der Kleinhirn Granulat Neuron Vorstufen wie Math1 und Pax6. Wenn dissoziiert und kultiviert mit berichtete Methoden ("Isolation, Anreicherung und Pflege von Medulloblastom Stammzellen", JoVE in press), die sekundäre Medulloblastom Tumorzellen rasch erweitert werden kann, zum Ausdruck mehrere Stammzell-Marker sind klonogenen und kann weiter zu initiieren Tumorbildung bei transplantierten in zusätzliche immunsupprimierten Empfängern.
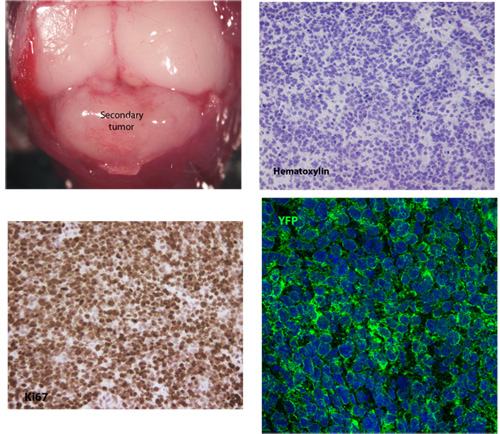
Abbildung 1. Typische ganzen-mount und Schnitte eines sekundären Medulloblastom Gewebe
Ein typisches Beispiel für sekundäre Medulloblastom Gewebe entwickelt 26 Tage nach der Injektion von 5x10 5 primären Tumorzellen. Hämatoxylin Färbung zeigt den typischen zellulären Morphologie Medulloblastom, darunter hohe nukleare / Plasma-Relation und Kernpolymorphie. Diese sekundären Tumorzellen sind hoch proliferative wie Ki67 Ausdruck angegeben und sie auch kräftig ausdrücken membranöse SmoM2-YFP.
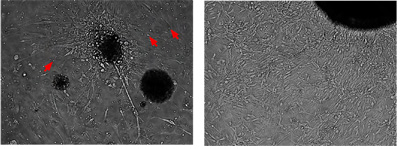
Abbildung 2. Sekundäre Medulloblastom-Zellen können kultiviert und erweitert werden in vitro
Mit dem Protokoll für die primäre Maustaste Medulloblastom-Zellen ("Isolation, Anreicherung und Pflege von Medulloblastom Stammzellen", JoVE in press) beschrieben, können diese sekundären Medulloblastom-Zellen kultiviert und erweitert werden für mehrere Passagen. Das Bild zeigt den gleichen repräsentativen Tumorkoloniebildung bei 4 Tage und 14 Tage kultiviert. Die kultivierten Tumorzellen sind bipolar, mit wenig Zytoplasma und oft strahlen aus einem dichten Kern der zellulären insgesamt verlängert. Sie zeigen nicht das Wachstum Kontakt Hemmung. Die kleinen runden Zellen sind rote Blutkörperchen.
Diskussion
Mehrere kritische Faktoren für eine erfolgreiche Medulloblastom Zelle Allotransplantaten, dass die Erträge sekundäre Tumorbildung sind wie folgt zu gewährleisten: Erstens, verwenden Sie nur 50% Accutase für Gewebedissoziation und nicht über-digest das Gewebe als verlängerte Enzymbehandlung führt zu einer signifikanten Reduktion der Lebensfähigkeit der Zellen. Nutzen Sie auch nur die 1 mL Größe Pipetman als kleinere Tipps auch erzeugen kann körperliche Schäden an der dissoziierten Zellen. Es ist schön, eine Mischung aus Einzelzellen und kleine Aggregate für Allotransplantaten haben. Zweitens, mischen und ins Gleichgewicht der Tumorzelle Lösung jedes Mal vor dem Laden des Hamilton-Spritze. Verwenden Sie nicht mehr als 4 ul für jede Injektion als ein größeres Volumen zu viel intrakraniellen Druck und Widerstand erzeugen würde. Schließlich ist es wichtig, eine zusätzliche 2 Minuten warten, damit der injizierten Lösung in den Kleinhirn-Gewebe nach jeder Injektion zu zerstreuen.
Die hier beschriebenen Verfahren erlauben die Bestimmung von genetisch markierten Zell-Typ (en), zu initiieren und zu verbreiten Tumoren. Dieses Protokoll gilt auch für Situationen, in denen die Zellen injiziert werden nicht abgeleitet werden direkt aus primärem Tumorgewebe, sondern von etablierten kultivierten Zelllinien. Man kann die entsprechende Anzahl von Zellen entweder durch Verdau und / oder wiederholtes Pipettieren vorzubereiten, und beginnen Sie mit Schritt 2 dieses Protokolls. Deshalb können wir auch testen Sie die Funktionen der Kandidatengene und die hemmende Wirkung von chemischen Verbindungen mit einer in vivo Tumor-Wachstum Anzeige.
Offenlegungen
Danksagungen
Diese Studie wurde durch Zuschüsse der Vanderbilt-Ingram Cancer Center Support Grant (P30 CA068485), der Hirntumor bei Kindern Foundation und den National Institutes of Health (NS042205) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Stereotaxic instrument | Stoelting Co. | 51730 | |
| Foredom flexible shaft drill, hang-up style | Stoelting Co. | 58650 | |
| Large probe holder | Stoelting Co. | 51633 | |
| 10 μL syringe, 26 ga., bevel tip | Stoelting Co. | 51105 | |
| Drill bit .75mm | Stoelting Co. | 51455-3 |
Referenzen
- Schuller, U. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh-induced medulloblastoma. Cancer Cell. 14, 123-134 (2008).
- Yang, Z. J. Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell. 14, 135-145 (2008).
- Kessler, J. D. N-myc alters the fate of preneoplastic cells in a mouse model of medulloblastoma. Genes Dev. 23, 157-170 (2009).
- Flora, A., Klisch, T. J., Schuster, G., Zoghbi, H. Y., Y, H. Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma. Science. 326, 1424-1427 (2009).
- Salsano, E. Expression of the neurogenic basic helix-loop-helix transcription factor NEUROG1 identifies a subgroup of medulloblastomas not expressing ATOH1. Neuro Oncol. 9, 298-307 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten