Method Article
Gramicidina baseado em Ensaio de fluorescência; para determinar Moléculas Pequenas Potencial para Modificação de Propriedades bicamada lipídica
Neste Artigo
Resumo
Nós introduzimos um ensaio de fluorescência baseada rápido que monitora a taxa de extinção de fluorescência como uma medida da atividade do canal gramicidin. Os canais gramicidin são usados como transdutores de força molecular para monitorar as mudanças nas propriedades bicamada lipídica como sentiu por proteínas bicamada de expansão.
Resumo
Muitas drogas e outras moléculas pequenas usadas para modular a função biológica são anfifílicos que adsorvem na interface bicamada / solução e, assim, alterar as propriedades de bicamada lipídica. Isto é importante porque as proteínas da membrana são energeticamente acoplado a sua bicamada acolhimento por interações hidrofóbicas. Alterações nas propriedades bicamada, assim, alterar a função da membrana de proteína, que fornece uma maneira indireta de anfifílicos para modular a função das proteínas e um possível mecanismo para "fora do alvo" efeitos de drogas. Nós já desenvolveram um ensaio para a detecção de alterações eletrofisiológicas nas propriedades bicamada lipídica utilizando canais gramicidin linear como sondas 3,12. Canais gramicidina são mini-proteínas formadas pela dimerização transbilayer de duas subunidades não-condutor. Eles são sensíveis a mudanças em seu ambiente de membrana, o que os torna sondas poderosa para acompanhamento da evolução das propriedades bicamada lipídica como sentiu por proteínas bicamada de expansão. Nós agora demonstrar um ensaio de fluorescência para a detecção de alterações nas propriedades bicamada utilizando os mesmos canais como sondas. O ensaio é baseado na medição do tempo de percurso de extinção de fluorescência de fluoróforo-carregado vesículas unilamelares grandes devido à entrada de um supressor através dos canais gramicidin. Usamos o par indicador / supressor de fluorescência 8-aminonaftaleno-1 ,3,6-trisulfonate (ANTS) / Tl + que tem sido utilizado com sucesso em outros ensaios extinção de fluorescência 5,13. Tl + permeia a bicamada lipídica lentamente 8, mas passa facilmente através da realização de canais gramicidin 1,14. O método é escalável e adequado tanto para estudos mecanísticos e high-throughput screening de moléculas pequenas para bicamada perturbando, e potencial "fora do alvo", os efeitos. Nós achamos que os resultados obtidos utilizando este método estão em boa concordância com resultados anteriores eletrofisiológicas 12.
Protocolo
1. Gerar ANTS cheio de Lipossomas
- No dia 1, remover solvente orgânico a partir de lipídios.
- Retire do freezer de lipídios e deixá-lo atingir a temperatura ambiente.
- Adicionar 0,6 mL de 25 mg / mL (1,2-dierucoyl-sn-glicero-3-fosfocolina) lipídico em clorofórmica solução para um balão de fundo 25 mL rodada.
- Continuamente girar o frasco durante a secagem em nitrogênio, até que todos os clorofórmio tenha evaporado e uma fina película branca de camadas lipídicas toda a metade inferior do balão.
- Seco em um dessecador sob vácuo durante a noite.
- No dia 2, prepare a amostra com o fluoróforo que serão incorporados nas vesículas.
- Reidratar em 100 mM NaNO 3, 25 mM ANTS (Na sal), 10 mM HEPES. Use HNO 3 ou NaOH para ajustar o pH para 7,0. Cada molécula de formigas tem 2 + Na, para um total de 150 mM [Na +]. Adicionar 1,671 mL de eletrólito para obter uma suspensão lipídica 10 mM.
- Parafilme e vortex suspensão completamente.
- Proteger amostra da luz com papel alumínio e deixe-a idade em temperatura ambiente durante a noite.
- No dia 3, fazer grandes vesículas unilamelares e remover todos os fluoróforo de fora das vesículas.
- Sonicate por 1 min em um sonicador de baixa potência.
- Congelamento e descongelamento da amostra 5-6 vezes, cada vez com 5 minutos em gelo seco e 5 minutos em água morna (~ 50 ° C) de água.
- Extrude a suspensão lipídica usando uma mini-extrusora Avanti. Configurar o mini-extrusora com um filtro de 0,1 mícron de policarbonato e suportes dos filtros (ver extrusora manual para detalhes). Extrude a suspensão e voltar 21 vezes de tal forma que a suspensão acaba na seringa oposto. Quando vários lotes são extrudados, lembre-se sempre para carregar amostras com a mesma seringa. Durante a extrusão da suspensão lipídica nublado inicial deve-se quase translúcido (ainda vai ser amarelo devido ao fluoróforo ANTS). Se a extrusão de repente se torna mais fácil e menos pressão é necessária para mover através do filtro, o filtro pode ter rompido e precisa ser substituído.
- Remover ANTS externa, executando a suspensão extrudados através de uma coluna de dessalinização PD-10 usando um protocolo de gravidade. Equilibrar coluna com 20-30 mL de Na-tampão (140 mM NaNO 3, 10 mM HEPES, pH 7.0, lembre-se de usar HNO 3 ou NaOH para ajustar o pH). Adicionar 1,5 mL da suspensão lipídica extrudado para a coluna e deixá-lo escoar dentro Traga o volume total da amostra para 2,5 mL, adicionando 1 mL Na-buffer. Após o buffer é totalmente incorporada na coluna e nada está vazando, eluir os lipossomas com 3 mL de Na-buffer e coletar a amostra resultante. O ANTS resultando cheia LUV solução de reserva deve conter cerca de lipídios mM 4-5 e aparecem translúcido branco leitoso. Proteger a amostra da luz com papel alumínio.
- Se a solução de reserva não for utilizado imediatamente loja, a 13 ° C para um máximo de 7 dias. Atenção: não congelar ou resfriar a solução de lipídios abaixo do seu líquido-cristal a fase de temperatura (~ 12 ° C), pois isso irá destruir a integridade da vesícula e do fluoróforo irá vazar transição.
2. Mix Solução de fluorescência
- 24 horas antes do uso, diluir lipossomas e incubar com gramicidin (a 13 ° C). Equilíbrio de gramicidin entre monocamadas as vesículas lipídicas "interna e externa é um processo lento, exigindo uma longa incubação.
- Vortex completamente o ANTS-cheia LUV solução de ações como a luvs têm uma densidade> 1 g / mL e, portanto, de sedimentos nas soluções.
- Misture o ANTS-cheia LUV 01:20 ações de Na-buffer. Misture todos os lipossomas para uso em um dia de experiências juntos em um único frasco para melhorar a uniformidade da amostra.
- Separar 04/03 dos lipossomas e adicionar 260 Nm gramicidin pré-diluído em DMSO (500 mcg / mL).
- Para os restantes 04/01 adicionar o mesmo volume de DMSO (sem gramicidin) para manter a concentração do solvente constante em todas as amostras.
3. Configuração do aparelho de fluorescência
- Usamos um Fotofísica Aplicada SX.20 espectrofluorímetro stopped-flow com controle de temperatura para medir a taxa de extinção de fluorescência.
- Vire os instrumentos em uma hora de antecedência para permitir o aquecimento. Os componentes são: computador, unidade de controle eletrônico, banho-maria (ambos refrigerador e aquecedor), fonte de alimentação da lâmpada e tanque de nitrogênio.
- Criar as condições de gravação utilizando o software Pro-Data SX.
- Definir o comprimento de onda de excitação a 352 nm monocromador e aberturas largura da fenda de excitação para 01/01.
- Usar um λ = 455 nm filtro passa-alta para gravar a emissão.
- Use a "pressão Hold" configuração, que permite que o instrumento para manter a pressão de nitrogênio durante a gravação e, assim, evita oscilações de pressão (e artefatos de gravação) durante o primeiro poucos milissegundos.
- Conjunto de "Time "para um s e" Pontos "para 5000.
- Use a caixa de repetir e ajustar o número de repetições, normalmente usamos 9 e 13 repetições para buffer e funciona quencher, respectivamente.
- Banho-maria a temperatura deve ser ajustado para 25 ° C, a temperatura deve ser monitorada no software SX.
- Definir o volume do disco para 120 mL, o que significa que cada vez que o instrumento funciona uma amostra, mistura 60 mL de cada uma das duas seringas. Com esta configuração instrumental, um volume de 120 mL dá um tempo morto de ≈ 1,2 ms.
- Ajustar a tensão alta (ganho) sobre o detector de fluorescência para a saída do ANTS-lipossomas de ser em torno de 8. Para uma mistura padrão experimental o ganho deve ser 400-420 V. Algumas drogas são fluorescentes, de tal forma que eles podem saturar o sinal de fluorescência. Nestes casos, o ganho / tensão deve ser diminuída.
- Sempre carregue a amostra fluorescente dentro da seringa para a esquerda e buffer / quencher na seringa direita. Certifique-se completamente vórtice todas as amostras contendo lipossomas antes do carregamento, e estar ciente de que o luvs com o tempo vai resolver na seringa.
4. Fazendo uma experiência
- Prepare uma amostra de ANTS-carregado luvs com qualquer solvente ou composto, e carregar no espectrofluorímetro juntamente com tanto Na-tampão ou Tl-quencher (50 mM TlNO 3, 94 mM NaNO 3, 10 mM HEPES pH 7,0).
- Use 1,5 ml diluída ANTS-LUV solução, com ou sem gramicidin, preparado no dia anterior.
- Adicionar o composto na concentração desejada ou o solvente para controles. Manter a concentração de solvente a um mínimo e constante em todas as amostras. As concentrações terá de ser ajustada com qualquer composto (desconhecido) nova para alcançar o desejado intervalo de dose-resposta. Incubar por 10 min a 25 ° C no escuro.
- Vortex do LUV amostra e carregar para dentro da seringa esquerda. Carregar o Na-tampão ou Tl-quencher dentro da seringa direita.
- Eliminar completamente as bolhas de ar de ambas as amostras, empurrando as seringas e para trás.
- Certifique-se de ambas as seringas são carregados igualmente antes de fechar as válvulas. Carregamento desigual irá resultar em pré-mistura de soluções antes de chegar a câmara de gravação.
- Para a amostra primeiro, o registro da fluorescência com o Na-tampão, repita quatro vezes, ajustar a tensão alta (ganho) como necessário, e repita 5 vezes.
- Para as demais amostras, registro 9 repete com Na-buffer.
- Na substituir o tampão com o Tl-quencher e recorde de 13 repetições.
- Lavar com água e continuar com a amostra seguinte. Como controles usamos amostras com: no gramicidin e com solvente, não gramicidin e com a concentração de compostos máxima, com ambos os gramicidin e solvente.
5. Dados da análise
- Transferir os resultados para o computador de análise. Ler todos os dados em MATLAB para a análise. Para cada amostra, lido em todas as tampão e repete quencher, excluindo os quatro primeiros em cada caso, como os artefatos contêm mistura. Assumindo um volume de 120 mL disco que leva um pouco menos de quatro tiros para limpar completamente a mistura anterior do tubo stopped-flow.
- O tampão repete para todas as amostras devem ser muito semelhantes. Se houver uma mudança significativa no sinal de fluorescência, o que depende da concentração composto, em seguida, o composto em si pode ser fluorescente e pode ser necessário para a primeira subtrair o sinal de fluorescência extras antes de normalizar as amostras.
- Manualmente através dos traços e remover "mau" repete: repete contendo picos ou desvios multi-exponencialidade devido a artefatos de mistura e / ou bolhas.
- Normalizar a repete quencher ao valor médio inicial da repetições de buffer para cada amostra. Combine as médias de todas as amostras em um gráfico para visualização.
- Traços gravados sem gramicidin devem ser todos semelhantes e mostram quase extinção ausência de fluorescência, pode haver uma redução lenta no sinal de fluorescência devido ao lento vazamento de Tl + através da bicamada vesículas 8. Se a amostra sem gramicidin e nenhum modificador mostra quenching significativo, então as vesículas se deterioraram e não deve ser usado posteriormente. Se as amostras sem gramicidin mas com o modificador de mostrar quenching significativo, então o modificador perturba a bicamada vesículas de tal forma que permite que o fluoróforo ou quencher para atravessar a bicamada.
- Se o composto altera propriedades bicamada lipídica, como percebida pelos canais gramicidin, o tempo de fluorescência será visivelmente alterado.
- Para cada amostra, uma exponencial esticada
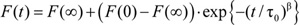 por exemplo, 4) está apto para o primeiro 200-100 ms da curva de extinção de fluorescência normalizado do indivíduo e repete a taxa de
por exemplo, 4) está apto para o primeiro 200-100 ms da curva de extinção de fluorescência normalizado do indivíduo e repete a taxa de  4calculado em 2 ms. Médias e desvios-padrão são calculados para uma dada amostra de todas as repete individual.
4calculado em 2 ms. Médias e desvios-padrão são calculados para uma dada amostra de todas as repete individual. - Finalmente, determinar a mudança relativa na taxa de saciar normalizando com a amostra mais próxima de controle em tempo que gramicidin e nenhum modificador.
6. Resultados representante
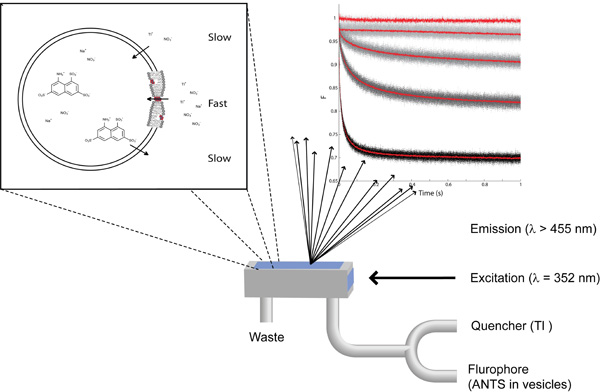
Figura 1: Os fundamentos do ensaio saciar baseado fluorescência para detectar mudanças nas propriedades bicamada lipídica Top left:. A zoom-in em uma vesícula de lipídios único com ANTS mais NaNO 3 no interior e NaNO 3 mais TlNO três no exterior. Superior direito: O sinal de fluorescência gravados utilizando (forma de cima para baixo) ANTS cheio de vesículas sem quencher, com quencher, com quencher e pré-dopado com 87, 260 e 780 gramicidin nM. Inferior: Representação esquemática da câmara de fluxo interrompido de mistura.
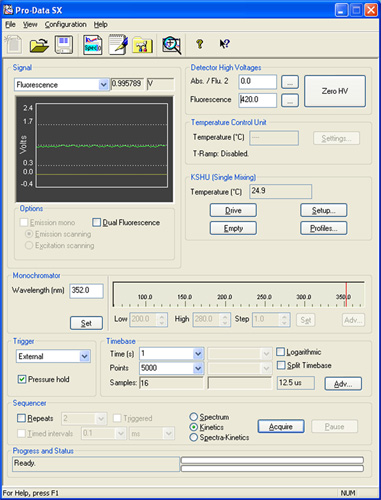
Figura 2: A captura de tela a partir do software SX Pro-Data ilustrando os vários painéis de referência na descrição da configuração experimental.

Figura 3:. Determinações repetir múltiplas do sinal de fluorescência de formigas-carregado com luvs Na-tampão Os primeiros quatro repetições são sempre excluídos, pois eles contêm artefatos de mistura. A tubulação que liga o seringas de amostra para a célula de mistura tem um volume definido, por isso se repete primeiros nos dará uma leitura do que estava anteriormente na tubulação: água para repetir 1 e 2, uma combinação de água e amostra para repetir 3, na maior parte da amostra para repetir 4, e apenas uma amostra para o restante repete.
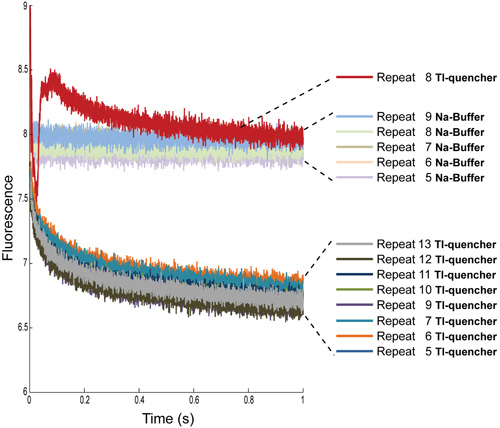
Figura 4:. Determinações repetir múltiplas do sinal de fluorescência de formigas-carregado com luvs Na-tampão e com Tl-quencher Os primeiros quatro repetições foram removidos de ambas as condições. Além disso, para as medições Tl quencher, repita 8 precisa ser removido devido a artefatos, bolhas de ar mais provável.

. Figure 5: Efeito da capsaicina (Cap) sobre o curso tempo de ANTS extinção de fluorescência (A) sinal de fluorescência normalizada mais de 1 s, cinza pontos denotam os resultados de todas as repetições (n> 5 por condição); linhas vermelhas indicam a média de todos repete. (B) Os primeiros 100 ms, cinza pontos denotam os resultados de uma repetição único para cada condição; linhas vermelhas são esticadas encaixa exponencial (2-100 ms) para as repetições. A linha pontilhada azul indica o 2 ms marca, o momento em que a taxa de extinção é determinado. Em ambos A e B o traço superior mostra resultados na ausência de Tl +; os próximos dois traços mostrar resultados na ausência de GA, com Tl + ± Cap, os quatro traços inferiores mostram resultados com 260 nM e gA + Tl, onde os números denotam [Cap] em mM. As taxas de extinção de 0, 10, 30 e 90 Cap M, conforme determinado pela taxa de uma exponencial esticada, são 36 ± 6, 69 ± 6, 85 ± 8 e 247 ± 27 (média ± dp, n> 8) , respectivamente.
Discussão
Nós demonstramos um ensaio de fluorescência baseada rápido para determinar o potencial de modificar bicamada de drogas e outros anfifílicos de pequeno porte. Compostos que modificam propriedades bicamada são susceptíveis de alterar a função da membrana de proteína de uma maneira indireta inespecífica, possivelmente contribuindo para "fora do alvo" efeitos de drogas. O ensaio explora o poder dos canais de gramicidin como sondas para mudanças nas propriedades bicamada 12 que são sentidos pela bicamada-spanning proteínas. Os resultados obtidos utilizando o ensaio de fluorescência baseada estão em bom acordo com os resultados de experimentos de canal único gA 12, indicando que este método pode ser usado para estudos mecanísticos, bem como para bibliotecas de compostos de triagem. Usando a configuração atual do ensaio podemos testar dezenas de compostos de um dia, que é um-para-duas ordens de magnitude maior rendimento do que seria possível usando a abordagem de um único canal. Não há limitação de taxa de fundamentais os passos no ensaio de fluorescência de base, o que significa que ele pode ser estendido para executar no modo de alto rendimento verdadeiro. É possível variar as soluções do ensaio de eletrólitos e / ou uso composição lipídica diferente para a Luvs '. É interessante notar que algumas composições de lipídios pode separar quando secas, que exigem sistemas de troca rápida de solvente em vez de secagem / hidratação passos 7.
Ainda não está claro se há uma relação causal entre o aumento da lipofilicidade leva de drogas e aumentar o atrito no desenvolvimento de medicamentos 10,11,17 e, em caso afirmativo, quais são os mecanismo subjacente (s)? No entanto, porque as proteínas da membrana tendem a ser regulado por mudanças em seu ambiente de membrana 2, seria prudente testar se as drogas anfifílicas e leva drogas alteram as propriedades bicamada lipídica e pertinentes, em caso afirmativo, em que concentrações? Anfifílico adsorção na dupla camada lipídica que empobrecem a fase aquosa, pois a concentração relevante é a concentração livre na fase aquosa que pode ser várias ordens de magnitude menor do que a concentração nominal do sistema, por exemplo, 6,9,16. Se uma molécula desejada (biológico) efeitos ocorrem em concentrações que ele altera as propriedades bicamada, torna-se importante fazer a distinção entre o "não-específicas", bicamada mediada por alterações na função da proteína de membrana, ao contrário de efeitos diretos devido a (alta afinidade ) vinculação a uma ou mais proteínas-alvo. Conhecendo a propensão bicamada de modificação de uma vantagem de drogas, descoberto através de high-throughput screening convencional, é, portanto, provável que seja importante para as decisões sobre seu futuro desenvolvimento.
Qualquer anfifílico, em algum concentração alterar alguma propriedade bicamada. Principais considerações, portanto, tornam-se: em que concentração, e são as alterações nas propriedades bicamada detectado pelo (bicamada-spanning) proteínas da membrana? Aqui nós explorar a capacidade de gramicidin para formar canais por transbilayer dimerização 15. Isso os torna sondas útil para o acoplamento energético entre bicamadas lipídicas e proteínas bicamada-incorporado, e para explorar pequenas moléculas se alteram as propriedades bicamada que são captados por proteínas da membrana. O ensaio é rápido, confiável e escalável, e, portanto, adequado tanto para estudos biofísicos e para a seleção bibliotecas de compostos para drogas com potencial bicamada perturbando-efeitos.
Para obter informações adicionais sobre o ensaio, a verificação da eficácia do ensaio, e comparação com a eletrofisiologia single-channel ver 12.
Divulgações
Agradecimentos
Agradecemos a Michael J. Bruno, Radda Rusinova e Jon T. Sack para muitas discussões estimulantes. Apoio financeiro do NIH, R01GM021342 e complementar ARRA R01GM021342-35S1, ea Josiah Macy, Jr. da Fundação para a SAOS, o Tri-I programa CMB para HII, e L. A Iris e Leverett S. Woodworth Medical Fellowship Scientist e NIH MSTP conceder GM07739 para RK.
Materiais
| Name | Company | Catalog Number | Comments |
| ANTS | Invitrogen | A-350 | |
| gramicidin | Sigma-Aldrich | G-5002 | |
| 1,2-dierucoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipid, Inc | 850398C | |
| Mini-Extruder kit | Avanti Polar Lipid, Inc | 610000 | |
| PD-10 Desalting column | Sigma-Aldrich | 54805 |
Referências
- Andersen, O. S. Ion transport through simple membranes. Renal Function. Giebisch, G. H., Purcel, E. F. , The Josiah Macy, Jr. Foundation. New York. (1978).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: An energetic perspective. Annu. Rev. Biophys. Biomol. Struct. 36, 107-130 (2007).
- Andersen, O. S., Koeppe, R. E., Roux, B. Gramicidin channels. Versatile tools. Biological Membrane Ion Channels: Dynamics, Structure, and Applications. Chung, S. -H., Andersen, O. S., Krishnamurthy, V. , Springer Verlag. New York. (2007).
- Berberan-Santos, M. N., Bodunov, E. N., Valeur, B. Mathematical functions for the analysis of luminescence decays with underlying distributions 1. Kohlrausch decay function (stretched exponential. Chem. Phys. 315, 171-182 (2005).
- Bruggemann, E. P., Kayalar, C. Determination of the molecularity of the colicin E1 channel by stopped-flow ion flux kinetics. Proc. Natl. Acad. Sci. USA. 83, 4273-4276 (1986).
- Bruno, M. J., Koeppe, R. E., Andersen, O. S. Docosahexaenoic acid alters bilayer elastic properties. Proc. Natl. Acad. Sci. USA. 104, 9638-9643 (2007).
- Buboltz, J. T., Feigenson, G. W. A novel strategy for the preparation of liposomes: rapid solvent exchange. Biochim. Biophys. Acta. 1417, 232-245 (1999).
- Gutknecht, J. Cadmium & thallous ion permeabilities through lipid bilayer membranes. Biochim. Biophys. Acta. 735, 185-188 (1983).
- Ingólfsson, H. I., Koeppe, R. E., Andersen, O. S. Curcumin is a modulator of bilayer material properties. Biochemistry. 46, 10384-10391 (2007).
- Keserü, G. M., Makara, G. M. The influence of lead discovery strategies on the properties of drug candidates. Nat. Rev. Drug Discov. 8, 203-212 (2009).
- Leeson, P. D., Springthorpe, B. The influence of drug-like concepts on decision-making in medicinal chemistry. Nat. Rev. Drug Discov. 6, 881-890 (2007).
- Lundb k, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S., S, O. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. J. R. Soc. Interface. 7, 373-395 (2010).
- Moore, H. P. &, Raftery, M. A. Direct spectroscopic studies of cation translocation by Torpedo acetylcholine receptor on a time scale of physiological relevance. Proc. Natl. Acad. Sci. USA. 77, 4509-4513 (1980).
- Neher, E. Ionic specificity of the gramicidin channel and the thallous ion. Biochim. Biophys. Acta. 401, 540-544 (1975).
- O'Connell, A. M., Koeppe, R. E., Andersen, O. S. Kinetics of gramicidin channel formation in lipid bilayers: transmembrane monomer association. Science. 250, 1256-1259 (1990).
- Søgaard, R. GABAA receptor function is regulated by lipid bilayer elasticity. Biochemistry. 45, 13118-13129 (2006).
- Waring, M. J. Defining optimum lipophilicity and molecular weight ranges for drug candidates-Molecular weight dependent lower logD limits based on permeability. Bioorg. Med. Chem. Lett. 19, 2844-2851 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados