Method Article
Gramicidina basado en ensayo de fluorescencia, para la determinación de moléculas pequeñas posibles para modificar las propiedades bicapa lipídica
En este artículo
Resumen
Se introduce una rápida basada en fluorescencia ensayo que controla la tasa de extinción de fluorescencia como una medida de la actividad del canal gramicidina. Los canales de gramicidina se utilizan como sensores de fuerza molecular para monitorear los cambios en las propiedades de bicapa lipídica detectada por las proteínas de dos capas de expansión.
Resumen
Muchos fármacos y otras moléculas pequeñas que se utilizan para modular la función biológica se anfifilos que adsorben en la interfase de dos capas / solución y por lo tanto alterar las propiedades de bicapa lipídica. Esto es importante porque las proteínas de membrana son energéticamente, junto a sus dos capas de acogida por interacciones hidrofóbicas. Cambios en las propiedades de dos capas por lo tanto alterar la función de proteínas de membrana, que proporciona una forma indirecta de anfifilos para modular la función de proteínas y un posible mecanismo para "fuera de objetivo" efectos de los medicamentos. Anteriormente hemos desarrollado un ensayo electrofisiológico para detectar cambios en las propiedades bicapa lipídica con canales lineales gramicidina como sondas 3,12. Los canales de gramicidina son mini-proteínas formadas por la dimerización transbilayer de dos organizaciones no-realización de las subunidades. Son sensibles a los cambios en su entorno de membrana, lo que las hace las sondas de gran alcance para vigilar los cambios en las propiedades de bicapa lipídica detectada por las proteínas de dos capas de expansión. Ahora demuestran un ensayo de fluorescencia para la detección de cambios en las propiedades de dos capas utilizando los mismos canales que las sondas. El ensayo se basa en la medición del tiempo-por supuesto de extinción de fluorescencia de fluoróforo cargado vesículas unilamelares grandes debido a la entrada de un extintor a través de los canales de gramicidina. Usamos la fluorescencia indicador / extintor par de 8 aminonaftaleno-1 ,3,6-trisulfonato (hormigas) / Tl + que ha sido utilizado con éxito en otros ensayos de extinción de fluorescencia 5,13. Tl + impregna la bicapa lipídica lentamente 8, pero pasa fácilmente a través de la realización de canales de gramicidina 1,14. El método es escalable y adecuado tanto para estudios de mecánica y de alto rendimiento de detección de pequeñas moléculas de doble capa-perturbadora, y su potencial "en blanco", los efectos. Nos encontramos con que los resultados con este método se encuentran en buen acuerdo con los anteriores resultados electrofisiológicos 12.
Protocolo
1. Generar HORMIGAS lleno de liposomas
- El día 1, eliminar el disolvente orgánico a partir de lípidos.
- Eliminar los lípidos del congelador y dejar que alcancen la temperatura ambiente.
- Añadir 0,6 ml de 25 mg / ml (1,2-dierucoyl-sn-glicero-3-fosfocolina) de lípidos en solución de cloroformo a un matraz de fondo redondo de 25 ml.
- Continuamente girar el matraz durante el secado en atmósfera de nitrógeno, hasta que todo el cloroformo se ha evaporado y una fina capa blanca de las capas de lípidos toda la mitad inferior de la botella.
- Seca en un desecador al vacío durante la noche.
- El día 2, preparar la muestra con el fluoróforo que se incorporarán en las vesículas.
- Rehidratar en 100 mM NaNO 3, 25 mM HORMIGAS (sal Na), HEPES 10 mM. Use HNO 3 o NaOH para ajustar el pH a 7.0. Cada molécula de hormigas tiene 2 + Na, para un total de 150 mM [Na +]. Añadir 1,671 ml de electrolito para obtener una suspensión mM de lípidos 10.
- Parafilm y agitar la suspensión a fondo.
- Proteger la muestra de la luz con papel aluminio y dejar que la edad a temperatura ambiente durante la noche.
- El día 3, hacer grandes vesículas unilamelares y eliminar todos los fluoróforo de fuera de las vesículas.
- Someter a ultrasonidos durante 1 minuto en un baño de ultrasonidos de baja potencia.
- De congelación y descongelación de la muestra 5.6 veces, cada vez con 5 minutos en hielo seco y 5 minutos en agua caliente (~ 50 ° C).
- Extruir la suspensión de lípidos mediante un Avanti mini-extrusora. Configurar el mini-extrusora con un 0,1 micras filtro de policarbonato y apoya filtro (consulte el manual de extrusión para más detalles). Extruir la suspensión de ida y vuelta 21 veces de tal manera que la suspensión termina en la jeringa contrario. Cuando varios lotes se sacan, recuerde siempre que la carga de muestras con la misma jeringa. Durante la extrusión de la suspensión turbia lipídico inicial debe ser casi transparente (que seguirá siendo amarillo debido a la fluoróforo hormigas). Si la extrusión de repente se vuelve más fácil y menos presión es necesaria para moverse a través del filtro, el filtro puede tener roto y necesita ser reemplazado.
- Quitar HORMIGAS externo mediante la ejecución de la suspensión de extrusión en una columna de desalación PD-10 mediante un protocolo de gravedad. Equilibrar la columna con 20-30 ml de Na-buffer (140 mM NaNO 3, 10 mM HEPES, pH 7,0, recuerde utilizar HNO 3 y NaOH para ajustar el pH). Añadir 1,5 ml de la suspensión de lípidos extruido a la columna y deje que se filtre pulg obtener un volumen total de la muestra de 2,5 ml mediante la adición de 1 ml de Na-buffer. Después de que el tampón se incorpore plenamente en la columna y no se está filtrando, eluir los liposomas con 3 ml de Na-buffer y recoger la muestra resultante. El resultado llena de hormigas LUV solución de reserva debe contener alrededor de los lípidos de 4-5 mm y parecen translúcidas de color blanco lechoso. Proteger la muestra de la luz con papel de aluminio.
- Si la solución de reserva no se utiliza inmediatamente, almacenar a 13 ° C por un máximo de 7 días. Advertencia: no se congelan o enfriar la solución de lípidos por debajo de su líquido a temperatura de transición de fase de cristal (~ 12 ° C), ya que esto va a destruir la integridad de las vesículas y el fluoróforo se escapará.
2. Mezcla de fluorescencia de soluciones
- 24 horas antes de su uso, diluir los liposomas y se incuban con gramicidina (a 13 ° C). Equilibrio de gramicidina entre monocapas las vesículas lipídicas "internos y externos es un proceso lento, que requiere una larga incubación.
- Agite bien en vórtex las hormigas llenas de LUV solución madre como el LUVs tienen una densidad> 1 g / ml y por lo tanto, los sedimentos en las soluciones.
- Mezclar las hormigas llenas de LUV 1:20 acciones de Na-buffer. Mezclar todos los liposomas para su uso en un solo día de los experimentos juntos en un solo frasco para mejorar la uniformidad de la muestra.
- Separar 3 / 4 de los liposomas y añadir 260 nm gramicidina previamente diluido en DMSO (500 mg / mL).
- Para el restante 1 / 4 añadir el mismo volumen de DMSO (sin gramicidina) para mantener la concentración de disolvente constante en todas las muestras.
3. La creación del Instrumento de fluorescencia
- Nosotros usamos un Fotofísica Aplicada SX.20 flujo detenido espectrofluorómetro con control de temperatura para medir la tasa de extinción de fluorescencia.
- A su vez los instrumentos de una hora de anticipación para permitir la entrada en calor. Los componentes son: informática, unidad de control electrónico, baño de agua (tanto frío y calor), el suministro de potencia de la lámpara y el tanque de nitrógeno.
- Establecer las condiciones de grabación con el software Pro-Data SX.
- La longitud de onda de excitación monocromador a 352 nm y aperturas de corte ancho para la excitación de 1 / 1.
- Use un λ = 455 nm filtro pasa-altos para grabar la emisión.
- Utilice la opción "mantener la presión" el establecimiento, lo que permite que el instrumento para mantener la presión de nitrógeno durante la grabación y por lo tanto evita oscilaciones de la presión (y los artefactos de grabación) durante la primera unos pocos milisegundos.
- Set "Time "a 1 s, y" Puntos "en 5000.
- Utilice el cuadro de repetir y ajustar el número de repeticiones, normalmente usamos 9 y 13 repeticiones para el búfer y se ejecuta extintor, respectivamente.
- Baño de agua la temperatura se debe establecer en 25 ° C, la temperatura debe ser monitoreada en el software de SX.
- Ajuste el volumen del disco a 120 l, lo que significa que cada vez que el instrumento funciona de una muestra, se mezcla 60 l de cada una de las dos jeringas. Con esta configuración instrumental, un volumen de 120 l da un tiempo muerto de ≈ 1,2 ms.
- Ajuste la alta tensión (ganancia) en el detector de fluorescencia para la salida de las hormigas-liposoma es de alrededor de 8. Para una mezcla estándar experimental de la ganancia debe ser 400 a 420 V. Algunos medicamentos son fluorescentes, de manera que puedan saturar la señal de fluorescencia. En estos casos, la ganancia / tensión debería disminuir.
- Cargue siempre la muestra fluorescente en la jeringa izquierda y buffer / extintor en la jeringa derecha. Asegúrese de que todas las muestras de fondo vórtice que contienen liposomas antes de cargar, y ser conscientes de que la LUVs con el tiempo se instalará en la jeringa.
4. Haciendo un experimento
- Prepare una muestra de hormigas cargadas LUVs, ya sea con solventes o compuestos, y la carga en el espectrofluorómetro, juntamente con Na-buffer o Tl-extintor (50 mM TlNO 3, 94 mM NaNO 3, 10 mM HEPES a pH 7,0).
- Use 1,5 ml diluida ANTS-LUV solución, con o sin gramicidina, preparado el día anterior.
- Añadir el compuesto a la concentración deseada y el disolvente para los controles. Mantener la concentración de disolvente a un mínimo y constante en todas las muestras. Las concentraciones tendrán que ser ajustados con cualquier nuevo (desconocido) compuesto para lograr la deseada dosis-respuesta. Incubar durante 10 min a 25 ° C en la oscuridad.
- Vortex la LUV de la muestra y la carga en la jeringa izquierda. Cargue la Na-buffer o Tl-extintor en la jeringa derecha.
- Bien eliminar las burbujas de aire de ambas muestras, empujando las jeringas de ida y vuelta.
- Asegúrese de que ambas jeringas se cargan por igual antes de cerrar las válvulas. Carga desigual se traducirá en pre-mezcla de soluciones antes de llegar a la cámara de grabación.
- Para la muestra de primera, registrar la fluorescencia con Na-buffer, repetir 4 veces, ajuste la alta tensión (ganancia) en caso necesario, y repetir 5 veces.
- Para el resto de muestras, registro de 9 repeticiones con Na-buffer.
- Vuelva a colocar la Na-buffer con el Tl-extintor y registro de 13 repeticiones.
- Enjuague con agua y continuar con la siguiente muestra. Como controles se utiliza con muestras: no gramicidina y con disolventes, no gramicidina y con la máxima concentración del compuesto, tanto con gramicidina y solvente.
5. Análisis de datos
- Transferir los resultados a la computadora de análisis. Leer todos los datos en MATLAB para el análisis. Para cada muestra, lea en todos los buffer y repite extintor, con exclusión de los primeros cuatro en cada caso, como los que contienen artefactos de mezcla. Asumiendo un volumen de disco de 120 l que se necesita un poco menos de cuatro disparos para despejar completamente la mezcla anterior de la tubería de flujo detenido.
- Se repite el buffer para todas las muestras deben ser muy similares. Si hay un cambio significativo en la señal de fluorescencia, que depende de la concentración del compuesto, el compuesto en sí puede ser fluorescente y puede ser necesario para restar esta primera señal de fluorescencia extra antes de la normalización de las muestras.
- Manualmente ir a través de las huellas y eliminar "malo", repite: repite que contiene los picos o las desviaciones de multi-exponentiality debido a los artefactos de mezcla y / o burbujas.
- Normalizar las repeticiones extintor con el valor medio a partir de las repeticiones de amortiguación para cada muestra. Combine los promedios de todas las muestras en un gráfico para la visualización.
- Rastros registrados sin gramicidina todos debe ser similar y casi no muestran extinción de fluorescencia, que puede haber una lenta reducción en la señal de fluorescencia debido a la lenta fuga de Tl + a través de la bicapa de vesículas 8. Si la muestra, sin gramicidina y modificador de extinción si no se presenta importantes, a continuación, las vesículas se han deteriorado y no debe usarse más. Si las muestras sin gramicidina, pero con el modificador mostrar enfriamiento significativo, entonces el modificador perturba la bicapa de vesículas de tal manera que permite que el fluoróforo o extintor para cruzar la bicapa.
- Si el compuesto altera las propiedades de bicapa lipídica, detectada por los canales de gramicidina, el curso temporal de fluorescencia se visiblemente alterado.
- Para cada muestra, se extendía una exponencial
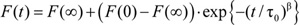 por ejemplo, 4) es apto para el primer 200-100 m de la curva de enfriamiento normalizado fluorescencia de las repeticiones individuales y la tasa de
por ejemplo, 4) es apto para el primer 200-100 m de la curva de enfriamiento normalizado fluorescencia de las repeticiones individuales y la tasa de  4calculado en 2 ms. Medias y desviaciones estándar se calculan para una muestra dada de todas las repeticiones individuales.
4calculado en 2 ms. Medias y desviaciones estándar se calculan para una muestra dada de todas las repeticiones individuales. - Por último, determinar el cambio relativo en la tasa de enfriamiento por la normalización de la muestra más cercana de control en el tiempo que ha gramicidina y modificador no.
6. Resultados representante
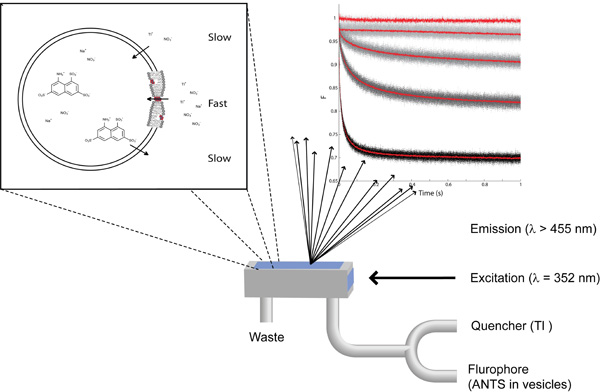
Figura 1: Los puntos esenciales de la fluorescencia apagar basado en análisis para detectar cambios en las propiedades bicapa lipídica Arriba a la izquierda:. Un zoom-in en una vesícula lipídica solo con las hormigas más NaNO 3 en el interior y NaNO 3, además de TlNO 3 en el exterior. Arriba a la derecha: La señal de fluorescencia grabado con (formulario de arriba a abajo) HORMIGAS vesículas llenas sin extintor, con extintor, extintor y con pre-dopado con 87, 260 y 780 nM gramicidina. Abajo: Representación esquemática de la cámara de mezcla de flujo detenido.
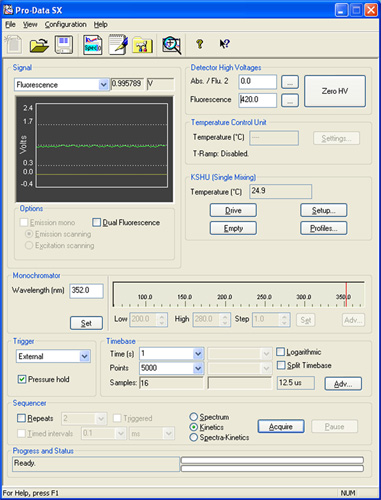
Figura 2: Una captura de pantalla del software Pro-SX datos que ilustran los distintos grupos de referencia en la descripción de la configuración experimental.

Figura 3:. Determinaciones múltiple repetición de la señal de fluorescencia de las hormigas cargadas LUVs con Na-buffer Las primeras cuatro se repite, siempre se excluyen, ya que contienen artefactos de mezcla. El tubo de conexión de las jeringas de la muestra a la celda de mezcla tiene un volumen definido, por lo tanto, las repeticiones primeras nos dará una lectura de lo que estaba previamente en el tubo: agua para repetir 1 y 2, una combinación de agua y la muestra para la repetición de 3, la mayoría de la muestra para repetir 4, y muestra sólo para el resto repite.
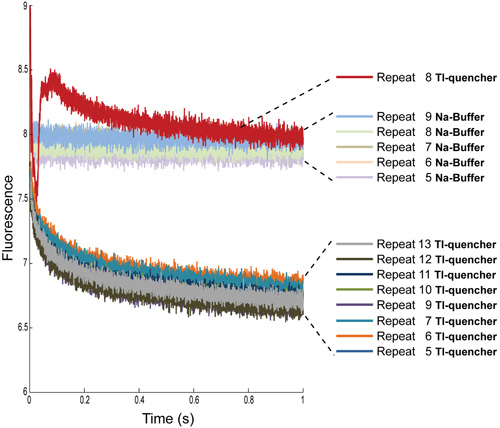
Figura 4:. Determinaciones múltiple repetición de la señal de fluorescencia de las hormigas cargadas LUVs con Na-buffer y con Tl-extintor Los primeros cuatro repeticiones se han eliminado de ambas condiciones. Además, para las mediciones de TI, extintor, repita 8 debe ser eliminado debido a los artefactos, las burbujas de aire más probable.

. Figura 5: Efecto de la capsaicina (Cap) en el transcurso del tiempo de la extinción de fluorescencia HORMIGAS (A) de la señal de fluorescencia normalizada más de 1 s, puntos grises indican los resultados de todas las repeticiones (n> 5 por condición); líneas rojas indican el promedio de todos repite. (B) Los primeros 100 ms, puntos grises indican los resultados de una sola repetición para cada condición, las líneas rojas se extienden ajuste exponencial (2 - 100 ms) a los que se repite. La línea azul punteada indica la marca de 2 ms, el tiempo en que se determina la tasa de extinción. En tanto A como B y la traza de arriba muestra los resultados en la ausencia de Tl +, en los próximos dos huellas mostrar resultados en la ausencia de GA, con Tl + Cap ±; las cuatro huellas inferiores muestran los resultados con 260 nM y gA + TI, donde los números indican [PAC] en M. Las tasas de extinción de Cap M 0, 10, 30 y 90, según lo determinado por la velocidad de una estirada exponencial, de 36 ± 6, 69 ± 6, 85 ± 8 y 247 ± 27 (media ± DE, n> 8) , respectivamente.
Discusión
Hemos demostrado una rápida basada en fluorescencia de ensayo para determinar el potencial de doble capa modificación de las drogas y otros anfifilos pequeños. Los compuestos que modifican las propiedades de dos capas es probable que alteran la función de proteínas de membrana de una manera indirecta, no específica, que podría contribuir a "fuera de objetivo" efectos de los medicamentos. El ensayo explota el poder de los canales de gramicidina como sondas para cambios en las propiedades de dos capas 12 que son detectados por dos capas, que abarca las proteínas. Los resultados obtenidos con el ensayo de fluorescencia basada en están en buen acuerdo con los resultados de un solo canal experimentos GA 12, lo que indica que este método puede ser utilizado para estudios sobre el mecanismo, así como de bibliotecas de compuestos de detección. Utilizando la configuración actual de la prueba de que podemos probar docenas de compuestos de un día, que es de uno a dos órdenes de magnitud mayor que el rendimiento posible con el único canal de acceso. No hay ningún tipo de limitación fundamental pasos en el ensayo de fluorescencia basada en lo que significa que se puede ampliar para ejecutarse en cierto modo de alto rendimiento. Es posible variar el ensayo de soluciones de electrolitos y / o uso de la composición lipídica de las diferentes LUVs. Vale la pena señalar que algunas de las composiciones de lípidos se puede separar cuando se seca, lo que requiere un rápido cambio de los sistemas de disolvente en lugar de secado / hidratación pasos 7.
No está claro si existe una relación causal entre el aumento de la lipofilia de los cables de drogas y el aumento de desgaste en el desarrollo de medicamentos 10,11,17 y, si es así, ¿cuáles son los mecanismo (s)? Sin embargo, debido a las proteínas de membrana tiende a ser regulada por los cambios en su entorno membrana 2, sería prudente para probar si los medicamentos anfifílicos y lleva la droga altera las propiedades pertinentes bicapa lipídica y, si es así, en qué concentraciones? Anfifilo adsorción a la bicapa lipídica se agotará la fase acuosa, por lo tanto, la concentración que es la concentración libre en la fase acuosa que puede ser varios órdenes de magnitud inferior a la concentración nominal en el sistema, por ejemplo, 6,9,16. Si una molécula deseada (biológica) los efectos se producen en concentraciones en las que altera las propiedades de dos capas, es importante distinguir entre el "no específicos", bicapa mediada por cambios en la función de proteínas de membrana, a diferencia de los efectos directos debido a la (alta afinidad ) que se une a una o más proteínas diana. Conocer la tendencia de dos capas-la modificación de una ventaja de drogas, descubiertas a través de convencionales selección de alto rendimiento, por lo tanto, es probable que sea importante para las decisiones sobre su desarrollo futuro.
Cualquier anfifilo en algún concentración de modificar algunas propiedades de dos capas. Las consideraciones clave por lo tanto, se convierten en: a qué concentración, y son los cambios en las propiedades bicapa detectada por (doble capa-expansión) proteínas de la membrana? Aquí podemos explotar la capacidad de gramicidina para formar canales a través de la dimerización transbilayer 15. Esto hace que sean sondas útiles para el acoplamiento de energía entre las bicapas de lípidos y proteínas bicapa embebido, y para explorar si las moléculas pequeñas alterar las propiedades de dos capas que son detectados por las proteínas de membrana. El ensayo es rápido, fiable y escalable, y por lo tanto conveniente para los estudios biofísicos y para la detección de bibliotecas de compuestos de fármacos con potencial de doble capa, perturbando efectos.
Para información adicional sobre el ensayo, la verificación de la eficacia de la prueba, y la comparación con la electrofisiología de un solo canal ver 12.
Divulgaciones
Agradecimientos
Damos las gracias a Michael J. Bruno, Rusinova Radda y Jon T. saco de muchas discusiones estimulantes. El apoyo financiero del NIH, R01GM021342 y complementar ARRA R01GM021342-35S1, y la Josiah Macy Jr. Foundation para OSA, el Tri-I CMB programa de HII, y El Iris L. y S. Woodworth Leverett Médico Científico de becas y subvención del NIH MSTP GM07739 de RK.
Materiales
| Name | Company | Catalog Number | Comments |
| ANTS | Invitrogen | A-350 | |
| gramicidin | Sigma-Aldrich | G-5002 | |
| 1,2-dierucoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipid, Inc | 850398C | |
| Mini-Extruder kit | Avanti Polar Lipid, Inc | 610000 | |
| PD-10 Desalting column | Sigma-Aldrich | 54805 |
Referencias
- Andersen, O. S., Giebisch, G. H., Purcel, E. F. Ion transport through simple membranes. Renal Function. , (1978).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: An energetic perspective. Annu. Rev. Biophys. Biomol. Struct. 36, 107-130 (2007).
- Andersen, O. S., Koeppe, R. E., Roux, B., Chung, S. -. H., Andersen, O. S., Krishnamurthy, V. Gramicidin channels. Versatile tools. Biological Membrane Ion Channels: Dynamics, Structure, and Applications. , (2007).
- Berberan-Santos, M. N., Bodunov, E. N., Valeur, B. Mathematical functions for the analysis of luminescence decays with underlying distributions 1. Kohlrausch decay function (stretched exponential. Chem. Phys. 315, 171-182 (2005).
- Bruggemann, E. P., Kayalar, C. Determination of the molecularity of the colicin E1 channel by stopped-flow ion flux kinetics. Proc. Natl. Acad. Sci. USA. 83, 4273-4276 (1986).
- Bruno, M. J., Koeppe, R. E., Andersen, O. S. Docosahexaenoic acid alters bilayer elastic properties. Proc. Natl. Acad. Sci. USA. 104, 9638-9643 (2007).
- Buboltz, J. T., Feigenson, G. W. A novel strategy for the preparation of liposomes: rapid solvent exchange. Biochim. Biophys. Acta. 1417, 232-245 (1999).
- Gutknecht, J. Cadmium & thallous ion permeabilities through lipid bilayer membranes. Biochim. Biophys. Acta. 735, 185-188 (1983).
- Ingólfsson, H. I., Koeppe, R. E., Andersen, O. S. Curcumin is a modulator of bilayer material properties. Biochemistry. 46, 10384-10391 (2007).
- Keserü, G. M., Makara, G. M. The influence of lead discovery strategies on the properties of drug candidates. Nat. Rev. Drug Discov. 8, 203-212 (2009).
- Leeson, P. D., Springthorpe, B. The influence of drug-like concepts on decision-making in medicinal chemistry. Nat. Rev. Drug Discov. 6, 881-890 (2007).
- Lundb k, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S., S, O. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. J. R. Soc. Interface. 7, 373-395 (2010).
- Moore, H. P. &. a. m. p. ;. a. m. p., Raftery, M. A. Direct spectroscopic studies of cation translocation by Torpedo acetylcholine receptor on a time scale of physiological relevance. Proc. Natl. Acad. Sci. USA. 77, 4509-4513 (1980).
- Neher, E. Ionic specificity of the gramicidin channel and the thallous ion. Biochim. Biophys. Acta. 401, 540-544 (1975).
- O'Connell, A. M., Koeppe, R. E., Andersen, O. S. Kinetics of gramicidin channel formation in lipid bilayers: transmembrane monomer association. Science. 250, 1256-1259 (1990).
- Søgaard, R. GABAA receptor function is regulated by lipid bilayer elasticity. Biochemistry. 45, 13118-13129 (2006).
- Waring, M. J. Defining optimum lipophilicity and molecular weight ranges for drug candidates-Molecular weight dependent lower logD limits based on permeability. Bioorg. Med. Chem. Lett. 19, 2844-2851 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados