Method Article
인간 CD14+ 단핵구에서 톨러겐 수지상 세포 생성을 위한 면역조절제를 테스트하는 간단하고 효율적인 방법
요약
in vitro 에서 naive monocyte 유래 수지상 세포에서 내성 수지상 세포를 생성하는 약리학적 제제의 능력을 평가하고 자가 조절 T 세포 생성을 통해 그 효능을 검증하는 절차를 설명합니다.
초록
톨러겐 수지상 세포(tolDC)는 수지상 세포(DC)의 하위 집합으로, 조절 T 세포(Treg) 표현형에 대한 미접촉 T 세포에 영향을 미치는 것으로 알려져 있습니다. TolDC는 현재 세포 치료제 및 내인성 DC에서 tolDC를 유도하는 방법으로 자가면역 및 이식을 위한 치료법으로 연구되고 있습니다. 그러나 현재까지 미성숙 DC에서 tolDC를 유도하는 것으로 알려진 제제의 수는 상대적으로 적고 생체 내에서 Tregs를 생성하는 효능은 일관되지 않았으며, 특히 내인성 DC에서 tolDC를 유도하는 치료법은 일관되지 않았습니다. 이는 내성을 생성하기 위해 새로운 화합물을 탐색할 수 있는 기회를 제공합니다.
여기에서는 in vitro 에서 단핵구 유래 DC(moDC)에서 새로운 면역조절 화합물을 테스트하고 자가 Treg를 생성하는 기능을 검증하는 방법을 설명합니다. 먼저, PBMC를 얻고 상업적으로 이용 가능한 자기 분리 키트를 사용하여 CD14+ 단핵구와 CD3+ T 세포를 분리합니다. 다음으로, 단핵구를 moDC로 분화하고, 라파마이신, 덱사메타손, IL-10 또는 비타민 D3와 같은 확립된 면역조절제로 24시간 동안 치료하고, 프로토콜의 검증으로 단핵구의 내성 마커 변화를 테스트합니다. 마지막으로, 항-CD3/CD28 자극이 있는 상태에서 유도된 tolDC를 자가 T 세포와 공동 배양하고 Treg 집단 및 T 세포 증식의 변화를 관찰합니다. 우리는 이 프로토콜이 이미 분화된 DC를 tolDC로 재프로그래밍하기 위해 새로운 면역조절제의 효능을 평가하는 데 사용될 것으로 예상합니다.
서문
수지상 세포(DC)는 선천성 면역과 적응 면역 사이의 중요한 매개체입니다. 주로 점막, 피부 및 림프 조직에 상주하는 DC는 주요 항원 제시 세포(APC)입니다1. DC는 외래 단백질을 흡수하여 주요 조직적합성(MHC) 단백질에 전달하여 미성숙한 T 세포에 제공합니다. DC는 인간에서 인간 백혈구 항원-DR(HLA-DR)과 같은 MHC 클래스 II 단백질을 특이적으로 발현합니다. 항원 노출 시 DC의 활성화 상태는 다운스트림 T 세포 반응2에 매우 중요합니다. 미성숙 DC는 박테리아 벽 구성 요소인 지질다당류(LPS)3와 같은 병원체 관련 분자 패턴(PAMP)이라고 하는 분자 클래스를 인식하는 다양한 패턴 인식 수용체(PRR)를 발현합니다. PRR 자극 시, DC는 성숙한 DC가 되어 CD80, CD86 및 CD40과 같은 중요한 T 세포 공동 자극 단백질을 상향 조절하고 종양 괴사 인자 알파(TNFα)와 같은 전염증성 사이토카인을 분비하여 미접촉 T 세포가 기존 효과기 또는 보조 T 세포로 분화하는 것을 촉진합니다2. 반대로, DC 성숙이 중단되거나 DC가 허용 환경에서 발생하는 경우 DC는 허용 DC 상태(tolDC)4를 생성할 수 있습니다. TolDC는 고전적인 T 세포 공동 자극 수용체를 하향 조절하고 대신 PD-L1(programmed cell death ligand 1) 및 BTLA(B-lymphocyte attenuator)와 같은 내성 수용체를 상향 조절하고 인터루킨 10(IL-10) 및 형질전환 성장 인자 베타(TGF-β)4와 같은 억제 사이토카인을 생성합니다. 이것은 허용 오차 마커의 포괄적인 목록이 아니며, 실제로 tolDC 상태5를 정의하는 데 어떤 tolDC 마커가 적절한지에 대한 합의가 제한적입니다. 이를 고려하여 다양한 tolDC 유도제의 효과를 비교하는 데 사용해야 하는 기능 마커로 조절 T 세포(Treg) 생성을 제안합니다.
tolDC/성숙한 DC 활성화 상태 외에도 DC는 계통 또는 조직 위치에 따라 분류할 수 있으며 각 하위 집합은 약간 다른 기능을 표시합니다. tolDC/성숙한 DC 분열은 명확하지 않고 연속체로 더 많이 존재하는 반면, 계통 분열은 인간과 생쥐 모두에서 잘 정의된 마커를 가지고 있습니다. DC 전구체는 골수에서 형성되지만, 그 계통에 따라 DC에는 1) 림프구 계통에서 유래한 형질세포(plasmacytoid dendritic cell, pDC)와 골수성 계통(myeloid lineage)에서 유래한 기존 수지상 세포(cDC)의 두 가지 주요 하위 유형이 있습니다. 인간의 경우, pDC는 림프 기관에서 성숙하고, CD303을 발현하며, 바이러스 감염에 매우 민감하게 반응합니다6. 한편, cDC를 발현하는 CD11c는 말초 조직에서 성숙하며 각각 뚜렷한 T 세포 반응을 생성하는 CD1c+ cDC1 및 CD141+ cDC2의 두 가지 별개의 아형으로 존재합니다7. 또한, 모든 cDC는 조직 상주(CD103-) 또는 철새(CD103+) 하위 상태에 존재할 수 있습니다8. 마지막으로, 특정 조건 하에서, 단핵구 계통(CD14+)의 세포는 수지상 세포 표현형으로 유도될 수 있으며 CD14-, CD141+, CD1c+ 9로 식별됩니다. 단핵구 유래 DC(moDC)로 알려진 이러한 세포는 단핵구가 인간 말초 혈액 단핵 세포(PBMC)의 약 10-30%를 차지하는 반면 pDC는 1-3%에 불과하기 때문에 인간의 체외 분석에 가장 일반적으로 사용됩니다10. 이것은 moDC를 매력적인 선택으로 만들지만, moDC가 일차 조직에서 분리된 일반적인 cDC보다 더 염증성이 있는 것으로 알려져 있습니다9.
현재 임상적 내성을 생성하기 위해 tolDC를 사용하는 노력에는 크게 두 가지 범주가 있습니다. 첫째, tolDC는 세포 치료제로 사용하기 위해 단핵구에서 생성됩니다. 이 패러다임에서 moDC는 일반적으로 IL-4/GM-CSF를 비타민 D3, 라파마이신(rapa), IL-10, 덱사메타손 또는 이들의 조합과 같은 면역조절제와 동시에 사용하여 구별됩니다11,12. 이러한 tolDC는 자가면역 및 이식을 위한 자가 세포 치료법으로 연구되어 왔다13. tolDC의 다른 용도는 유리 약물 또는 나노 캐리어를 사용하여 면역 조절제와 관심 항원을 모두 전달하여 내인성 DC를 tolDC로 재프로그래밍하는 것입니다14 , 15 , 16 . 그러나 이미 분화된 DC의 유도는 일반적으로 tolDC 대사와 대조되는 DC의 강력한 대사 표현형의 발달로 인해 더 어렵습니다17,18. 이것은 대부분의 약리학적 면역조절제에 대한 높은 기준입니다. 이러한 이유로, 대부분의 내인성 DC 재프로그래밍 연구는 효과적인 DC 억제와 종종 일부 Treg 유도를 보고하지만, 종종 T 세포 지속성 부족으로 인해 임상적 성공이 부족합니다 15,19,20. 이는 기존 DC에서 잠재적인 tolDC 유도제를 식별하기 위한 전략의 필요성을 강조합니다.
여기에서는 자가 Treg 유도의 최종 메트릭을 사용하여 분화된 moDC에 대한 면역조절제의 체외 평가 방법을 제시합니다. 이 프로토콜은 이미 분화된 human moDC를 내성으로 재프로그래밍하기 위해 면역조절제의 효과를 평가하도록 설계되었습니다. 또한 이 프로토콜은 동일한 PBMC 샘플에서 분리된 자가 T 세포에 대해 Tregs를 생성하기 위해 재프로그래밍된 tolDC의 기능을 검증합니다. 이는 분화 과정에서 내성을 유도하거나 동종 공여자의 T 세포를 이용한 tolDC에 도전하는 다른 프로토콜과 대조적이다21. 이 프로토콜에서는 일반적인 내성 제제 rapa를 예로 사용하지만 Reg를 생성하기 위한 rapa 처리 moDC의 제한된 효과도 보여줍니다. 대표적인 결과에서는 IL-10, 덱사메타손, 비타민 D3와 같은 다른 일반적인 면역조절 치료제의 효능도 입증되었습니다. 우리는 이 프로토콜이 이미 확립된 moDC에 대해 잠재적으로 더 효과적인 tolDC 유도제를 스크리닝하는 데 사용될 것으로 예상합니다22.
프로토콜
모든 인간 말초 혈액 단핵 세포(PBMC) 샘플은 환자의 동의하에 펜실베이니아 대학의 IRB(Institutional Review Board)의 사전 승인을 받은 비식별 기증자로부터 펜실베니아 대학교의 인간 면역학 코어에서 얻었습니다.
선택 사항: 이 방법에서는 학술 실험실에서 얻은 갓 분리한 PBMC를 사용했지만, PBMC는 전혈 또는 백혈구 성분 채집이 풍부한 혈액 제제에서 분리할 수 있습니다. 밀도 구배 원심분리법(density gradient centrifugation method)을 사용하는 것이 좋은데, 이는 다른 곳에서 기술된 잘 정립되고 신뢰할 수 있는 방법이기 때문이다23.
1. 단핵구/T세포의 분리 및 moDC 분화
- PBMC에서 단핵구 및 T 세포 분리-Day 1
- 건강한 기증자로부터 2억 개의 인간 PBMC를 얻습니다. 세포를 15mL 튜브에 보관하고 얼음에 옮겨 놓습니다.
- 분취 50mL의 분리 완충액(시판되는 분리 키트에 제공됨)을 원뿔형 튜브에 담습니다.
참고: 분리 완충액은 2% 소 태아 혈청(FBS) 및 1mM 에틸렌디아민테트라아세트산(EDTA)이 함유된 DPBS로 교체할 수도 있습니다. - 얼음에서 PBMC 튜브를 제거하고 분리 버퍼로 채웁니다. 300 x g에서 5분 동안 원심분리기.
- 10mL 혈청학적 피펫을 사용하여 상등액을 흡입합니다. 혈청학적 피펫을 사용하여 권장 배지 4mL에 세포 펠렛을 재현탁합니다.
- 현탁액을 두 개의 서로 다른 15mL 튜브로 나누고 튜브당 2mL(튜브당 5 × 107 셀/mL)를 추가합니다. 한 튜브에는 "T", 다른 튜브에는 "단핵구"라고 라벨을 붙입니다.
- Human Monocyte Isolation Kit를 회수하고 제조업체의 프로토콜에 따라 단핵구가 표지된 튜브에서 단핵구를 분리합니다.
- Human T Cell Isolation Kit를 회수하고 두 번째 튜브가 T 세포를 분리하기 위한 제조업체의 프로토콜에 따릅니다.
- T 세포의 분화 및 동결을 위한 단핵구 도금-Day 1
- 50mL의 moDC 배양 배지(표 1)를 37°C에서 최소 10분 동안 예열합니다.
- 농축 단핵구가 있는 15mL 튜브와 T 세포가 있는 15mL 튜브를 250 × g 에서 5분 동안 원심분리합니다.
- 상층액을 흡인합니다. 위아래로 피펫팅하여 1mL의 moDC 배양 배지와 T 세포 배양 배지의 T 세포에 단핵구를 재현탁합니다(표 1). 펠릿이 제대로 분산되었는지 확인하십시오.
- 자동 세포 계수기 또는 Trypan Blue 염색을 사용한 수동 혈구계를 사용하여 세포를 계수합니다.
참고: 대표 데이터의 경우, 1,000만 개의 T 세포와 300만 개의 단핵구를 분리했습니다. - 단핵구가 있는 튜브를 취하고 현탁액에 9mL의 따뜻한 moDC 배양 배지를 추가하여 최종 부피 10mL를 만듭니다. 그런 다음 10μg/mL GM-CSF 및 10μg/mL IL-4 스톡을 각각 100μL씩 추가하여 배지 내 GM-CSF 및 IL-4의 최종 농도 100ng/mL를 얻습니다. 현탁액을 페트리 접시에 옮기고 "moDC"(1일차)로 표시하고 5% CO2로 37°C에서 배양합니다.
- T 세포 튜브를 취하고 1mL의 T 세포 동결 배지(표 1)와 1mL의 T 세포 현탁액을 혼합합니다. 2개의 2mL cryovials(1mL/바이알)로 나눕니다. 단단히 밀봉합니다(바이알당 500만 개의 세포 최종 농도). cryovials를 사용하지 않는 웰에 밸런싱 튜브와 함께 냉동 챔버에 놓습니다. 챔버를 -80°C에서 하룻밤 동안 보관한 다음 cryovials를 cryotank로 옮깁니다.
- 4일차에 5mL의 새로운 moDC 배양 배지를 추가하여 배지를 새로 고치고 GM-CSF 및 IL-4 스톡을 각각 100μL씩 추가합니다. 차별화된 moDC는 7일차에 준비됩니다.
2. 내성 moDC 생성을 위한 면역조절 약물 추가
- moDC 플레이트를 설정합니다.
- 7일차에 인큐베이터에서 분화된 moDC를 회수하고 moDC 세포 현탁액을 50mL 튜브로 옮깁니다.
- 현탁액을 250×g에서 5 분 동안 원 심분리합니다. 상층액을 흡인하고 위아래로 피펫팅하여 1mL의 따뜻한 moDC 배양 배지에 세포 펠렛을 재현탁합니다. 혈구계로 세포를 계수하고 100ng/mL, GM-CSF 및 IL-4를 함유하는 따뜻한 moDC 배양 배지에서 세포를 3 ×10 5 cells/mL의 농도로 희석합니다.
- 100μL의 3 × 104 cells/well을 평평한 바닥 96웰 조직 배양 플레이트의 원하는 웰 수에 추가합니다.
참고: 대표적인 결과를 위해 총 48개의 웰을 사용했지만(섹션 3 및 4에서 4개의 다른 분석을 위해 3회씩 준비된 4개의 조건), 이는 최대 60개의 웰에 대해 조정할 수 있습니다. 건조를 방지하기 위해 남아있는 모든 웰, 특히 외부 웰을 100μL/웰 PBS로 채웁니다. 각 분석 방법에 대해 다른 플레이트를 준비하는 것이 좋습니다. - 1μL/웰의 면역조절 약물을 원하는 웰에 추가합니다(여기서는 10ng/mL 라파). 37 ° C에서 5 % CO2로 밤새 플레이트를 배양합니다.
참고: 8일째에 면역 자극을 포함하는 경우, 면역 자극이 있거나 없는 면역 조절 약물에 대한 웰을 준비합니다. moDC를 성숙시키기 위해 면역 자극을 사용하는 것은 선택 사항입니다.
- T 세포를 다시 해동합니다.
- 8일차에 극저온 탱크에서 두 개의 극저온 용액을 회수하고 내용물이 녹기 시작할 때까지(<3분 후) 37°C의 뜨거운 비드 수조 또는 수조에서 극저온 용액을 해동합니다.
- 내용물이 녹기 시작하면 바이알을 세포 배양 후드로 옮기고 따뜻한 T 세포 배양 배지 1mL를 바이알에 피펫으로 넣어 빠르게 해동합니다. 바이알의 전체 내용물을 50mL 튜브에 넣습니다. 1mL의 T 세포 배양 배지로 냉동 여과액을 헹구어 모든 세포가 튜브로 전달되었는지 확인합니다.
- Flow Staining Solution(표 1)을 15mL까지 현탁액에 보충합니다. 200 × g 에서 10분 동안 원심분리기를 하고 상층액을 흡입합니다. 그런 다음 펠릿을 Flow Staining Solution 5mL에 재현탁시키고 다시 원심분리합니다.
- 상등액을 흡인하고 1mL의 따뜻한 T 세포 배양 배지에 세포를 재현탁합니다. 혈구계를 사용하여 세포를 세십시오.
참고: 이 단계에서 생존율은 >70%여야 합니다. 많은 양의 사멸 세포가 남아 있으면 새 튜브로 옮기고 10mL의 세포 염색 용액을 추가하고 200× g 에서 5분 동안 원심분리한 다음 1mL의 T 세포 배지에 재현탁하고 다시 계산합니다. - 9mL의 따뜻한 T 세포 배양 배지를 추가하여 10mL의 최종 부피를 만듭니다. 현탁액을 페트리 접시에 옮깁니다. "Rethawed T Cells"라고 표시하고 37°C에서 5% CO2 로 밤새 배양하여 세포를 쉬게 합니다.
- moDC 플레이트를 세척하고 원하는 경우 면역자극기를 추가합니다.
- 8일차에 300× g 에서 5분 동안 moDC 플레이트(7일차부터)를 원심분리합니다.
- 상층액을 흡인하고, 따뜻한 HBSS로 세척하고, 원심분리를 반복하고, 다시 흡인하고, GM-CSF 및 IL-4(100μL/well)를 함유한 따뜻한 moDC 배양 배지에 세포를 재현탁합니다.
참고: 세포를 방해하지 않도록 주의하십시오. 흡인 중에 플레이트를 기울이십시오. 약 10μL가 웰에 남아 있을 수 있습니다. - 면역자극제를 사용하는 경우, 1μL/웰의 100x 스톡 LPS(또는 기타 면역자극제)를 원하는 웰에 첨가합니다. 37 ° C에서 5 % CO2로 밤새 플레이트를 배양합니다.
3. moDC(Validation + Tolerance)에 대한 흐름 분석
- moDC 검증을 위한 흐름 분석
- 8일차에 표 2에 설명된 대로 HLA-DR, CD14, 수지상 세포 특이적 C형 렉틴(DC-SIGN), CD1c 및 CD40 마커를 표적으로 하여 검증 패널용 항체 칵테일을 준비합니다. 모든 항체를 flow stain 용액으로 희석합니다.
참고: 이 패널은 7채널 적색/청색 레이저 유세포 분석기용으로 설계되었습니다. - 인큐베이터에서 moDC 플레이트를 검색합니다. 300 × g 에서 5분 동안 플레이트를 원심분리합니다. 상층액을 제거합니다. 선택 사항: 제조업체의 지침에 따라 시판되는 키트를 사용하여 사이토카인 IL-10 및 TNFα에 대한 ELISA 분석을 위한 상층액을 보관합니다.
- 200μL/well의 유동 염색 용액을 추가합니다. 플레이트를 300 × g 에서 5분 동안 원심분리합니다.
- 상층액을 흡입하고 유동 염색 용액에 1:200으로 희석된 Fc 수용체 결합 억제제 항체 50μL/웰을 첨가하여 비특이적 결합을 차단합니다. 실온(RT)에서 30분 동안 배양합니다.
- 준비된 Validation Panel 항체 칵테일 50 μL/well을 추가합니다.
- 50 μL의 보상 비드와 50 μL의 희석된 각 항체를 혼합하여 플레이트 또는 1.5 mL 튜브에서 보상 대조군을 준비합니다. 플레이트를 4°C에서 1시간 동안 배양합니다.
참고: 여기에는 moDC에서 마커의 발현이 낮을 수 있기 때문에 보상을 위해 셀 대신 보상 비드가 사용됩니다. - 300 × g 에서 5분 동안 원심분리하고 상층액을 제거한 후 200μL의 Flow Staining Solution에 재현탁하여 세척합니다. 두 번 세탁하십시오.
- 최종 세척 후 다시 원심분리하고 Flow Staining Solution의 110μL/well에 세포를 재현탁합니다. 이제 샘플은 유세포 분석을 위한 준비가 되었습니다.
- 8일차에 표 2에 설명된 대로 HLA-DR, CD14, 수지상 세포 특이적 C형 렉틴(DC-SIGN), CD1c 및 CD40 마커를 표적으로 하여 검증 패널용 항체 칵테일을 준비합니다. 모든 항체를 flow stain 용액으로 희석합니다.
- tolerogenic moDC(Tolerance Panel)에 대한 흐름 분석
- 8일차의 3.1단계와 유사하게, CD86, PD-L1, DC-SIGN, CD1c, BTLA 및 CD40 마커를 표적으로 하여 Tolerance Panel에 대한 항체 칵테일을 준비합니다(표 2).
- 3.1.2-3.1.8 단계를 반복하여 항체 칵테일을 Tolerance Panel 칵테일로 대체합니다.
4. T cell의 유동 분석
- T 세포를 처리된 톨러겐 moDC와 결합합니다.
- 9일째에 인큐베이터에서 다시 해동된 T 세포 페트리 접시를 꺼내 모든 T 세포를 50mL 튜브로 옮깁니다. Flow Staining Solution을 보충합니다.
- 선택 사항: T 세포 증식 분석을 수행하는 경우 T 세포를 두 개의 튜브로 나눕니다.
- 첫 번째 튜브로 250×g에서 5 분 동안 스핀 다운하고 상층액을 제거합니다. 제조업체의 지침에 따라 이 튜브를 세포 증식 염료로 염색하십시오.
참고: 우리는 30분의 배양 단계와 두 번의 세척 단계가 필요한 정착성 생존도 염료 eFluor 670을 사용했습니다. 세포 손실을 방지하기 위해 50mL 원뿔형 튜브를 사용하고 염색 후 세척할 때 10% HIFBS가 포함된 HBSS를 사용하는 것이 좋습니다. - Treg 분석을 위해 염색되지 않은 T 세포가 들어 있는 두 번째 튜브를 사용합니다. 마찬가지로 250 ×g에서 5 분 동안 스핀 다운하고 상층액을 제거하고 따뜻한 세포 배양 배지에 재현탁한 다음 염색 과정 중에 인큐베이터에 보관합니다. T 세포 증식이 필요하지 않은 경우 모든 T 세포를 스핀다운하고 따뜻한 T 세포 배양 배지로 대체합니다.
- 첫 번째 튜브로 250×g에서 5 분 동안 스핀 다운하고 상층액을 제거합니다. 제조업체의 지침에 따라 이 튜브를 세포 증식 염료로 염색하십시오.
- 세포를 계수하고 최소 400만개(Treg 분석의 경우) 또는 800만개(Treg 및 T 증식 분석의 경우)를 얻습니다.
- 인큐베이터에서 나머지 웰과 함께 moDC 플레이트를 회수하고 300×g에서 5 분 동안 원 심분리한 다음 상층액을 양분합니다. 200μL/웰 T 세포를 1.6 × 105 세포/웰에 추가합니다. Treg 분석 플레이트에는 염색되지 않은 T 세포를 추가하고 T 세포 증식 플레이트에는 염색된 T 세포를 추가합니다.
참고: 이렇게 하면 초기 3 ×104 moDC가 일반적으로 약간 확장되므로 T 셀 대 moDC 비율이 5:1로 유지됩니다. - 음성 대조군 웰을 제외한 모든 그룹에 25μL/mL의 항-CD3/CD28 항체 칵테일을 추가하여 T 세포를 자극합니다. 12일까지 37°C에서 72시간 동안 5% CO2 로 플레이트를 배양합니다.
참고: 증식 분석에는 염색된 T 세포를 사용하고 Treg 분석에는 염색되지 않은 T 세포를 사용해야 합니다.
- Treg 흐름 분석
- 표면 마커 염색
- 12일차에 Treg Panel을 위한 항체 칵테일을 준비합니다(표 2).
- 96웰 배양 플레이트의 모든 세포 현탁액을 Flow Staining Solution이 있는 V-바닥 플레이트로 옮깁니다. 사이토카인 분석을 위해 상층액을 유지합니다.
- 원심분리(200× g 에서 5분 동안 사용한 후 200μL의 유류 염색 용액)로 세포를 2회 세척합니다. 보상 제어를 위해 일부 셀을 따로 보관하십시오. FOXP3 염색 및 염색되지 않은 대조군을 위해 하나를 따로 보관하십시오.
참고: 필요한 보상 제어를 얻기 위해 4.2.1.3단계에서 최종 스핀 전에 모든 샘플 10μL를 빗질하는 것이 좋습니다. 이는 세포에 있는 각 마커의 모든 표면 수준 발현을 대표하는 샘플을 제공합니다. - 두 번째 세척 후 실온에서 200 x g 에서 5분 동안 원심분리하고 흡입한 다음 50μL/well Fc 수용체 결합 억제제 항체(Flow Staining Solution에서 1:200으로 희석)를 추가합니다. 실온에서 10분 동안 배양합니다.
- 준비된 Treg Panel 항체 칵테일 50 μL/well을 추가합니다.
- 보상 대조군의 경우, 50 μL의 염색되지 않은 보상 세포를 각 단일 염색 항체 50 μL와 혼합합니다.
- 플레이트와 보상 제어 장치를 4°C에서 1시간 동안 배양합니다. Flow Stain Solution으로 플레이트를 한 번 세척하고 300×g에서 5 분 동안 원 심분리합니다.
- 200μL/well에서 HBSS (1:1,000)로 희석된 Live/Dead Near-IR 염료를 사용한 염색. 4 °C에서 30 분 동안 배양하십시오.
- Flow Staining Solution(200μL/well)으로 300×g에서 5 분 동안 플레이트 를 한 번 세척합니다.
- 제조업체의 지침에 따라 FoxP3로 염색하려면 하룻밤 배양이 필요합니다. FoxP3 염색 프로토콜에 대한 간략한 개요는 다음과 같습니다.
- 제조업체의 지침에 따라 FoxP3 고정/투과 작업 솔루션을 준비합니다. FoxP3 고정/투과화 농축액 1부와 FoxP3 고정/투과화 희석제 3부를 혼합합니다. 샘플당 200μL의 작업 용액을 준비합니다.
- 모든 시료를 200 μL/well의 working Fixation/Permeabilization 용액으로 배양합니다. 4°C에서 1시간 동안 그대로 두십시오.
- 1x 투과화 완충액 준비: 10x 투과화 완충액(상업용 키트에서 얻음)의 1부와 증류수 9부를 혼합합니다.
- 1x 투과 완충액(200μL/well)으로 300g에서 5 분 동안 플레이트 를 300× 2x 세척합니다.
- FoxP3 항체를 사용한 염색(PE-Cy5.5, 1x 투과화 완충액에서 1:300 희석): 희석된 FoxP3 항체 100μL/웰을 추가하고 4°C에서 하룻밤 동안 배양합니다.
- 1x 투과 버퍼(200μL/well)로 300g에서 5 분 동안 플레이트 를 300× 2x 세척합니다.
- Flow Staining Solution의 110 μL/well에 세포를 재현탁합니다.
- 유세포 분석을 수행합니다.
- 표면 마커 염색
- T 세포 증식 분석
- T Proliferation Panel을 위한 항체 칵테일을 준비합니다(표 2).
- 96웰 배양 플레이트의 모든 세포 현탁액을 Flow Staining Solution이 있는 V-바닥 플레이트로 옮깁니다. 사이토카인 분석을 위해 상층액을 유지합니다.
- 원심분리(200× g 에서 5분 동안 사용한 후 200μL의 유류 염색 용액)로 세포를 2회 세척합니다. 보상 제어를 위해 일부 셀을 따로 보관하십시오. FOXP3 염색 및 염색되지 않은 대조군을 위해 하나를 따로 보관하십시오.
참고: 필요한 보상 제어를 얻기 위해 4.3.3단계에서 최종 스핀 전에 모든 샘플 10μL를 빗질하는 것이 좋습니다. 이는 세포에 있는 각 마커의 모든 표면 수준 발현을 대표하는 샘플을 제공합니다. - 두 번째 세척 후 원심분리기(실온에서 5분 동안 200× g )하고 흡인시킨 다음 50μL/well Fc 수용체 결합 억제제 항체(Flow Staining Solution에 1:200 희석)를 추가합니다. 실온에서 10분 동안 배양합니다.
- 준비된 T Proliferation Panel 항체 칵테일 50 μL/well을 추가합니다.
- 보상 대조군의 경우, 50 μL의 염색되지 않은 보상 세포를 각 단일 염색 항체 50 μL와 혼합합니다.
- 플레이트와 보상 제어 장치를 4°C에서 1시간 동안 배양합니다. Flow Stain Solution으로 플레이트를 한 번 세척하고 300×g에서 5 분 동안 원 심분리합니다.
- 200μL/well에서 HBSS(1:1,000)로 희석된 Live/Dead Near-IR 염료를 사용한 염색. 4 °C에서 30 분 동안 배양하십시오.
- Flow Staining Solution(200μL/well)으로 300×g에서 5 분 동안 플레이트 를 한 번 세척합니다.
- 유세포 분석을 수행합니다.
결과
당사는 human PBMCs에 대한 프로토콜을 설명하고, 상업적으로 이용 가능한 자기 분리 키트를 사용하여 CD3+ T 세포와 CD14+ 단핵구를 모두 분리하고, GM-CSF 및 IL-4를 사용하여 단핵구를 CD14-, HLA-DR+, CD141+, CD1c+ moDC로 분화하고, 24시간 동안 처리하고, 72시간 동안 anti-CD3/CD28 자극으로 자가 T 세포와 공동 배양합니다. 실험적 회로도는 그림 1에 나와 있습니다.
단핵구/T 세포의 분리 및 moDC 분화
초기 대표 결과의 경우, 2억 개의 인간 PBMC를 펜실베이니아 대학교 인간 면역학 코어(HIC)에서 건강한 기증자 한 명으로부터 구매하여 프로토콜 섹션 1 및 2에 설명된 대로 처리했습니다. 혈액은 1일차에 채취하여 HIC 시설에서 표준 Ficoll 분획법을 사용하여 분리했습니다. T 세포 및 단핵구 분리를 위해 1억 개의 PBMC를 사용했으며, 각각 1,000만 개의 T 세포와 300만 개의 단핵구를 수율로 얻었습니다. 7일째 GM-CSF/IL-4 분화 후 단핵구 및 moDC를 유세포분석을 통해 분석했습니다. 미분화 단핵구에서 두 개의 뚜렷한 그룹, 즉 고전적인 CD14+, HLA-DR- 단핵구(>45%)와 CD1c를 최소량으로 발현하고 CD141은 없는 소량의 CD14-, HLA-DR+ 세포 집단을 관찰했습니다. 이와는 대조적으로, 분화 7일차에는 CD14-, HLA-DR+, CD141+, CD1c+인 대부분의 세포가 관찰되어 moDC를 나타냅니다(그림 2). 초기 300만 개의 단핵구에서 약 400만 개의 moDC를 얻었습니다.
moDC에 대한 흐름 분석(검증 + 허용 오차)
7일째에 moDC를 rapa로 24시간 동안 배양하고, 세척하고, LPS로 24시간 동안 배양한 다음, 프로토콜 3단계를 통해 9일째에 유세포분석으로 분석했습니다. 치료 그룹은 다음과 같습니다: 1) 무처리 + 무처리(UT), 2) 무처리 + 0.1μg/mL LPS(LPS), 3) 10ng/mL 라파 + 무처리(라파) 또는 4) 10ng/mL 라파 + 0.1μg/mL LPS(LPS + 라파). LPS가 있는 경우와 없는 경우 모두 라파를 사용한 경우 비율은 >50%를 유지했지만 UT의 CD1c+, DC-SIGN+ 집단은 감소했습니다(그림 3A). 9일차의 MoDC는 또한 DC 성숙 마커인 CD86 및 CD40의 발현에 대해 분석되었습니다. 우리는 moDC가 LPS로 처리되었을 때 CD86의 현저한 증가를 관찰했으며, 이는 moDC가 rapa로 전처리되었을 때 방지되었습니다(그림 3B). 신호가 UT 대조군으로 정규화되었을 때, 라파 치료 그룹에서 CD40 및 CD86 모두에서 상당한 감소를 관찰했으며 LPS + 라파 그룹에서는 신호의 증가가 관찰되지 않았습니다(그림 3C, D). 이와 동일한 패턴이 내성 마커인 PD-L1 및 BTLA에서 관찰되었으며, 라파 치료는 신호를 감소시키고 LPS 자극에 대한 반응 증가를 방지했습니다(그림 3E, F). 이는 라파 치료가 LPS 성숙을 방해하는 동시에 내성 마커의 발현을 제한했음을 나타냅니다.
Treg에 대한 흐름 해석
다음으로 프로토콜 단계 4.2를 사용하여 12일째에 moDC와 공동 배양 및 CD3/CD28 자극으로 자극한 후 자가 T 세포를 1:5 moDC:T 세포의 비율로 분석했습니다. CD4+, CD25+, FoxP3+ 로 Treg 집단을 식별했습니다(그림 4)24. 샘플에는 자극이 없는 T 세포(음성 대조군), CD3/CD28 자극이 있지만 moDC가 없는 T 세포, CD3/CD28 자극이 있고 이전 단락의 4개의 moDC 그룹과 공동 배양된 T 세포가 포함되었습니다. 우리는 moDC가 공동 배양에 추가되었을 때 명확한 Treg 개체군과 Treg의 현저한 증가를 관찰했습니다. 그러나 라파 처리된 tolDC에서 Treg 생성이 증가했음을 보여주는 일부 문헌 보고서와 달리 4개의 moDC 간에 Treg 빈도에는 유의한 차이가 없었습니다(그림 5A)25.
T 세포 증식의 유동 분석
또한 프로토콜 단계 4.3을 사용하여 T 세포 증식에 대한 대표 샘플을 분석했습니다. T cell-moDC co-culture는 Treg 분석에서와 같이 유사하게 자극된 다음 CD4+ 또는 CD8+ T 세포의 세포 증식 염료에 대한 흐름으로 분석되었습니다(그림 5B). 라파로 처리된 moDC는 CD3/CD28 자극 시 LPS 처리된 moDC 및 처리되지 않은 moDC에 비해 CD4+ 및 CD8+ T 세포 구획 모두에서 T 세포 증식이 중간 정도로 감소하는 것을 관찰했습니다.
추가 환자 검체 및 면역조절제 분석:
대표적인 결과는 라파를 투여한 moDC가 CD86 및 CD40과 같은 DC 성숙 마커를 감소시키고 비특이적 CD3/CD28 자극에 대한 T 세포 증식을 감소시킨다는 것을 나타냅니다. 그러나 Rapa-처리된 moDC는 PD-L1 또는 BTLA와 같은 내성의 양성 마커에 거의 영향을 미치지 않으며 CD3/CD28 자극 시 Treg 개체군을 증가시키지 않습니다. 다른 환자 및 면역조절제에서도 유사한 T세포 결과가 관찰될 수 있는지 알아보기 위해 추가 인간 샘플(분석에 따라 총 4개 또는 5개)에서 자가 공동 배양 실험을 반복했습니다. 2.1.4단계에서 주어진 면역조절제로서 10ng/mL Rapa와 1μM 덱사메타손(Dex), 10ng/mL IL-10(IL-10), 1μg/mL 지포다당류(LPS) 또는 1nM 비타민 D3(VD3)를 추가로 테스트했지만 면역 자극은 생략했습니다. 또한 2.1.4단계에서 Dex를 투여하고 8일째(Dex + LPS)에 2.3.3단계에서 0.1μg/mL LPS로 처리한 샘플을 포함했습니다. 먼저 8일째에 2.3.3단계 후 24시간 또는 72시간 후에 moDC(T 세포 추가 없이)의 상층액을 공통 내성 사이토카인 IL-10 및 염증성 사이토카인 TNFα에 대해 테스트했습니다(그림 6A-D). 라파로 처리된 moDC는 24시간 또는 72시간에 어떤 샘플에서도 IL-10을 증가시키지 않는 것을 관찰했지만, IL-10 처리된 샘플은 외인성으로 추가된 IL-10을 제거하기 위해 두 번의 세척 단계를 거친 후에도 24시간에 IL-10 생산을 유의하게 증가시켰습니다. (그림 6A). 또한 Dex로 처리한 moDC가 IL-10 생산을 유의하게 증가시켰지만 72시간 동안 휴지한 후에만 가능함을 관찰했습니다(그림 6B). 또한 자체적으로 TNFα를 생성하는 면역조절제는 없음을 관찰했지만, Dex의 전처리는 이 결과가 유의하지 않았지만 24시간에 LPS 처리 시 평균 TNFα 생성을 감소시켰습니다(그림 6C). 이 데이터는 또한 PD-L1의 moDC 발현이 24시간에 어떠한 면역조절제에 의해서도 증가하지 않는 반면, 72시간에 Dex + LPS- 및 Rapa- 처리군에서 PD-L1+ moDC의 유의한 증가가 관찰되었음을 보여줍니다(그림 6E, F). 단일 대표 샘플과 마찬가지로, 우리는 또한 24시간 및 72시간 모두에서 모든 면역조절제 투여군에서 CD86 발현의 억제를 관찰했습니다(그림 6G,H). 이는 면역조절제가 moDC에 대한 내성 마커를 증가시킬 수 있음을 확인하지만, 효과는 지연됩니다.
12일째 공동 배양 후 T 세포 반응을 추가로 분석했습니다. 면역조절제 처리된 moDC는 다른 발표된 보고서와 유사하게 처리되지 않은 moDC 대조군에 비해 CD4+ T 세포 증식을 증가시키지 않는 것을 관찰했습니다26 (그림 6I). 흥미롭게도, 더 큰 표본에서 면역조절제 처리된 moDC에 대한 Treg 집단의 유의미한 증가는 관찰되지 않았습니다(그림 6J). 우리는 이러한 유의성 부족이 환자 표본 간의 높은 변동성 때문이라고 생각합니다. 환자 샘플 중 2개(1 및 2)는 어떤 치료에도 Tregs를 증가시키지 않는 것으로 보였고, 다른 2개(3 및 4)는 거의 모든 면역조절 치료에서 Tregs가 증가한 것으로 나타났습니다(그림 6J). 이는 여러 환자 샘플로 면역조절제 분석을 수행해야 할 필요성을 강조하고 면역조절제 처리된 moDC를 통한 Treg 증식이 환자마다 매우 다양하다는 것을 시사합니다.

그림 1: 실험 개요 회로도. 단핵구와 T 세포는 PBMC에서 분리되고, 단핵구는 moDC로 분화되며, 면역조절제에 투여되어 tolDC를 생성하고, T 세포와 공동 배양됩니다. 약어: PBMC = 말초 혈액 단핵 세포; moDCs = 단핵구 유래 수지상 세포; tolDCs = lerogenic dendritic cells(톨러겐 수지상 세포). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
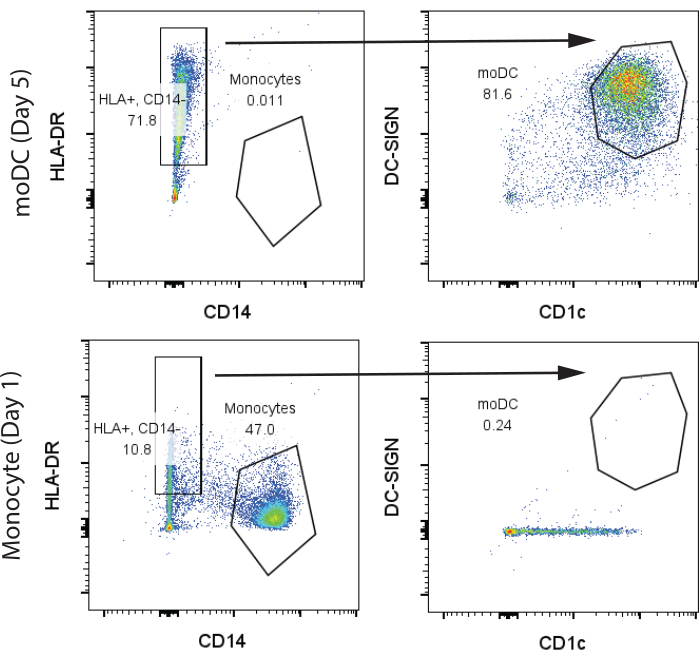
그림 2: CD14+, HLA-DR- 단핵구 및 CD14-, HLA-DR+, CD1c+, DC-SIGN+ moDC 식별을 위한 대표적인 게이팅 전략. 샘플은 7일째에 분석되었습니다. 약어: moDC = 단핵구 유래 수지상 세포; HLA-DR = 인간 백혈구 항원-DR; DC-SIGN = 수지상 세포 특이적 C형 렉틴. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: rapa 및/또는 LPS 처리 후 moDC의 유세포 분석 분석. 6일차에 10개의5 moDC를 24시간 동안 면역조절제로 배양한 다음 24시간 동안 0.1μg/mL LPS를 사용하거나 사용하지 않고 세척 및 배양했습니다. 9일째에 moDC를 세척하고 유세포 분석으로 분석했습니다. (A) CD14+, HLA-DR- 단핵구 및 CD14-, HLA-DR+, CD1c+, DC-SIGN+ moDC의 동정. (B) 처리 후 moDC CD86 신호의 대표적인 히스토그램; (C) CD86, (D) CD40, (E) PD-L1 및 (F) BTLA에 대한 평균 형광 강도. 샘플은 동일한 환자 PBMC로부터 기술적 삼중(N = 3)으로 측정되었습니다. 유의성은 UT 그룹과 비교하여 일원 분산 분석에 의해 결정되었습니다. *p < 0.05, **p < 0.01, ***p < 1 × 10-3, ****p < 1 × 10-4. 약어: PBMC = 말초 혈액 단핵 세포; moDCs = 단핵구 유래 수지상 세포; HLA-DR = 인간 백혈구 항원-DR; 라파 = 라파마이신; LPS = 지질다당류; MFI = 평균 형광 강도; BTLA = B 및 T 림프구 감쇠기; PD-L1 = 프로그래밍된 세포 사멸 리간드 1; UT = 치료되지 않음; LPS moDC= 8일째에 0.1μg/mL LPS로 처리된 moDCs; Rapa moDC = 7일째에 10ng/mL rapa로 처리한 후 8일째에 세척한 moDCs; Rapa + LPS moDCs = 7일째에 10ng/mL rapa로 처리한 moDCs, 8일째에 0.1μg/mL LPS를 세척 및 처리했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
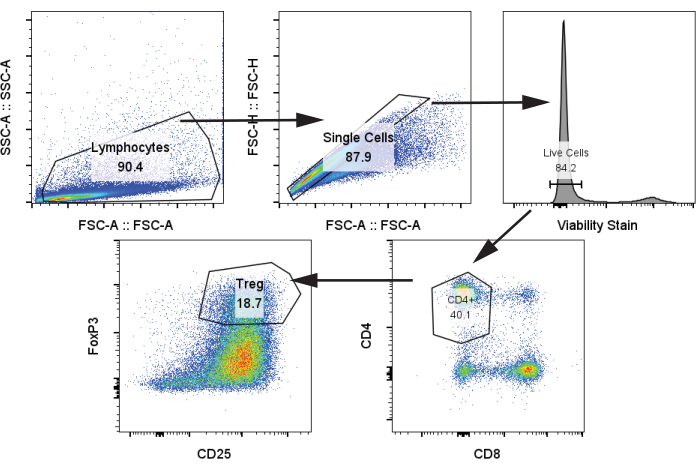
그림 4: CD4+, CD25+, FoxP3+ Tregs 식별을 위한 대표적인 게이팅 전략. 12일째에 해동된 T 세포에서 샘플을 분석했습니다. 약어: SSC-A = 측면 산란 피크 영역; FSC-A = 전방 산란-피크 면적; Tregs = 조절 T 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 12일차 moDC-T 세포 공동 배양의 대표적인 T 세포 분석. (A) Tregs를 식별하기 위한 살아있는 CD4+ T 세포의 대표적인 CD25 대 FoxP3 흐름도. 왼쪽 열에는 대조군이 포함되어 있습니다: T 세포만(위) 및 CD3/CD28 자극 T 세포(아래). 가운데 열: 라파 처리가 없는 moDC, 오른쪽 열: 라파 처리가 있는 moDcs. 중간 및 오른쪽 열의 경우 맨 위 행은 LPS가 없는 샘플이고 맨 아래 행은 LPS 처리가 된 샘플입니다. (B) T 세포 증식을 위한 대표적인 게이팅. CD4+ (왼쪽) 또는 CD8+ (오른쪽) T 세포를 증식 염색에 대해 플롯화했습니다. 피크는 0, 1, 2 또는 3개의 세포 분열에 대해 표시됩니다. 히스토그램은 moDC 처리 유형으로 표시됩니다. 약어 : rapa = rapamycin; LPS = 지질다당류; moDCs = 단핵구 유래 수지상 세포; T 세포만 = CD3/CD28 처리되지 않은 moDC가 없는 T 세포; UT = 치료되지 않음; LPS moDC = 8일차에 0.1μg/mL LPS를 처리한 moDC; Rapa moDC = 7일째에 10ng/mL rapa로 처리한 후 8일째에 세척한 moDC. 라파 처리는 0 분열로 세포의 상대적인 양을 증가시킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 추가 면역조절제를 사용한 다중 moDC/T 세포 시료 분석. MoDC는 2.1.4단계에서 주어진 면역조절제로서 10ng/mL Rapa와 함께 1μM 덱사메타손, 10ng/mL IL-10, 1μg/mL 지질다당류 또는 1nM 비타민 D3로 처리했지만 면역자극은 생략했습니다. 또한 2.1.4단계에서 Dex를 투여하고 8일째(Dex + LPS)에 2.3.3단계에서 0.1μg/mL LPS로 처리한 샘플을 포함했습니다. (A,-D) moDC의 사이토카인 분석. 상등액은 2.3.3 단계 후 (A) 24 시간 또는 (B) 72 시간 후에 IL-10에 대해 테스트하거나 상업용 ELISA 키트를 사용하여 C) 24 시간 또는 (D) 2.3.3 단계 후 72 시간 동안 TNFα에 대해 테스트했습니다. N = 5입니다. (E-H) moDC 표면 마커 분석. 유사하게, moDC는 (E) 24시간 또는 (F) 72시간에 PD-L1에 대해 유세포 분석을 통해 분석하거나 (G) 24시간 또는 (H) 72시간에 CD86에 대해 분석했습니다. N = 5. (I) T 세포 증식 분석. 12일째에 CD4+ T 세포를 T 세포 증식에 대해 분석하고 100개의 T 세포당 세포 분열 수를 계산했습니다. 샘플은 1:5 moDC:T 세포 비율, N=4로 배양했습니다. (E) Treg 분석. 5명의 서로 다른 환자로부터 구별된 MoDC는 그림 5와 유사한 방식으로 분석되었습니다. 왼쪽, 처리되지 않은 moDC; 오른쪽, 10ng/mL rapa로 처리된 moDC. 각 컬러 라인은 서로 다른 환자 샘플을 나타냅니다. 유의성은 일원 분산 분석에 의해 결정되었습니다. * p < 0.05, ** p < 0.01.약어 : rapa = rapamycin; LPS = 지질다당류; TNFα = 종양 괴사 인자-알파; moDCs = 단핵구 유래 수지상 세포; UT = 치료되지 않음; LPS moDC = 0.1 μg/mL LPS로 처리된 moDC; Rapa moDC = 10ng/mL rapa로 처리된 moDC, Dex = 1μM 덱사메타손으로 처리된 moDC, IL-10= 10ng/mL IL-10으로 처리된 moDC, VD3= 1nM 비타민 D3로 처리된 moDC, 7일째에 1μM 덱사메타손으로 처리된 Dex + LPS= moDC, 8일째에 0.1μg/mL LPS로 처리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| moDC 배양 배지 | Flow Staining Solution | T 세포 배양 배지 | T 세포 동결 배지 | |
| 미디어 베이스 | RPMI 1640년 | HBSS (하이브에스) | RPMI 1640년 | T 세포 배양 배지 |
| 구성 요소 1 | 10% 열 비활성화 FBS(HI-FBS) | 1% BSA w/v | 10% 열 비활성화 FBS(HI-FBS) | 10% DMSO |
| 구성 요소 2 | 1x 페니실린-스트렙토마이신 | 0.1 mM 에다 | 1x 페니실린-스트렙토마이신 | 해당 사항 없음 |
| 구성 요소 3 | 해당 사항 없음 | 해당 사항 없음 | 1 mM 헤페스 | 해당 사항 없음 |
| 구성 요소 4 | 해당 사항 없음 | 해당 사항 없음 | 1 x 비필수 아미노산 | 해당 사항 없음 |
| 구성 요소 5 | 해당 사항 없음 | 해당 사항 없음 | 50μM β-메르캅토에탄올 | 해당 사항 없음 |
표 1: 세포 배양 시약에 대한 설명
| 패널 | 항체 | 형광단 | 희석 | 채널 |
| 유효성 검사 | HLA-DR (영어) | 알렉사 플루어488 | 1:500 | 블루 1 |
| CD14 | 체육 | 1:500 | 블루 2 | |
| DC 사인 | 퍼프-Cy5.5 | 1:500 | 블루 3 | |
| CD1c | PE-Cy7 | 1:500 | 블루 4 | |
| CD40 | APC (에이피씨) | 1:500 | 빨강 1 | |
| 공차 | CD86 | FITC (영어) | 1:500 | 블루 1 |
| PD-L1 | 체육 | 1:5000 | 블루 2 | |
| DC 사인 | 퍼프-Cy5.5 | 1:500 | 블루 3 | |
| CD1c | PE-Cy7 | 1:500 | 블루 4 | |
| 비틀라(BTLA) | APC (에이피씨) | 1:250 | 빨강 1 | |
| CD40 | APC 에플루오르 780 | 1:500 | 빨강 3 | |
| 트레그 | CD4 | 알렉사 플루어488 | 1:500 | 블루 1 |
| CD8 | PE-Cy7 | 1:500 | 블루 4 | |
| CD25 (영어) | APC (에이피씨) | 1:500 | 빨강 1 | |
| T 확산 | CD4 | 알렉사 플루어488 | 1:500 | 블루 1 |
| CD69 (영어) | 체육 | 1:500 | 블루 2 | |
| CD8 | PE-Cy7 | 1:500 | 블루 4 | |
| *모든 항체는 Flow Stain Solution에 희석됩니다. | ||||
표 2: 유세포 분석 항체 패널에 대한 설명
토론
여기에서는 moDC에서 tolDC를 유도하기 위한 면역조절제의 기능을 평가하고 생체 외 자가 T 세포에서 Tregs를 생성하는 기능을 검증하는 신뢰할 수 있고 다재다능한 방법에 대해 설명합니다. 이 프로토콜에는 몇 가지 중요한 단계가 있습니다. 첫째, 단핵구는 민감하기로 악명이 높으며 최상의 결과를 얻으려면 이전에 냉동되지 않은 신선한 PBMC에서 얻어야 합니다. 단핵구는 가능한 한 빨리 분리하여 분화 칵테일에 넣어야 합니다. 일반적으로 첫 24시간 동안 단핵구 수율이 낮거나 단핵구 사멸률이 높은 것은 동결/해동 주기 또는 PBMC와 단핵구의 분리 사이의 연장된 기간 때문입니다. 둘째, moDC와 T 세포 배양 배지의 분화에 사용되는 사이토카인은 고품질 공급원에서 가져와야 합니다. 일반적으로 moDC의 분화가 불량한 것은 품질이 낮거나 사이토카인의 농도가 잘못되었기 때문입니다. 셋째, T 세포는 1일째와 7일 사이에 동결하고 순진하고 자극되지 않은 표현형을 보존하기 위해 배양에 보관하지 않는 것이 좋습니다. 넷째, 그림 6에서 볼 수 있듯이 PD-L1 및 IL-10과 같은 내성 마커의 증가를 허용하기 위해 처리된 moDC를 최대 72시간 동안 휴지시키는 것이 도움이 될 수 있습니다. 마지막으로, 데이터에서 볼 수 있듯이 Treg 생성 용량에는 환자 변동성이 크므로 결론을 도출하려면 각 환자 샘플에 대해 각 대조군을 실행해야 합니다. 여러 환자 샘플을 테스트하는 것이 좋습니다.
대표적인 결과에서는 높은 기준에서 내성을 입증하기 위해 다소 제한적인 실험 설계를 선택했습니다. 적당히 낮은 농도의 라파(10ng/mL)를 선택하여 이미 분화된 moDCs로만 24시간 동안 배양한 다음 CD3/CD28 비특이적 자극으로 72시간 동안 1:5 moDC:T 세포 비율로 배양했습니다. 이 프로토콜은 면역조절제 농도, 면역조절제 배양 시간, 배양이 moDC 분화와 동시에 발생하는지 아니면 별도로 발생하는지, moDC:T 세포 공동 배양 비율, 공동 배양 시간 및 T 세포 공동 자극과 같은 조건 중 하나를 쉽게 변경할 수 있기 때문에 매우 다재다능합니다. 이러한 모든 요인은 moDC 처리가 Treg 생성을 유도하는 정도를 얼마나 쉽게 변화시킬 수 있습니다. 주목할 점은 T 세포 증식을 유도하기 위해 비특이적 CD3/CD28 자극을 사용하는 것입니다. 이것은 관심 항원으로 쉽게 대체될 수 있습니다 -- 건강한 환자 샘플이 있는 CEFT 펩타이드 풀과 같은 대조 항원 또는 제1형 당뇨병 환자 샘플이 있는 인슐린과 같은 자가항원27,28. 이는 항원 특이적 내성 데이터를 제공할 수 있으며, 이는 비특이적 Treg 매개 내성과 다를 수 있습니다.
이 프로토콜은 다재다능하지만 몇 가지 제한 사항이 있습니다. 즉, 몇 가지 tolDC 마커, CD86, CD40, PD-L1 및 BTLA로 제한됩니다. 이는 일반적으로 허용되는 마커이며 실험실 유세포 분석기에서 사용 가능한 채널 수를 제한합니다. ILT-3 및 ILT-4 또는 기타와 같은 다른 마커도 또한 선택될 수 있다(25). 이 프로토콜은 또한 생체 내에서 강력한 보호 표현형을 입증할 수 있는 유형 1 조절 T 세포(Tr1) 세포와 같은 다른 유형의 억제 T 세포 하위 집합을 평가하지 않습니다 29. 그러나 우리는 이 프로토콜이 DC의 기능을 평가하여 고전적인 FoxP3+ CD25+ Tregs를 생성하며, 이는 새로운 면역 조절 화합물의 초기 스크리닝 및 DC 내성 용량 평가에 충분하다고 주장합니다.
인간 moDC 평가의 또 다른 흥미로운 측면은 환자의 가변성과 제한된 IL-10, PD-L1, BLTA, 그리고 가장 중요하게는 대표적인 결과에서 나타난 면역조절제, 특히 rapa에 대한 Treg 반응입니다. 문헌은 상충되는 결과를 보여줍니다. 이 논문과 유사한 결과는 rapa-treatment murine 및 human DC 모두에서 관찰되었으며, 비특이적으로 자극되었을 때 DC 성숙도(CD80/CD86/CD40) 마커의 감소와 T 세포로부터의 IL-2 방출 방지를 보여주었지만 T 세포 사멸 또는 Treg 생성26,30은 없었습니다. 그러나 인간과 생쥐 모두를 대상으로 한 다른 연구에서는 생체 외 라파 처리된 DC가 높은 수준의 Treg generation25를 보인다는 것을 보여줍니다. 라파(Rapa)는 세포 성장, 증식 및 생존과 같은 몇 가지 중요한 세포 기능을 가진 PI3K/AKT/mTOR 신호 경로의 단백질 키나아제인 라파마이신(mTOR) 억제제의 기계론적 표적입니다31. 라파는 이식을 위한 거부 반응 방지 약물로 자주 사용되며 면역학적 반응을 예방하는 데 잘 확립된 임상적 이점이 있습니다. 그러나 특히 tolDC 유도제로서의 사용을 위해 라파는 환자마다 다양한 효과를 가질 수 있습니다.
이는 더 넓은 환자 집단에 대한 tolDC 유도제를 엄격하게 조사하고 새로운 면역 조절 화합물을 식별해야 할 필요성을 강조합니다. 인간 tolDC에 대한 압도적인 수의 임상 연구에서 rapa, IL-10, 덱사메타손 또는 비타민 D3를 면역조절제로 사용합니다32. 이로 인해 광범위한 화학 공간이 탐사되지 않은 상태로 남습니다. 우리는 이 분석을 새로운 면역조절제의 tolDC 유도 가능성을 평가하고 내인성 DC에서 tolDC를 생성할 수 있는 잠재력을 평가하기 위한 조사 도구로 제시합니다. 이 프로토콜은 간단하고 다재다능하며 유세포 분석기만 필요하고 고처리량 기능에 맞게 조정할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
기증자로부터 새로운 인간 PBMC를 제공한 University of Pennsylvania의 Human Immunology Core(HIC)에 감사드립니다. HIC는 NIH P30 AI045008 및 P30 CA016520에 의해 부분적으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
참고문헌
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.