Method Article
Méthode simple et efficace pour tester des agents immunomodulateurs pour la génération de cellules dendritiques tolérogènes à partir de monocytes CD14+ humains
Dans cet article
Résumé
Nous décrivons une procédure pour évaluer la capacité des agents pharmacologiques à générer des cellules dendritiques tolérogènes à partir de cellules dendritiques naïves dérivées de monocytes in vitro et à valider leur puissance par génération autologue de cellules T régulatrices.
Résumé
Les cellules dendritiques tolérogènes (tolDC) sont un sous-ensemble de cellules dendritiques (DC) connues pour influencer les lymphocytes T naïfs vers un phénotype de lymphocytes T régulateurs (Treg). Les TolDC sont actuellement à l’étude en tant que thérapies pour l’auto-immunité et la transplantation, à la fois en tant que thérapie cellulaire et méthode pour induire des TolDC à partir de DC endogènes. À ce jour, cependant, le nombre d’agents connus pour induire des tolDC à partir de DC naïfs est relativement faible et leur capacité à générer des Tregs in vivo a été incohérente, en particulier les thérapies qui induisent des tolDC à partir de DC endogènes. Cela offre l’occasion d’explorer de nouveaux composés pour générer une tolérance.
Nous décrivons ici une méthode pour tester de nouveaux composés immunomodulateurs sur des CD dérivés de monocytes (moDC) in vitro et valider leur fonctionnalité pour générer des Tregs autologues. Tout d’abord, nous obtenons des PBMC et isolons les monocytes CD14+ et les lymphocytes T CD3+ à l’aide de kits de séparation magnétique disponibles dans le commerce. Ensuite, nous différencions les monocytes en moDC, les traitons avec un immunomodulateur établi, tel que la rapamycine, la dexaméthasone, l’IL-10 ou la vitamine D3, pendant 24 heures et testons leur changement de marqueurs tolérogènes comme validation du protocole. Enfin, nous co-cultivons les tolDC induits avec des lymphocytes T autologues en présence d’une stimulation anti-CD3/CD28 et observons les changements dans les populations de Tregs et la prolifération des lymphocytes T. Nous envisageons que ce protocole soit utilisé pour évaluer l’efficacité de nouveaux agents immunomodulateurs pour reprogrammer des CD déjà différenciés vers des tolDC.
Introduction
Les cellules dendritiques (DC) sont des médiateurs essentiels entre l’immunité innée et l’immunité adaptative. Les DC, qui résident principalement dans les muqueuses, la peau et les tissus lymphoïdes, sont les cellules présentatrices d’antigènes primaires (APCs)1. Les DC absorbent les protéines étrangères et les traitent et les présentent sur les principales protéines d’histocompatibilité (CMH) aux lymphocytes T naïfs. Les DC expriment spécifiquement des protéines du CMH de classe II, telles que l’antigène leucocytaire humain (HLA-DR) chez l’homme. L’état d’activation des DC lors de l’exposition à l’antigène est essentiel pour la réponse des lymphocytes T en aval2. Les DC immatures expriment divers récepteurs de reconnaissance de formes (PRR) qui reconnaissent des classes de molécules appelées motifs moléculaires associés à des agents pathogènes (PAMP), tels que le composant de la paroi bactérienne, le lipopolysaccharide (LPS)3. Lors de la stimulation PRR, les DC deviennent des DC matures et régulent à la hausse d’importantes protéines de co-stimulation des lymphocytes T, telles que CD80, CD86 et CD40, et sécrètent des cytokines pro-inflammatoires telles que le facteur de nécrose tumorale alpha (TNFα), facilitant la différenciation des lymphocytes T naïfs en lymphocytes T effecteurs ou auxiliaires conventionnels2. Au contraire, si la maturation des DC est interrompue ou si les DC se développent dans un environnement tolérogène, les DC peuvent générer un état DC tolérogène (tolDCs)4. Les TolDC régulent à la baisse les récepteurs de co-stimulation classiques des lymphocytes T et régulent à la hausse les récepteurs de tolérance tels que le ligand de mort cellulaire programmée 1 (-L1) et l’atténuateur de lymphocytes B et T (BTLA) et génèrent des cytokines suppressives telles que l’interleukine 10 (IL-10) et le facteur de croissance transformant bêta (TGF-β)4. Il ne s’agit pas d’une liste exhaustive de marqueurs de tolérance et, en fait, il y a un consensus limité quant aux marqueurs tolDC appropriés pour définir l’état tolDC5. Compte tenu de cela, nous proposons la génération de lymphocytes T régulateurs (Treg) comme marqueur fonctionnel qui devrait être utilisé pour comparer l’efficacité de divers agents d’induction tolDC.
En plus des états d’activation tolDC/matured DC, les DC peuvent également être classés en fonction de leur lignée ou de leur emplacement tissulaire, chaque sous-ensemble affichant des fonctionnalités légèrement différentes. Alors que la division tolDC/DC mature est moins définitive et existe davantage comme un continuum, les divisions de lignée ont des marqueurs bien définis chez l’homme et la souris. Les précurseurs de DC se forment dans la moelle osseuse, mais il existe deux sous-types principaux de DC en fonction de leur lignée : 1) les cellules dendritiques plasmacytoïdes (pDC), qui dérivent des lignées lymphoïdes et 2) les cellules dendritiques conventionnelles (cDC), qui dérivent des lignées myéloïdes. Chez l’homme, les pDC sont matures dans les organes lymphoïdes, expriment CD303 et répondent très bien aux infections virales6. Les cDC exprimant CD11c, quant à eux, sont matures dans les tissus périphériques et existent en deux sous-types distincts, les CD1c+ cDC1 et CD141+ cDC2, qui génèrent chacun des réponses distinctes des lymphocytes T7. De plus, tous les cDC peuvent exister dans lessous-états 8 des tissus résidents (CD103-) ou migratoires (CD103+). Enfin, dans certaines conditions, les cellules issues de lignées de monocytes (CD14+) peuvent être induites vers un phénotype de cellules dendritiques et sont identifiées comme CD14-, CD141+, CD1c+ 9. Ces cellules, connues sous le nom de DC dérivées de monocytes (moDC), sont les plus couramment utilisées pour l’analyse ex vivo chez l’homme, car les monocytes constituent environ 10 à 30 % des cellules mononucléées du sang périphérique humain (PBMC), tandis que les pDC n’en constituent que 1 à 3 %10. Cela fait des moDC un choix attrayant, mais on sait également que les moDC sont plus inflammatoires que les cDC typiques isolés du tissu primaire9.
Il existe actuellement deux grandes catégories d’efforts visant à utiliser les tolDC pour générer une tolérance clinique. Tout d’abord, les tolDC sont générés à partir de monocytes pour être utilisés comme thérapie cellulaire. Dans ce paradigme, les moDC sont généralement différenciées à l’aide de l’IL-4/GM-CSF en même temps que des immunomodulateurs tels que la vitamine D3, la rapamycine (rapa), l’IL-10, la dexaméthasone ou des combinaisons de ces11,12. Ces tolDC ont été explorés en tant que thérapies cellulaires autologues pour l’auto-immunité et les greffes13. L’autre utilisation des tolDC consiste à reprogrammer des DC endogènes vers des tolDC en utilisant des médicaments gratuits ou des nanotransporteurs pour délivrer à la fois l’immunomodulateur et l’antigène d’intérêt 14,15,16. L’induction de DC déjà différenciées est cependant plus difficile en raison du développement de phénotypes métaboliques robustes des DC qui contrastent généralement avec le métabolisme des tolDC17,18. Il s’agit d’une barre haute pour la plupart des immunomodulateurs pharmacologiques ; pour cette raison, la plupart des études de reprogrammation endogène des DC font état d’une suppression efficace des DC et souvent d’une certaine induction des Tregs, mais manquent de succès clinique, souvent en raison d’un manque de persistance des lymphocytes T 15,19,20. Cela souligne la nécessité de stratégies pour identifier les agents d’induction potentiels de tolDC à partir de CD existants.
Ici, nous présentons une méthode d’évaluation in vitro d’agents immunomodulateurs contre des moDC différenciés avec la métrique finale de l’induction autologue des Treg. Ce protocole est conçu pour évaluer l’efficacité des agents immunomodulateurs pour reprogrammer des moDC humains déjà différenciés vers la tolérance. De plus, ce protocole valide la fonctionnalité des tolDC reprogrammés pour générer des Tregs contre des lymphocytes T autologues isolés à partir du même échantillon PBMC. Cela contraste avec d’autres protocoles qui induisent une tolérance lors de la différenciation et/ou promettent des tolDC avec des lymphocytes T de donneurs allogéniques21. Dans ce protocole, nous utilisons l’agent tolérant commun rapa comme exemple, mais nous démontrons également l’efficacité limitée des moDC traités par rapa pour générer des Tregs. Dans nos résultats représentatifs, nous montrons également l’efficacité d’autres traitements immunomodulateurs courants tels que l’IL-10, la dexaméthasone et la vitamine D3. Nous prévoyons que ce protocole sera utilisé pour dépister des agents inducteurs de tolDC potentiellement plus efficaces par rapport à des moDC22 déjà établis.
Protocole
Tous les échantillons de cellules mononucléées du sang périphérique humain (PBMC) ont été prélevés auprès de la centrale d’immunologie humaine de l’Université de Pennsylvanie auprès de donneurs anonymisés, avec l’approbation préalable de l’Institutional Review Board (IRB) de l’Université de Pennsylvanie et avec le consentement du patient.
Facultatif : Alors que dans cette méthode, nous avons utilisé des PBMC fraîchement isolés obtenus d’un laboratoire universitaire, les PBMC peuvent être isolés à partir de sang total ou de produits sanguins enrichis en leucaphérèse. Nous recommandons d’utiliser la méthode de centrifugation par gradient de densité, car il s’agit d’une méthode bien établie et fiable qui est décrite ailleurs23.
1. Isolement des monocytes/lymphocytes T et différenciation des moDC
- Isolement des monocytes et des lymphocytes T des PBMC-Jour 1
- Obtenez 200 millions de PBMC humains d’un donneur sain. Conservez les cellules dans un tube de 15 ml et transférez-les sur de la glace.
- Aliquote 50 mL de tampon de séparation (fourni dans les kits de séparation disponibles dans le commerce) dans un tube conique.
REMARQUE : Le tampon de séparation peut également être remplacé par du DPBS avec 2 % de sérum de veau fœtal (FBS) et 1 mM d’acide éthylènediaminetétraacétique (EDTA). - Retirez le tube PBMC de la glace et remplissez-le de tampon de séparation. Centrifuger à 300 x g pendant 5 minutes.
- Aspirer le surnageant à l’aide d’une pipette sérologique de 10 mL. Remettre en suspension la pastille cellulaire dans 4 mL de milieu recommandé à l’aide d’une pipette sérologique.
- Divisez la suspension en deux tubes différents de 15 ml, en ajoutant 2 ml par tube (5 × 107 cellules/ml par tube). Étiquetez un tube « T » et l’autre « Monocytes ».
- Récupérez la trousse d’isolement des monocytes humains et suivez le protocole du fabricant pour isoler les monocytes du tube marqué aux monocytes.
- Récupérez le kit d’isolement des lymphocytes T humains et suivez le protocole du fabricant pour le deuxième tube afin d’isoler les lymphocytes T.
- Placage de monocytes pour la différenciation et la congélation des lymphocytes T - Jour 1
- Préchauffer 50 mL de milieu de culture moDC (tableau 1) à 37 °C pendant au moins 10 min.
- Centrifuger les tubes de 15 mL avec des monocytes enrichis et le tube de 15 mL avec des lymphocytes T de l’étape 1.1 à 250 × g pendant 5 min.
- Aspirez le surnageant. Réinjectez les monocytes en suspension dans 1 mL de milieu de culture moDC et les lymphocytes T dans le milieu de culture de cellules T (Tableau 1) en pipetant de haut en bas. Assurez-vous que la pastille est correctement dispersée.
- Comptez les cellules à l’aide d’un compteur de cellules automatisé ou d’un hémacytomètre manuel à l’aide de la coloration au bleu trypan.
REMARQUE : Pour les données représentatives, 10 millions de lymphocytes T et 3 millions de monocytes ont été isolés. - Prenez le tube avec les monocytes et ajoutez 9 mL de milieu de culture moDC chaud à la suspension pour un volume final de 10 mL. Ensuite, ajouter 100 μL de GM-CSF et 10 μg/mL d’IL-4 pour obtenir une concentration finale de 100 ng/mL de GM-CSF et d’IL-4 dans le milieu. Transvaser la suspension dans une boîte de Pétri et étiqueter comme « moDC » (Jour 1) et incuber à 37 °C avec 5 % de CO2.
- Prenez le tube de cellules T et mélangez 1 mL de milieu de congélation pour cellules T (tableau 1) avec 1 mL de suspension de cellules T. Diviser en deux flacons cryogéniques de 2 mL (1 mL/flacon) ; Fermer hermétiquement (concentration finale de 5 millions de cellules par flacon). Placez les cryoflacons dans une chambre de congélation avec des tubes d’équilibrage dans les puits inutilisés. Conservez la chambre à −80 °C pendant la nuit, puis transférez les cryoflacons dans un réservoir cryogénique.
- Le jour 4, rafraîchir le milieu avec l’ajout de 5 ml de milieu de culture moDC frais et ajouter 100 μL chacun de GM-CSF et d’IL-4. Les moDC différenciés seront prêts le jour 7.
2. Ajout de médicaments immunomodulateurs pour générer des moDC tolérogènes
- Configurez la plaque moDC.
- Le jour 7, récupérez les moDC différenciés de l’incubateur et transférez la suspension de cellules moDC dans un tube de 50 ml.
- Centrifuger la suspension à 250 × g pendant 5 min. Aspirez le surnageant et remettez en suspension la pastille cellulaire dans 1 mL de milieu de culture moDC chaud en pipetant de haut en bas. Compter les cellules à l’aide d’un hémacytomètre et diluer les cellules à une concentration de 3 × 10 à5 cellules/mL dans un milieu de culture chaud contenant 100 ng/mL DE GM-CSF et d’IL-4.
- Ajouter 3 × 104 cellules/puits dans 100 μL au nombre désiré de puits dans une plaque de culture tissulaire à fond plat de 96 puits.
REMARQUE : Pour des résultats représentatifs, nous avons utilisé un total de 48 puits (quatre conditions faites en trois exemplaires préparées pour quatre analyses différentes dans les sections 3 et 4), mais cela peut être ajusté pour un maximum de 60 puits. Remplissez tous les puits restants avec 100 μL/puits PBS pour éviter le dessèchement, en particulier les puits extérieurs. Nous recommandons de préparer différentes plaques pour chaque méthode d’analyse. - Ajouter 1 μL/puits de médicaments immunomodulateurs dans les puits souhaités (ici 10 ng/mL de rapa). Incuber la plaque pendant une nuit à 37 °C avec 5 % de CO2.
REMARQUE : Si vous incluez l’immunostimulation le 8e jour, préparez des puits pour le médicament immunomodulateur avec et sans immunostimulation. L’utilisation de l’immunostimulation chez les moDC matures est facultative.
- Redécongeler les lymphocytes T.
- Le jour 8, récupérez deux cryoflacons du réservoir cryogénique et décongelez-les dans un bain de billes chaudes ou un bain-marie à 37 °C jusqu’à ce que le contenu commence à fondre (en <3 min).
- Lorsque le contenu commence à fondre, transférez les flacons dans une hotte de culture cellulaire et placez 1 mL de milieu de culture de cellules T chaud dans le flacon pour décongeler rapidement. Transférez tout le contenu du flacon dans un tube de 50 ml. Rincez les cryoflacons avec 1 mL de milieu de culture de cellules T pour vous assurer que toutes les cellules sont transférées dans le tube.
- Complétez la suspension avec la solution de coloration par écoulement (tableau 1) à 15 ml. Centrifuger à 200 × g pendant 10 min et aspirer le surnageant. Ensuite, mettez la pastille en suspension dans 5 mL de solution de coloration par écoulement et centrifugez-la à nouveau.
- Aspirer le surnageant et remettre les cellules en suspension dans 1 mL de milieu de culture de cellules T chaudes. Comptez les cellules à l’aide d’un hémacytomètre.
REMARQUE : La viabilité doit être de >70 % à ce stade ; s’il reste de grandes quantités de cellules mortes, transférer dans un tube frais, ajouter 10 ml de solution de coloration cellulaire, centrifuger à 200 × g pendant 5 min, remettre en suspension dans 1 ml de milieu à cellules T et recompter. - Ajouter 9 mL de milieu de culture de cellules T chaud pour obtenir un volume final de 10 mL. Transférez la suspension dans une boîte de Pétri. Étiquetez-le comme « lymphocytes T décongelés » et incubez toute la nuit à 37 °C avec 5 % de CO2 pour laisser reposer les cellules.
- Lavez la plaque moDC et ajoutez l’immunostimulateur si vous le souhaitez.
- Le jour 8, centrifugez la plaque moDC (à partir du jour 7) à 300 × g pendant 5 min.
- Aspirer le surnageant, laver avec du HBSS chaud, répéter la centrifugation, aspirer à nouveau et remettre en suspension les cellules dans un milieu de culture chaud moDC contenant du GM-CSF et de l’IL-4 (100 μL/puits).
REMARQUE : Veillez à ne pas déranger les cellules. Inclinez la plaque pendant l’aspiration. Environ 10 μL peuvent rester dans le puits. - Si vous utilisez l’immunostimulation, ajoutez 1 μL/puits de LPS 100x stock (ou un autre agent immunostimulant) dans les puits souhaités. Incuber la plaque pendant une nuit à 37 °C avec 5 % de CO2.
3. Analyse de flux pour moDC (Validation + Tolérance)
- Analyse de flux pour la validation de moDC
- Le jour 8, préparer des cocktails d’anticorps pour le panel de validation, en ciblant les marqueurs suivants : HLA-DR, CD14, lectine de type C spécifique des cellules dendritiques (DC-SIGN), CD1c et CD40, comme décrit dans le tableau 2. Diluez tous les anticorps avec une solution de coloration d’écoulement.
REMARQUE : Le panneau a été conçu pour un cytomètre de flux laser rouge / bleu à 7 canaux. - Récupérez la plaque moDC de l’incubateur. Centrifuger la plaque à 300 × g pendant 5 min. Retirez les surnageants. Facultatif : Conservez les surnageants pour l’analyse ELISA des cytokines IL-10 et TNFα à l’aide de kits disponibles dans le commerce conformément aux instructions du fabricant.
- Ajouter 200 μL/puits de solution de coloration d’écoulement. Centrifuger la plaque à 300 × g pendant 5 min.
- Aspirer le surnageant et ajouter 50 μL/puits d’anticorps inhibiteur de liaison au récepteur Fc dilué 1:200 dans une solution de coloration en flux pour bloquer la liaison non spécifique. Incuber à température ambiante (RT) pendant 30 min.
- Ajouter 50 μL/puits du cocktail d’anticorps du panel de validation préparé.
- Préparez des témoins de compensation dans la plaque ou dans des tubes de 1,5 mL en mélangeant 50 μL de billes de compensation avec 50 μL de chaque anticorps dilué. Incuber la plaque à 4 °C pendant 1 h.
REMARQUE : Les billes de compensation sont utilisées ici plutôt que les cellules pour la compensation en raison de l’expression potentiellement faible des marqueurs sur les moDC. - Laver par centrifugation à 300 × g pendant 5 min, en éliminant le surnageant et en remettant en suspension dans 200 μL de solution de coloration par écoulement. Effectuez deux lavages.
- Après le lavage final, centrifuger à nouveau et remettre les cellules en suspension dans 110 μL/puits de solution de coloration en flux. Les échantillons sont maintenant prêts pour l’analyse par cytométrie en flux.
- Le jour 8, préparer des cocktails d’anticorps pour le panel de validation, en ciblant les marqueurs suivants : HLA-DR, CD14, lectine de type C spécifique des cellules dendritiques (DC-SIGN), CD1c et CD40, comme décrit dans le tableau 2. Diluez tous les anticorps avec une solution de coloration d’écoulement.
- Analyse de flux pour moDC tolérogène (Tolerance Panel)
- Comme à l’étape 3.1 du jour 8, préparer des cocktails d’anticorps pour le panel de tolérance, en ciblant les marqueurs suivants : CD86,-L1, DC-SIGN, CD1c, BTLA et CD40 (tableau 2).
- Répétez les étapes 3.1.2 à 3.1.8 en remplaçant le cocktail d’anticorps par le cocktail du panel de tolérance .
4. Analyse de l’écoulement des lymphocytes T
- Combinez les lymphocytes T avec des moDC tolérogènes traités.
- Le 9e jour, récupérez la boîte de Pétri des lymphocytes T redécongelés de l’incubateur et transférez tous les lymphocytes T dans un tube de 50 ml. Complétez avec la solution de coloration Flow.
- Facultatif : Si vous effectuez une analyse de la prolifération des lymphocytes T, divisez les lymphocytes T en deux tubes.
- Avec le premier tube, tournez à 250 × g pendant 5 min et retirez le surnageant. Teignez ce tube avec un colorant de prolifération cellulaire selon les instructions du fabricant.
REMARQUE : Nous avons utilisé le colorant de viabilité fixable eFluor 670, qui nécessite une étape d’incubation de 30 minutes, suivie de deux étapes de lavage. Nous suggérons d’utiliser des tubes coniques de 50 ml pour éviter la perte de cellules et d’utiliser du HBSS avec 10 % de HIFBS pour laver après la coloration. - Utilisez le deuxième tube contenant des cellules T non colorées pour l’analyse des Treg. De même, essorez à 250 × g pendant 5 min, retirez le surnageant, remettez-le en suspension dans un milieu de culture cellulaire chaud et conservez-le dans l’incubateur pendant le processus de coloration. Si aucune prolifération de lymphocytes T n’est nécessaire, faites tourner tous les lymphocytes T et remplacez-les par des milieux de culture de lymphocytes T chauds.
- Avec le premier tube, tournez à 250 × g pendant 5 min et retirez le surnageant. Teignez ce tube avec un colorant de prolifération cellulaire selon les instructions du fabricant.
- Comptez les cellules et obtenez au moins 4 millions (pour l’analyse des Tregs uniquement) ou 8 millions (pour l’analyse de la prolifération des Treg et des T).
- Récupérez la plaque moDC de l’incubateur avec les puits restants, centrifugez à 300 × g pendant 5 min et apiratez les surnageants. Ajouter 200 μL/puits de cellules T à 1,6 × 105 cellules/puits. Ajoutez des lymphocytes T non colorés pour les plaques d’analyse Treg et des lymphocytes T colorés pour les plaques de prolifération des lymphocytes T.
REMARQUE : Cela maintiendra un rapport cellule T/moDC de 5:1, car les 3 ×10 initiaux4 moDC se dilatent généralement légèrement. - Ajouter 25 μL/mL de cocktail d’anticorps anti-CD3/CD28 à tous les groupes, à l’exception des puits de contrôle négatifs, pour stimuler les lymphocytes T. Incuber la plaque pendant 72 h à 37 °C avec 5 % de CO2 jusqu’au 12e jour.
REMARQUE : Assurez-vous d’utiliser des lymphocytes T colorés pour l’analyse de la prolifération et non colorés pour l’analyse des Treg.
- Analyse de l’écoulement Treg
- Coloration au marqueur de surface
- Le 12e jour, préparez des cocktails d’anticorps pour le panel Treg (tableau 2).
- Transférez toutes les suspensions cellulaires de la plaque de culture à 96 puits dans une plaque à fond en V avec une solution de coloration par écoulement. Conservez les surnageants pour l’analyse des cytokines.
- Laver les cellules 2 fois par centrifugation (200 × g pendant 5 min suivi de 200 μL de solution de coloration Flow). Réservez certaines cellules pour les contrôles de compensation. Mettez-en un de côté pour la coloration FOXP3 et pour les témoins non colorés.
REMARQUE : Nous suggérons de peigner 10 μL de tous les échantillons avant l’essorage final à l’étape 4.2.1.3 pour obtenir les contrôles de compensation nécessaires. Cela fournit un échantillon représentatif de toute l’expression au niveau de la surface de chaque marqueur sur les cellules. - Après le deuxième lavage, centrifuger à 200 x g pendant 5 min à température ambiante et aspirer, puis ajouter 50 μL/puits d’anticorps inhibiteur de liaison au récepteur Fc (dilué 1:200 dans une solution de coloration en flux). Incuber à température ambiante pendant 10 min.
- Ajouter 50 μL/puits du cocktail d’anticorps Treg Panel préparé.
- Pour les contrôles de compensation, mélanger 50 μL de cellules de compensation non colorées avec 50 μL de chaque anticorps coloré.
- Incuber la plaque et les commandes de compensation à 4 °C pendant 1 h. Lavez la plaque une fois avec Flow Stain Solution et centrifugez-la à 300 × g pendant 5 min.
- Coloration avec un colorant proche infrarouge vivant/mort dilué dans HBSS (1:1 000) à 200 μL/puits. Incuber à 4 °C pendant 30 min.
- Lavez la plaque une fois avec la solution de coloration Flow (200 μL/puits) à 300 × g pendant 5 min.
- Colorer avec FoxP3 selon les instructions du fabricant, ce qui nécessitera une incubation d’une nuit. Un bref aperçu du protocole de coloration FoxP3 est décrit ci-dessous.
- Préparez la solution de travail de fixation/perméabilisation FoxP3 selon les instructions du fabricant. Mélangez 1 partie de concentré de fixation/perméabilisation FoxP3 avec 3 parties de diluant de fixation/perméabilisation FoxP3. Préparez 200 μL de la solution de travail par échantillon.
- Incuber tous les échantillons dans 200 μL/puits de la solution de fixation/perméabilisation en état de marche. Laisser à 4 °C pendant 1 h.
- Préparez 1x tampon de perméabilisation : Mélangez 1 partie de 10x tampon de perméabilisation (obtenu à partir d’un kit commercial) avec 9 parties d’eau distillée.
- Lavez la plaque 2x avec 1x tampon de perméabilisation (200 μL/puits) à 300 × g pendant 5 min.
- Coloration avec anticorps FoxP3 (PE-Cy5.5, dilution 1:300 dans 1x tampon de perméabilisation) : Ajouter 100 μL/puits de l’anticorps FoxP3 dilué et incuber à 4 °C pendant la nuit.
- Lavez la plaque 2x avec 1x tampon de perméabilisation (200 μL/puits) à 300 × g pendant 5 min.
- Remettre les cellules en suspension dans 110 μL/puits de solution de coloration par écoulement.
- Effectuer une analyse par cytométrie en flux.
- Coloration au marqueur de surface
- Analyse de la prolifération des lymphocytes T
- Préparer des cocktails d’anticorps pour le panel sur la prolifération T (tableau 2).
- Transférez toutes les suspensions cellulaires de la plaque de culture à 96 puits dans une plaque à fond en V avec une solution de coloration par écoulement. Conserver les surnageants pour l’analyse des cytokines.
- Laver les cellules 2 fois par centrifugation (200 × g pendant 5 min suivi de 200 μL de solution de coloration Flow). Réservez certaines cellules pour les contrôles de compensation. Mettez-en un de côté pour la coloration FOXP3 et pour les témoins non colorés.
REMARQUE : Nous suggérons de peigner 10 μL de tous les échantillons avant l’essorage final à l’étape 4.3.3 pour obtenir les contrôles de compensation nécessaires. Cela fournit un échantillon représentatif de toute l’expression au niveau de la surface de chaque marqueur sur les cellules. - Après le deuxième lavage, centrifuger (200 × g pendant 5 min à température ambiante) et aspirer, puis ajouter 50 μL/puits d’anticorps inhibiteur de liaison au récepteur Fc (dilué 1:200 dans une solution de coloration en flux). Incuber à température ambiante pendant 10 min.
- Ajouter 50 μL/puits du cocktail d’anticorps du panel de prolifération T préparé.
- Pour les contrôles de compensation, mélanger 50 μL de cellules de compensation non colorées avec 50 μL de chaque anticorps coloré.
- Incuber la plaque et les commandes de compensation à 4 °C pendant 1 h. Lavez la plaque une fois avec Flow Stain Solution et centrifugez-la à 300 × g pendant 5 min.
- Coloration avec un colorant proche infrarouge vivant/mort dilué dans HBSS (1:1 000) à 200 μL/puits. Incuber à 4 °C pendant 30 min.
- Lavez la plaque une fois avec la solution de coloration Flow (200 μL/puits) à 300 × g pendant 5 min.
- Effectuer une analyse par cytométrie en flux.
Résultats
Nous avons décrit un protocole pour les PBMC humains, isolé à la fois les lymphocytes T CD3+ et les monocytes CD14+ à l’aide de kits de séparation magnétique disponibles dans le commerce, différencié les monocytes en moDC CD14-, HLA-DR+, CD141+, CD1c+ à l’aide de GM-CSF et IL-4, les traitons pendant 24 h, et co-cultivons avec des lymphocytes T autologues avec stimulation anti-CD3/CD28 pendant 72 h. Un schéma expérimental est illustré à la figure 1.
Isolement des monocytes/lymphocytes T et différenciation des moDC
Pour nos premiers résultats représentatifs, 200 millions de PBMC humains ont été achetés auprès de l’Université de Pennsylvanie Human Immunology Core (HIC) auprès d’un donneur sain et traités comme décrit dans les sections 1 et 2 du protocole. Le sang a été prélevé le jour 1 et isolé à l’aide d’un fractionnement standard de Ficoll dans l’établissement HIC. Nous avons utilisé 100 millions de PBMC pour l’isolement des lymphocytes T et des monocytes, chacun avec des rendements de 10 millions de lymphocytes T et 3 millions de monocytes, respectivement. Les monocytes et les moDC après différenciation GM-CSF/IL-4 au jour 7 ont été analysés par cytométrie en flux. Nous avons observé deux groupes distincts dans les monocytes indifférenciés, les monocytes classiques CD14+, HLA-DR- (>45 %), et une petite population de cellules CD14-, HLA-DR+ exprimant des quantités minimales de CD1c et aucun CD141. En revanche, au jour 7 de la différenciation, nous avons observé que la plupart des cellules étaient CD14-, HLA-DR+, CD141+, CD1c+, indiquant des moDC (Figure 2). Nous avons obtenu environ 4 millions de moDC à partir des 3 millions de monocytes initiaux.
Analyse de flux pour moDC (Validation + Tolérance)
Le jour 7, les moDC ont été incubés avec du rapa pendant 24 h, lavés, incubés avec du LPS pendant 24 h, puis analysés par cytométrie en flux le jour 9 via l’étape 3 du protocole. Les groupes de traitement comprenaient : 1) aucun traitement + aucun traitement (UT), 2) aucun traitement + 0,1 μg/mL LPS (LPS), 3) 10 ng/mL de rapa + aucun traitement (rapa), ou 4) 10 ng/mL de rapa + 0,1 μg/mL DE LPS (LPS + rapa). Le traitement par rapa, avec et sans LPS, a diminué les populations CD1c+, DC-SIGN+ de l’UT, bien que les pourcentages soient restés >50 % (figure 3A). Au jour 9, les MoDC ont également été analysés pour l’expression des marqueurs de maturation des DC, CD86 et CD40. Nous avons observé une augmentation marquée de CD86 lorsque les moDC étaient traités avec du LPS, ce qui a été évité lorsque les moDC étaient prétraités avec du rapa (Figure 3B). Lorsque le signal a été normalisé pour les témoins UT, nous avons observé une diminution significative de CD40 et CD86 dans les groupes de traitement rapa et aucune augmentation du signal avec les groupes LPS + rapa (Figure 3C,D). Ce même schéma a été observé pour les marqueurs tolérogènes,-L1 et BTLA, le traitement par rapa diminuant le signal et empêchant une augmentation de la réponse à la stimulation LPS (Figure 3E,F). Cela indique que le traitement par rapa a empêché la maturation du LPS mais a simultanément limité l’expression des marqueurs tolérogènes.
Analyse de l’écoulement pour les Treg
Nous avons ensuite analysé les cellules T autologues après co-culture avec des moDC et stimulation avec stimulation CD3/CD28 le jour 12 à un rapport de 1:5 cellules moDC :T en utilisant l’étape de protocole 4.2. Nous avons identifié les populations de Tregs par CD4+, CD25+, FoxP3+ (Figure 4)24. Les échantillons comprenaient des lymphocytes T sans stimulation (contrôle négatif), des lymphocytes T avec stimulation CD3/CD28 mais sans moDC, et des lymphocytes T avec stimulation CD3/CD28 et co-cultivés avec les quatre groupes moDC du paragraphe précédent. Nous avons observé une population claire de Tregs et une augmentation marquée des Tregs lorsque les moDC ont été ajoutés à la co-culture. Cependant, il n’y avait pas de différence significative dans la fréquence des Treg entre les quatre moDC, contrairement à certains rapports de littérature qui démontrent une augmentation de la génération de Treg à partir des tolDC traités par rapa (Figure 5A)25.
Analyse en flux de la prolifération des lymphocytes T
Nous avons également analysé notre échantillon représentatif pour la prolifération des lymphocytes T à l’aide de l’étape 4.3 du protocole. Les co-cultures de lymphocytes T-moDC ont été stimulées de la même manière que dans l’analyse Treg, puis analysées par flux pour le colorant de prolifération cellulaire des lymphocytes T CD4+ ou CD8+ (Figure 5B). Nous avons observé que les moDC traités par rapa présentent une diminution modérée de la prolifération des lymphocytes T dans les compartiments des lymphocytes T CD4+ et CD8+ par rapport aux moDC traités au LPS et aux moDC non traités lors de la stimulation CD3/CD28.
Analyse d’échantillons de patients supplémentaires et d’immunomodulateurs :
Nos résultats représentatifs indiquent que les moDC traités par rapa réduisent les marqueurs de maturité des DC tels que CD86 et CD40 et réduisent la prolifération des lymphocytes T à la stimulation non spécifique de CD3/CD28. Cependant, les moDC traités par Rapa ont peu d’effet sur les marqueurs positifs de tolérance, tels que-L1 ou BTLA, et n’augmentent pas les populations de Tregs lors de la stimulation CD3/CD28. Pour déterminer si des résultats similaires des lymphocytes T seraient observés chez d’autres patients et immunomodulateurs, nous avons répété l’expérience de co-culture autologue à partir d’échantillons humains supplémentaires (pour un total de 4 ou 5 selon l’analyse). Nous avons ensuite testé 1 μM de dexaméthasone (Dex), 10 ng/mL d’IL-10 (IL-10), 1 μg/mL de lipopolysaccharide (LPS) ou 1 nM de vitamine D3 (VD3) en plus de 10 ng/mL de Rapa comme immunomodulateurs administrés à l’étape 2.1.4, mais en omettant l’immunostimulation. Nous avons également inclus un échantillon qui a reçu du Dex à l’étape 2.1.4 et traité avec 0,1 μg/mL de LPS à l’étape 2.3.3 le jour 8 (Dex + LPS). Nous avons d’abord testé les surnageants de moDC (sans ajout de lymphocytes T) soit 24 h ou 72 h après l’étape 2.3.3 le jour 8 pour la cytokine de tolérance commune IL-10 et la cytokine inflammatoire TNFα (Figure 6A-D). Nous avons observé que les moDC traités par rapa n’augmentaient pas l’IL-10 dans les échantillons à 24 h ou 72 h, mais que les échantillons traités à l’IL-10 augmentaient significativement la production d’IL-10 à 24 h, même après deux étapes de lavage pour éliminer l’IL-10 ajoutée exogène. (Figure 6A). Nous avons également observé que les moDC traités au Dex augmentaient significativement la production d’IL-10, mais seulement après 72 heures de repos (Figure 6B). Nous avons également observé qu’aucun immunomodulateur ne générait de TNFα à lui seul, mais que le prétraitement de Dex réduisait la production moyenne de TNFα lors d’un traitement par LPS à 24 h, bien que ce résultat ne soit pas significatif (Figure 6C). Les données montrent en outre que si l’expression de la moDC de-L1 n’est augmentée par aucun immunomodulateur à 24 h, des augmentations significatives des moDC de-L1+ ont été observées dans les groupes traités par Dex + LPS et Rapa à 72 h (Figure 6E,F). Comme notre échantillon représentatif unique, nous observons également une suppression de l’expression de CD86 chez tous les groupes traités par immunomodulateur à la fois à 24 h et à 72 h (Figure 6G,H). Ceux-ci confirment que les immunomodulateurs peuvent augmenter les marqueurs tolérogènes des moDC, bien que l’effet soit retardé.
Nous avons analysé plus en détail les réponses des lymphocytes T après la co-culture au 12e jour. Nous avons observé que les moDC traités par immunomodulateur n’augmentaient pas la prolifération des lymphocytes T CD4+ par rapport aux témoins moDC non traités, comme dans d’autres rapports publiés26 (Figure 6I). Il est intéressant de noter que nous n’avons pas observé d’augmentation significative des populations de Tregs pour les moDC traités par immunomodulateur dans l’échantillon plus large (Figure 6J). Nous pensons que ce manque de signification est dû à une grande variabilité entre les échantillons de patients ; deux des échantillons de patients (1 et 2) ne semblaient pas augmenter les Tregs pour aucun traitement, tandis que les deux autres (3 et 4) ont montré des augmentations avec presque tous les traitements immunomodulateurs (Figure 6J). Cela souligne la nécessité d’effectuer une analyse des immunomodulateurs avec plusieurs échantillons de patients et suggère que la prolifération des Treg via les moDC traités par immunomodulateur est très variable entre les patients.

Figure 1 : Schéma de vue d’ensemble expérimental. Les monocytes et les lymphocytes T sont isolés à partir de PBMC, les monocytes sont différenciés en moDC, sont testés avec des agents immunomodulateurs pour générer des tolDC et sont co-cultivés avec des lymphocytes T. Abréviations : PBMC = cellules mononucléées du sang périphérique ; moDCs = cellules dendritiques dérivées de monocytes ; tolDCs = cellules dendritiques tolérogènes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
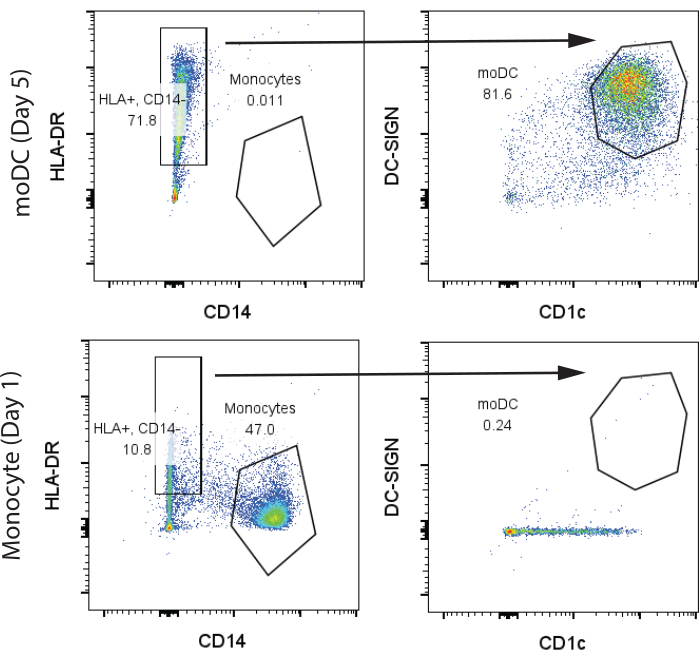
Figure 2 : Stratégie de contrôle représentative pour l’identification des monocytes CD14+, HLA-DR- et des moDC CD14-, HLA-DR+, CD1c+, DC-SIGN+. Les échantillons ont été analysés le jour 7. Abréviations : moDC = cellule dendritique dérivée de monocytes ; HLA-DR = antigène leucocytaire humain-DR ; DC-SIGN = lectine de type C spécifique des cellules dendritiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Analyse par cytométrie en flux des moDC après un traitement par rapa et/ou LPS. Le jour 6, 105 moDC ont été incubés avec des immunomodulateurs pendant 24 h, puis lavés et incubés avec ou sans LPS à 0,1 μg/mL pendant 24 h. Le 9e jour, les moDC ont été lavés et analysés par cytométrie en flux. (A) Identification des monocytes CD14+, HLA-DR- et des moDC CD14-, HLA-DR+, CD1c+, DC-SIGN+. (B) Histogrammes représentatifs du signal moDC CD86 après traitement ; intensité moyenne de fluorescence pour (C) CD86, (D) CD40, (E)-L1 et (F) BTLA. Les échantillons étaient en triplets techniques (N = 3) provenant des PBMC du même patient. La signification a été déterminée par ANOVA à un facteur par rapport au groupe UT. *p < 0,05, **p < 0,01, ***p < 1 × 10-3, ****p < 1 × 10-4. Abréviations : PBMC = cellules mononucléées du sang périphérique ; moDCs = cellules dendritiques dérivées de monocytes ; HLA-DR = antigène leucocytaire humain-DR ; rapa = rapamycine ; LPS = lipopolysaccharide ; MFI = intensité moyenne de fluorescence ; BTLA = atténuateur des lymphocytes B et T ; -L1 = ligand 1 de mort cellulaire programmée ; UT = Non traité ; LPS moDC = moDC traités avec 0,1 μg/mL de LPS le jour 8 ; Rapa moDC = moDC traités avec 10 ng/mL de rapa le jour 7 puis lavés le jour 8 ; Rapa + LPS moDCs = moDC traités avec 10 ng/mL de rapa le jour 7, puis lavés et traités à 0,1 μg/mL de LPS le jour 8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
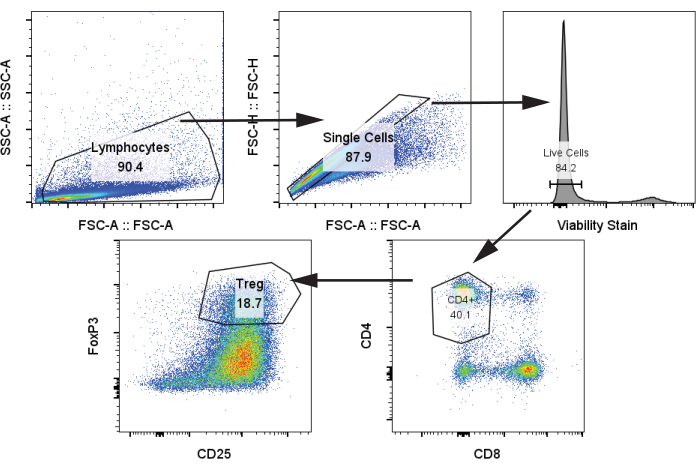
Figure 4 : Stratégie de contrôle représentative pour l’identification des Tregs CD4+, CD25+, FoxP3+. L’échantillon a été analysé à partir de cellules T décongelées le 12e jour. Abréviations : SSC-A = aire de crête de diffusion latérale ; FSC-A = aire de crête de diffusion vers l’avant ; Tregs = lymphocytes T régulateurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Analyse représentative des lymphocytes T de la co-culture de cellules moDC-T au jour 12. (A) Tracés représentatifs des flux CD25 par rapport à FoxP3 des lymphocytes T CD4+ vivants et uniques pour identifier les Tregs. La colonne de gauche contient les contrôles : lymphocytes T uniquement (en haut) et lymphocytes T stimulés par CD3/CD28 (en bas). Colonne du milieu : moDC sans traitement rapa, colonne de droite : moDcs avec traitement rapa. Pour les colonnes du milieu et de droite, la rangée supérieure est constituée d’échantillons sans LPS et la rangée inférieure est avec traitement LPS. (B) Gate représentatif de la prolifération des lymphocytes T. Les lymphocytes T CD4+ (à gauche) ou CD8+ (à droite) ont été tracés en fonction de la coloration de prolifération. Les pics sont indiqués pour les divisions cellulaires 0, 1, 2 ou 3. Les histogrammes sont étiquetés avec le type de traitement moDC. Abréviations : rapa = rapamycine ; LPS = lipopolysaccharide ; moDCs = cellules dendritiques dérivées de monocytes ; Lymphocytes T seulement = lymphocytes T sans moDC sans traitement CD3/CD28 ; UT = Non traité ; LPS moDC = moDC traités à 0,1 μg/mL LPS le jour 8 ; Rapa moDC = moDC traités avec 10 ng/mL de rapa le jour 7 puis lavés le jour 8. Notez que le traitement par rapa augmente les quantités relatives de cellules avec 0 division. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Analyse de plusieurs échantillons de cellules moDC/T avec des immunomodulateurs supplémentaires. Les MoDC ont été traités avec 1 μM de dexaméthasone, 10 ng/mL d’IL-10, 1 μg/mL de lipopolysaccharide ou 1 nM de vitamine D3 en plus de 10 ng/mL de Rapa comme immunomodulateurs administrés à l’étape 2.1.4, mais en omettant l’immunostimulation. Nous avons également inclus un échantillon qui a reçu du Dex à l’étape 2.1.4 et traité avec 0,1 μg/mL de LPS à l’étape 2.3.3 le jour 8 (Dex + LPS). (A,-D) Analyse des cytokines des moDC. Les surnageants ont été testés pour l’IL-10 soit (A) 24 h ou (B) 72 h après l’étape 2.3.3, ou testés pour le TNFα pour C) 24 h ou (D) 72 h après l’étape 2.3.3 à l’aide de trousses ELISA commerciales. N = 5. (E-H) Analyse des marqueurs de surface moDC. De même, les moDC ont été analysés par cytométrie en flux pour-L1 à (E) 24 h ou (F) 72 h ou pour CD86 à (G) 24 h ou (H) 72 h. N = 5. (I) Analyse de la prolifération des lymphocytes T. Au jour 12, les lymphocytes T CD4+ ont été analysés pour déterminer la prolifération des lymphocytes T et calculer le nombre de divisions cellulaires par 100 lymphocytes T. Les échantillons ont été incubés à un rapport de cellules moDC :T de 1:5, N = 4. (E) Analyse des Tregs. Les MoDC différenciés de cinq patients différents ont été analysés de la même manière que dans la figure 5. À gauche, non traités ; à droite, les moDC traités avec 10 ng/mL de rapa. Chaque ligne colorée représente un échantillon de patient différent. La signification a été déterminée par une ANOVA à une façon. *p < 0,05, **p < 0,01.Abréviations : rapa = rapamycine ; LPS = lipopolysaccharide ; TNFα = facteur de nécrose tumorale-alfa ; moDCs = cellules dendritiques dérivées de monocytes ; UT = Non traité ; LPS moDC = moDC traités 0,1 μg/mL LPS ; Rapa moDC = moDC traités avec 10 ng/mL de rapa, Dex = moDC traités avec 1 μM de dexaméthasone, IL-10 = moDC traités avec 10 ng/mL d’IL-10, VD3 = moDC traités avec 1 nM de vitamine D3, Dex + LPS = moDC traités avec 1 μM de dexaméthasone le jour 7, puis 0,1 μg/mL de LPS le jour 8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Milieu de culture moDC | Solution de coloration par écoulement | Milieu de culture de cellules T | Milieu de congélation des cellules T | |
| Base multimédia | RPMI 1640 | HBSS | RPMI 1640 | Milieux de culture de cellules T |
| Volet 1 | 10 % de FBS inactivé par la chaleur (hi-fbs) | 1 % BSA p/v | 10 % de FBS inactivé par la chaleur (hi-fbs) | 10 % de DMSO |
| Volet 2 | 1x Pénicilline-Streptomycine | 0,1 mM EDTA | 1x Pénicilline-Streptomycine | N/A |
| Volet 3 | N/A | N/A | 1 mM HEPES | N/A |
| Volet 4 | N/A | N/A | 1 x acides aminés non essentiels | N/A |
| Volet 5 | N/A | N/A | 50 μM β-mercaptoéthanol | N/A |
Tableau 1 : Description des réactifs de culture cellulaire
| Panneau | Anticorps | Fluorophore | Dilution | Canal |
| Validation | HLA-DR | Alexa Fluor488 | 1:500 | Bleu 1 |
| CD14 | PE | 1:500 | Bleu 2 | |
| SIGNE DC | Percp-Cy5.5 | 1:500 | Bleu 3 | |
| CD1c | PE-Cy7 | 1:500 | Bleu 4 | |
| CD40 | APC | 1:500 | Rouge 1 | |
| Tolérance | CD86 | FITC | 1:500 | Bleu 1 |
| -L1 | PE | 1:5000 | Bleu 2 | |
| SIGNE DC | Percp-Cy5.5 | 1:500 | Bleu 3 | |
| CD1c | PE-Cy7 | 1:500 | Bleu 4 | |
| BTLA | APC | 1:250 | Rouge 1 | |
| CD40 | APC efluor 780 | 1:500 | Rouge 3 | |
| Treg | CD4 | Alexa Fluor488 | 1:500 | Bleu 1 |
| CD8 | PE-Cy7 | 1:500 | Bleu 4 | |
| CD25 | APC | 1:500 | Rouge 1 | |
| T Prolifération | CD4 | Alexa Fluor488 | 1:500 | Bleu 1 |
| CD69 | PE | 1:500 | Bleu 2 | |
| CD8 | PE-Cy7 | 1:500 | Bleu 4 | |
| *Tous les anticorps sont dilués dans une solution de teinture d’écoulement | ||||
Tableau 2 : Description des panels d’anticorps de cytométrie en flux
Discussion
Nous décrivons ici une méthode fiable et polyvalente pour évaluer la fonctionnalité des agents immunomodulateurs pour induire des tolDC à partir de moDC et valider leur fonctionnalité pour générer des Tregs à partir de cellules T autogènes ex vivo. Ce protocole comporte plusieurs étapes critiques. Tout d’abord, les monocytes sont des cellules notoirement sensibles et doivent être obtenus à partir de PBMC frais, qui n’ont pas encore été congelés, pour obtenir les meilleurs résultats. Les monocytes doivent être isolés dès que possible et placés dans le cocktail de différenciation. En règle générale, un faible rendement en monocytes ou des taux élevés de mort des monocytes dans les premières 24 heures sont dus à des cycles de gel/dégel ou à des périodes prolongées entre l’isolement des PBMC et des monocytes. Deuxièmement, les cytokines utilisées pour la différenciation des moDC et des milieux de culture de cellules T doivent provenir d’une source de haute qualité. En règle générale, une mauvaise différenciation des moDC est due à une mauvaise qualité ou à des concentrations incorrectes de cytokines. Troisièmement, nous recommandons que les lymphocytes T soient congelés entre le jour 1 et le jour 7 et qu’ils ne soient pas conservés en culture afin de préserver leur phénotype naïf et non stimulé. Quatrièmement, il peut être utile de laisser les moDC traités au repos jusqu’à 72 heures pour permettre l’augmentation des marqueurs tolérogènes tels que-L1 et IL-10, comme le montre la figure 6. Enfin, comme le montrent nos données, il existe une grande variabilité de la capacité de génération de Tregs chez les patients, de sorte que chaque contrôle doit être exécuté avec chaque échantillon de patient pour tirer des conclusions. Nous vous recommandons de tester plusieurs échantillons de patients.
Dans nos résultats représentatifs, nous avons choisi un modèle expérimental plutôt restrictif pour démontrer la tolérance avec une barre haute. Nous avons choisi une concentration modérément faible de rapa (10 ng/mL), incubé uniquement avec des moDC déjà différenciés pendant 24 h, puis incubé dans un rapport de cellules moDC :T de 1:5 pendant 72 h avec une stimulation non spécifique CD3/CD28. Ce protocole est très polyvalent car l’une des conditions suivantes peut être facilement modifiée : concentration de l’immunomodulateur, temps d’incubation de l’immunomodulateur, si l’incubation se produit en même temps que la différenciation du moDC ou séparément, rapport de co-culture des cellules moDC :T, temps d’incubation de la co-culture et co-stimulation des lymphocytes T. Tous ces facteurs peuvent modifier la facilité avec laquelle le traitement moDC induit la génération de Treg. Il convient de noter l’utilisation de la stimulation non spécifique des CD3/CD28 pour induire la prolifération des lymphocytes T. Cela pourrait facilement être remplacé par un antigène d’intérêt - un antigène de contrôle tel que les pools de peptides CEFT avec des échantillons de patients sains ou des auto-antigènes comme l’insuline avec des échantillons de patients atteints de diabète de type 127,28. Cela fournirait des données de tolérance spécifiques à l’antigène, qui seraient probablement différentes de la tolérance non spécifique médiée par les Tregs.
Bien que polyvalent, ce protocole présente certaines limites. À savoir, il est limité à seulement quelques marqueurs tolDC, CD86, CD40,-L1 et BTLA. Il s’agit de marqueurs couramment acceptés et d’une limitation du nombre de canaux disponibles dans notre cytomètre en flux de laboratoire. D’autres marqueurs tels que ILT-3 et ILT-4 ou d’autres pourraient également être choisis25. Ce protocole n’évalue pas non plus d’autres types de sous-ensembles de lymphocytes T suppresseurs, tels que les lymphocytes T régulateurs de type 1 (Tr1), qui peuvent présenter de puissants phénotypes protecteurs in vivo29. Nous soutenons cependant que ce protocole évalue la fonctionnalité des DC pour générer des Tregs FoxP3+ CD25+ classiques, ce qui est suffisant pour le criblage initial de nouveaux composés immunomodulateurs et l’évaluation de la capacité tolérogène des DC.
Un autre aspect intéressant de l’évaluation du moDC humain est la variabilité des patients et la réponse limitée de l’IL-10, du-L1, du BLTA et, surtout, des Tregs aux immunomodulateurs montrés dans nos résultats représentatifs, en particulier au rapa. La littérature montre des résultats contradictoires. Des résultats similaires à cet article ont été observés dans des CD murins et humains traités par rapa, montrant une diminution des marqueurs de maturité des DC (CD80/CD86/CD40) et la prévention de la libération d’IL-2 par les lymphocytes T lorsqu’ils ne sont pas stimulés de manière non spécifique, mais pas de mort des lymphocytes T ou de génération de Treg26,30. Cependant, d’autres études chez l’homme et la souris montrent que les DC traités ex vivo par rapa présentent des niveaux élevés de génération25 de Treg. Rapa est une cible mécaniste de la rapamycine inhibitrice (mTOR), une protéine kinase dans la voie de signalisation PI3K/AKT/mTOR ayant plusieurs fonctions cellulaires cruciales telles que la croissance cellulaire, la prolifération et la survie31. Rapa est souvent utilisé comme médicament anti-rejet pour la transplantation et présente un avantage clinique bien établi dans la prévention des réponses immunologiques. Cependant, en raison de son utilisation en tant qu’agent d’induction du tolDC, le rapa peut avoir une efficacité variable d’un patient à l’autre.
Cela souligne la nécessité d’étudier rigoureusement les agents d’induction de tolDC contre des populations de patients plus larges et d’identifier de nouveaux composés immunomodulateurs. Un nombre écrasant d’études cliniques sur les tolDC humains utilisent soit le rapa, l’IL-10, la dexaméthasone ou la vitamine D3 comme immunomodulateurs32. Cela laisse un vaste espace chimique inexploré. Nous présentons ce test comme un outil d’investigation pour évaluer le potentiel d’induction de tolDC de nouveaux immunomodulateurs et pour évaluer leur potentiel à générer des tolDC à partir de DC endogènes. Ce protocole est simple, polyvalent, ne nécessite qu’un cytomètre en flux et peut être adapté pour une fonctionnalité à haut débit.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous tenons à remercier le Human Immunology Core (HIC) de l’Université de Pennsylvanie d’avoir fourni de nouveaux PBMC humains provenant de donateurs. Le HIC est soutenu en partie par les AI045008 P30 et P30 CA016520 des NIH.
matériels
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
Références
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon