Method Article
Eine einfache und effiziente Methode zum Testen immunmodulatorischer Wirkstoffe zur Erzeugung tolerogener dendritischer Zellen aus humanen CD14+ -Monozyten
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren zur Bewertung der Fähigkeit pharmakologischer Wirkstoffe, tolerogene dendritische Zellen aus naiven Monozyten-abgeleiteten dendritischen Zellen in vitro zu generieren und ihre Wirksamkeit durch autologe regulatorische T-Zell-Generierung zu validieren.
Zusammenfassung
Tolerogene dendritische Zellen (tolDCs) sind eine Untergruppe der dendritischen Zellen (DCs), von denen bekannt ist, dass sie naive T-Zellen in Richtung eines regulatorischen T-Zell-Phänotyps (Treg) beeinflussen. TolDCs werden derzeit als Therapien für Autoimmunität und Transplantation untersucht, sowohl als Zelltherapie als auch als Methode zur Induktion von tolDCs aus endogenen DCs. Bisher ist die Anzahl der bekannten Wirkstoffe zur Induktion von tolDCs aus naiven DCs jedoch relativ gering und ihre Wirksamkeit zur Erzeugung von Tregs in vivo war inkonsistent, insbesondere bei Therapien, die tolDCs aus endogenen DCs induzieren. Dies bietet die Möglichkeit, neuartige Verbindungen zu erforschen, um Toleranz zu erzeugen.
Hier beschreiben wir eine Methode, um neuartige immunmodulatorische Verbindungen an Monozyten-abgeleiteten DCs (moDCs) in vitro zu testen und ihre Funktionalität zur Erzeugung autologer Tregs zu validieren. Zunächst erhalten wir PBMCs und isolieren CD14+ -Monozyten und CD3+ T-Zellen mit kommerziell erhältlichen magnetischen Trennkits. Als nächstes differenzieren wir Monozyten in moDCs, behandeln sie 24 h lang mit einem etablierten Immunmodulator wie Rapamycin, Dexamethason, IL-10 oder Vitamin D3 und testen ihre Veränderung in tolerogenen Markern als Validierung des Protokolls. Schließlich co-kultivieren wir die induzierten tolDCs mit autologen T-Zellen in Gegenwart einer anti-CD3/CD28-Stimulation und beobachten Veränderungen in den Treg-Populationen und der T-Zellproliferation. Wir stellen uns vor, dass dieses Protokoll verwendet wird, um die Wirksamkeit neuartiger immunmodulatorischer Wirkstoffe zu bewerten, um bereits differenzierte DCs in Richtung tolDC umzuprogrammieren.
Einleitung
Dendritische Zellen (DCs) sind wichtige Vermittler zwischen angeborener und adaptiver Immunität. DCs, die sich hauptsächlich in Schleimhäuten, Haut und lymphatischem Gewebe befinden, sind die primären antigenpräsentierenden Zellen (APCs)1. DCs nehmen fremde Proteine auf und verarbeiten sie und präsentieren sie auf Haupthistokompatibilitätsproteinen (MHC) für naive T-Zellen. DCs exprimieren spezifisch MHC-Klasse-II-Proteine, wie z. B. das humane Leukozytenantigen-DR (HLA-DR) beim Menschen. Der Aktivierungszustand der DCs nach Antigenexposition ist entscheidend für die nachgeschaltete T-Zell-Antwort2. Unreife DCs exprimieren verschiedene Mustererkennungsrezeptoren (PRRs), die Klassen von Molekülen erkennen, die als pathogenassoziierte molekulare Muster (PAMPs) bezeichnet werden, wie z. B. die bakterielle Wandkomponente Lipopolysaccharid (LPS)3. Nach der PRR-Stimulation werden DCs zu gereiften DCs und regulieren wichtige co-stimulatorische T-Zell-Proteine wie CD80, CD86 und CD40 hoch und sezernieren proinflammatorische Zytokine wie den Tumornekrosefaktor-alpha (TNFα), was die Differenzierung naiver T-Zellen in konventionelle Effektor- oder Helfer-T-Zellen erleichtert2. Im Gegenteil, wenn die DC-Reifung unterbrochen wird oder wenn sich DCs in einer tolerogenen Umgebung entwickeln, können DCs einen tolerogenen DC-Zustand (tolDCs) erzeugen4. TolDCs regulieren klassische T-Zell-Co-stimulatorische Rezeptoren herunter und regulieren stattdessen Toleranzrezeptoren wie den programmierten Zelltod-Liganden 1 (PD-L1) und den B- und T-Lymphozyten-Attenuator (BTLA) hoch und erzeugen suppressive Zytokine wie Interleukin 10 (IL-10) und den transformierenden Wachstumsfaktor Beta (TGF-β)4. Dies ist keine vollständige Liste von Toleranzmarkern, und tatsächlich besteht nur begrenzter Konsens darüber, welche tolDC-Marker geeignet sind, um den tolDC-Zustand5 zu definieren. Vor diesem Hintergrund schlagen wir die regulatorische T-Zell-Generierung (Treg) als funktionellen Marker vor, der zum Vergleich der Wirksamkeit verschiedener tolDC-Induktionsmittel verwendet werden sollte.
Zusätzlich zu tolDC/gereiften DC-Aktivierungszuständen können DCs auch nach ihrer Abstammung oder Gewebelokalisation kategorisiert werden, wobei jede Untergruppe eine leicht unterschiedliche Funktionalität aufweist. Während die Teilung von tolDC und gereiftem DC weniger definitiv ist und eher als Kontinuum existiert, haben Abstammungsteilungen sowohl bei Menschen als auch bei Mäusen gut definierte Marker. DC-Vorläufer werden im Knochenmark gebildet, aber es gibt zwei Hauptsubtypen von DCs, die auf ihrer Abstammung basieren: 1) plasmazytoide dendritische Zellen (pDCs), die von lymphoiden Linien abstammen, und 2) konventionelle dendritische Zellen (cDCs), die von myeloischen Linien abstammen. Beim Menschen sind pDCs in lymphatischen Organen gereift, exprimieren CD303 und reagieren sehr gut auf Virusinfektionen6. CD11c-exprimierende cDCs hingegen sind in peripheren Geweben gereift und existieren in zwei unterschiedlichen Subtypen, CD1c+ cDC1s und CD141+ cDC2, die jeweils unterschiedliche T-Zell-Antworten erzeugen7. Darüber hinaus können alle cDCs entweder in geweberesidenten (CD103-) oder migratorischen (CD103+) Subzuständen existieren8. Schließlich können Zellen aus Monozytenlinien (CD14+) unter bestimmten Bedingungen in Richtung eines dendritischen Zellphänotyps induziert werden und werden als CD14-, CD141+, CD1c+ 9 identifiziert. Diese Zellen, die als Monozyten-abgeleitete DCs (moDCs) bekannt sind, werden am häufigsten für die Ex-vivo-Analyse beim Menschen verwendet, da Monozyten etwa 10-30 % der mononukleären Zellen (PBMCs) des menschlichen peripheren Blutes ausmachen, während pDCs nur 1-3 % ausmachen10. Dies macht moDCs zu einer attraktiven Wahl, aber es ist auch bekannt, dass moDCs entzündlicher sind als typische cDCs, die aus primärem Gewebe isoliert wurden9.
Derzeit gibt es zwei große Kategorien von Bemühungen, tolDCs zur Erzeugung klinischer Toleranz einzusetzen. Zunächst werden tolDCs aus Monozyten für den Einsatz als Zelltherapie erzeugt. In diesem Paradigma werden moDCs typischerweise unter Verwendung von IL-4/GM-CSF gleichzeitig mit Immunmodulatoren wie Vitamin D3, Rapamycin (Rapa), IL-10, Dexamethason oder Kombinationen dieserunterschieden 11,12. Diese tolDCs wurden als autologe Zelltherapien für Autoimmunität und Transplantationen erforscht13. Die andere Verwendung von tolDCs besteht darin, endogene DCs unter Verwendung von freien Wirkstoffen oder Nanocarriern in Richtung tolDCs umzuprogrammieren, um sowohl Immunmodulatoren als auch Antigene von Interesse zu liefern 14,15,16. Die Induktion bereits differenzierter DCs stellt jedoch eine größere Herausforderung dar, da sich robuste metabolische Phänotypen von DCs entwickeln, die typischerweise im Gegensatz zum tolDC-Metabolismus stehen17,18. Dies ist eine hohe Messlatte für die meisten pharmakologischen Immunmodulatoren; Aus diesem Grund berichten die meisten endogenen DC-Reprogrammierungsstudien über eine effektive DC-Suppression und oft eine gewisse Treg-Induktion, aber keinen klinischen Erfolg, oft aufgrund mangelnder T-Zell-Persistenz 15,19,20. Dies unterstreicht den Bedarf an Strategien zur Identifizierung potenzieller tolDC-Induktionsstoffe aus bestehenden DCs.
In dieser Arbeit stellen wir eine Methode zur in vitro Evaluierung von immunmodulatorischen Wirkstoffen gegen differenzierte moDCs mit der Endmetrik der autologen Treg-Induktion vor. Dieses Protokoll wurde entwickelt, um die Wirksamkeit von immunmodulatorischen Wirkstoffen zu bewerten, um bereits differenzierte menschliche moDCs in Richtung Toleranz umzuprogrammieren. Darüber hinaus validiert dieses Protokoll die Funktionalität von umprogrammierten tolDCs zur Erzeugung von Tregs gegen autologe T-Zellen, die aus derselben PBMC-Probe isoliert wurden. Dies steht im Gegensatz zu anderen Protokollen, die Toleranz während der Differenzierung induzieren und/oder tolDCs mit T-Zellen von allogenen Spendern herausfordern21. In diesem Protokoll verwenden wir den gängigen Tolerierungsstoff Rapa als Beispiel, zeigen aber auch die begrenzte Wirksamkeit von Rapa-behandelten moDCs zur Erzeugung von Tregs. In unseren repräsentativen Ergebnissen zeigen wir auch die Wirksamkeit anderer gängiger immunmodulatorischer Behandlungen wie IL-10, Dexamethason und Vitamin D3. Wir stellen uns vor, dass dieses Protokoll verwendet wird, um potenziell wirksamere tolDC-induzierende Wirkstoffe gegen bereits etablierte moDCs zu screenen22.
Protokoll
Alle Proben von humanen mononukleären Blutzellen (PBMC) wurden aus dem Human Immunology Core der University of Pennsylvania von anonymisierten Spendern mit vorheriger Genehmigung des Institutional Review Board (IRB) der University of Pennsylvania mit Zustimmung des Patienten entnommen.
Optional: Während wir bei dieser Methode frisch isolierte PBMCs aus einem akademischen Labor verwendet haben, können PBMCs entweder aus Vollblut oder mit Leukapherese angereicherten Blutprodukten isoliert werden. Wir empfehlen die Verwendung der Dichtegradientenzentrifugationsmethode, da es sich um eine etablierte und zuverlässige Methode handelt, die an anderer Stellebeschrieben wird 23.
1. Isolierung von Monozyten/T-Zellen und moDC-Differenzierung
- Isolierung von Monozyten und T-Zellen aus PBMCs - Tag 1
- Erhalten Sie 200 Millionen menschliche PBMCs von einem gesunden Spender. Bewahren Sie die Zellen in einem 15-ml-Röhrchen auf und übertragen Sie sie auf Eis.
- Aliquot 50 mL Separationspuffer (in kommerziell erhältlichen Separationskits enthalten) in einem konischen Röhrchen.
HINWEIS: Der Trennpuffer kann auch durch DPBS mit 2 % fötalem Rinderserum (FBS) und 1 mM Ethylendiamintetraessigsäure (EDTA) ersetzt werden. - Nehmen Sie das PBMC-Röhrchen aus dem Eis und füllen Sie es mit Separation Buffer. Bei 300 x g 5 Minuten zentrifugieren.
- Aspirieren Sie den Überstand mit einer serologischen 10-ml-Pipette. Resuspendieren Sie das Zellpellet in 4 ml des empfohlenen Mediums mit einer serologischen Pipette.
- Teilen Sie die Suspension in zwei verschiedene 15-ml-Röhrchen auf und fügen Sie 2 mL pro Röhrchen hinzu (5 × 107 Zellen/mL pro Röhrchen). Beschriften Sie ein Röhrchen mit "T" und das andere mit "Monozyten".
- Entnehmen Sie das humane Monozyten-Isolationskit und befolgen Sie das Protokoll des Herstellers, um Monozyten aus dem mit Monozyten markierten Röhrchen zu isolieren.
- Nehmen Sie das humane T-Zell-Isolationskit und befolgen Sie das Protokoll des Herstellers für das zweite Röhrchen zur Isolierung von T-Zellen.
- Plattierung von Monozyten zur Differenzierung und zum Einfrieren von T-Zellen - Tag 1
- 50 ml moDC-Nährmedium (Tabelle 1) mindestens 10 Minuten lang auf 37 °C vorheizen.
- Zentrifugieren Sie die 15-ml-Röhrchen mit angereicherten Monozyten und das 15-ml-Röhrchen mit T-Zellen aus Schritt 1.1 bei 250 × g für 5 min.
- Aspirieren Sie den Überstand. Resuspendieren Sie Monozyten in 1 ml moDC-Kulturmedium und T-Zellen in T-Zell-Kulturmedium (Tabelle 1) durch Auf- und Abpipettieren. Stellen Sie sicher, dass das Pellet richtig verteilt ist.
- Zählen Sie die Zellen mit einem automatisierten Zellzähler oder einem manuellen Hämazytometer mit Trypanblau-Färbung.
HINWEIS: Für die repräsentativen Daten wurden 10 Millionen T-Zellen und 3 Millionen Monozyten isoliert. - Nehmen Sie das Röhrchen mit den Monozyten und geben Sie 9 ml warmes moDC-Kulturmedium in die Suspension, um ein Endvolumen von 10 ml zu erhalten. Geben Sie dann jeweils 100 μl 10 μg/ml GM-CSF und 10 μg/ml IL-4-Stamm hinzu, um eine Endkonzentration von 100 ng/ml GM-CSF und IL-4 im Medium zu erreichen. Die Suspension wird in eine Petrischale überführt und als "moDC" (Tag 1) gekennzeichnet und bei 37 °C mit 5 % CO2 inkubiert.
- Nehmen Sie das T-Zell-Röhrchen und mischen Sie 1 ml T-Zell-Gefriermedium (Tabelle 1) mit 1 ml T-Zell-Suspension. In zwei 2-ml-Kryoröhrchen (1 ml/Fläschchen) aufteilen; dicht verschließen (Endkonzentration von 5 Millionen Zellen pro Fläschchen). Stellen Sie die Kryofläschchen in eine Gefrierkammer mit Ausgleichsrohren in unbenutzte Vertiefungen. Lagern Sie die Kammer über Nacht bei -80 °C und stellen Sie die Kryoröhrchen dann in einen Kryotank um.
- An Tag 4 wird das Medium mit 5 ml frischem moDC-Kulturmedium aufgefrischt und mit je 100 μl GM-CSF- und IL-4-Stamm angereichert. Differenzierte moDCs werden an Tag 7 fertig sein.
2. Zugabe von immunmodulatorischen Arzneimitteln zur Erzeugung tolerogener moDCs
- Richten Sie die moDC-Platte ein.
- Entnehmen Sie an Tag 7 die differenzierten moDCs aus dem Inkubator und überführen Sie die moDC-Zellsuspension in ein 50-ml-Röhrchen.
- Die Suspension wird bei 250 × g 5 Minuten lang zentrifugiert. Aspirieren Sie den Überstand und resuspendieren Sie das Zellpellet in 1 ml warmem moDC-Kulturmedium, indem Sie auf und ab pipettieren. Zählen Sie die Zellen mit einem Hämazytometer und verdünnen Sie die Zellen auf eine Konzentration von 3 × 105 Zellen/ml in warmem moDC-Kulturmedium mit 100 ng/ml, GM-CSF und IL-4.
- Geben Sie 3 × 104 Zellen/Vertiefung in 100 μl zur gewünschten Anzahl von Vertiefungen in einer 96-Well-Gewebekulturplatte mit flachem Boden.
HINWEIS: Für repräsentative Ergebnisse haben wir insgesamt 48 Wells verwendet (vier Bedingungen in dreifacher Ausfertigung, die für vier verschiedene Analysen in den Abschnitten 3 und 4 vorbereitet wurden), aber dies kann für bis zu 60 Wells angepasst werden. Füllen Sie alle verbleibenden Vertiefungen mit 100 μL/Vertiefung PBS, um ein Austrocknen zu verhindern, insbesondere in den äußeren Vertiefungen. Wir empfehlen, für jede Analysemethode unterschiedliche Platten vorzubereiten. - Geben Sie 1 μl/Well immunmodulatorische Arzneimittel in die gewünschten Wells (hier 10 ng/ml Rapa). Die Platte über Nacht bei 37 °C mit 5 % CO2 inkubieren.
HINWEIS: Wenn Sie die Immunstimulation an Tag 8 einschließen, bereiten Sie Vertiefungen für das immunmodulatorische Arzneimittel sowohl mit als auch ohne Immunstimulation vor. Die Anwendung von Immunstimulation bei reifen moDCs ist optional.
- T-Zellen wieder auftauen.
- Nehmen Sie an Tag 8 zwei Kryoröhrchen aus dem Kryotank und tauen Sie die Kryoröhrchen in einem heißen Perlbad oder Wasserbad bei 37 °C auf, bis der Inhalt zu schmelzen beginnt (in <3 Minuten).
- Wenn der Inhalt zu schmelzen beginnt, geben Sie die Fläschchen in eine Zellkulturhaube und pipetieren Sie 1 ml warmes T-Zellkulturmedium in das Fläschchen, um es schnell aufzutauen. Übertragen Sie den gesamten Inhalt des Fläschchens in ein 50-ml-Röhrchen. Spülen Sie die Kryoröhrchen mit 1 ml T-Zell-Kulturmedium, um sicherzustellen, dass alle Zellen in das Röhrchen überführt werden.
- Füllen Sie die Suspension mit Flow Staining Solution (Tabelle 1) auf 15 mL auf. Bei 200 × g für 10 min zentrifugieren und den Überstand absaugen. Dann das Pellet in 5 mL Fließfärbelösung resuspendieren und erneut zentrifugieren.
- Aspirieren Sie den Überstand und resuspendieren Sie die Zellen in 1 ml warmem T-Zell-Kulturmedium. Zählen Sie die Zellen mit einem Hämazytometer.
HINWEIS: Die Rentabilität sollte zu diesem Zeitpunkt >70 % betragen; Wenn große Mengen abgestorbener Zellen verbleiben, in ein frisches Röhrchen umfüllen, 10 ml Zellfärbelösung hinzufügen, 5 Minuten lang bei 200 × g zentrifugieren, in 1 ml T-Zellmedium resuspendieren und neu zählen. - Fügen Sie 9 ml warmes T-Zell-Kulturmedium hinzu, um ein Endvolumen von 10 ml zu erhalten. Übertragen Sie die Suspension in eine Petrischale. Beschriften Sie es als "aufgetaute T-Zellen" und inkubieren Sie es über Nacht bei 37 °C mit 5 % CO2 , damit die Zellen ruhen können.
- Waschen Sie die moDC-Platte und fügen Sie nach Belieben den Immunstimulator hinzu.
- Zentrifugieren Sie an Tag 8 die moDC-Platte (ab Tag 7) bei 300 × g für 5 min.
- Den Überstand aspirieren, mit warmem HBSS waschen, die Zentrifugation wiederholen, erneut aspirieren und die Zellen in warmem moDC-Kulturmedium resuspendieren, das GM-CSF und IL-4 (100 μl/Well) enthält.
HINWEIS: Achten Sie darauf, die Zellen nicht zu stören. Kippen Sie die Platte während der Aspiration. Ungefähr 10 μl können in der Vertiefung verbleiben. - Wenn Sie Immunstimulation verwenden, geben Sie 1 μl/Vertiefung 100x LPS (oder ein anderes immunstimulierendes Mittel) in die gewünschten Vertiefungen. Die Platte über Nacht bei 37 °C mit 5 % CO2 inkubieren.
3. Strömungsanalyse für moDC (Validierung + Toleranz)
- Strömungsanalyse zur Validierung von moDC
- Bereiten Sie an Tag 8 Antikörper-Cocktails für das Validierungspanel vor, die auf die folgenden Marker abzielen: HLA-DR, CD14, dendritisches zellspezifisches C-Typ-Lektin (DC-SIGN), CD1c und CD40, wie in Tabelle 2 beschrieben. Verdünnen Sie alle Antikörper mit Fließfärbelösung.
HINWEIS: Das Panel wurde für ein 7-Kanal-Rot/Blau-Laser-Durchflusszytometer entwickelt. - Nehmen Sie die moDC-Platte aus dem Inkubator. Die Platte bei 300 × g 5 min zentrifugieren. Entfernen Sie die Überstände. Optional: Bewahren Sie die Überstände für die ELISA-Analyse der Zytokine IL-10 und TNFα mit handelsüblichen Kits gemäß den Herstellerangaben auf.
- Fügen Sie 200 μl/Vertiefung Fließfärbelösung hinzu. Die Platte bei 300 × g 5 min zentrifugieren.
- Aspirieren Sie den Überstand und fügen Sie 50 μl/Vertiefung des 1:200 in Fließfärbelösung verdünnten Fc-Rezeptor-Bindungsinhibitor-Antikörpers hinzu, um eine unspezifische Bindung zu blockieren. 30 min bei Raumtemperatur (RT) inkubieren.
- 50 μl/Vertiefung des vorbereiteten Validierungspanel-Antikörpercocktails zugeben.
- Bereiten Sie Kompensationskontrollen in der Platte oder in 1,5-ml-Röhrchen vor, indem Sie 50 μl Kompensationsbeads mit 50 μl jedes verdünnten Antikörpers mischen. Die Platte 1 h lang bei 4 °C inkubieren.
HINWEIS: Aufgrund der potenziell geringen Expression von Markern auf moDCs werden hier Kompensationsbeads anstelle von Zellen zur Kompensation verwendet. - Waschen Sie, indem Sie 5 Minuten lang bei 300 × g zentrifugieren, den Überstand entfernen und in 200 μl Fließfärbelösung resuspendieren. Führen Sie zwei Wäschen durch.
- Nach der abschließenden Wäsche erneut zentrifugieren und die Zellen in 110 μl/Vertiefung Fließfärbelösung resuspendieren. Die Proben sind nun bereit für die durchflusszytometrische Analyse.
- Bereiten Sie an Tag 8 Antikörper-Cocktails für das Validierungspanel vor, die auf die folgenden Marker abzielen: HLA-DR, CD14, dendritisches zellspezifisches C-Typ-Lektin (DC-SIGN), CD1c und CD40, wie in Tabelle 2 beschrieben. Verdünnen Sie alle Antikörper mit Fließfärbelösung.
- Durchflussanalyse für tolerogenes moDC (Tolerance Panel)
- Ähnlich wie in Schritt 3.1 an Tag 8 bereiten Sie Antikörper-Cocktails für das Tolerance Panel vor, die auf die folgenden Marker abzielen: CD86, PD-L1, DC-SIGN, CD1c, BTLA und CD40 (Tabelle 2).
- Wiederholen Sie die Schritte 3.1.2 bis 3.1.8 und ersetzen Sie den Antikörpercocktail durch den Tolerance Panel-Cocktail .
4. Strömungsanalyse von T-Zellen
- Kombinieren Sie T-Zellen mit behandelten tolerogenen moDCs.
- Entnehmen Sie an Tag 9 die aufgetaute T-Zell-Petrischale aus dem Inkubator und geben Sie alle T-Zellen in ein 50-ml-Röhrchen. Mit Flow Staining Solution auffüllen.
- Optional: Wenn Sie eine T-Zell-Proliferationsanalyse durchführen, teilen Sie die T-Zellen in zwei Röhrchen.
- Mit der ersten Tube bei 250 × g 5 min herunterschleudern und den Überstand entfernen. Färben Sie diese Tube mit Zellproliferationsfarbstoff gemäß den Anweisungen des Herstellers.
HINWEIS: Wir haben Fixable Viability Dye eFluor 670 verwendet, der einen 30-minütigen Inkubationsschritt erfordert, gefolgt von zwei Waschschritten. Wir empfehlen die Verwendung von konischen 50-ml-Röhrchen, um Zellverlust zu verhindern, und die Verwendung von HBSS mit 10 % HIFBS zum Waschen nach der Färbung. - Verwenden Sie das zweite Röhrchen mit ungefärbten T-Zellen für die Treg-Analyse. Auf ähnliche Weise 5 Minuten lang bei 250 × g herunterschleudern, den Überstand entfernen, in warmen Zellkulturmedien resuspendieren und während des Färbevorgangs im Inkubator aufbewahren. Wenn keine T-Zellproliferation erforderlich ist, drehen Sie alle T-Zellen herunter und ersetzen Sie sie durch warme T-Zell-Kulturmedien.
- Mit der ersten Tube bei 250 × g 5 min herunterschleudern und den Überstand entfernen. Färben Sie diese Tube mit Zellproliferationsfarbstoff gemäß den Anweisungen des Herstellers.
- Zählen Sie die Zellen und erhalten Sie mindestens 4 Millionen (nur für die Treg-Analyse) oder 8 Millionen (für die Treg- und T-Proliferationsanalyse).
- Die moDC-Platte mit den restlichen Vertiefungen aus dem Inkubator nehmen, 5 min bei 300 × g zentrifugieren und die Überstände apitieren. Fügen Sie 200 μl/Well T-Zellen bei 1,6 × 105 Zellen/Well hinzu. Fügen Sie ungefärbte T-Zellen für Treg-Analyseplatten und gefärbte T-Zellen für T-Zell-Proliferationsplatten hinzu.
HINWEIS: Dadurch wird ein T-Zell-zu-moDC-Verhältnis von 5:1 beibehalten, da sich die anfänglichen 3 ×104 moDCs in der Regel leicht ausdehnen. - 25 μl/ml Anti-CD3/CD28-Antikörpercocktail in alle Gruppen mit Ausnahme der negativen Kontrollvertiefungen geben, um T-Zellen zu stimulieren. Die Platte 72 h bei 37 °C mit 5 % CO2 bis zum 12. Tag inkubieren.
HINWEIS: Achten Sie darauf, gefärbte T-Zellen für die Proliferationsanalyse und ungefärbte für die Treg-Analyse zu verwenden.
- Analyse der Treg-Strömung
- Färben von Oberflächenmarkern
- Bereiten Sie an Tag 12 Antikörper-Cocktails für das Treg-Panel vor (Tabelle 2).
- Übertragen Sie alle Zellsuspensionen von der 96-Well-Kulturplatte in eine V-Bodenplatte mit Flow Staining Solution. Bewahren Sie die Überstände für die Zytokinanalyse auf.
- Waschen Sie die Zellen 2x durch Zentrifugation (200 × g für 5 min, gefolgt von 200 μl Flow-Fleckenlösung). Reservieren Sie einige Zellen für die Kompensationskontrolle. Legen Sie einen für die FOXP3-Färbung und für ungefärbte Kontrollen beiseite.
HINWEIS: Wir empfehlen, 10 μl aller Proben vor dem endgültigen Schleudern in Schritt 4.2.1.3 zu kämmen, um die erforderlichen Kompensationskontrollen zu erhalten. Dies liefert eine repräsentative Stichprobe aller oberflächennahen Expressionen jedes Markers auf den Zellen. - Nach dem zweiten Waschen 5 Minuten lang bei Raumtemperatur bei 200 x g zentrifugieren und aspirieren, dann 50 μl/Well Fc-Rezeptor-Bindungsinhibitor-Antikörper hinzufügen (1:200 verdünnt in Fließfärbelösung). 10 min bei Raumtemperatur inkubieren.
- 50 μl/Vertiefung des vorbereiteten Treg-Panel-Antikörpercocktails zugeben.
- Mischen Sie für Kompensationskontrollen 50 μl ungefärbte Kompensationszellen mit 50 μl jedes einzelnen gefärbten Antikörpers.
- Die Platte und die Kompensationsregler 1 h lang bei 4 °C inkubieren. Waschen Sie die Platte einmal mit Fließbeizlösung und zentrifugieren Sie sie bei 300 × g für 5 min.
- Färben Sie mit Lebend/Tot-Nahinfrarot-Farbstoff, verdünnt in HBSS (1:1.000) bei 200 μL/Well. 30 min bei 4 °C inkubieren.
- Waschen Sie die Platte einmal mit Flow Staining Solution (200 μl/Well) bei 300 × g für 5 min.
- Färben Sie mit FoxP3 gemäß den Anweisungen des Herstellers, was eine Inkubation über Nacht erfordert. Im Folgenden wird ein kurzer Überblick über das FoxP3-Färbeprotokoll beschrieben.
- Bereiten Sie die FoxP3-Fixierungs-/Permeabilisierungs-Arbeitslösung gemäß den Anweisungen des Herstellers vor. Mischen Sie 1 Teil FoxP3 Fixierungs-/Permeabilisierungskonzentrat mit 3 Teilen FoxP3 Fixierungs-/Permeabilisierungsverdünnungsmittel. Bereiten Sie 200 μl der Arbeitslösung pro Probe vor.
- Inkubieren Sie alle Proben in 200 μl/Vertiefung der Arbeitsfixierungs-/Permeabilisierungslösung. 1 h bei 4 °C ziehen lassen.
- Bereiten Sie 1x Permeabilisierungspuffer vor: Mischen Sie 1 Teil 10x Permeabilisierungspuffer (aus dem handelsüblichen Kit erhalten) mit 9 Teilen destilliertem Wasser.
- Waschen Sie die Platte 2x mit 1x Permeabilization Buffer (200 μL/Well) bei 300 × g für 5 min.
- Mit FoxP3-Antikörper (PE-Cy5.5, 1:300 Verdünnung in 1x Permeabilisierungspuffer) färben: 100 μl/Well des verdünnten FoxP3-Antikörpers zugeben und über Nacht bei 4 °C inkubieren.
- Waschen Sie die Platte 2x mit 1x Permeabilization Buffer (200 μL/Well) bei 300 × g für 5 min.
- Resuspendieren Sie die Zellen in 110 μl/Vertiefung Fließfärbelösung.
- Führen Sie eine Durchflusszytometrie-Analyse durch.
- Färben von Oberflächenmarkern
- Analyse der T-Zell-Proliferation
- Bereiten Sie Antikörper-Cocktails für das T-Proliferationspanel vor (Tabelle 2).
- Übertragen Sie alle Zellsuspensionen von der 96-Well-Kulturplatte in eine V-Bodenplatte mit Flow Staining Solution. Bewahren Sie Überstände für die Zytokinanalyse auf.
- Waschen Sie die Zellen 2x durch Zentrifugation (200 × g für 5 min, gefolgt von 200 μl Flow-Fleckenlösung). Reservieren Sie einige Zellen für die Kompensationskontrolle. Legen Sie einen für die FOXP3-Färbung und für ungefärbte Kontrollen beiseite.
HINWEIS: Wir empfehlen, 10 μl aller Proben vor dem endgültigen Schleudern in Schritt 4.3.3 zu kämmen, um die erforderlichen Kompensationskontrollen zu erhalten. Dies liefert eine repräsentative Stichprobe aller oberflächennahen Expressionen jedes Markers auf den Zellen. - Nach dem zweiten Waschen zentrifugieren (200 × g für 5 min bei Raumtemperatur) und aspirieren, dann 50 μl/Vertiefung Fc-Rezeptor-Bindungsinhibitor-Antikörper hinzufügen (1:200 verdünnt in Fließfärbelösung). 10 min bei Raumtemperatur inkubieren.
- Geben Sie 50 μl/Vertiefung des vorbereiteten T-Proliferationspanel-Antikörpercocktails hinzu.
- Mischen Sie für Kompensationskontrollen 50 μl ungefärbte Kompensationszellen mit 50 μl jedes einzelnen gefärbten Antikörpers.
- Die Platte und die Kompensationsregler 1 h lang bei 4 °C inkubieren. Waschen Sie die Platte einmal mit Fließbeizlösung und zentrifugieren Sie sie bei 300 × g für 5 min.
- Färben Sie mit Lebend/Tot-Nahinfrarot-Farbstoff, verdünnt in HBSS (1:1.000) bei 200 μL/Well. 30 min bei 4 °C inkubieren.
- Waschen Sie die Platte einmal mit Flow Staining Solution (200 μl/Well) bei 300 × g für 5 min.
- Führen Sie eine Durchflusszytometrie-Analyse durch.
Ergebnisse
Wir haben ein Protokoll für humane PBMCs beschrieben, isolieren sowohl CD3+ T-Zellen als auch CD14+ Monozyten mit kommerziell erhältlichen magnetischen Trennkits, differenzieren Monozyten in CD14-, HLA-DR+-, CD141+, CD1c+ moDCs mit GM-CSF und IL-4, behandeln sie für 24 h und co-kultivieren mit autologen T-Zellen mit Anti-CD3/CD28-Stimulation für 72 h. Ein experimentelles Schema ist in Abbildung 1 dargestellt.
Isolierung von Monozyten/T-Zellen und moDC-Differenzierung
Für unsere ersten repräsentativen Ergebnisse wurden 200 Millionen humane PBMCs vom Human Immunology Core (HIC) der University of Pennsylvania von einem gesunden Spender gekauft und wie in den Protokollabschnitten 1 und 2 beschrieben verarbeitet. An Tag 1 wurde Blut abgenommen und mittels Standard-Ficoll-Fraktionierung in der HIC-Einrichtung isoliert. Wir verwendeten 100 Millionen PBMCs für die Isolierung von T-Zellen und Monozyten mit einer Ausbeute von jeweils 10 Millionen T-Zellen bzw. 3 Millionen Monozyten. Monozyten und moDCs nach GM-CSF/IL-4-Differenzierung an Tag 7 wurden mittels Durchflusszytometrie analysiert. Wir beobachteten zwei unterschiedliche Gruppen in den undifferenzierten Monozyten, klassische CD14+, HLA-DR-Monozyten (>45%) und eine kleine Population von CD14-, HLA-DR+-Zellen, die minimale Mengen an CD1c und kein CD141 exprimierten. Im Gegensatz dazu beobachteten wir am 7. Tag der Differenzierung die meisten Zellen, die CD14-, HLA-DR+, CD141+, CD1c+ waren, was auf moDCs hinweist (Abbildung 2). Wir erhielten etwa 4 Millionen moDCs von den anfänglichen 3 Millionen Monozyten.
Strömungsanalyse für moDC (Validierung + Toleranz)
An Tag 7 wurden die moDCs 24 Stunden lang mit Rapa inkubiert, gewaschen, 24 Stunden lang mit LPS inkubiert und dann an Tag 9 mittels Durchflusszytometrie über Protokollschritt 3 analysiert. Zu den Behandlungsgruppen gehörten: 1) keine Behandlung + keine Behandlung (UT), 2) keine Behandlung + 0,1 μg/mL LPS (LPS), 3) 10 ng/ml Rapa + keine Behandlung (Rapa) oder 4) 10 ng/ml Rapa + 0,1 μg/ml LPS (LPS + Rapa). Die Behandlung mit Rapa, sowohl mit als auch ohne LPS, verringerte die CD1c+, DC-SIGN+-Populationen durch UT, obwohl die Prozentsätze bei >50% blieben (Abbildung 3A). Die MoDCs an Tag 9 wurden auch auf die Expression der DC-Reifungsmarker CD86 und CD40 analysiert. Wir beobachteten einen deutlichen Anstieg von CD86, wenn moDCs mit LPS behandelt wurden, was verhindert wurde, wenn moDCs mit Rapa vorbehandelt wurden (Abbildung 3B). Als das Signal auf UT-Kontrollen normalisiert wurde, beobachteten wir eine signifikante Abnahme sowohl von CD40 als auch von CD86 in Rapa-Behandlungsgruppen und keinen Anstieg des Signals in LPS + Rapa-Gruppen (Abbildung 3C,D). Das gleiche Muster wurde bei den tolerogenen Markern PD-L1 und BTLA beobachtet, wobei die Rapa-Behandlung das Signal verringerte und eine Zunahme der Reaktion auf die LPS-Stimulation verhinderte (Abbildung 3E, F). Dies deutet darauf hin, dass die Rapa-Behandlung die LPS-Reifung verhinderte, aber gleichzeitig die Expression tolerogener Marker einschränkte.
Strömungsanalyse für Treg
Als nächstes analysierten wir autologe T-Zellen nach Co-Kultur mit moDCs und Stimulation mit CD3/CD28-Stimulation an Tag 12 in einem Verhältnis von 1:5 moDC:T-Zellen unter Verwendung von Protokollschritt 4.2. Wir identifizierten Treg-Populationen anhand von CD4+, CD25+, FoxP3+ (Abbildung 4)24. Die Proben umfassten T-Zellen ohne Stimulation (Negativkontrolle), T-Zellen mit CD3/CD28-Stimulation, aber ohne moDCs, und T-Zellen mit CD3/CD28-Stimulation, die mit den vier moDC-Gruppen aus dem vorstehenden Absatz kokultiviert wurden. Wir beobachteten eine deutliche Treg-Population und einen deutlichen Anstieg der Treg, wenn moDCs zur Co-Kultur hinzugefügt wurden. Es gab jedoch keinen signifikanten Unterschied in der Treg-Häufigkeit zwischen den vier moDCs, im Gegensatz zu einigen Literaturberichten, die eine erhöhte Treg-Erzeugung von Rapa-behandelten tolDCs zeigen (Abbildung 5A)25.
Flussanalyse der T-Zell-Proliferation
Wir analysierten auch unsere repräsentative Probe auf T-Zellproliferation mit Hilfe von Protokollschritt 4.3. T-Zell-moDC-Cokulturen wurden ähnlich stimuliert wie in der Treg-Analyse und dann mittels Flow auf den Zellproliferationsfarbstoff von CD4+ - oder CD8+ -T-Zellen analysiert (Abbildung 5B). Wir beobachteten, dass Rapa-behandelte moDCs eine moderate Abnahme der T-Zellproliferation sowohl in CD4+ als auch in CD8+ T-Zellkompartimenten im Vergleich zu LPS-behandelten moDCs und unbehandelten moDCs nach CD3/CD28-Stimulation aufweisen.
Analyse von zusätzlichen Patientenproben und Immunmodulatoren:
Unsere repräsentativen Ergebnisse deuten darauf hin, dass Rapa-behandelte moDCs Marker der DC-Reife wie CD86 und CD40 reduzieren und die T-Zellproliferation bei unspezifischer CD3/CD28-Stimulation reduzieren. Mit Rapa behandelte moDCs haben jedoch nur einen geringen Einfluss auf positive Toleranzmarker wie PD-L1 oder BTLA und erhöhen die Treg-Populationen nach CD3/CD28-Stimulation nicht. Um zu untersuchen, ob ähnliche T-Zell-Ergebnisse bei anderen Patienten und Immunmodulatoren beobachtet werden können, wiederholten wir das autologe Co-Kultur-Experiment mit zusätzlichen menschlichen Proben (insgesamt 4 oder 5, je nach Analyse). Darüber hinaus testeten wir 1 μM Dexamethason (Dex), 10 ng/ml IL-10 (IL-10), 1 μg/ml Lipopolysaccharid (LPS) oder 1 nM Vitamin D3 (VD3) zusätzlich zu 10 ng/ml Rapa als die in Schritt 2.1.4 angegebenen Immunmodulatoren, wobei die Immunstimulation weggelassen wurde. Wir schlossen auch eine Probe ein, die Dex in Schritt 2.1.4 erhielt und die in Schritt 2.3.3 an Tag 8 mit 0,1 μg/ml LPS behandelt wurde (Dex + LPS). Wir testeten zunächst Überstände aus moDC (ohne T-Zell-Zugabe) entweder 24 h oder 72 h nach Schritt 2.3.3 an Tag 8 auf das gemeinsame Toleranzzytokin IL-10 und das inflammatorische Zytokin TNFα (Abbildung 6A-D). Wir beobachteten, dass Rapa-behandelte moDCs IL-10 in keiner Probe nach 24 h oder 72 h erhöhten, aber IL-10-behandelte Proben erhöhten die IL-10-Produktion nach 24 h signifikant, selbst nach zwei Waschschritten zur Entfernung von exogen hinzugefügtem IL-10. (Abbildung 6A). Wir beobachteten auch, dass Dex-behandelte moDCs die IL-10-Produktion signifikant erhöhten, jedoch erst nach einer Ruhephase von 72 Stunden (Abbildung 6B). Wir beobachteten ferner, dass kein Immunmodulator allein TNFα erzeugte, aber die Vorbehandlung mit Dex reduzierte die durchschnittliche TNFα-Bildung nach einer LPS-Behandlung nach 24 Stunden, obwohl dieses Ergebnis nicht signifikant war (Abbildung 6C). Die Daten zeigen ferner, dass die moDC-Expression von PD-L1 zwar nach 24 h durch keinen Immunmodulator erhöht wird, während in den mit Dex + LPS und Rapa behandelten Gruppen nach 72 h ein signifikanter Anstieg der PD-L1+ moDCs beobachtet wurde (Abbildung 6E,F). Wie in unserer einzigen repräsentativen Stichprobe beobachten wir auch hier eine Unterdrückung der CD86-Expression in allen immunmodulatorisch behandelten Gruppen sowohl nach 24 h als auch nach 72 h (Abbildung 6G,H). Diese bestätigen, dass Immunmodulatoren die tolerogenen Marker für moDC erhöhen können, wenn auch verzögert wirken.
Wir analysierten weiterhin die T-Zell-Antworten nach Co-Kultur an Tag 12. Wir beobachteten, dass mit Immunmodulatoren behandelte moDCs die CD4+ T-Zellproliferation im Vergleich zu unbehandelten moDC-Kontrollen nicht erhöhten, ähnlich wie in anderen veröffentlichten Berichten26 (Abbildung 6I). Interessanterweise beobachteten wir in der größeren Stichprobe keinen signifikanten Anstieg der Treg-Populationen für immunmodulatorisch behandelte moDCs (Abbildung 6J). Wir glauben, dass dieser Mangel an Signifikanz auf die hohe Variabilität zwischen den Patientenproben zurückzuführen ist; zwei der Patientenproben (1 und 2) schienen die Tregs bei keiner Behandlung zu erhöhen, während die anderen beiden (3 und 4) bei fast allen immunmodulatorischen Behandlungen einen Anstieg zeigten (Abbildung 6J). Dies unterstreicht die Notwendigkeit, eine Analyse von Immunmodulatoren mit mehreren Patientenproben durchzuführen, und deutet darauf hin, dass die Treg-Proliferation über mit Immunmodulatoren behandelte moDCs zwischen den Patienten sehr unterschiedlich ist.

Abbildung 1: Schematische Darstellung der experimentellen Übersicht. Monozyten und T-Zellen werden aus PBMCs isoliert, Monozyten in moDCs differenziert, mit immunmodulatorischen Wirkstoffen zur Erzeugung von tolDCs provoziert und mit T-Zellen co-kultiviert. Abkürzungen: PBMCs = mononukleäre Zellen des peripheren Blutes; moDCs = dendritische Zellen aus Monozyten; tolDCs = tolerogene dendritische Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
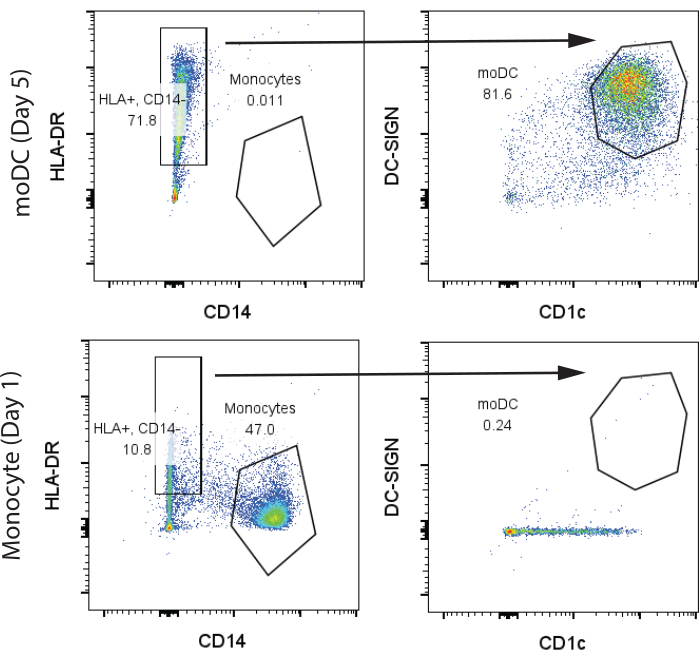
Abbildung 2: Repräsentative Gating-Strategie zur Identifizierung von CD14+, HLA-DR-Monozyten und CD14-, HLA-DR+, CD1c+, DC-SIGN+ moDCs. Die Proben wurden an Tag 7 analysiert. Abkürzungen: moDC = Monozyten-abgeleitete dendritische Zelle; HLA-DR = humanes Leukozyten-Antigen-DR; DC-SIGN = dendritisches zellspezifisches C-Typ-Lektin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Durchflusszytometrische Analyse von moDCs nach Rapa- und/oder LPS-Behandlung. An Tag 6 wurden 105 moDCs 24 h lang mit Immunmodulatoren inkubiert, dann gewaschen und 24 h lang mit oder ohne 0,1 μg/ml LPS inkubiert. An Tag 9 wurden die moDCs gewaschen und mittels Durchflusszytometrie analysiert. (A) Identifizierung von CD14+, HLA-DR-Monozyten und CD14-, HLA-DR+-, CD1c+, DC-SIGN+ moDCs. (B) Repräsentative Histogramme des moDC CD86-Signals nach der Behandlung; mittlere Fluoreszenzintensität für (C) CD86, (D) CD40, (E) PD-L1 und (F) BTLA. Die Proben wurden in technischen Triplikaten (N = 3) von denselben Patienten-PBMCs genommen. Die Signifikanz wurde durch eine unidirektionale ANOVA im Vergleich zur UT-Gruppe bestimmt. *p < 0,05, **p < 0,01, ***p < 1 × 10-3, ****p < 1 × 10-4. Abkürzungen: PBMCs = mononukleäre Zellen des peripheren Blutes; moDCs = dendritische Zellen aus Monozyten; HLA-DR = humanes Leukozyten-Antigen-DR; Rapa = Rapamycin; LPS = Lipopolysaccharid; MFI = mittlere Fluoreszenzintensität; BTLA = B- und T-Lymphozyten-Abschwächer; PD-L1 = programmierter Zelltod-Ligand 1; UT = Unbehandelt; LPS moDC= moDCs, die an Tag 8 mit 0,1 μg/ml LPS behandelt wurden; Rapa moDC = moDCs, die an Tag 7 mit 10 ng/ml Rapa behandelt und dann an Tag 8 gewaschen wurden; Rapa + LPS moDCs = moDCs, die an Tag 7 mit 10 ng/mL behandelt wurden, dann an Tag 8 gewaschen und mit 0,1 μg/mL LPS behandelt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
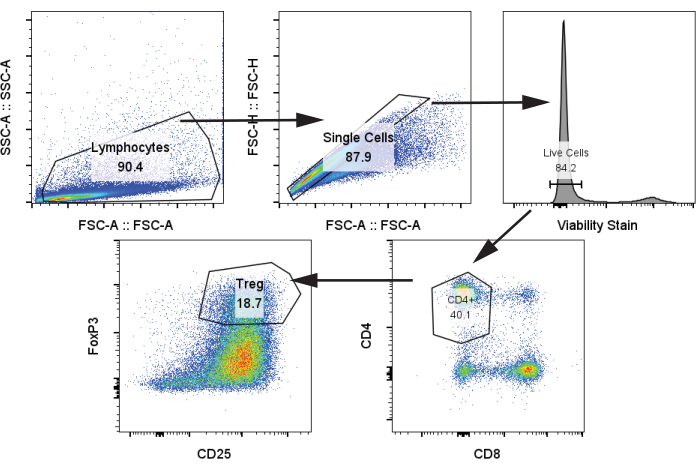
Abbildung 4: Repräsentative Gating-Strategie zur Identifizierung von CD4+, CD25+, FoxP3+ Tregs. Die Probe wurde an Tag 12 aus aufgetauten T-Zellen analysiert. Abkürzungen: SSC-A = Side Scatter-Peak Area; FSC-A = Vorwärts-Scatter-Peak-Fläche; Tregs = regulatorische T-Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative T-Zell-Analyse der moDC-T-Zell-Co-Kultur am Tag 12. (A) Repräsentative CD25- vs. FoxP3-Flussdiagramme von lebenden, einzelnen, CD4+ T-Zellen zur Identifizierung von Tregs. Die linke Spalte enthält Kontrollen: Nur T-Zellen (oben) und CD3/CD28-stimulierte T-Zellen (unten). Mittlere Spalte: moDCs ohne Rapa-Behandlung, rechte Spalte: moDcs mit Rapa-Behandlung. Für die mittlere und rechte Spalte ist die obere Reihe die Probe ohne LPS und die untere mit LPS-Behandlung. (B) Repräsentatives Gating für die T-Zell-Proliferation. Entweder CD4+ (links) oder CD8+ (rechts) T-Zellen wurden gegen die Proliferationsfärbung aufgetragen. Peaks sind für 0, 1, 2 oder 3 Zellteilungen angegeben. Histogramme sind mit der Art der moDC-Behandlung beschriftet. Abkürzungen: rapa = Rapamycin; LPS = Lipopolysaccharid; moDCs = dendritische Zellen aus Monozyten; Nur T-Zellen = T-Zellen ohne moDCs ohne CD3/CD28-Behandlung; UT = Unbehandelt; LPS moDC = moDCs, die an Tag 8 0,1 μg/ml LPS behandelt wurden; Rapa moDC = moDCs, die an Tag 7 mit 10 ng/ml Rapa behandelt und dann an Tag 8 gewaschen wurden. Beachten Sie, dass die Rapa-Behandlung die relative Anzahl der Zellen mit 0 Teilungen erhöht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Analyse mehrerer moDC/T-Zellproben mit zusätzlichen Immunmodulatoren. MoDCs wurden mit 1 μM Dexamethason, 10 ng/ml IL-10, 1 μg/ml Lipopolysaccharid oder 1 nM Vitamin D3 zusätzlich zu 10 ng/ml Rapa als Immunmodulatoren behandelt, wobei die Immunstimulation weggelassen wurde. Wir schlossen auch eine Probe ein, die Dex in Schritt 2.1.4 erhielt und die in Schritt 2.3.3 an Tag 8 mit 0,1 μg/ml LPS behandelt wurde (Dex + LPS). (A,-D) Zytokinanalyse von moDCs. Die Überstände wurden entweder (A) 24 h oder (B) 72 h nach Schritt 2.3.3 auf IL-10 getestet oder für C) 24 h oder (D) 72 h nach Schritt 2.3.3 unter Verwendung kommerzieller ELISA-Kits auf TNFα. N = 5. (E-H) Analyse von moDC-Oberflächenmarkern. In ähnlicher Weise wurden moDCs mittels Durchflusszytometrie für PD-L1 bei (E) 24 h oder (F) 72 h oder für CD86 bei (G) 24 h oder (H) 72 h analysiert. N = 5. (I) Analyse der T-Zell-Proliferation. CD4+ T-Zellen an Tag 12 wurden auf T-Zellproliferation analysiert und die Anzahl der Zellteilungen pro 100 T-Zellen berechnet. Die Proben wurden bei einem moDC:T-Zellverhältnis von 1:5 inkubiert, N = 4. (E) Treg-Analyse. MoDCs, die von fünf verschiedenen Patienten unterschieden wurden, wurden auf ähnliche Weise wie in Abbildung 5 analysiert. Links, unbehandelte moDCs; rechts, moDCs, die mit 10 ng/mL Rapa behandelt wurden. Jede farbige Linie stellt eine andere Patientenprobe dar. Die Signifikanz wurde durch die One-Way-ANOVA bestimmt. *p < 0,05, **p < 0,01 Abkürzungen: rapa = Rapamycin; LPS = Lipopolysaccharid; TNFα = Tumornekrosefaktor-alfa; moDCs = dendritische Zellen aus Monozyten; UT = Unbehandelt; LPS moDC = moDCs, behandelt 0,1 μg/mL LPS; Rapa moDC = moDCs, die mit 10 ng/ml Rapa behandelt wurden, Dex = moDCs, die mit 1 μM Dexamethason behandelt wurden, IL-10 = moDCs, die mit 10 ng/ml IL-10 behandelt wurden, VD3= moDCs, die mit 1 nM Vitamin D3 behandelt wurden, Dex + LPS= moDCs, die an Tag 7 mit 1 μM Dexamethason behandelt wurden, und dann 0,1 μg/ml LPS an Tag 8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| moDC Kulturmedium | Fließ-Färbelösung | T-Zell-Kulturmedium | T-Zell-Gefriermedium | |
| Medienbasis | RPMI 1640 | HBSS | RPMI 1640 | T-Zell-Kulturmedien |
| Komponente 1 | 10 % hitzeinaktivierte FBS (HI-FBS) | 1% BSA w/v | 10 % hitzeinaktivierte FBS (HI-FBS) | 10% DMSO |
| Komponente 2 | 1x Penicillin-Streptomycin | 0,1 mM EDTA | 1x Penicillin-Streptomycin | N/A |
| Komponente 3 | N/A | N/A | 1 mM HEPES | N/A |
| Komponente 4 | N/A | N/A | 1 x nicht-essentielle Aminosäuren | N/A |
| Komponente 5 | N/A | N/A | 50 μM β-Mercaptoethanol | N/A |
Tabelle 1: Beschreibung der Zellkulturreagenzien
| Gremium | Antikörper | Fluorophor | Verdünnung | Kanal |
| Validierung | HLA-DR | Alexa Fluor488 | 1:500 | Blau 1 |
| CD14 | PE | 1:500 | Blau 2 | |
| DC-ZEICHEN | Percp-Cy5.5 | 1:500 | Blau 3 | |
| CD1c | PE-Cy7 | 1:500 | Blau 4 | |
| CD40 | APC | 1:500 | Rot 1 | |
| Toleranz | CD86 | FITC | 1:500 | Blau 1 |
| PD-L1 | PE | 1:5000 | Blau 2 | |
| DC-ZEICHEN | Percp-Cy5.5 | 1:500 | Blau 3 | |
| CD1c | PE-Cy7 | 1:500 | Blau 4 | |
| BTLA | APC | 1:250 | Rot 1 | |
| CD40 | APC efluor 780 | 1:500 | Rot 3 | |
| Treg | CD4 | Alexa Fluor488 | 1:500 | Blau 1 |
| CD8 | PE-Cy7 | 1:500 | Blau 4 | |
| CD25 | APC | 1:500 | Rot 1 | |
| T-Proliferation | CD4 | Alexa Fluor488 | 1:500 | Blau 1 |
| CD69 (englisch) | PE | 1:500 | Blau 2 | |
| CD8 | PE-Cy7 | 1:500 | Blau 4 | |
| *Alle Antikörper werden in Fließ-Fleckenlösung verdünnt | ||||
Tabelle 2: Beschreibung der Antikörper-Panels für die Durchflusszytometrie
Diskussion
Hier beschreiben wir eine zuverlässige und vielseitige Methode, um die Funktionalität von immunmodulatorischen Wirkstoffen zur Induktion von tolDCs aus moDCs zu bewerten und ihre Funktionalität zur Erzeugung von Tregs aus autogenen T-Zellen ex vivo zu validieren. Dieses Protokoll umfasst mehrere kritische Schritte. Erstens sind Monozyten notorisch empfindliche Zellen und müssen aus frischen, nicht zuvor gefrorenen PBMCs gewonnen werden, um die besten Ergebnisse zu erzielen. Monozyten sollten so bald wie möglich isoliert und in den Differenzierungscocktail gegeben werden. Typischerweise sind eine schlechte Monozytenausbeute oder eine hohe Monozytentodesrate in den ersten 24 Stunden auf Gefrier-/Auftauzyklen oder längere Zeiträume zwischen der Isolierung von PBMCs und Monozyten zurückzuführen. Zweitens müssen Zytokine, die zur Differenzierung von moDCs und T-Zell-Kulturmedien verwendet werden, aus einer hochwertigen Quelle stammen. In der Regel ist eine schlechte Differenzierung von moDCs auf eine schlechte Qualität oder falsche Konzentrationen von Zytokinen zurückzuführen. Drittens empfehlen wir, T-Zellen zwischen Tag 1 und Tag 7 einzufrieren und nicht in Kultur zu halten, um ihren naiven und unstimulierten Phänotyp zu erhalten. Viertens, wenn es hilfreich sein kann, behandelte moDCs bis zu 72 Stunden ruhen zu lassen, um einen Anstieg der tolerogenen Marker wie PD-L1 und IL-10 zu ermöglichen, wie in Abbildung 6 zu sehen ist. Schließlich gibt es, wie in unseren Daten zu sehen ist, eine große Variabilität der Patienten-Erzeugungskapazität, so dass jede Kontrolle mit jeder Patientenprobe durchgeführt werden muss, um Schlussfolgerungen zu ziehen. Wir empfehlen, mehrere Patientenproben zu testen.
In unseren repräsentativen Ergebnissen wählten wir ein eher restriktives Versuchsdesign zum Nachweis der Toleranz mit hoher Messlatte. Wir wählten eine moderat niedrige Konzentration von Rapa (10 ng/ml), inkubierten nur 24 h lang mit bereits differenzierten moDCs und inkubierten dann 72 h lang in einem moDC:T-Zellverhältnis von 1:5 mit unspezifischer CD3/CD28-Stimulation. Dieses Protokoll ist äußerst vielseitig, da jede der folgenden Bedingungen leicht geändert werden kann: Immunmodulator-Konzentration, Immunmodulator-Inkubationszeit, ob die Inkubation gleichzeitig mit der moDC-Differenzierung oder separat erfolgt, moDC:T-Zell-Co-Kultur-Verhältnis, Co-Kultur-Inkubationszeit und T-Zell-Co-Stimulation. All diese Faktoren können beeinflussen, wie leicht die moDC-Behandlung die Treg-Bildung induziert. Bemerkenswert ist die Verwendung von unspezifischer CD3/CD28-Stimulation zur Induktion der T-Zellproliferation. Dies könnte leicht durch ein Antigen von Interesse ersetzt werden - ein Kontrollantigen wie CEFT-Peptidpools mit gesunden Patientenproben oder Autoantigene wie Insulin mit Typ-1-Diabetes-Patientenproben27,28. Dies würde antigenspezifische Toleranzdaten liefern, die sich wahrscheinlich von der unspezifischen Treg-vermittelten Toleranz unterscheiden würden.
Dieses Protokoll ist zwar vielseitig, hat aber einige Einschränkungen. Es ist nämlich auf nur wenige tolDC-Marker beschränkt, CD86, CD40, PD-L1 und BTLA. Dies sind allgemein anerkannte Marker und eine Begrenzung der Anzahl der verfügbaren Kanäle in unserem Labor-Durchflusszytometer. Andere Marker, wie ILT-3 und ILT-4 oder andere, könnten ebenfalls gewählt werden25. Dieses Protokoll untersucht auch keine anderen Arten von Suppressor-T-Zell-Untergruppen, wie z. B. regulatorische T-Zellen vom Typ 1 (Tr1), die in vivo starke schützende Phänotypen aufweisen können 29. Wir behaupten jedoch, dass dieses Protokoll die Funktionalität von DCs zur Erzeugung klassischer FoxP3+ CD25+ Tregs bewertet, was für das initiale Screening neuer immunmodulatorischer Verbindungen und die Bewertung der tolerogenen Kapazität von DC ausreichend ist.
Ein weiterer interessanter Aspekt der moDC-Evaluierung beim Menschen ist die Variabilität der Patienten und die begrenzte IL-10-, PD-L1-, BLTA- und vor allem Treg-Reaktion, die in unseren repräsentativen Ergebnissen gezeigt wurde, insbesondere auf Rapa. Die Literatur zeigt widersprüchliche Ergebnisse. Ähnliche Ergebnisse wie in dieser Arbeit wurden sowohl bei Rapa-behandelten murinen als auch bei humanen DCs beobachtet, die eine Abnahme der Marker für die DC-Reife (CD80/CD86/CD40) und die Verhinderung der IL-2-Freisetzung aus T-Zellen bei unspezifischer Stimulation zeigten, aber keinen T-Zelltod oder Treg-Bildung26,30. Andere Studien an Menschen und Mäusen zeigen jedoch, dass ex vivo mit Rapa behandelte DCs hohe Konzentrationen der Treg-Generationaufweisen 25. Rapa ist ein mechanistisches Ziel des Rapamycin-Inhibitors (mTOR), einer Proteinkinase im PI3K/AKT/mTOR-Signalweg, die mehrere entscheidende zelluläre Funktionen wie Zellwachstum, -proliferation und -überleben hat31. Rapa wird häufig als Medikament gegen Abstoßungsreaktionen bei Transplantationen eingesetzt und hat einen gut etablierten klinischen Nutzen bei der Verhinderung immunologischer Reaktionen. Speziell für seine Verwendung als tolDC-Induktionsmittel kann Rapa jedoch von Patient zu Patient unterschiedlich wirksam sein.
Dies unterstreicht die Notwendigkeit, tolDC-Induktionsmittel sowohl rigoros an breiteren Patientenpopulationen zu untersuchen als auch neue immunmodulatorische Verbindungen zu identifizieren. In einer überwältigenden Anzahl klinischer Studien zu humanen tolDCs werden entweder Rapa, IL-10, Dexamethason oder Vitamin D3 als Immunmodulatoren verwendet32. Damit bleibt ein großer chemischer Raum unerforscht. Wir stellen diesen Assay als Untersuchungswerkzeug vor, um das tolDC-Induktionspotenzial neuartiger Immunmodulatoren zu bewerten und ihr Potenzial zur Generierung von tolDCs aus endogenen DCs zu bewerten. Dieses Protokoll ist einfach, vielseitig, erfordert nur ein Durchflusszytometer und kann für die Hochdurchsatzfunktionalität angepasst werden.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken dem Human Immunology Core (HIC) der University of Pennsylvania für die Bereitstellung frischer humaner PBMCs von Spendern. Das HIC wird teilweise von NIH P30 AI045008 und P30 CA016520 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
Referenzen
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten