Method Article
Un método simple y eficiente para probar agentes inmunomoduladores para la generación de células dendríticas tolerogénicas a partir de monocitos CD14+ humanos
En este artículo
Resumen
Describimos un procedimiento para evaluar la capacidad de los agentes farmacológicos para generar células dendríticas tolerogénicas a partir de células dendríticas derivadas de monocitos naïve in vitro y validar su potencia mediante la generación de células T reguladoras autólogas.
Resumen
Las células dendríticas tolerogénicas (tolDC) son un subconjunto de células dendríticas (CD) que se sabe que influyen en las células T vírgenes hacia un fenotipo de células T reguladoras (Treg). Los TolDC están actualmente bajo investigación como terapias para la autoinmunidad y el trasplante, tanto como terapia celular como método para inducir TolDC a partir de CD endógenos. Hasta la fecha, sin embargo, el número de agentes conocidos para inducir tolDCs a partir de DC ingenuas es relativamente pequeño y su potencia para generar Tregs in vivo ha sido inconsistente, en particular las terapias que inducen tolDCs a partir de DC endógenas. Esto brinda la oportunidad de explorar nuevos compuestos para generar tolerancia.
En este trabajo describimos un método para probar nuevos compuestos inmunomoduladores en CD derivadas de monocitos (moDCs) in vitro y validar su funcionalidad para generar Tregs autólogas. En primer lugar, obtenemos PBMC y aislamos monocitos CD14+ y linfocitos T CD3+ utilizando kits de separación magnética disponibles en el mercado. A continuación, diferenciamos los monocitos en moDC, los tratamos con un inmunomodulador establecido, como rapamicina, dexametasona, IL-10 o vitamina D3, durante 24 h y probamos su cambio en marcadores tolerogénicos como validación del protocolo. Por último, cocultivamos las tolDCs inducidas con linfocitos T autólogos en presencia de estimulación anti-CD3/CD28 y observamos cambios en las poblaciones de Treg y la proliferación de linfocitos T. Prevemos que este protocolo se utilizará para evaluar la eficacia de nuevos agentes inmunomoduladores para reprogramar las CD ya diferenciadas hacia tolDC.
Introducción
Las células dendríticas (CD) son mediadores críticos entre la inmunidad innata y la adaptativa. Las CD, que residen principalmente en las membranas mucosas, la piel y el tejido linfoide, son las células presentadoras de antígenos primarios (CPA)1. Las CD absorben proteínas extrañas y las procesan y presentan en proteínas de histocompatibilidad mayor (MHC) a las células T vírgenes. Las CD expresan específicamente proteínas MHC de clase II, como el antígeno leucocitario humano-DR (HLA-DR) en humanos. El estado de activación de las CD tras la exposición al antígeno es crítico para la respuesta de las células T aguas abajo2. Las CD inmaduras expresan varios receptores de reconocimiento de patrones (PRR) que reconocen clases de moléculas llamadas patrones moleculares asociados a patógenos (PAMP), como el componente de la pared bacteriana, el lipopolisacárido (LPS)3. Tras la estimulación con PRR, las CD se convierten en DC maduras y regulan al alza importantes proteínas coestimuladoras de células T, como CD80, CD86 y CD40, y secretan citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNFα), lo que facilita la diferenciación de las células T vírgenes en células T efectoras o auxiliares convencionales2. Por el contrario, si se interrumpe la maduración de las CD o si las DC se desarrollan en un entorno tolerogénico, las DC pueden generar un estado de DC tolerogénico (tolDCs)4. Los TolDC regulan a la baja los receptores coestimuladores clásicos de las células T y, en su lugar, regulan al alza los receptores de tolerancia, como el ligando de muerte celular programada 1 (PD-L1) y el atenuador de linfocitos B y T (BTLA), y generan citocinas supresoras como la interleucina 10 (IL-10) y el factor de crecimiento transformante beta (TGF-β)4. Esta no es una lista exhaustiva de marcadores de tolerancia y, de hecho, existe un consenso limitado en cuanto a qué marcadores tolDC son apropiados para definir el estado tolDC5. Teniendo en cuenta esto, proponemos la generación de células T reguladoras (Treg) como un marcador funcional que debe utilizarse para comparar la efectividad de varios agentes de inducción de tolDC.
Además de los estados de activación de tolDC/DC maduras, las DC también se pueden clasificar en función de su linaje o ubicación del tejido, y cada subconjunto muestra una funcionalidad ligeramente diferente. Mientras que la división tolDC/DC madura es menos definitiva y existe más como un continuo, las divisiones de linaje tienen marcadores bien definidos tanto en humanos como en ratones. Los precursores de DC se forman en la médula ósea, pero hay dos subtipos principales de DC en función de su linaje: 1) células dendríticas plasmocitoides (pDC), que derivan de linajes linfoides y 2) células dendríticas convencionales (cDC), que derivan de linajes mieloides. En los seres humanos, las pDC maduran en los órganos linfoides, expresan CD303 y responden muy bien a las infecciones virales6. Por su parte, las CD11c que expresan cDCs maduran en los tejidos periféricos y existen en dos subtipos distintos, CD1c+ cDC1 y CD141+ cDC2, cada uno de los cuales genera distintas respuestas de células T7. Además, todas las cDC pueden existir en los subestados residentes en los tejidos (CD103-) o migratorios (CD103+)8. Finalmente, bajo ciertas condiciones, las células de linajes de monocitos (CD14+) pueden ser inducidas hacia un fenotipo de célula dendrítica y se identifican como CD14-, CD141+, CD1c+ 9. Estas células, conocidas como CD derivadas de monocitos (moDC), son las más utilizadas para el análisis ex vivo en humanos, ya que los monocitos constituyen aproximadamente el 10-30% de las células mononucleares de sangre periférica humana (PBMC), mientras que las pDC constituyen solo el 1-3%10. Esto hace que las moDC sean una opción atractiva, pero también se sabe que las moDC son más inflamatorias que las cDC típicas aisladas del tejido primario9.
En la actualidad existen dos grandes categorías de esfuerzos para emplear tolDCs para generar tolerancia clínica. En primer lugar, los tolDC se generan a partir de monocitos para su uso como terapia celular. En este paradigma, las moDC se diferencian típicamente utilizando IL-4/GM-CSF simultáneamente con inmunomoduladores como la vitamina D3, la rapamicina (rapa), la IL-10, la dexametasona o combinaciones de estos11,12. Estos tolDCs han sido explorados como terapias celulares autólogas para la autoinmunidad y los trasplantes13. El otro uso de las tolDCs es la reprogramación de las CDs endógenas hacia las tolDCs utilizando fármacos libres o nanotransportadores para administrar tanto el inmunomodulador como el antígeno de interés 14,15,16. Sin embargo, la inducción de CD ya diferenciadas es más desafiante debido al desarrollo de fenotipos metabólicos robustos de DC que suelen estar en contraste con el metabolismo de tolDC17,18. Este es un listón alto para la mayoría de los inmunomoduladores farmacológicos; por esta razón, la mayoría de los estudios de reprogramación endógena de DC informan de una supresión efectiva de las CD y, a menudo, de alguna inducción de Treg, pero carecen de éxito clínico, a menudo debido a la falta de persistencia de las células T 15,19,20. Esto pone de manifiesto la necesidad de estrategias para identificar los posibles agentes de inducción de tolDC a partir de las CD existentes.
Aquí, presentamos un método para la evaluación in vitro de agentes inmunomoduladores frente a moDCs diferenciados con la métrica final de la inducción autóloga de Treg. Este protocolo está diseñado para evaluar la efectividad de los agentes inmunomoduladores para reprogramar los moDC humanos ya diferenciados hacia la tolerancia. Además, este protocolo valida la funcionalidad de los tolDCs reprogramados para generar Tregs contra células T autólogas aisladas de la misma muestra de PBMC. Esto contrasta con otros protocolos que inducen tolerancia durante la diferenciación y/o desafían a los tolDC con células T de donantes alogénicos21. En este protocolo, utilizamos el agente tolerador común rapa como ejemplo, pero también demostramos la eficacia limitada de los moDCs tratados con rapa para generar Tregs. En nuestros resultados representativos, también mostramos la eficacia de otros tratamientos inmunomoduladores comunes como la IL-10, la dexametasona y la vitamina D3. Prevemos que este protocolo se utilizará para examinar agentes inductores de tolDC potencialmente más efectivos contra moDCs ya establecidos22.
Protocolo
Todas las muestras de células mononucleares de sangre periférica humana (PBMC) se obtuvieron del Núcleo de Inmunología Humana de la Universidad de Pensilvania de donantes no identificados con la aprobación previa de la Junta de Revisión Institucional (IRB) de la Universidad de Pensilvania con el consentimiento del paciente.
Opcional: Mientras que en este método, utilizamos PBMC recién aislados obtenidos de un laboratorio académico, las PBMC se pueden aislar de sangre completa o productos sanguíneos enriquecidos con leucoféresis. Recomendamos utilizar el método de centrifugación en gradiente de densidad, ya que este es un método bien establecido y confiable que se describe en otra parte23.
1. Aislamiento de monocitos/células T y diferenciación de moDC
- Aislamiento de monocitos y linfocitos T de PBMCs-Día 1
- Obtener 200 millones de PBMC humanas de un donante sano. Mantenga las células en un tubo de 15 ml y transfiéralas a hielo.
- Alícuota de 50 mL de tampón de separación (provisto en kits de separación disponibles comercialmente) en un tubo cónico.
NOTA: El tampón de separación también se puede reemplazar con DPBS con 2% de suero fetal bovino (FBS) y 1 mM de ácido etilendiaminotetraacético (EDTA). - Retire el tubo de PBMC del hielo y llénelo con tampón de separación. Centrifugar a 300 x g durante 5 minutos.
- Aspirar el sobrenadante con una pipeta serológica de 10 mL. Vuelva a suspender el pellet celular en 4 mL del medio recomendado utilizando una pipeta serológica.
- Divida la suspensión en dos tubos diferentes de 15 mL, añadiendo 2 mL por tubo (5 × 107 células/mL por tubo). Etiquete un tubo con una "T" y el otro con "Monocitos".
- Recupere el kit de aislamiento de monocitos humanos y siga el protocolo del fabricante para aislar monocitos del tubo marcado con monocitos.
- Recupere el kit de aislamiento de células T humanas y siga el protocolo del fabricante para el segundo tubo para aislar las células T.
- Siembra de monocitos para diferenciación y congelación de linfocitos T-Día 1
- Precalentar 50 mL de medio de cultivo moDC (Tabla 1) a 37 °C durante al menos 10 min.
- Centrifugar los tubos de 15 mL con monocitos enriquecidos y el tubo de 15 mL con linfocitos T del paso 1.1 a 250 × g durante 5 min.
- Aspirar el sobrenadante. Vuelva a suspender los monocitos en 1 mL de medio de cultivo de moDC y las células T en el medio de cultivo de células T (Tabla 1) pipeteando hacia arriba y hacia abajo. Asegúrese de que el pellet esté correctamente dispersado.
- Cuente las células con un contador de células automatizado o un hemacitómetro manual con tinción con azul de tripano.
NOTA: Para los datos representativos, se aislaron 10 millones de células T y 3 millones de monocitos. - Tome el tubo con monocitos y agregue 9 mL de medio de cultivo moDC tibio a la suspensión para obtener un volumen final de 10 mL. A continuación, añada 100 μL de 10 μg/mL DE GM-CSF y 10 μg/mL de caldo de IL-4 para obtener una concentración final de 100 ng/mL de GM-CSF e IL-4 en el medio. Transfiera la suspensión a una placa de Petri y etiquétela como "moDC" (Día 1) e incube a 37 °C con 5% de CO2.
- Tome el tubo de células T y mezcle 1 mL de medio de congelación de células T (Tabla 1) con 1 mL de suspensión de células T. Dividir en dos crioviales de 2 mL (1 mL/vial); Sellar herméticamente (concentración final de 5 millones de células por vial). Coloque los crioviales en una cámara de congelación con tubos de equilibrio en pozos no utilizados. Almacene la cámara a -80 °C durante la noche, luego transfiera los crioviales a un tanque criogénico.
- El día 4, refresque el medio con la adición de 5 mL de medio de cultivo moDC fresco y agregue 100 μL de material GM-CSF e IL-4. Los moDCs diferenciados estarán listos el día 7.
2. Adición de fármacos inmunomoduladores para la generación de moDCs tolerogénicos
- Configure la placa moDC.
- El día 7, recupere los moDC diferenciados de la incubadora y transfiera la suspensión de la célula moDC a un tubo de 50 mL.
- Centrifugar la suspensión a 250 × g durante 5 min. Aspire el sobrenadante y vuelva a suspender el pellet de la célula en 1 mL de medio de cultivo de moDC caliente pipeteando hacia arriba y hacia abajo. Cuente las células con hematitómetro y diluya las células hasta una concentración de 3 × 105 células/mL en medio de cultivo moDC tibio que contenga 100 ng/mL GM-CSF e IL-4.
- Agregue 3 × 104 células/pocillo en 100 μL al número deseado de pocillos en una placa de cultivo de tejidos de fondo plano de 96 pocillos.
NOTA: Para obtener resultados representativos, utilizamos un total de 48 pozos (cuatro condiciones hechas por triplicado preparadas para cuatro análisis diferentes en las secciones 3 y 4), pero esto se puede ajustar hasta para 60 pozos. Llene todos los pocillos restantes con 100 μL/pocillo de PBS para evitar que se sequen, especialmente los pocillos exteriores. Recomendamos preparar placas diferentes para cada método de análisis. - Añadir 1 μL/pocillo de fármacos inmunomoduladores a los pocillos deseados (en este caso, 10 ng/mL de rapa). Incubar la placa durante la noche a 37 °C con 5% de CO2.
NOTA: Si incluye inmunoestimulación en el día 8, prepare pocillos para el fármaco inmunomodulador con y sin inmunoestimulación. El uso de la inmunoestimulación para madurar las moDC es opcional.
- Refriegue las células T.
- El día 8, saque dos crioviales del tanque criogénico y descongele los crioviales en un baño de perlas calientes o baño de agua a 37 °C hasta que el contenido comience a derretirse (en <3 min).
- A medida que el contenido comience a derretirse, transfiera los viales a una campana de cultivo celular y pipetee 1 ml de medio de cultivo de células T calientes en el vial para descongelarlo rápidamente. Transfiera todo el contenido del vial a un tubo de 50 ml. Enjuague los crioviales con 1 mL de medio de cultivo de células T para asegurarse de que todas las células se transfieran al tubo.
- Rellene la suspensión con una solución de tinción por flujo (Tabla 1) hasta 15 mL. Centrifugar a 200 × g durante 10 min y aspirar el sobrenadante. A continuación, vuelva a suspender el pellet en 5 ml de solución de tinción por flujo y vuelva a centrifugar.
- Aspirar el sobrenadante y resuspender las células en 1 mL de medio de cultivo de células T caliente. Cuente las células con un hematiómetro.
NOTA: La viabilidad debe ser del >70% en esta etapa; si quedan grandes cantidades de células muertas, transfiéralo a un tubo nuevo, agregue 10 ml de solución de tinción celular, centrifugue a 200 × g durante 5 minutos, vuelva a suspender en 1 ml de medio de células T y vuelva a contar. - Agregue 9 mL de medio de cultivo de células T tibias para hacer un volumen final de 10 mL. Transfiera la suspensión a una placa de Petri. Etiquételo como "Células T redescongeladas" e incube durante la noche a 37 °C con 5% de CO2 para dejar reposar las células.
- Lave la placa de moDC y agregue el inmunoestimulador si lo desea.
- El día 8, centrifugar la placa de moDC (a partir del día 7) a 300 × g durante 5 min.
- Aspirar el sobrenadante, lavar con HBSS tibio, repetir la centrifugación, aspirar de nuevo y volver a suspender las células en un medio de cultivo de moDC tibio que contenga GM-CSF e IL-4 (100 μL/pocillo).
NOTA: Tenga cuidado de no alterar las celdas. Incline la placa durante la aspiración. Aproximadamente 10 μL pueden permanecer en el pocillo. - Si utiliza inmunoestimulación, agregue 1 μL/pocillo de 100 veces el stock de LPS (u otro agente inmunoestimulador) a los pocillos deseados. Incubar la placa durante la noche a 37 °C con 5% de CO2.
3. Análisis de flujo para moDC (Validación + Tolerancia)
- Análisis de flujo para la validación de moDC
- El día 8, prepare cócteles de anticuerpos para el Panel de Validación, dirigidos a los siguientes marcadores: HLA-DR, CD14, lectina tipo C específica de células dendríticas (DC-SIGN), CD1c y CD40 como se describe en la Tabla 2. Diluya todos los anticuerpos con una solución de tinción de flujo.
NOTA: El panel fue diseñado para un citómetro de flujo láser rojo/azul de 7 canales. - Recupere la placa moDC de la incubadora. Centrifugar la placa a 300 × g durante 5 min. Retire los sobrenadantes. Opcional: Conserve los sobrenadantes para el análisis ELISA para las citocinas IL-10 y TNFα utilizando kits disponibles comercialmente de acuerdo con las instrucciones del fabricante.
- Agregue 200 μL/pocillo de solución de tinción por flujo. Centrifugar la placa a 300 × g durante 5 min.
- Aspirar el sobrenadante y añadir 50 μL/pocillo de anticuerpo inhibidor de la unión al receptor Fc diluido 1:200 en solución de tinción de flujo para bloquear la unión inespecífica. Incubar a temperatura ambiente (RT) durante 30 min.
- Añadir 50 μL/pocillo del cóctel de anticuerpos preparado por el Panel de Validación .
- Prepare controles de compensación en la placa o en tubos de 1,5 mL mezclando 50 μL de perlas de compensación con 50 μL de cada anticuerpo diluido. Incubar la placa a 4 °C durante 1 h.
NOTA: Aquí se utilizan cuentas de compensación en lugar de celdas para la compensación debido a la expresión potencialmente baja de marcadores en los moDC. - Lavar centrifugando a 300 × g durante 5 min, eliminando el sobrenadante y resuspendiendo en 200 μL de solución de tinción por flujo. Realiza dos lavados.
- Después del lavado final, centrifugar de nuevo y resuspender las células en 110 μL/pocillo de solución de tinción de flujo. Las muestras ya están listas para el análisis por citometría de flujo.
- El día 8, prepare cócteles de anticuerpos para el Panel de Validación, dirigidos a los siguientes marcadores: HLA-DR, CD14, lectina tipo C específica de células dendríticas (DC-SIGN), CD1c y CD40 como se describe en la Tabla 2. Diluya todos los anticuerpos con una solución de tinción de flujo.
- Análisis de caudal para moDC tolerogénico (Panel de tolerancia)
- De forma similar al paso 3.1 del día 8, prepare cócteles de anticuerpos para el Panel de Tolerancia, dirigidos a los siguientes marcadores: CD86, PD-L1, DC-SIGN, CD1c, BTLA y CD40 (Tabla 2).
- Repita los pasos 3.1.2-3.1.8, sustituyendo el cóctel de anticuerpos por el cóctel del panel de tolerancia .
4. Análisis de flujo de células T
- Combine las células T con las moDC tolerogénicas tratadas.
- El día 9, recupere la placa de Petri de células T descongeladas de la incubadora y transfiera todas las células T a un tubo de 50 ml. Rellene con la solución de tinción por flujo.
- Opcional: Si realiza un análisis de proliferación de células T, divida las células T en dos tubos.
- Con el primer tubo, gire a 250 × g durante 5 min y retire el sobrenadante. Tiña este tubo con tinte para la proliferación celular de acuerdo con las instrucciones del fabricante.
NOTA: Utilizamos el tinte de viabilidad fijable eFluor 670, que requiere un paso de incubación de 30 minutos, seguido de dos pasos de lavado. Sugerimos usar tubos cónicos de 50 mL para evitar la pérdida de células y usar HBSS con 10% de HIFBS para lavar después de la tinción. - Utilice el segundo tubo que contiene células T sin teñir para el análisis de Treg. Del mismo modo, centrifugar a 250 × g durante 5 minutos, retirar el sobrenadante, volver a suspender en medios de cultivo celular tibios y mantener en la incubadora durante el proceso de tinción. Si no se requiere proliferación de células T, reduzca la intensidad de todas las células T y reemplácelas con medios de cultivo de células T calientes.
- Con el primer tubo, gire a 250 × g durante 5 min y retire el sobrenadante. Tiña este tubo con tinte para la proliferación celular de acuerdo con las instrucciones del fabricante.
- Cuente las células y obtenga al menos 4 millones (solo para el análisis de Treg) u 8 millones (para el análisis de proliferación de Treg y T).
- Recupere la placa de moDC de la incubadora con los pocillos restantes, centrifugue a 300 × g durante 5 minutos y apire los sobrenadantes. Agregue 200 μL/pocillo de células T a 1,6 × 105 células/pocillo. Agregue células T sin teñir para las placas de análisis Treg y células T teñidas para las placas de proliferación de células T.
NOTA: Esto mantendrá una relación de células T a moDC de 5:1, ya que los 3 ×104 moDC iniciales suelen expandirse ligeramente. - Añadir 25 μL/mL de cóctel de anticuerpos anti-CD3/CD28 a todos los grupos, excepto a los pocillos de control negativos, para estimular las células T. Incubar la placa durante 72 h a 37 °C con 5% de CO2 hasta el día 12.
NOTA: Asegúrese de utilizar células T teñidas para el análisis de proliferación y sin tinción para el análisis de Treg.
- Análisis de flujo Treg
- Tinción de marcadores de superficie
- El día 12, prepare cócteles de anticuerpos para el Panel Treg (Tabla 2).
- Transfiera todas las suspensiones celulares de la placa de cultivo de 96 pocillos a una placa inferior en V con solución de tinción por flujo. Conserve los sobrenadantes para el análisis de citocinas.
- Lave las células 2 veces por centrifugación (200 × g durante 5 minutos seguidos de 200 μL de solución de tinción Flow). Reserve algunas celdas para los controles de compensación. Reserve uno para la tinción FOXP3 y para los controles sin teñir.
NOTA: Sugerimos peinar 10 μL de todas las muestras antes del centrifugado final en el paso 4.2.1.3 para obtener los controles de compensación necesarios. Esto proporciona una muestra representativa de toda la expresión a nivel de superficie de cada marcador en las celdas. - Después del segundo lavado, centrifugar a 200 x g durante 5 min a temperatura ambiente y aspirar, luego agregar 50 μL/pocillo de anticuerpo inhibidor de la unión al receptor Fc (diluido 1:200 en solución de tinción de flujo). Incubar a temperatura ambiente durante 10 min.
- Añadir 50 μL/pocillo del cóctel de anticuerpos Treg Panel preparado.
- Para los controles de compensación, mezcle 50 μL de células de compensación no teñidas con 50 μL de cada uno de los anticuerpos teñidos.
- Incubar la placa y los controles de compensación a 4 °C durante 1 h. Lave la placa una vez con Flow Stain Solution y centrifugue a 300 × g durante 5 min.
- Tinción con colorante vivo/muerto en infrarrojo cercano diluido en HBSS (1:1.000) a 200 μL/pocillo. Incubar a 4 °C durante 30 min.
- Lave la placa una vez con solución de tinción por flujo (200 μL/pocillo) a 300 × g durante 5 min.
- Teñir con FoxP3 de acuerdo con las instrucciones del fabricante, lo que requerirá una incubación nocturna. A continuación se describe una breve descripción general del protocolo de tinción FoxP3.
- Prepare la solución de trabajo de fijación/permeabilización FoxP3 de acuerdo con las instrucciones del fabricante. Mezcle 1 parte de concentrado de fijación/permeabilización FoxP3 con 3 partes de diluyente de fijación/permeabilización FoxP3. Prepare 200 μL de la solución de trabajo por muestra.
- Incubar todas las muestras en 200 μL/pocillo de la solución de fijación/permeabilización de trabajo. Dejar a 4 °C durante 1 h.
- Prepare 1x Tampón de permeabilización: Mezcle 1 parte de 10x Tampón de permeabilización (obtenido del kit comercial) con 9 partes de agua destilada.
- Lave la placa 2 veces con 1x tampón de permeabilización (200 μL/pocillo) a 300 × g durante 5 min.
- Tinción con anticuerpo FoxP3 (PE-Cy5.5, dilución 1:300 en tampón de permeabilización 1x): Añadir 100 μL/pocillo del anticuerpo FoxP3 diluido e incubar a 4 °C durante la noche.
- Lave la placa 2 veces con 1x tampón de permeabilización (200 μL/pocillo) a 300 × g durante 5 min.
- Vuelva a suspender las células en 110 μL/pocillo de solución de tinción por flujo.
- Realizar análisis de citometría de flujo.
- Tinción de marcadores de superficie
- Análisis de proliferación de linfocitos T
- Preparar cócteles de anticuerpos para el Panel de Proliferación T (Tabla 2).
- Transfiera todas las suspensiones celulares de la placa de cultivo de 96 pocillos a una placa inferior en V con solución de tinción por flujo. Retenga sobrenadantes para el análisis de citocinas.
- Lave las células 2 veces por centrifugación (200 × g durante 5 minutos seguidos de 200 μL de solución de tinción Flow). Reserve algunas celdas para los controles de compensación. Reserve uno para la tinción FOXP3 y para los controles sin teñir.
NOTA: Sugerimos peinar 10 μL de todas las muestras antes del centrifugado final en el paso 4.3.3 para obtener los controles de compensación necesarios. Esto proporciona una muestra representativa de toda la expresión a nivel de superficie de cada marcador en las celdas. - Después del segundo lavado, centrifugar (200 × g durante 5 min a temperatura ambiente) y aspirar, luego agregar 50 μL/pocillo de anticuerpo inhibidor de la unión al receptor Fc (diluido 1:200 en solución de tinción de flujo). Incubar a temperatura ambiente durante 10 min.
- Añadir 50 μL/pocillo del cóctel de anticuerpos T Proliferation Panel preparado.
- Para los controles de compensación, mezcle 50 μL de células de compensación no teñidas con 50 μL de cada uno de los anticuerpos teñidos.
- Incubar la placa y los controles de compensación a 4 °C durante 1 h. Lave la placa una vez con Flow Stain Solution y centrifugue a 300 × g durante 5 min.
- Tinción con colorante vivo/muerto en infrarrojo cercano diluido en HBSS (1:1.000) a 200 μL/pocillo. Incubar a 4 °C durante 30 min.
- Lave la placa una vez con solución de tinción por flujo (200 μL/pocillo) a 300 × g durante 5 min.
- Realizar análisis de citometría de flujo.
Resultados
Hemos descrito un protocolo para PBMCs humanas, aislar tanto las células T CD3+ como los monocitos CD14+ utilizando kits de separación magnética disponibles en el mercado, diferenciar los monocitos en CD14-, HLA-DR+, CD141+, CD1c+ moDCs utilizando GM-CSF e IL-4, tratarlos durante 24 h y cocultivar con células T autólogas con estimulación anti-CD3/CD28 durante 72 h. En la Figura 1 se muestra un esquema experimental.
Aislamiento de monocitos/células T y diferenciación de moDC
Para nuestros resultados representativos iniciales, se compraron 200 millones de PBMC humanos del Centro de Inmunología Humana (HIC) de la Universidad de Pensilvania de un donante sano y se procesaron como se describe en las secciones 1 y 2 del protocolo. La sangre se extrajo el día 1 y se aisló mediante fraccionamiento estándar de Ficoll en las instalaciones de HIC. Utilizamos 100 millones de PBMC para el aislamiento de células T y monocitos, cada uno con rendimientos de 10 millones de células T y 3 millones de monocitos, respectivamente. Los monocitos y las moDCs después de la diferenciación de GM-CSF/IL-4 en el día 7 se analizaron mediante citometría de flujo. Observamos dos grupos distintos en los monocitos indiferenciados, los monocitos CD14+ clásicos, los monocitos HLA-DR- (>45%) y una pequeña población de células CD14-, HLA-DR+ que expresaban cantidades mínimas de CD1c y ninguna CD141. Por el contrario, en el día 7 de diferenciación, observamos que la mayoría de las células eran CD14-, HLA-DR+, CD141+, CD1c+, lo que indica moDCs (Figura 2). Obtuvimos aproximadamente 4 millones de moDCs de los 3 millones de monocitos iniciales.
Análisis de flujo para moDC (Validación + Tolerancia)
El día 7, las moDC se incubaron con rapa durante 24 h, se lavaron, se incubaron con LPS durante 24 h y luego se analizaron por citometría de flujo el día 9 a través del paso 3 del protocolo. Los grupos de tratamiento incluyeron: 1) ningún tratamiento + ningún tratamiento (UT), 2) ningún tratamiento + 0,1 μg/mL LPS (LPS), 3) 10 ng/mL de rapa + ningún tratamiento (RAPA), o 4) 10 ng/mL de rapa + 0,1 μg/mL DE LPS (LPS + rapa). El tratamiento con rapa, con y sin LPS, disminuyó las poblaciones de CD1c+, DC-SIGN+ de UT, aunque los porcentajes se mantuvieron >50% (Figura 3A). También se analizaron los MoDCs en el día 9 para la expresión de los marcadores de maduración de DC, CD86 y CD40. Observamos un marcado aumento de CD86 cuando los moDCs fueron tratados con LPS, lo que se evitó cuando los moDCs fueron pretratados con rapa (Figura 3B). Cuando la señal se normalizó a los controles UT, observamos una disminución significativa tanto en CD40 como en CD86 en los grupos de tratamiento con rapa y ningún aumento en la señal con los grupos LPS + rapa (Figura 3C, D). Este mismo patrón se observó para los marcadores tolerogénicos, PD-L1 y BTLA, con el tratamiento con rapa disminuyendo la señal y previniendo un aumento en la respuesta a la estimulación de LPS (Figura 3E,F). Esto indica que el tratamiento con rapa previno la maduración de LPS, pero al mismo tiempo limitó la expresión de marcadores tolerogénicos.
Análisis de flujo para Treg
A continuación, analizamos los linfocitos T autólogos después del cocultivo con moDCs y la estimulación con estimulación CD3/CD28 en el día 12 en una proporción de linfocitos moDC:T de 1:5 utilizando el paso 4.2 del protocolo. Se identificaron las poblaciones de Treg por CD4+, CD25+, FoxP3+ (Figura 4)24. Las muestras incluyeron linfocitos T sin estimulación (control negativo), linfocitos T con estimulación CD3/CD28 pero sin moDC, y linfocitos T con estimulación CD3/CD28 y cocultivados con los cuatro grupos de moDC del párrafo anterior. Observamos una clara población de Treg y un marcado aumento de Treg cuando se añadieron las moDCs al cocultivo. Sin embargo, no hubo diferencias significativas en la frecuencia de Treg entre los cuatro moDC, contrariamente a algunos informes de la literatura que demuestran un aumento en la generación de Treg a partir de tolDC tratados con rapa (Figura 5A)25.
Análisis de flujo de la proliferación de células T
También analizamos nuestra muestra representativa de proliferación de linfocitos T utilizando el paso 4.3 del protocolo. Los cocultivos de células T y moDC se estimularon de manera similar a los análisis de Treg y luego se analizaron mediante flujo para detectar el colorante de proliferación celular de células T CD4+ o CD8+ (Figura 5B). Observamos que las moDC tratadas con rapa tienen una disminución moderada en la proliferación de células T en los compartimentos de células T CD4+ y CD8+ en comparación con las moDC tratadas con LPS y las moDC no tratadas tras la estimulación de CD3/CD28.
Análisis de muestras adicionales de pacientes e inmunomoduladores:
Nuestros resultados representativos indican que las moDCs tratadas con rapa reducen los marcadores de madurez de DC como CD86 y CD40 y reducen la proliferación de células T a la estimulación inespecífica de CD3/CD28. Sin embargo, las moDC tratadas con rapa tienen poco efecto sobre los marcadores positivos de tolerancia, como PD-L1 o BTLA, y no aumentan las poblaciones de Treg tras la estimulación de CD3/CD28. Para explorar si se observarían resultados similares de células T con otros pacientes e inmunomoduladores, repetimos el experimento de cocultivo autólogo a partir de muestras humanas adicionales (para un total de 4 o 5 dependiendo del análisis). Además, probamos 1 μM de dexametasona (Dex), 10 ng/mL de IL-10 (IL-10), 1 μg/mL de lipopolisacárido (LPS) o 1 nM de vitamina D3 (VD3) además de 10 ng/mL de Rapa como los inmunomoduladores administrados en el paso 2.1.4 pero omitiendo la inmunoestimulación. También incluimos una muestra a la que se le administró Dex en el paso 2.1.4 y se trató con 0,1 μg/mL de LPS en el paso 2.3.3 el día 8 (Dex + LPS). Primero probamos sobrenadantes de moDC (sin adición de células T) 24 h o 72 h después del paso 2.3.3 en el día 8 para la citocina de tolerancia común IL-10 y la citocina inflamatoria TNFα (Figura 6A-D). Observamos que los moDC tratados con rapa no aumentaron la IL-10 en ninguna muestra a las 24 h o 72 h, pero las muestras tratadas con IL-10 sí aumentaron significativamente la producción de IL-10 a las 24 h, incluso después de dos pasos de lavado para eliminar la IL-10 añadida exógenamente. (Figura 6A). También observamos que los moDC tratados con Dex aumentaron significativamente la producción de IL-10, pero solo después de descansar durante 72 h (Figura 6B). Además, observamos que ningún inmunomodulador por sí solo generó TNFα, pero el pretratamiento de Dex redujo la generación media de TNFα tras el tratamiento con LPS a las 24 h, aunque este resultado no fue significativo (Figura 6C). Los datos muestran además que, si bien la expresión de moDC de PD-L1 no se incrementa con ningún inmunomodulador a las 24 h, se observaron aumentos significativos en los moDC de PD-L1+ en los grupos tratados con Dex + LPS y Rapa a las 72 h (Figura 6E,F). Al igual que nuestra única muestra representativa, también observamos una supresión de la expresión de CD86 en todos los grupos tratados con inmunomoduladores tanto a las 24 h como a las 72 h (Figura 6G,H). Estos confirman que los inmunomoduladores pueden aumentar los marcadores tolerogénicos de las moDC, aunque el efecto sea tardío.
Analizamos más a fondo las respuestas de las células T después del cocultivo en el día 12. Observamos que las moDC tratadas con inmunomoduladores no aumentaron la proliferación de linfocitos T CD4+ en relación con los controles de moDC no tratados, al igual que en otros informes publicados26 (Figura 6I). Curiosamente, no observamos aumentos significativos en las poblaciones de Treg para ninguna moDC tratada con inmunomoduladores en la muestra más grande (Figura 6J). Creemos que esta falta de significación se debe a la alta variabilidad entre las muestras de pacientes; dos de las muestras de pacientes (1 y 2) no parecieron aumentar las Tregs a ningún tratamiento, mientras que las otras dos (3 y 4) mostraron aumentos con casi todos los tratamientos inmunomoduladores (Figura 6J). Esto pone de manifiesto la necesidad de realizar análisis de inmunomoduladores con múltiples muestras de pacientes y sugiere que la proliferación de Treg a través de moDC tratados con inmunomoduladores es muy variable entre los pacientes.

Figura 1: Esquema de visión general experimental. Los monocitos y las células T se aíslan de las PBMC, los monocitos se diferencian en moDC, se desafían con agentes inmunomoduladores para generar tolDC y se cocultivan con las células T. Abreviaturas: PBMCs = células mononucleares de sangre periférica; moDCs = células dendríticas derivadas de monocitos; tolDCs = células dendríticas tolerogénicas. Haga clic aquí para ver una versión más grande de esta figura.
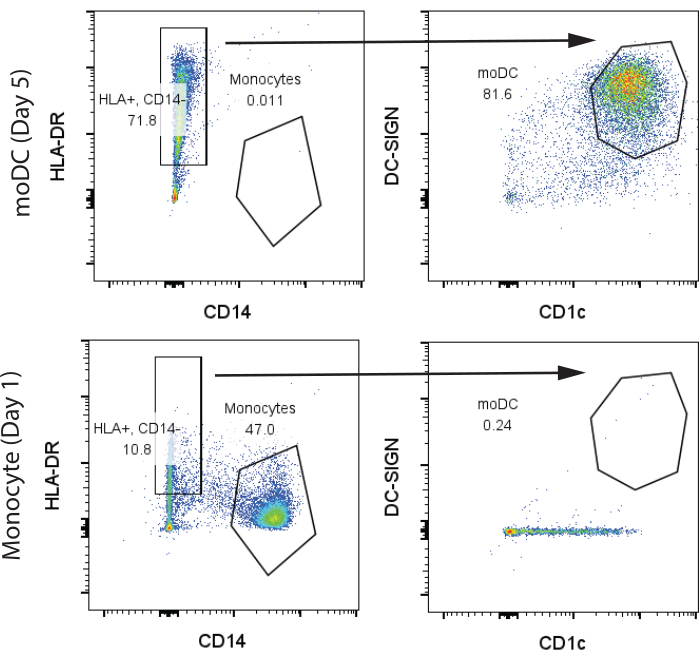
Figura 2: Estrategia representativa de compuerta para la identificación de monocitos CD14+, HLA-DR- y CD14-, HLA-DR+, CD1c+, DC-SIGN+ moDCs. Las muestras se analizaron el día 7. Abreviaturas: moDC = célula dendrítica derivada de monocitos; HLA-DR = antígeno leucocitario humano-DR; DC-SIGN = lectina de tipo C específica de células dendríticas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Análisis por citometría de flujo de moDCs post tratamiento con rapa y/o LPS. El día 6, se incubaron 105 moDCs con inmunomoduladores durante 24 h, luego se lavaron e incubaron con o sin 0,1 μg/mL de LPS durante 24 h. El día 9, las moDC se lavaron y analizaron mediante citometría de flujo. (A) Identificación de monocitos CD14+, HLA-DR- y moDCs CD14-, HLA-DR+, CD1c+, DC-SIGN+. (B) Histogramas representativos de la señal de moDC CD86 después del tratamiento; intensidad media de fluorescencia para (C) CD86, (D) CD40, (E) PD-L1 y (F) BTLA. Las muestras se presentaron por triplicado técnico (N = 3) de las mismas PBMC del paciente. La significación se determinó mediante ANOVA de un factor en comparación con el grupo UT. *p < 0.05, **p < 0.01, ***p < 1 × 10-3, ****p < 1 × 10-4. Abreviaturas: PBMCs = células mononucleares de sangre periférica; moDCs = células dendríticas derivadas de monocitos; HLA-DR = antígeno leucocitario humano-DR; rapa = rapamicina; LPS = lipopolisacárido; MFI = intensidad media de fluorescencia; BTLA = atenuador de linfocitos B y T; PD-L1 = ligando 1 de muerte celular programada; UT = Sin tratar; LPS moDC= moDCs tratados con 0,1 μg/mL de LPS en el día 8; Rapa moDC = moDCs tratados con 10 ng/mL de rapa el día 7 y luego lavados el día 8; Rapa + LPS moDCs = moDCs tratados con 10 ng/mL de rapa el día 7, luego lavados y tratados con 0,1 μg/mL de LPS el día 8. Haga clic aquí para ver una versión más grande de esta figura.
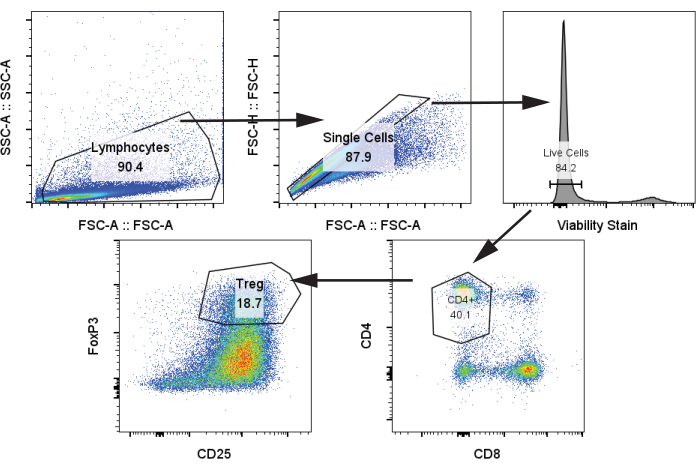
Figura 4: Estrategia representativa de compuerta para la identificación de Tregs CD4+, CD25+, FoxP3+ . La muestra se analizó a partir de células T descongeladas el día 12. Abreviaturas: SSC-A = área de pico de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; Tregs = linfocitos T reguladores. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Análisis representativo de células T del cocultivo de células T moDC-T en el día 12. (A) Diagramas de flujo representativos de CD25 frente a FoxP3 de células T CD4+ vivas, únicas, para identificar Tregs. La columna de la izquierda contiene los controles: solo linfocitos T (arriba) y linfocitos T estimulados por CD3/CD28 (abajo). Columna central: moDCs sin tratamiento de rapa, columna de la derecha: moDcs con tratamiento de rapa. Para las columnas central y derecha, la fila superior son muestras sin LPS y la inferior es con tratamiento LPS. (B) Puerta representativa de la proliferación de linfocitos T. Las células T CD4+ (izquierda) o CD8+ (derecha) se trazaron contra la tinción de proliferación. Los picos están indicados para 0, 1, 2 o 3 divisiones celulares. Los histogramas se etiquetan con el tipo de tratamiento moDC. Abreviaturas: rapa = rapamicina; LPS = lipopolisacárido; moDCs = células dendríticas derivadas de monocitos; Células T solamente = Células T sin MODC sin tratamiento con CD3/CD28; UT = Sin tratar; LPS moDC = moDCs tratados con 0,1 μg/mL de LPS en el día 8; Rapa moDC = moDCs tratados con 10 ng/mL de rapa el día 7 y luego lavados el día 8. Tenga en cuenta que el tratamiento con rapa aumenta las cantidades relativas de células con divisiones 0. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Análisis de múltiples muestras de células moDC/T con inmunmoduladores adicionales. Los MoDC se trataron con 1 μM de dexametasona, 10 ng/mL de IL-10, 1 μg/mL de lipopolisacárido o 1 nM de vitamina D3 además de 10 ng/mL de Rapa como inmunomoduladores administrados en el paso 2.1.4, pero omitiendo la inmunoestimulación. También incluimos una muestra a la que se le administró Dex en el paso 2.1.4 y se trató con 0,1 μg/mL de LPS en el paso 2.3.3 el día 8 (Dex + LPS). (A,-D) Análisis de citocinas de moDCs. Los sobrenadantes se analizaron para IL-10 (A) 24 h o (B) 72 h después del paso 2.3.3 o se analizaron para TNFα para C) 24 h o (D) 72 h después del paso 2.3.3 utilizando kits comerciales de ELISA. N = 5. (E-H) Análisis de marcadores de superficie moDC. Del mismo modo, las moDCs se analizaron mediante citometría de flujo para PD-L1 a (E) 24 h o (F) 72 h o para CD86 a (G) 24 h o (H) 72 h. N = 5. (I) Análisis de la proliferación de linfocitos T. Se analizó la proliferación de linfocitos T CD4+ en el día 12 y se calculó el número de divisiones celulares por cada 100 linfocitos T. Las muestras se incubaron en una proporción de células T de 1:5 moDC:T, N = 4. (E) Análisis Treg. Los MoDCs diferenciados de cinco pacientes diferentes se analizaron de manera similar a la Figura 5. Izquierda, moDCs sin tratar; derecha, moDCs tratados con 10 ng/mL de rapa. Cada línea de color representa una muestra de paciente diferente. La significación se determinó mediante ANOVA de una vía. *p < 0.05, **p < 0.01.Abreviaturas: rapa = rapamicina; LPS = lipopolisacárido; TNFα = factor de necrosis tumoral alfa; moDCs = células dendríticas derivadas de monocitos; UT = Sin tratar; LPS moDC = moDCs tratados 0,1 μg/mL de LPS; Rapa moDC = moDCs tratados con 10 ng/mL de rapa, Dex = moDCs tratados con 1 μM de dexametasona, IL-10= moDCs tratados con 10 ng/mL de IL-10, VD3= moDCs tratados con 1 nM de vitamina D3, Dex + LPS= moDCs tratados con 1 μM de dexametasona el día 7 y luego 0,1 μg/mL de LPS el día 8. Haga clic aquí para ver una versión más grande de esta figura.
| Medio de cultivo moDC | Solución de tinción por flujo | Medio de cultivo de células T | Medio de congelación de células T | |
| Base de medios | RPMI 1640 | HBSS | RPMI 1640 | Medios de cultivo de células T |
| Componente 1 | 10% FBS INACTIVADO POR CALOR (HI-FBS) | 1% BSA c/v | 10% FBS INACTIVADO POR CALOR (HI-FBS) | 10% DMSO |
| Componente 2 | 1x Penicilina-estreptomicina | 0,1 mM EDTA | 1x Penicilina-estreptomicina | N/A |
| Componente 3 | N/A | N/A | HEPES de 1 mM | N/A |
| Componente 4 | N/A | N/A | 1 x Aminoácidos no esenciales | N/A |
| Componente 5 | N/A | N/A | 50 μM de β-mercaptoetanol | N/A |
Tabla 1: Descripción de los reactivos de cultivo celular
| Tablero | Anticuerpo | Fluoróforo | Dilución | Canal |
| Validación | HLA-DR | Alexa Fluor488 | 1:500 | Azul 1 |
| CD14 | PEI | 1:500 | Azul 2 | |
| SIGNO DC | Perpp-Cy5.5 | 1:500 | Azul 3 | |
| CD1c | PE-Cy7 | 1:500 | Azul 4 | |
| CD40 | APC | 1:500 | Rojo 1 | |
| Tolerancia | CD86 | FITC | 1:500 | Azul 1 |
| PD-L1 | PEI | 1:5000 | Azul 2 | |
| SIGNO DC | Perpp-Cy5.5 | 1:500 | Azul 3 | |
| CD1c | PE-Cy7 | 1:500 | Azul 4 | |
| BTLA | APC | 1:250 | Rojo 1 | |
| CD40 | Fluor APC 780 | 1:500 | Rojo 3 | |
| Treg | CD4 | Alexa Fluor488 | 1:500 | Azul 1 |
| CD8 | PE-Cy7 | 1:500 | Azul 4 | |
| CD25 | APC | 1:500 | Rojo 1 | |
| Proliferación de T | CD4 | Alexa Fluor488 | 1:500 | Azul 1 |
| CD69 | PEI | 1:500 | Azul 2 | |
| CD8 | PE-Cy7 | 1:500 | Azul 4 | |
| *Todos los anticuerpos se diluyen en una solución de tinción de flujo | ||||
Tabla 2: Descripción de los paneles de anticuerpos por citometría de flujo
Discusión
En este trabajo describimos un método fiable y versátil para evaluar la funcionalidad de agentes inmunomoduladores para inducir tolDCs a partir de moDCs y validar su funcionalidad para generar Tregs a partir de células T autógenas ex vivo. Hay varios pasos críticos en este protocolo. En primer lugar, los monocitos son células notoriamente sensibles y deben obtenerse de PBMC frescas, no previamente congeladas, para obtener los mejores resultados. Los monocitos deben aislarse lo antes posible y colocarse en el cóctel de diferenciación. Por lo general, el rendimiento deficiente de monocitos o las altas tasas de muerte de monocitos en las primeras 24 h se deben a ciclos de congelación/descongelación o períodos prolongados entre el aislamiento de PBMC y monocitos. En segundo lugar, las citocinas utilizadas para la diferenciación de las moDC y los medios de cultivo de células T deben proceder de una fuente de alta calidad. Por lo general, la mala diferenciación de las moDCs se debe a una mala calidad o a concentraciones incorrectas de citocinas. En tercer lugar, recomendamos que las células T se congelen entre el día 1 y el día 7 y no se mantengan en cultivo para preservar su fenotipo previo y no estimulado. En cuarto lugar, puede ser útil permitir que las moDC tratadas descansen hasta 72 h para permitir aumentos en los marcadores tolerogénicos como PD-L1 e IL-10 como se ve en la Figura 6. Por último, como se observa en nuestros datos, existe una gran variabilidad de pacientes en la capacidad de generación de Treg, por lo que se debe realizar cada control con cada muestra de pacientes para sacar conclusiones. Recomendamos analizar varias muestras de pacientes.
En nuestros resultados representativos, elegimos un diseño experimental bastante restrictivo para demostrar la tolerancia con una barra alta. Elegimos una concentración moderadamente baja de rapa (10 ng/mL), solo incubada con moDCs ya diferenciados durante 24 h y luego incubada en una proporción de 1:5 moDC:T durante 72 h con estimulación inespecífica CD3/CD28. Este protocolo es muy versátil, ya que cualquiera de las siguientes condiciones puede modificarse fácilmente: concentración del inmunomodulador, tiempo de incubación del inmunomodulador, si la incubación se produce simultáneamente con la diferenciación de moDC o por separado, relación de cocultivo de células MoDC:T, tiempo de incubación de cocultivo y coestimulación de células T. Todos estos factores pueden alterar la facilidad con la que el tratamiento con moDC induce la generación de Treg. Cabe destacar el uso de la estimulación inespecífica de CD3/CD28 para inducir la proliferación de células T. Esto podría ser fácilmente reemplazado por un antígeno de interés: un antígeno de control, como los grupos de péptidos CEFT con muestras de pacientes sanos, o autoantígenos como la insulina con muestras de pacientes con diabetes tipo 127,28. Esto proporcionaría datos de tolerancia específica del antígeno, que probablemente serían diferentes de la tolerancia mediada por Treg no específica.
Aunque es versátil, este protocolo tiene algunas limitaciones. Es decir, se limita a solo unos pocos marcadores tolDC, CD86, CD40, PD-L1 y BTLA. Estos son marcadores comúnmente aceptados y una limitación del número de canales disponibles en nuestro citómetro de flujo de laboratorio. También se podrían elegir otros marcadores como ILT-3 e ILT-4 u otros25. Este protocolo tampoco evalúa otros tipos de subconjuntos de linfocitos T supresores, como los linfocitos T reguladores de tipo 1 (Tr1), que pueden demostrar potentes fenotipos protectores in vivo29. Sostenemos, sin embargo, que este protocolo evalúa la funcionalidad de las CD para generar Tregs CD25+ FoxP3+ clásicas, lo cual es suficiente para el cribado inicial de nuevos compuestos inmunomoduladores y la evaluación de la capacidad tolerogénica de las DC.
Otro aspecto interesante de la evaluación de moDC en humanos es la variabilidad del paciente y la limitada respuesta de IL-10, PD-L1, BLTA y, lo que es más importante, Treg a los inmunomoduladores que se muestra en nuestros resultados representativos, particularmente a la rapa. La literatura muestra resultados contradictorios. Se han observado resultados similares a los de este trabajo tanto en CD murinas tratadas con rapa como en humanas, mostrando disminuciones en los marcadores de madurez de DC (CD80/CD86/CD40) y prevención de la liberación de IL-2 de las células T cuando no se estimulan específicamente, pero sin muerte de las células T ni generación de Treg26,30. Sin embargo, otros estudios tanto en humanos como en ratones muestran que las CD ex vivo tratadas con rapa muestran altos niveles de generación25 de Treg. Rapa es un objetivo mecanicista del inhibidor de la rapamicina (mTOR), una proteína quinasa en la vía de señalización PI3K/AKT/mTOR que tiene varias funciones celulares cruciales, como el crecimiento celular, la proliferación y la supervivencia31. Rapa se usa a menudo como medicamento contra el rechazo para trasplantes y tiene un beneficio clínico bien establecido en la prevención de respuestas inmunológicas. Sin embargo, específicamente para su uso como agente de inducción de tolDC, la rapa puede tener una eficacia variable de un paciente a otro.
Esto pone de manifiesto la necesidad de investigar rigurosamente los agentes de inducción de tolDC frente a poblaciones de pacientes más amplias e identificar nuevos compuestos inmunomoduladores. Un número abrumador de estudios clínicos sobre tolDC humanos utilizan rapa, IL-10, dexametasona o vitamina D3 como inmunomoduladores32. Esto deja un amplio espacio químico sin explorar. Presentamos este ensayo como una herramienta de investigación para evaluar el potencial de inducción de tolDC de nuevos inmunomoduladores y para evaluar su potencial para generar tolDC a partir de CD endógenas. Este protocolo es simple, versátil, solo requiere un citómetro de flujo y podría adaptarse para una funcionalidad de alto rendimiento.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Nos gustaría agradecer al Centro de Inmunología Humana (HIC) de la Universidad de Pensilvania por proporcionar PBMC humanos frescos de los donantes. El HIC está respaldado en parte por los AI045008 P30 y P30 CA016520 de los NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
Referencias
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ISSN 2689-3649
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.