Method Article
ヒトCD14+ 単球から寛容性樹状細胞を作製するための免疫調節剤を試験するための簡便で効率的な方法
要約
薬理学的薬剤がナイーブ単球由来樹状細胞からin vitro で寛容性樹状細胞を生成する能力を評価し、自家制御性T細胞生成によってその効力を検証する手順について説明します。
要約
トレロゲン樹状細胞(tolDC)は、ナイーブT細胞を制御性T細胞(Treg)表現型に向けて影響を与えることが知られている樹状細胞(DC)のサブセットです。TolDCは、自己免疫の治療法として、また細胞療法として、また内因性DCからtolDCを誘導する方法として、現在研究が進められています。しかし、今日まで、ナイーブDCからtolDCを誘導する既知の薬剤の数は比較的少なく、 in vivo でTregを生成するそれらの効力、特に内因性DCからtolDCを誘導する治療法には一貫性がありません。これにより、耐性を生み出すための新規化合物を探索する機会が得られます。
ここでは、単球由来DC(moDC)上の新規免疫調節化合物を in vitro で試験し、その機能を検証して自家Tregを生成する方法について説明します。まず、PBMCを取得し、市販の磁気分離キットを使用してCD14+ 単球とCD3+ T細胞を分離します。次に、単球をmoDCに分化し、ラパマイシン、デキサメタゾン、IL-10、ビタミンD3などの確立された免疫調節剤で24時間処理し、プロトコルの検証として寛容性マーカーの変化をテストします。最後に、誘導されたtolDCを抗CD3/CD28刺激の存在下で自家T細胞と共培養し、Treg集団とT細胞増殖の変化を観察します。このプロトコルは、すでに分化しているDCをtolDCに向けて再プログラムするための新規免疫調節剤の有効性を評価するために使用されることを想定しています。
概要
樹状細胞(DC)は、自然免疫と適応免疫の間の重要なメディエーターです。DCは、主に粘膜、皮膚、リンパ組織に存在する主要な抗原提示細胞(APC)1です。DCは外来タンパク質を取り込み、それらをナイーブT細胞に対して主要組織適合菌(MHC)タンパク質で処理して提示します。DCは、ヒトのヒト白血球抗原-DR(HLA-DR)などのMHCクラスIIタンパク質を特異的に発現します。抗原曝露時のDCの活性化状態は、下流のT細胞応答2にとって重要です。未成熟DCは、細菌壁成分であるリポ多糖(LPS)3など、病原体関連分子パターン(PAMP)と呼ばれる分子のクラスを認識するさまざまなパターン認識受容体(PRR)を発現します。PRR刺激を受けると、DCは成熟DCとなり、CD80、CD86、CD40などの重要なT細胞共刺激タンパク質をアップレギュレートし、腫瘍壊死因子α(TNFα)などの炎症誘発性サイトカインを分泌し、ナイーブT細胞の従来のエフェクターT細胞またはヘルパーT細胞への分化を促進します2。それどころか、DCの成熟が中断された場合、またはDCが寛容性の環境で発達した場合、DCは耐久性DC状態(tolDC)4を生成する可能性があります。TolDCは、従来のT細胞共刺激受容体をダウンレギュレートし、代わりにプログラム細胞死リガンド1(PD-L1)やBリンパ球およびTリンパ球減衰因子(BTLA)などの耐性受容体をアップレギュレートし、インターロイキン10(IL-10)やトランスフォーミング成長因子ベータ(TGF-β)4などの抑制性サイトカインを生成します。これは許容範囲マーカーの包括的なリストではなく、実際、どのtolDCマーカーがtolDC状態5を定義するのに適しているかについてのコンセンサスは限られています。これを考慮して、さまざまなtolDC誘導剤の有効性を比較するために使用するべき機能マーカーとして、制御性T細胞(Treg)の生成を提案します。
tolDC/成熟DC活性化状態に加えて、DCは系統または組織の位置に基づいて分類することもでき、各サブセットはわずかに異なる機能を示します。tolDC/成熟DCの分裂はそれほど明確ではなく、連続体として存在しますが、系統の分裂はヒトとマウスの両方で明確に定義されたマーカーを持っています。DC前駆体は骨髄で形成されますが、DCにはその系統に基づいて、1)リンパ系に由来する形質細胞様樹状細胞(pDC)と、2)骨髄系に由来する従来の樹状細胞(cDC)の2つの主要なサブタイプがあります。ヒトでは、pDCはリンパ器官で成熟し、CD303を発現し、ウイルス感染に対して高い応答性を示します6。一方、cDCを発現するCD11cは末梢組織で成熟し、CD1c+ cDC1とCD141+ cDC2の2つの異なるサブタイプに存在し、それぞれが異なるT細胞応答を産生する7。さらに、すべてのcDCは、組織常在性(CD103-)または遊性(CD103+)の亜状態8のいずれかに存在することができる。最後に、特定の条件下で、単球系統からの細胞(CD14+)を樹状細胞の表現型に向けて誘導することができ、CD14−、CD141+、CD1c+ 9として同定される。単球由来DC(moDC)として知られるこれらの細胞は、単球がヒト末梢血単核細胞(PBMC)の約10〜30%を占めるのに対し、pDCはわずか10%を構成するため、ヒトの ex vivo 分析に最も一般的に使用されています10。これにより、moDCは魅力的な選択肢になりますが、moDCは一次組織から単離された典型的なcDCよりも炎症性が高いことも知られています9。
現在、臨床的耐性を生み出すためにtolDCを採用する取り組みには、大きく分けて2つのカテゴリーがあります。まず、tolDCは単球から生成され、細胞療法として使用されます。このパラダイムでは、moDCは通常、IL-4/GM-CSFと、ビタミンD3、ラパマイシン(ラパ)、IL-10、デキサメタゾン、またはこれらの11,12の組み合わせなどの免疫調節剤と併用して分化されます。これらのtolDCは、自己免疫および移植のための自家細胞療法として研究されてきた13。tolDCの他の用途は、遊離薬物またはナノキャリアを使用して内因性DCをtolDCに向けて再プログラムし、免疫調節剤および目的の抗原の両方を送達することである14,15,16。しかし、すでに分化したDCの誘導は、典型的にはtolDC代謝17,18とは対照的なDCの堅牢な代謝表現型の発達により、より困難である。これは、ほとんどの薬理学的免疫調節剤にとって高いハードルです。このため、ほとんどの内因性DCリプログラミング研究は、効果的なDC抑制としばしばいくつかのTreg誘導を報告していますが、多くの場合、T細胞の持続性の欠如により、臨床的成功を欠いています15,19,20。このことは、既存のDCから潜在的なtolDC誘導剤を特定する戦略の必要性を浮き彫りにしています。
ここでは、自家Treg誘導の最終指標を使用して、分化したmoDCに対する免疫調節剤の in vitro 評価方法を紹介します。このプロトコルは、免疫調節剤の有効性を評価するために設計されています すでに分化したヒトmoDCを耐性に向けて再プログラムします。さらに、このプロトコルは、同じPBMCサンプルから単離された自家T細胞に対してTregを生成するために、再プログラムされたtolDCの機能性を検証します。これは、分化中に耐性を誘導する、および/または同種ドナー21からのT細胞によるtolDCへの挑戦を行う他のプロトコルとは対照的である。このプロトコルでは、一般的な忍容剤であるラパを例として使用しますが、ラパ処理された moDC が Treg を生成するための限定的な有効性も示しています。代表的な結果では、IL-10、デキサメタゾン、ビタミンD3などの他の一般的な免疫調節治療の有効性も示しています。このプロトコルは、すでに確立されたmoDCに対して、より効果的な可能性のあるtolDC誘導剤をスクリーニングするために使用されることを想定しています22。
プロトコル
すべてのヒト末梢血単核細胞(PBMC)サンプルは、ペンシルベニア大学のヒト免疫学コアから、患者の同意を得てペンシルベニア大学の治験審査委員会(IRB)からの事前承認を得て、匿名化されたドナーから取得されました。
オプション:この方法では、学術研究室から入手した新たに分離されたPBMCを使用しましたが、PBMCは全血または白血フェレーシスが豊富な血液製剤から分離できます。密度勾配遠心分離法は、他の場所で説明されているように、十分に確立され信頼性の高い方法であるため、使用することをお勧めします23。
1. 単球/T細胞の単離とmoDCの分化
- PBMCからの単球とT細胞の単離-1日目
- 健康なドナーから2億個のヒトPBMCを入手します。細胞を15mLのチューブに入れ、氷上に移します。
- 50 mLの分離バッファー(市販の分離キットで提供)をコニカルチューブに入れて分注します。
注:分離バッファーは、2%ウシ胎児血清(FBS)および1 mMエチレンジアミン四酢酸(EDTA)を含むDPBSに置き換えることもできます。 - PBMCチューブを氷から取り出し、分離バッファーで満たします。300 x gで5分間遠心分離します。
- 10mLの血清ピペットを使用して上清を吸引します。血清ピペットを使用して、細胞ペレットを4 mLの推奨培地に再懸濁します。
- 懸濁液を2つの異なる15 mLチューブに分割し、チューブあたり2 mL(チューブあたり5 × 107 細胞/mL)を追加します。一方のチューブに「T」、もう一方に「単球」とラベルを付けます。
- Human Monocyte Isolation Kitを取り出し、製造元のプロトコルに従って、単球標識チューブから単球を分離します。
- ヒトT細胞単離キットを取り出し、2本目のチューブのメーカーのプロトコルに従ってT細胞を単離します。
- T細胞の分化と凍結のための単球のプレーティング-1日目
- 50 mLのmoDC Culture Medium(表1)を37°Cで少なくとも10分間予熱します。
- 濃縮単球を含む15 mLチューブとステップ1.1のT細胞を含む15 mLチューブを250 × g で5分間遠心分離します。
- 上清を吸引します。ピペッティングで上下させて、単球を1 mLのmoDC Culture MediumおよびT細胞培養培地(表1)に再懸濁します。ペレットが適切に分散していることを確認してください。
- 自動セルカウンターまたはTrypan Blue染色を使用した手動血球計算盤を使用して細胞をカウントします。
注:代表的なデータとして、1000万個のT細胞と300万個の単球を単離した。 - 単球を入れたチューブを取り、9 mLの温かいmoDC Culture Mediumを懸濁液に加え、最終容量10 mLにします。次に、10 μg/mL の GM-CSF ストックと 10 μg/mL の IL-4 ストックをそれぞれ 100 μL 加えて、培地中の GM-CSF と IL-4 の両方を最終濃度 100 ng/mL にします。懸濁液をペトリ皿に移し、「moDC」とラベル付けし(1日目)、5%CO2で37°Cでインキュベートします。
- T細胞チューブを取り、1 mLのT細胞凍結培地(表1)と1 mLのT細胞懸濁液を混合します。2つの2 mLクライオバイアル(1 mL /バイアル)に分けます。しっかりと密封します(バイアルあたり500万個の細胞の最終濃度)。クライオバイアルを、未使用のウェルにバランスチューブを入れた凍結チャンバーに入れます。チャンバーを-80°Cで一晩保存し、クライオバイアルをクライオタンクに移します。
- 4日目に、5 mLの新鮮なmoDC Culture Mediumを加えて培地をリフレッシュし、GM-CSFおよびIL-4ストックをそれぞれ100 μL加えます。差別化されたmoDCは7日目に準備が整います。
2. 寛容性moDCを作製するための免疫調節薬の添加
- moDC プレートを設定します。
- 7日目に、インキュベーターから分化したmoDCを取り出し、moDC細胞懸濁液を50mLチューブに移します。
- 懸濁液を250 × g で5分間遠心分離します。上清を吸引し、ピペッティングで上下させて、細胞ペレットを1 mLの温かいmoDC培養培地に再懸濁します。血球計算盤で細胞をカウントし、100 ng/ml、GM-CSFおよびIL-4を含む温かいmoDC培地で細胞を3×105 細胞/mLの濃度に希釈します。
- 平底×96ウェル組織培養プレートで、100 μL中34 細胞/ウェルを希望のウェル数まで加えます。
注:代表的な結果として、合計48のウェルを使用しました(セクション3と4の4つの異なる分析のために準備されたトリプリケートで行われた4つの条件)が、これは最大60ウェルまで調整できます。残りのすべてのウェルを100 μL/ウェルPBSで満たし、特に外側のウェルの乾燥を防ぎます。分析方法ごとに異なるプレートを用意することをお勧めします。 - 1 μL/ウェルの免疫調節薬を目的のウェルに加えます(ここでは10 ng/mLラパ)。プレートを5%CO2で37°Cで一晩インキュベートします。
注:8日目に免疫刺激を含める場合は、免疫刺激の有無にかかわらず、免疫調節薬のウェルを準備します。.成熟したmoDCへの免疫刺激の使用はオプションです。
- T細胞を再解凍します。
- 8日目に、クライオタンクから2つのクライオバイアルを取り出し、内容物が溶け始めるまで(<3分で)37°Cのホットビーズバスまたはウォーターバスでクライオバイアルを解凍します。
- 内容物が溶け始めたら、バイアルを細胞培養フードに移し、1 mLの温かいT細胞培養培地をバイアルにピペットで移して急速に解凍します。バイアルの内容物全体を50mLチューブに移します。クライオバイアルを1 mLのT細胞培養培地ですすぎ、すべての細胞がチューブに移されたことを確認します。
- 懸濁液にフロー染色液(表1)を15 mLまで補充します。200 × g で10分間遠心分離し、上清を吸引します。次に、ペレットを5 mLのフロー染色溶液に再懸濁し、再度遠心分離します。
- 上清を吸引し、細胞を温かいT細胞培養培地1 mLに再懸濁します。血球計算盤を使用して細胞をカウントします。
注:この段階での生存率は>70%である必要があります。死細胞が大量に残っている場合は、新しいチューブに移し、細胞染色液10 mLを加え、200 × g で5分間遠心分離し、T細胞培地1 mLに再懸濁して再計数します。 - 9 mLの温かいT細胞培養培地を加えて、最終容量を10 mLにします。懸濁液をペトリ皿に移します。「Rethawed T Cells」とラベル付けし、5% CO2 で 37 °C で一晩インキュベートし、細胞を休ませます。
- moDCプレートを洗浄し、必要に応じて免疫賦活剤を追加します。
- 8日目に、moDCプレート(7日目から)を300 × g で5分間遠心分離します。
- 上清を吸引し、温かいHBSSで洗浄し、遠心分離を繰り返し、再度吸引し、GM-CSFとIL-4(100 μL/well)を含む温かいmoDC培地に細胞を再懸濁します。
注:セルを乱さないように注意してください。吸引中はプレートを傾けます。ウェル内には約10μLが残存します。 - 免疫刺激を使用する場合は、100倍ストックLPS(またはその他の免疫賦活剤)の1 μL/ウェルを目的のウェルに加えます。プレートを5%CO2で37°Cで一晩インキュベートします。
3. moDCのフロー解析(検証+許容誤差)
- moDCの検証のためのフロー解析
- 8日目に、表2に記載されているように、HLA-DR、CD14、樹状細胞特異的C型レクチン(DC-SIGN)、CD1c、およびCD40のマーカーを標的として、バリデーションパネル用の抗体カクテルを調製します。すべての抗体をフロー染色液で希釈します。
注:このパネルは、7チャンネルの赤/青レーザーフローサイトメーター用に設計されました。 - インキュベーターからmoDCプレートを取り出します。プレートを300 × g で5分間遠心分離します。上清を取り除きます。 オプション:サイトカインIL-10およびTNFαのELISA分析のために、メーカーの指示に従って市販のキットを使用して上清を保持します。
- 200 μL/ウェルのフロー染色溶液を添加します。プレートを300 × g で5分間遠心分離します。
- 上清を吸引し、フロー染色溶液で1:200に希釈した50 μL/ウェルのFc受容体結合阻害剤抗体を添加して、非特異的結合をブロックします。室温(RT)で30分間インキュベートします。
- 調製した Validation Panel 抗体カクテルを50 μL/ウェル加えます。
- プレート内または1.5 mLチューブ内に、50 μLのコンペンセーションビーズと希釈した各抗体50 μLを混合して、コンペンセーションコントロールを調製します。プレートを4°Cで1時間インキュベートします。
注:ここでは、moDC上のマーカーの発現が低い可能性があるため、補正のために細胞ではなく補正ビーズが使用されます。 - 300 × g で5分間遠心分離し、上清を取り除き、200 μLのフロー染色溶液に再懸濁して洗浄します。2回の洗浄を行います。
- 最終洗浄後、再度遠心分離し、細胞を110 μL/ウェルのフロー染色溶液に再懸濁します。これで、サンプルをフローサイトメトリー分析する準備が整いました。
- 8日目に、表2に記載されているように、HLA-DR、CD14、樹状細胞特異的C型レクチン(DC-SIGN)、CD1c、およびCD40のマーカーを標的として、バリデーションパネル用の抗体カクテルを調製します。すべての抗体をフロー染色液で希釈します。
- 寛容性moDC(トレランスパネル)の流動解析
- 8日目のステップ3.1と同様に、CD86、PD-L1、DC-SIGN、CD1c、BTLA、およびCD40のマーカーを標的とする Tolerance Panel用の抗体カクテルを調製します(表2)。
- 手順3.1.2-3.1.8を繰り返し、抗体カクテルを Tolerance Panel カクテルに置き換えます。
4. T細胞の流動解析
- T細胞を治療した寛容性moDCと組み合わせます。
- 9日目に、再解凍したT細胞ペトリ皿をインキュベーターから取り出し、すべてのT細胞を50mLチューブに移します。フロー染色液を補充します。
- オプション:T細胞増殖解析を行う場合は、T細胞を2つのチューブに分割します。
- 最初のチューブで、250 × g で5分間スピンダウンし、上清を取り除きます。このチューブを細胞増殖色素でメーカーの指示に従って染色します。
注:Fixable Viability Dye eFluor 670を使用しましたが、これには30分のインキュベーションステップとその後の2回の洗浄ステップが必要です。細胞の損失を防ぐために50 mLのコニカルチューブを使用し、染色後の洗浄には10% HIFBSを含むHBSSを使用することをお勧めします。 - Treg分析には、未染色のT細胞を含む2番目のチューブを使用します。同様に、250 × g で5分間スピンダウンし、上清を除去し、温かい細胞培養培地に再懸濁し、染色プロセス中はインキュベーターに保持します。T細胞の増殖が不要な場合は、すべてのT細胞をスピンダウンし、温かいT細胞培養培地と交換します。
- 最初のチューブで、250 × g で5分間スピンダウンし、上清を取り除きます。このチューブを細胞増殖色素でメーカーの指示に従って染色します。
- 細胞を数え、少なくとも400万個(Treg解析のみの場合)または800万個(TregおよびT増殖解析の場合)を取得します。
- 残りのウェルとともにインキュベーターからmoDCプレートを取り出し、300 × g で5分間遠心分離し、上清を補呈します。200 μL/ウェルのT細胞を1.6 × 105 細胞/ウェルで添加します。Treg分析プレートには未染色T細胞を、T細胞増殖プレートには染色T細胞を添加します。
注:これにより、最初の3 × 104 moDCは通常わずかに拡大するため、TセルとmoDCの比率は5:1に維持されます。 - 25 μL/mLの抗CD3/CD28抗体カクテルをネガティブコントロールウェルを除くすべてのグループに加えて、T細胞を刺激します。プレートを5%CO2 で37°Cで72時間インキュベートし、12日目までインキュベートします。
注:増殖解析には染色したT細胞を、Treg解析には未染色のT細胞を使用してください。
- Tregフロー解析
- 表面マーカー染色
- 12日目に、Tregパネル用の抗体カクテルを調製します(表2)。
- すべての細胞懸濁液を96ウェル培養プレートからフロー染色溶液を含むVボトムプレートに移します。サイトカイン分析のために上清を保持します。
- 細胞を遠心分離(200 × g で5分間、続いて200 μLのFlow染色液)で2回洗浄します。一部のセルを補正コントロール用に取っておきます。FOXP3染色用および未染色コントロール用に1つ取っておきます。
注:ステップ4.2.1.3の最終スピンの前に、すべてのサンプルを10 μLでコーミングして、必要なコンペンセーションコントロールを得ることをお勧めします。これにより、細胞上の各マーカーのすべての表面レベル発現の代表的なサンプルが得られます。 - 2回目の洗浄後、室温で200 x g で5分間遠心分離して吸引し、50 μL/ウェルのFc受容体結合阻害剤抗体(フロー染色溶液で1:200に希釈)を加えます。室温で10分間インキュベートします。
- 調製した Treg Panel 抗体カクテルを50 μL/ウェル加えます。
- コンペンセーションコントロールには、50 μLの未染色コンペンセーションセルと50 μLの染色済み抗体をそれぞれ混合します。
- プレートとコンペンセーションコントロールを4°Cで1時間インキュベートします。プレートをFlow Stain Solutionで一度洗浄し、300 × g で5分間遠心分離します。
- HBSS(1:1,000)で200 μL/wellで希釈したLive/Dead Near-IR色素で染色します。4°Cで30分間インキュベートします。
- プレートをFlow Staining Solution (200 μL/well) で 300 × g で 5 分間 1 回洗浄します。
- 製造元の指示に従ってFoxP3で染色しますが、これには一晩のインキュベーションが必要です。FoxP3染色プロトコルの簡単な概要を以下に示します。
- 製造元の指示に従って、 FoxP3固定/透過化作業溶液 を準備します。FoxP3固定/透過化濃縮液1部とFoxP3固定/透過化希釈液3部を混合します。サンプルあたり200μLの作業溶液を調製します。
- すべてのサンプルを200 μL/ウェルの作業用固定/透過化溶液でインキュベートします。4°Cで1時間放置します。
- 1x Permeabilization Bufferを調製する:10x Permeabilization Buffer(市販のキットから入手)1部と9部の蒸留水とを混合します。
- プレートを1x Permeabilization Buffer(200 μL/well)で300 × g で5分間2回洗浄します。
- FoxP3抗体(PE-Cy5.5、1:300希釈、1x透過化バッファー)で染色する:希釈したFoxP3抗体を100 μL/ウェル加え、4°Cで一晩インキュベートします。
- プレートを1x Permeabilization Buffer(200 μL/well)で300 g×5 分間2回 洗浄します。
- 細胞を110 μL/ウェルのフロー染色溶液に再懸濁します。
- フローサイトメトリー解析を行います。
- 表面マーカー染色
- T細胞増殖解析
- T増殖パネル用の抗体カクテルを調製します(表2)。
- すべての細胞懸濁液を96ウェル培養プレートからフロー染色溶液を含むVボトムプレートに移します。サイトカイン分析のために上清を保持します。
- 細胞を遠心分離(200 × g で5分間、続いて200 μLのFlow染色液)で2回洗浄します。一部のセルを補正コントロール用に取っておきます。FOXP3染色用および未染色コントロール用に1つ取っておきます。
注:ステップ4.3.3の最終スピンの前に、すべてのサンプルを10 μLコーミングして、必要なコンペンセーションコントロールを得ることをお勧めします。これにより、細胞上の各マーカーのすべての表面レベル発現の代表的なサンプルが得られます。 - 2回目の洗浄後、遠心分離(200 × g 、室温で5分間)して吸引し、50 μL/well Fc受容体結合阻害剤抗体(フロー染色溶液で1:200に希釈)を加えます。室温で10分間インキュベートします。
- 調製した T Proliferation Panel 抗体カクテルを50 μL/ウェル加えます。
- コンペンセーションコントロールには、50 μLの未染色コンペンセーションセルと50 μLの染色済み抗体をそれぞれ混合します。
- プレートとコンペンセーションコントロールを4°Cで1時間インキュベートします。プレートをFlow Stain Solutionで一度洗浄し、300 × g で5分間遠心分離します。
- HBSS(1:1,000)で200 μL/wellで希釈したLive/Dead Near-IR色素で染色します。4°Cで30分間インキュベートします。
- プレートをFlow Staining Solution (200 μL/well) で 300 × g で 5 分間 1 回洗浄します。
- フローサイトメトリー解析を行います。
結果
我々は、ヒトPBMCのプロトコルを記載し、市販の磁気分離キットを用いてCD3+ T細胞とCD14+ 単球の両方を単離し、単球をGM-CSFおよびIL-4を用いてCD14-、HLA-DR+、CD141+、CD1c+ moDCに分化させ、それらを24時間処理し、抗CD3/CD28刺激を伴う自家T細胞と72時間共培養した。実験的な概略図を 図1に示します。
単球/T細胞の単離とmoDCの分化
私たちの最初の代表的な結果として、2億個のヒトPBMCがペンシルベニア大学のヒト免疫学コア(HIC)から1人の健康なドナーから購入され、プロトコルセクション1および2で説明されているように処理されました。1日目に採血し、HIC施設で標準的なFicoll分画を用いて単離した。T細胞と単球の単離には1億個のPBMCを使用し、それぞれ1,000万個のT細胞と300万個の単球を収量しました。7日目のGM-CSF/IL-4分化後の単球およびmoDCをフローサイトメトリーで解析しました。未分化単球では、古典的CD14+、HLA-DR- 単球(>45%)、およびCD1cを発現し、CD141を発現しないCD14-、HLA-DR+ 細胞の小さな集団の2つの異なるグループが観察されました。対照的に、分化7日目には、CD14-、HLA-DR+、CD141+、CD1c+のほとんどの細胞が観察され、moDCが示されました(図2)。最初の300万個の単球から約400万個のmoDCを取得しました。
moDCのフロー解析(検証+許容誤差)
7日目に、moDCをラパと24時間インキュベートし、洗浄し、LPSと24時間インキュベートした後、9日目にプロトコルステップ3を介してフローサイトメトリーで分析しました。治療群には、1)無治療+無治療(UT)、2)無治療+0.1μg/mlのLPS(LPS)、3)10ng/mLのラパ+無治療(ラパ)、または4)10ng/mLのラパ+0.1μg/mLのLPS(LPS+ラパ)が含まれていました。ラパによる治療は、LPSの有無にかかわらず、UTからのCD1c +、DC-SIGN+ 集団を減少させたが、割合は>50%のままであった(図3A)。9日目のMoDCについても、DC成熟マーカーであるCD86およびCD40の発現について分析しました。moDCをLPSで処理するとCD86が著しく増加し、これはmoDCをラパで前処理すると防止されました(図3B)。シグナルをUTコントロールに正規化すると、ラパ治療群ではCD40とCD86の両方で有意な減少が観察され、LPS+ラパグループではシグナルの増加は見られませんでした(図3C、D)。これと同じパターンが寛容性マーカーであるPD-L1およびBTLAでも観察され、ラパ治療によりシグナルが減少し、LPS刺激に対する反応の増加が防止されました(図3E、F)。これは、ラパ治療がLPSの成熟を防いだが、同時に寛容性マーカーの発現を制限したことを示しています。
Tregの流動解析
次に、プロトコルステップ4.2を使用して、12日目にmoDCsと共培養し、CD3/CD28刺激でCD3/CD28刺激と刺激した後、自家T細胞を1:5 moDC:T細胞の割合で分析しました。我々は、CD4+、CD25+、FoxP3+ によってTreg集団を同定した(図4)24。サンプルには、刺激なしのT細胞(ネガティブコントロール)、CD3/CD28刺激を受けたがmoDCなしのT細胞、およびCD3/CD28刺激を受けたT細胞が含まれ、前の段落の4つのmoDCグループと共培養されました。明確なTreg個体群と、moDCを共培養に追加するとTregの顕著な増加が観察されました。しかし、ラパ処理されたtolDCからのTreg生成の増加を示すいくつかの文献報告とは対照的に、4つのmoDC間でTreg周波数に有意差はありませんでした(図5A)25。
T細胞増殖のフロー解析
また、プロトコルステップ4.3を使用して、T細胞増殖の代表サンプルを分析しました。T細胞-moDC共培養物をTreg分析と同様に刺激し、次にCD4+ またはCD8+ T細胞の細胞増殖色素についてフローで分析しました(図5B)。ラパ処理されたmoDCは、CD3/CD28刺激時にLPS処理されたmoDCおよび未処理のmoDCと比較して、CD4+ およびCD8+ T細胞コンパートメントの両方でT細胞増殖が中程度に減少することが観察されました。
追加の患者サンプルと免疫調節剤の分析:
私たちの代表的な結果は、ラパ処理されたmoDCがCD86やCD40などのDC成熟マーカーを減少させ、T細胞の増殖を非特異的なCD3/CD28刺激に減少させることを示しています。しかし、ラパで治療されたmoDCは、PD-L1やBTLAなどの耐性の陽性マーカーにほとんど影響を与えず、CD3/CD28の刺激によってTregの集団を増加させません。他の患者や免疫調節剤でも同様のT細胞結果が観察されるかどうかを調べるために、追加のヒトサンプル(分析に応じて合計4つまたは5つ)から自家共培養実験を繰り返しました。さらに、ステップ 2.1.4 で与えられた免疫調節剤として 10 ng/mL の Rapa に加えて、1 μM デキサメタゾン (Dex)、10 ng/mL IL-10 (IL-10)、1 μg/mL のリポ多糖 (LPS)、または 1 nM ビタミン D3 (VD3) を試験しましたが、免疫刺激は省略しました。また、ステップ 2.1.4 で Dex を投与し、ステップ 2.3.3 で 8 日目に 0.1 μg/mL LPS で処理したサンプル(Dex + LPS)も含めました。まず、8日目のステップ2.3.3の24時間後または72時間後に、一般的な耐性サイトカインIL-10および炎症性サイトカインTNFαについて、moDC(T細胞添加なし)の上清をテストしました(図6A-D)。ラパ処理されたmoDCは、24時間または72時間でどのサンプルでもIL-10を増加させなかったが、IL-10処理されたサンプルは、外因的に添加されたIL-10を除去するための2つの洗浄ステップの後でも、24時間でIL-10産生を有意に増加させたことを観察した。(図6A)。また、Dexで処理したmoDCは、IL-10産生を有意に増加させましたが、それは72時間休息した後に限られることも観察されました(図6B)。さらに、それ自体でTNFαを生成する免疫調節剤はないことを観察しましたが、Dexの前処理により、24時間後のLPS処理での平均TNFα生成が減少しましたが、この結果は有意ではありませんでした(図6C)。データはさらに、PD-L1のmoDC発現が24時間で免疫調節剤によって増加しない一方で、72時間でDex+LPSおよびRapa治療群でPD-L1+ moDCの有意な増加が観察されたことを示しています(図6E、F)。私たちの単一の代表的なサンプルと同様に、24時間および72時間の両方で、すべての免疫調節剤治療群からのCD86発現の抑制も観察されます(図6G、H)。これらは、免疫調節剤がmoDCの寛容性マーカーを増加させることができることを確認していますが、効果は遅れます。
さらに、12日目の共培養後のT細胞応答を解析しました。我々は、免疫調節剤で処理されたmoDCは、他の発表された報告と同様に、未処理のmoDCコントロールと比較してCD4+ T細胞の増殖を増加させなかったことを観察した26 (図6I)。興味深いことに、より大きなサンプルでは、免疫調節剤で処理されたmoDCについて、Treg集団の有意な増加は観察されませんでした(図6J)。この重要性の欠如は、患者サンプル間のばらつきが大きいためであると考えています。患者サンプルのうち2つ(1および2)は、どの治療でもTregを増加させないように見えましたが、他の2つ(3および4)は、ほぼすべての免疫調節治療で増加を示しました(図6J)。このことは、複数の患者サンプルを用いて免疫調節剤の分析を行う必要性を浮き彫りにしており、免疫調節剤で処理されたmoDCを介したTregの増殖は患者間で大きく異なることが示唆されています。

図1:実験の概要図。 PBMCから単球とT細胞を単離し、単球をmoDCに分化させ、免疫調節剤を添加してtolDCを作製し、T細胞と共培養します。略語:PBMC =末梢血単核細胞;moDCs = 単球由来樹状細胞;tolDCs = 寛容性樹状細胞。 この図の拡大版を表示するには、ここをクリックしてください。
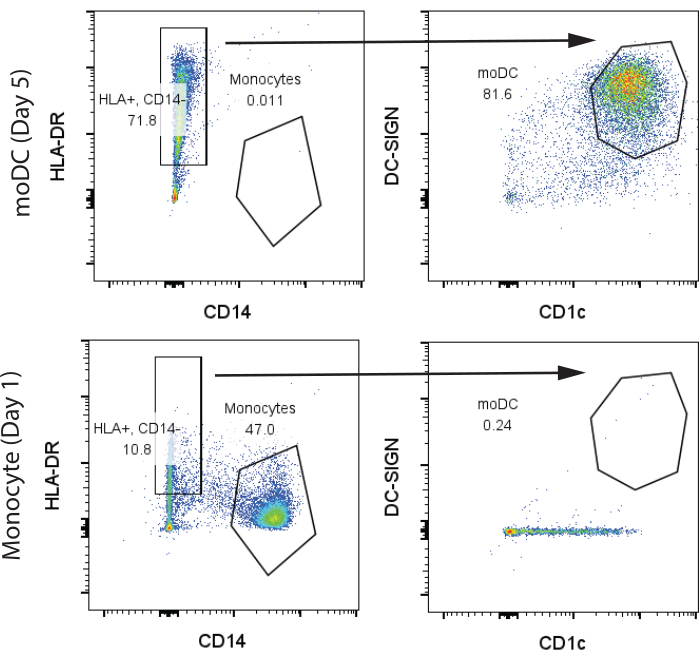
図2:CD14+、HLA-DR- 単球およびCD14-、HLA-DR+、CD1c+、DC-SIGN+ moDCの同定のための代表的なゲーティング戦略。 サンプルは7日目に分析しました。略語:moDC =単球由来樹状細胞;HLA-DR = ヒト白血球抗原-DR;DC-SIGN = 樹状細胞特異的なC型レクチン。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ラパおよび/またはLPS治療後のmoDCのフローサイトメトリー解析。 6日目に、105 moDCを免疫調節剤と24時間インキュベートした後、0.1 μg/mL LPSの有無にかかわらず24時間洗浄およびインキュベートしました。9日目に、moDCを洗浄し、フローサイトメトリーで分析しました。(A)CD14+、HLA-DR- 単球、およびCD14-、HLA-DR+、CD1c+、DC-SIGN+ moDCの同定。(B)処理後のmoDC CD86シグナルの代表的なヒストグラム。(C)CD86、(D)CD40、(E)PD-L1、および(F)BTLAの平均蛍光強度。サンプルは、同じ患者PBMCからのテクニカルトリプリケート(N = 3)であり、有意性はUT群と比較した一元配置ANOVAによって決定されました。*p < 0.05, **p < 0.01, ***p < 1 × 10-3, ****p < 1 × 10-4.略語:PBMC =末梢血単核細胞;moDCs = 単球由来樹状細胞;HLA-DR = ヒト白血球抗原-DR;rapa = ラパマイシン;LPS =リポ多糖;MFI = 平均蛍光強度;BTLA = BおよびTリンパ球減衰剤;PD-L1 = プログラム細胞死リガンド 1;UT = 未治療;LPS moDC= 8 日目に 0.1 μg/mL LPS で処理した moDC;ラパmoDC = 7日目に10 ng / mLラパで処理し、8日目に洗浄したmoDC。ラパ + LPS moDCs = 7 日目に 10 ng/mL ラパで処理した moDC を 8 日目に 0.1 μg/mL LPS を洗浄して処理しました。 この図の拡大版を表示するには、ここをクリックしてください。
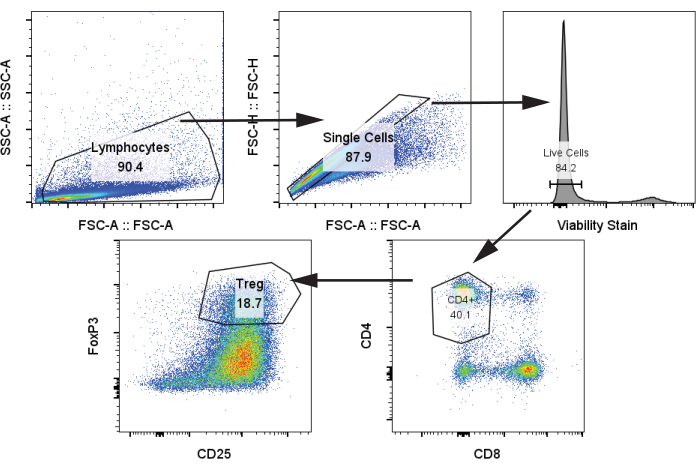
図4:CD4+、CD25+、FoxP3+ 制御性Tregの同定のための代表的なゲーティング戦略。 12日目に解凍したT細胞からサンプルを分析しました。略語:SSC-A =側方散乱ピーク面積;FSC-A = 前方散乱ピーク面積;Tregs = 制御性T細胞。 この図の拡大版を表示するには、ここをクリックしてください。

図5:12日目のmoDC-T細胞共培養の代表的なT細胞解析。 (A)Tregsを同定するための、生細胞、単一、CD4+ T細胞の代表的なCD25対FoxP3フロープロット。左の列には、T細胞のみ(上)とCD3/CD28刺激T細胞(下)のコントロールが含まれています。中央の列:ラパ処理を施していないmoDC、右の列:ラパ処理を施したmoDC。中央と右の列では、上の行がLPSなしのサンプル、下の行がLPS処理済みのサンプルです。(B)T細胞増殖の代表的なゲーティング。CD4+ (左)またはCD8+ (右)T細胞のいずれかを増殖染色に対してプロットしました。ピークは、0、1、2、または3細胞分裂で示されています。ヒストグラムには、moDC 処理のタイプでラベルが付けられます。略語:rapa = rapamycin;LPS =リポ多糖;moDCs = 単球由来樹状細胞;T細胞のみ= CD3/CD28処理なしでmoDCのないT細胞;UT = 未治療;LPS moDC = 8日目に0.1 μg/mL LPSを処理したmoDC;ラパmoDC = 7日目に10 ng/mLラパで処理し、8日目に洗浄したmoDCs。ラパ治療は、分裂が0で細胞の相対量が増加することに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。

図6:免疫調節剤を追加した複数のmoDC/T細胞サンプルの解析。 MoDCは、ステップ2.1.4で与えられた免疫調節剤として、1 μMデキサメタゾン、10 ng/mL IL-10、1 μg/mLリポ多糖、または1 nMビタミンD3で処理されましたが、免疫刺激は省略されました。また、ステップ 2.1.4 で Dex を投与し、ステップ 2.3.3 で 8 日目に 0.1 μg/mL LPS で処理したサンプル(Dex + LPS)も含めました。(A,-D)moDCのサイトカイン解析。上清は、(A)24時間または(B)ステップ2.3.3の72時間後にIL-10について試験したか、または C)24時間または(D)ステップ2.3.3の72時間後に市販のELISAキットを使用してTNFαについて試験した。N = 5 です。(E-H) moDC表面マーカーの解析。同様に、(E) 24時間または (F) 72時間でPD−L1について、または (G) 24時間または (H) 72時間でCD86について、フローサイトメトリーによりmoDCを解析した。 N=5。(I)T細胞増殖の解析。12日目のCD4+ T細胞のT細胞増殖について分析し、T細胞100個あたりの細胞分裂数を計算しました。サンプルは、1:5 moDC:T細胞比、N = 4でインキュベートしました。(E)Treg分析。5人の異なる患者から区別されたMoDCは、 図5と同様の方法で分析されました。左、未処理のmoDC。右、10 ng/mLラパで処理したmoDC。色付きの各線は、異なる患者サンプルを表しています。有意性は一元配置分散分析によって決定されました。*p < 0.05, **p < 0.01.略語: rapa = rapamycin;LPS =リポ多糖;TNFα = 腫瘍壊死因子 - アルファ;moDCs = 単球由来樹状細胞;UT = 未治療;LPS moDC = 0.1 μg/mL LPSで処理したmoDC;ラパ moDC = 10 ng/mL ラパで処理した moDC、Dex = 1 μM デキサメタゾンで処理した moDC、IL-10 = 10 ng/mL IL-10 で処理した moDC、1 nM ビタミン D3 で処理した VD3= moDC、7 日目に 1 μM デキサメタゾンで処理した Dex + LPS= moDC、8 日目に 0.1 μg/mL LPS で処理した この図の拡大版を表示するには、ここをクリックしてください。
| moDC培地 | フロー染色ソリューション | T細胞培養液 | T細胞凍結培地 | |
| メディアベース | RPMIの1640 | HBSSの | RPMIの1640 | T細胞培養培地 |
| コンポーネント 1 | 10%熱不活化FBS(HI-FBS) | 1% BSA w/v | 10%熱不活化FBS(HI-FBS) | 10%DMSO |
| コンポーネント 2 | 1xペニシリン-ストレプトマイシン | 0.1 mM EDTA | 1xペニシリン-ストレプトマイシン | 該当なし |
| コンポーネント 3 | 該当なし | 該当なし | 1 mM HEPESの | 該当なし |
| コンポーネント4 | 該当なし | 該当なし | 1 x 非必須アミノ酸 | 該当なし |
| コンポーネント5 | 該当なし | 該当なし | 50 μM β-メルカプトエタノール | 該当なし |
表1:細胞培養試薬の説明
| パネル | 抗体 | フルオロフォア | 希釈 | チャンネル |
| 検証 | HLA-DRの | アレクサフルオロ488 | 1:500 | ブルー 1 |
| CD14 | PEの | 1:500 | ブルー 2 | |
| DCサイン | パーCP-Cy5.5 | 1:500 | ブルー 3 | |
| CD1cの | PE-Cy7 | 1:500 | ブルー4 | |
| CD40の | APCの | 1:500 | レッド 1 | |
| 寛容 | CD86の | フィッツ | 1:500 | ブルー 1 |
| PD-L1 | PEの | 1:5000 | ブルー 2 | |
| DCサイン | パーCP-Cy5.5 | 1:500 | ブルー 3 | |
| CD1cの | PE-Cy7 | 1:500 | ブルー4 | |
| BTLAの | APCの | 1:250 | レッド 1 | |
| CD40の | APCのefluor 780 | 1:500 | レッド 3 | |
| トレグ | CD4の | アレクサフルオロ488 | 1:500 | ブルー 1 |
| CD8 | PE-Cy7 | 1:500 | ブルー4 | |
| CD25の | APCの | 1:500 | レッド 1 | |
| Tの増殖 | CD4の | アレクサフルオロ488 | 1:500 | ブルー 1 |
| CD69の | PEの | 1:500 | ブルー 2 | |
| CD8 | PE-Cy7 | 1:500 | ブルー4 | |
| *すべての抗体はFlow Stain Solutionで希釈されています | ||||
表2:フローサイトメトリー抗体パネルの説明
ディスカッション
ここでは、免疫調節剤がmoDCからtolDCを誘導し、 その機能が生体内で自己生成T細胞からTregを生成する機能を検証するための、信頼性と汎用性の高い方法について説明します。このプロトコルには、いくつかの重要なステップがあります。まず、単球は感受性が高いことで知られており、最良の結果を得るには、以前に凍結されたPBMCではなく、新鮮なPBMCから取得する必要があります。単球はできるだけ早く単離し、分化カクテルに入れる必要があります。通常、最初の24時間での単球の収量の低さまたは単球の死亡率が高いのは、PBMCと単球の分離の間の凍結/融解サイクルまたは長期化によるものです。次に、moDCとT細胞培養培地の分化に使用されるサイトカインは、高品質の供給源からのものでなければなりません。通常、moDCの分化不良は、サイトカインの品質が低いか、濃度が正しくないことが原因です。第三に、T細胞は1日目から7日目まで凍結し、ナイーブで刺激されていない表現型を維持するために培養物に保持しないことをお勧めします。第四に、 図6に見られるように、PD-L1やIL-10などの寛容性マーカーの増加を可能にするために、治療されたmoDCを最大72時間休ませることが役立つ場合があります。最後に、私たちのデータに見られるように、Treg生成能力には大きな患者ばらつきがあるため、結論を導き出すには、各患者サンプルで各コントロールを実行する必要があります。複数の患者サンプルを検査することをお勧めします。
私たちの代表的な結果では、高いバーで耐性を実証するために、かなり制限的な実験計画を選択しました。適度に低濃度のラパ(10 ng/mL)を選択し、すでに分化したmoDCとのみ24時間インキュベートした後、1:5 moDC:T細胞比でCD3/CD28非特異的刺激と72時間インキュベートしました。このプロトコールは、免疫調節剤の濃度、免疫調節剤のインキュベーション時間、インキュベーションがmoDCの分化と同時に行われるか、または別々に行われるか、moDC:T細胞の共培養比、共培養インキュベーション時間、およびT細胞の共刺激。これらすべての要因により、moDC処理がTreg生成をどの程度容易に誘発するかが変わる可能性があります。注目すべきは、非特異的なCD3/CD28刺激を使用してT細胞の増殖を誘導することです。これは、関心のある抗原、つまり健康な患者サンプルを含むCEFTペプチドプールなどの対照抗原や、1型糖尿病患者サンプルを含むインスリンなどの自己抗原に容易に置き換えることができます27,28。これにより、抗原特異的耐性データが得られますが、これは非特異的Treg媒介耐性とは異なる可能性があります。
このプロトコルは汎用性がありますが、いくつかの制限があります。つまり、CD86、CD40、PD-L1、およびBTLAの一部のtolDCマーカーのみに限定されています。これらは一般的に受け入れられているマーカーであり、当社のラボ用フローサイトメーターで利用可能なチャンネル数には制限があります。ILT-3やILT-4などの他のマーカーも選択できる25。このプロトコルはまた、 in vivo29で強力な保護表現型を示すことができる1型制御性T細胞(Tr1)細胞などの他のタイプのサプレッサーT細胞サブセットを評価しません。しかし、このプロトコルは、DCの機能を評価して古典的なFoxP3+ CD25+ Tregを生成するものであり、これは新規免疫調節化合物の初期スクリーニングとDC寛容性能力の評価に十分であると主張します。
ヒトmoDC評価のもう一つの興味深い側面は、患者の変動性と、IL-10、PD-L1、BLTA、そして最も重要なことに、免疫調節剤、特にラパに対する免疫調節剤に対するTreg反応が限られていることです。文献は矛盾する結果を示しています。この論文と同様の結果は、ラパ処理されたマウスとヒトのDCの両方で見られ、DC成熟度マーカー(CD80/CD86/CD40)の減少と、非特異的に刺激された場合のT細胞からのIL-2放出の防止が示されていますが、T細胞死やTregの生成はありませんでした26,30。しかし、ヒトとマウスの両方を対象とした他の研究では、ex vivo rapa処理されたDCは高レベルのTreg生成を示すことが示されています25。ラパは、PI3K/AKT/mTORシグナル伝達経路のプロテインキナーゼであるラパマイシン(mTOR)阻害剤の機構的標的であり、細胞増殖、増殖、生存などのいくつかの重要な細胞機能を有する31。ラパは、移植のための拒絶反応抑制薬としてよく使用され、免疫反応の予防に臨床的に十分な利点が確立されています。しかし、特にtolDC導入剤として使用する場合、ラパの有効性は患者ごとに異なる可能性があります。
このことは、より広範な患者集団に対するtolDC誘導剤の厳密な研究と、新規免疫調節化合物の同定の両方の必要性を浮き彫りにしています。ヒトtolDCに関する圧倒的な数の臨床研究では、免疫調節剤としてラパ、IL-10、デキサメタゾン、またはビタミンD3のいずれかが使用されています32。これにより、広大な化学空間が未踏のまま残されます。このアッセイは、新規免疫調節剤のtolDC誘導の可能性を評価し、内因性DCからtolDCを生成する可能性を評価するための調査ツールとして提示します。このプロトコルはシンプルで汎用性が高く、フローサイトメーターのみを必要とし、ハイスループット機能に適応させることができます。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
ペンシルベニア大学のHuman Immunology Core(HIC)がドナーから新鮮なヒトPBMCを提供してくれたことに感謝します。HIC は、NIH P30 AI045008 および P30 CA016520 によって部分的にサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
参考文献
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。